Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Cirugía
versión On-line ISSN 1561-2945
Rev Cubana Cir v.49 n.1 Ciudad de la Habana ene.-mar. 2010
Válvulas cardíacas protésicas: revisión histórica del tema
Prosthetic cardiac valves: subject historical review
Alejandro Villar Inclán
Especialista de II Grado en Cirugía Cardiovascular y Cirugía General. Profesor Auxiliar de Cirugía Cardiovascular. Servicio de Cirugía Cardíaca, Hospital «Hermanos Ameijeiras». La Habana, Cuba.
RESUMEN
Se realiza una revisión de la historia de las prótesis cardíacas mecánicas y biológicas. Se conceptualizan los diferentes tipos de prótesis biológicas y se clasifican las diferentes válvulas mecánicas, según su estructura. Se presenta un resumen histórico sobre las diferentes especialidades que han participado en las construcciones de las válvulas cardíacas.
Palabras clave: Válvulas cardíacas, válvulas cardíacas mecánicas, válvulas cardíacas biológicas, bioprótesis, aloinjertos, operación de Ross.
ABSTRACT
A historical review of mechanical and biological cardiac prosthesis is made, conceptualizing the different mechanical valves according to its structure. This is a historical abstract on different specialties involving in cardiac valves constructions.
Key words: Cardiac valves, mechanical cardiac valves, biological cardiac valves, bio-prosthesis, allografts, Ross operation.
INTRODUCCIÓN
Las válvulas cardíacas protésicas (VCP) son compuestos artificiales concebidos para reemplazar una válvula cardíaca humana, que constan de un orificio a través del cual fluye la sangre y de un mecanismo oclusor que cierra y abre el orificio.
Pueden clasificarse en 2 tipos: prótesis mecánicas (PM) constituidas por oclusores rígidos en cuya fabricación no se incluye el uso de material biológico y las válvulas biológicas (VB) o bioprótesis (BP), que son tejidos valvulares finos y están constituidas por valvas oclusoras flexibles de origen animal o humano.1,2
PRÓTESIS MECÁNICAS
Las prótesis mecánicas (PM) cardíacas, que en sus orígenes fueron denominadas «artificiales»,3 según su estructura se clasifican en: jaula-bola, jaula-disco, disco lenticular simple, y disco lenticular bivalva.
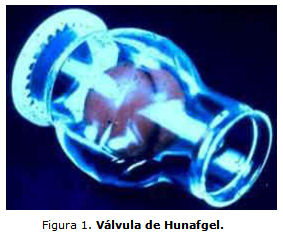
Según se recoge en la bibliografía, la primera prótesis valvular documentada implantada en un ser humano fue la válvula del modelo jaula-bola, desarrollada por Charles Hufnagel en 1947 (figura 1).4 Charles Hufnagel y Moore Campbell (1951) desarrollaron, de manera independiente un dispositivo para el manejo de la insuficiencia aórtica. Este consistía en un cilindro de acrílico, el cual contenía una esfera móvil de silicona que operaba a manera de válvula con el principio de bola en jaula. Ambos implantaron experimentalmente el dispositivo valvular en la aorta descendente de perros y con él mejoraron las anomalías hemodinámicas causadas por una incompetencia valvular llevada a cabo quirúrgicamente. Campbell nunca la implantó en seres humanos, mientras Hufnagel la empleó en 1952 en la aorta descendente de un paciente con insuficiencia grave de la válvula aórtica.4 Si bien este tipo de válvula no era estrictamente cardíaca, su importancia histórica radica en que se empleó antes del desarrollo de la circulación extracorpórea, por lo tanto el procedimiento se realizó con el corazón latiendo y sin el apoyo del mencionado soporte.
Las prótesis estrictamente cardíacas se desarrollaron a partir del inicio de la circulación extracorpórea, progreso que le significó a la cirugía cardíaca la posibilidad de trabajar sobre el interior del corazón exangüe e inmóvil.5
Harken, sin embargo, fue quien comenzó la verdadera era del reemplazo valvular con prótesis mecánicas;6 basado en las ideas de Hufnagel y Campbell, diseñó una válvula de bola con doble jaula (8 postes), la cual la implantó en posición subcoronariana en el año 1960 y obtuvo resultados alentadores.
Casi de inmediato la prótesis mitral, marca de fábrica Starr-Edwards (figura 2), fue implantada por primera vez en 1960 y debe su nombre a M. L. Edwards y A. Starr, sus diseñadores. La válvula estaba constituida por una jaula de material prototipo de plástico y una bola oclusora de goma de silicona, mantenida en su posición por el arnés plástico que se sujetaba a un anillo. En esta estructura la bola se desplaza libre y pasivamente desde el anillo, en su posición de cierre, hasta el extremo de la jaula en su posición de apertura, permitiendo el paso de la sangre a su alrededor y entre ella y la jaula y la pared aórtica o ventricular, de acuerdo con su posición.2 Desde el punto de vista hidrodinámico, esta prótesis correspondía a las del tipo de flujo lateral.
Como antecedente interesante se puede indicar que el primer paciente que recibió este tipo de válvula sobrevivió 10 años y falleció de un accidente ajeno a su enfermedad cardíaca de origen.7
Más tarde, el plástico de la jaula fue sustituido por acero inoxidable. Por otro lado, en los primeros modelos la jaula se hallaba cubierta por una tela cuyo objetivo era disminuir los fenómenos tromboembólicos, pero se dejó de usar al no alcanzarse el objetivo deseado con este recubrimiento, además de que esta tela contribuía a la disfunción de estas prótesis.
Luego, con la evolución de los diferentes materiales se conformó la jaula con aleación de cromo y cobalto, con el fin de ofrecer la mayor resistencia posible a todos los tipos de desgastes, con lo cual se procuraba alcanzar una mayor durabilidad, menos complicaciones y mejor hemodinámica. La bola estaba impregnada de sulfato de bario para la radiopacidad. En 1966 la firma Starr-Edwards introdujo el modelo 6120 para posición mitral y en el año 1968, el modelo 1260 para posición aórtica, últimas modificaciones técnicas de este tipo de prótesis.7
Según la Federación Americana de Drogas y Alimentos (FDA) desde el año 1965 hasta el año 1994 se habían implantado alrededor de 200000 válvulas prótesis de jaula-bola. A pesar de las críticas iniciales, el resultado hemodinámico fue aceptable y se ha constatado la existencia de prótesis con 30 años de implante y ningún signo de disfunción.2 Si bien el modelo de Starr-Edwards fue el más probado y usado, existían muchas variedades de este tipo de prótesis, entre ellas la de Smeloff-Cutter, la de Magoverm-Cromie, la de Braunwald-Cutter, la de Debakey-Surgitool, entre otras.
El alto perfil de estas prótesis y el obstáculo de la bola al flujo sanguíneo, hicieron que los fabricantes y diseñadores apostaran al diseño lenticular, sustituyendo al elemento oclusor esférico por uno lenticular, lo cual dio origen al modelo de jaula-disco, el cual mantenía todavía su característica de flujo lateral. En este modelo, que fue introducido a mediados del decenio de 1960, el elemento móvil que participaba en el cierre y apertura era un disco que era de carbón pirolítico; sin embargo, como no representaba una variante con ventajas significativas con respecto al modelo jaula-bola, poco a poco se dejó de usar.6 Ejemplos de estas válvulas fueron las de Cooley-Cutter, Cross Jones, Kay-Suzuki, Hufnagel-Conrad, Gott-Young, Barnard-Goosen, Kay-Shiley.
Con el propósito de disminuir el perfil y atenuar el efecto obstructor del elemento oclusor (bola o disco) del centro del torrente sanguíneo durante la apertura valvular, la bioingeniería condujo al modelo de disco lenticular simple de tipo oscilante. Las primeras prótesis de este tipo datan del año 1963, y cuales utilizaban un disco circular montado sobre un pivote que se unía a un anillo metálico. El disco era de grafito con una capa de carbón pirolítico, cubierto de acero inoxidable o titanio. El movimiento de apertura se hallaba limitado por unos topes, de manera que el grado de inclinación no era mayor de 60º u 80º. Durante la apertura el orificio primario quedaba dividido en dos orificios (uno mayor y otro menor).7
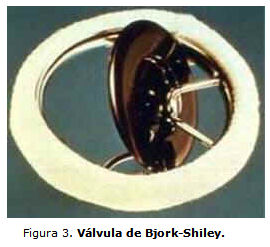
El primer diseño de perfil bajo fabricado fue introducido en 1969 por el profesor Viking Bjork, modelo sujeto posteriormente a cambios de diseños. Originalmente el disco era de polioximetileno, y fue cambiado más adelante por carbón pirolítico y cubierta de Stellite21®, marca de fábrica Bjork-Shiley, modelo estándar (figura 3). La prótesis fue retirada del mercado de los Estados Unidos en 1988 por la frecuencia elevada de accidentes,2 aún cuando su rendimiento hidrodinámico y su durabilidad parecían adecuados.
Es importante destacar que al momento de su retiro se habían implantado aproximadamente 360 000 válvulas de este tipo, por lo que hasta la fecha todavía se continúan mencionando los modelos de Björk-Shiley, ya que muchos pacientes con modelo estándar o válvulas posteriormente modificadas de Björk-Shiley, aún se encuentran vivos.
Posteriormente se introdujeron otras marcas de disco lenticular simple de tipo oscilante, como por ejemplo la de Lillehei-Kaster, la de Omni-Science y la de Medtronic-Hall. En la actualidad entre las válvulas de disco lenticular simple de tipo oscilante se encuentran en uso Omnicarbon, Monostrut y la Medtronic-Hall, entre otras.6
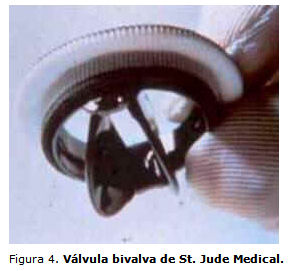
También a lo largo del decenio de 1970 aparece un nuevo concepto que se mantiene hasta nuestros días: el del flujo central, lo que significa una hemodinámica mucho más parecida a la fisiológica. En esta línea, se diseñaron las prótesis de disco lenticular bivalvas o de dos discos. El desarrollo actual de las PM se basa en el diseño de dos discos, introducido por St. Jude Medical en 1977 (figura 4). Esta prótesis valvular se diferencia de los oclusores libre-flotantes vistos en las válvulas de jaula-bola y jaula-disco y la de univalva en que las 2 valvas semicirculares de una válvula bivalva están conectadas con la cubierta del orificio por un mecanismo de bisagra de tipo mariposa.6 Las hojas pivotean durante la apertura, creando 3 áreas del flujo, 1 central y 2 laterales. El anillo es metálico y las dos valvas o discos son de carbono grafito, impregnados de tungsteno y recubiertos por carbono pirolítico, lo que disminuye su capacidad trombógena. Como los discos no poseen sutura las posibilidades de fractura son menores. El ángulo de apertura es de 85°, lo que permite que adquiera una posición casi paralela al flujo sanguíneo.
Gracias a las características del diseño de estas válvulas es posible obtener la mejor hemodinámica lograda en PM. En comparación con la prótesis monodisco, las de dos discos permiten lograr un área valvular efectiva mayor con un diámetro igual del anillo. Esto provoca un flujo casi laminar, central y de mínima turbulencia que se distribuye por los tres orificios (los dos laterales o mayores y el central o menor).
Según la FDA se calcula que desde 1977 hasta el 1994 se habían implantado más de 600 000 prótesis de tipo disco lenticular bivalva de la firma St. Jude Medical. Actualmente se mantienen en uso las opciones comerciales siguientes: St. Jude Medical, Bicarbon (Sorin), Carbomedics, ATS y Tekna, entre otras.7 En los últimos años el tipo de PM de tipo bivalva es el de mayor uso, y ha demostrado una excelente durabilidad y baja frecuencia de eventos tromboembólicos.
Hay que plantear que el área de las PM que declaran los fabricantes son medidas in vitro y no son las mismas áreas que encontramos a las semanas o meses después del implante.
Si bien los fabricantes declaran in vitro la medida de una válvula determinada, no significa necesariamente que todas las válvulas de una misma medida, aun de la misma fábrica, tengan exactamente la misma área valvular protésica.8
VÁLVULAS BIOLÓGICAS
Al principio del decenio de 1960, prácticamente en la misma época que se inicia el desarrollo de las PM, surgió gran interés por desarrollar tejidos biológicos con la intención de obtener una válvula con características más «fisiológicas», que fuera menos trombógena y por ende no exigiera el uso imperioso de agentes anticoagulantes.
Las primeras que se usaron fueron las válvulas homólogas esterilizadas químicamente; la gran mayoría de estas válvulas presentaron disfunción valvular a los 3 años. Luego se utilizaron válvulas homólogas frescas tratadas con antibióticos, o válvulas conservadas y tratadas con radiación; estas tuvieron mayor durabilidad, pero presentaron disfunción tardía debido a la disolución de las fibras de colágeno de las valvas, lo cual se interpretó como un fenómeno de rechazo.
El otro problema que existía era la dificultad de obtenerlas en número suficiente. Para evitar todas estas dificultades, a principios de 1965 se desarrollaron las válvulas heterólogas porcinas que pronto se usaron en seres humanos.
Inicialmente estas válvulas se esterilizaban con formalina, lo que provocaba una disolución de las fibras de colágeno que a la larga se acompañaba de disfunción valvular; posteriormente se desarrolló un proceso de fijación y esterilización de las válvulas porcinas empleando una solución diluida de glutaraldehído, lo cual favorecía la estabilización de las uniones entre las fibras de colágeno, por lo que después del tratamiento estas válvulas se volvían un tejido colágeno prácticamente inerte con poca o ninguna propiedad antigénica, de mayor biocompatibilidad.
Las válvulas así tratadas se montaban en un soporte semiflexible hecho de un anillo de estilete y con brazos flexibles hechos de polipropileno. Estas válvulas biológicas porcinas conocidas con el nombre de Hancok fueron las primeras en producirse a gran escala y emplearse en posición mitral, tricuspidea o aórtica.
A diferencia de las PM que varían en el tipo de flujo, las bioprótesis (BP) son todas de flujo central.
Existe una amplia variedad de válvulas biológicas, por lo cual se hace necesario comprender la nomenclatura biológica y conocer con precisión el origen de cada una de ellas y el tipo de montaje utilizado en su fabricación.
Nomenclatura biológica
- El autoinjerto (autograft) se refiere a una translocación dentro del mismo individuo, ejemplo: de la válvula pulmonar hacia la posición de la válvula aortica.
- El tejido valvular autógeno involucra la fabricación de una válvula de tejido no valvular del propio paciente, ejemplo: el pericardio.
- El aloinjerto (allograft) se refiere al trasplante de un donante de la misma especie; ejemplo: válvula pulmonar o aortica del donante hacia la posición aórtica o pulmonar del receptor.
- El heteroinjerto (heterograft) o xenoinjerto (xenograft), es cuando la válvula es trasplantada de otras especies, ya sea válvula intacta, ej., válvula aórtica porcina, o un modelo de válvula de tejido heterógeno, ejemplo: pericardio bovino.
Excepto las válvulas autógenas o autoinjertos, los demás recursos actuales quedan incluidos dentro de la denominación de prótesis valvulares biológicas.2
El objetivo de las válvulas biológicas es reducir las complicaciones asociadas a las válvulas mecánicas, por ejemplo el tromboembolismo y la necesidad de anticoagulación, además de optimizar la hemodinámica.
Características
Válvula de autoinjerto. El autoinjerto procedente de la pulmonar consiste en un autotransplante de la válvula pulmonar hacia la posición aórtica; y en la posición pulmonar se reemplaza por un homoinjerto o heteroinjerto de aorta o pulmonar, este procedimiento involucra un doble reemplazo. El primer procedimiento fue descrito en 1967; esta operación es denominada procedimiento de Ross. Han sido reportados resultados favorables a largo plazo y riesgos tardíos; sin embargo, los problemas tardíos están relacionados con la válvula pulmonar protésica (homoinjerto o heteroinjerto), los cuales son simples de remediar pero pueden requerir una segunda operación.1
Válvulas pericárdicas autógenas. Esta nueva categoría de bioprótesis es una tentativa innovadora al combinar la reproducibilidad y la facilidad de la inserción de una válvula comercial de heteroinjerto con soporte (stented) pero con las ventajas de que sería con tejido autógeno. Es una muestra de válvula pericárdica autógena montada en la sala de operaciones.1
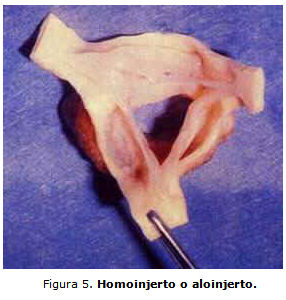
Válvulas de homoinjerto o aloinjerto (figura 5). Las válvulas de homoinjerto fueron utilizadas al principio del decenio de 1960, están constituidas por válvulas aórticas humanas preservadas que fueron extraídas de donantes cadavéricos, pacientes con muerte cerebral o de receptores de trasplante cardíaco. Tres técnicas del homoinjerto para reemplazo valvular aórtico (RVA) se utilizan: 1) sustituir solamente la válvula en la posición subcoronaria; 2) reemplazo de la raíz aortica completa con reimplante de las arterias coronarias; y 3) reemplazo de miniraíz (miniroot) con la válvula y pared aórtica del donante insertadas debajo del ostium coronario de la aorta del receptor. Con ella se alcanza un perfil hemodinámico excelente y tiene trombogenicidad baja, por lo que no hay necesidad de anticoagulación. Las desventajas son que se requiere una cirugía técnicamente más exigente, y por otro lado la baja disponibilidad del homoinjerto.
Válvulas porcinas de heteroinjerto. En 1965 se comienza con el implante de una válvula porcina preservada en formaldehído; como con esta preservación se presentaba una alta incidencia de degeneración precoz con escasa durabilidad, más tarde fueron tratadas con glutaraldehído.3 También se están utilizando diferentes sustancias antimineralizantes que retardan el proceso de calcificación. La mayoría de las válvulas porcinas se montan sobre los soportes (stents) rígidos o flexibles para lo cual a través de suturas se unen las valvas al anillo (figura 6).
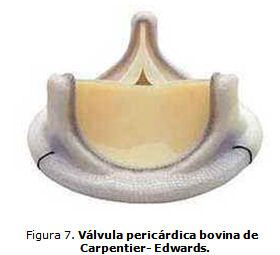
Válvulas pericárdicas bovinas. Comienzan a utilizarse a mediados del decenio de 1970. Con el pericardio de los bovinos como material, las válvulas pericárdicas son adaptadas y suturadas en una configuración valvular sobre un marco de soporte (stent), lo que hace que este tipo de válvula abra más ampliamente que una válvula porcina, con mejor hemodinámica. La mayor durabilidad también es lograda porque hay tejido adicional que permite la contracción y un porcentaje más alto del colágeno disponible que se reticulará durante la fijación. La Ionescu-Shiley, la primera válvula pericárdica disponible comercialmente, experimentó un porcentaje de averías más alto que las válvulas porcinas y fue sacada del mercado después de 10 años de uso. Sin embargo, las fallas eran en parte debidas a aspectos del diseño más bien que a un problema intrínseco con el tejido pericárdico en sí. La BP pericárdica de Carpentier-Edwards se fabrica sin los puntos que pasan a través de las valvas que están presentes en la válvula pericárdica de Ionescu-Shiley. En su lugar, las valvas son ancladas detrás de los pilares del soporte (figura 7).
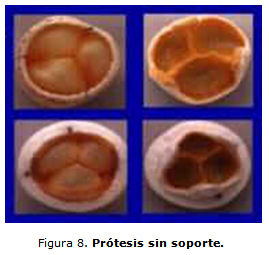
Bioprótesis sin soporte (stenless). Si bien el primer implante de una bioprótesis porcina sin soporte fue realizado por Binet a principios del decenio de 1960, estas bioprótesis fueron introducidas en la práctica clínica en el decenio de 1990. Modelos sin soportes han sido ideados por varios fabricantes. El objetivo es alcanzar algo de ventaja potencial, especialmente en la hemodinámica y durabilidad con respecto al homoinjerto, con un producto comercial fácilmente disponible.1 Las bioprótesis sin soporte son cúspides de válvulas aórticas porcinas tratadas con glutaraldehído y reforzadas con un anillo de dacrón que permite su sutura a la pared aórtica2 (figura 8). Si bien este anillo es más flexible que el anillo de las bioprótesis habituales, su flexibilidad es menor que las de los homoinjertos. La mayor experiencia se relaciona con los implantes en posición aórtica, porque hasta ahora se han comunicado muy pocos implantes en posición mitral.8 De la misma manera que con los homoinjertos hay potencialmente 3 maneras de implantar una válvula porcina sin soporte (válvula solamente, raíz aórtica, miniroot).
EL ARTE DE CONSTRUIR LAS VÁLVULAS Y SUS DESAFÍOS
En esta revisión hemos incursionado en diversos tipos de modelos y diseños protésicos, así como en variedades de biomateriales, con resultados clínicos disímiles.
Hemos comprendido que si bien hubo progresos, éstos hasta el momento no se reflejan proporcionalmente en términos de morbilidad y mortalidad. Sin embargo es necesario resaltar que la contribución de diversas disciplinas durante todos estos años ha sido valiosa; es así como en una primera etapa fue la física y la química, luego la incorporación al ámbito científico de las ciencias interdisciplinarias como la biofísica y la bioquímica produjo el acercamiento entre lo biológico y lo inorgánico. En los últimos años se ha creado la ingeniería biomédica y como resultado de ello se ha hecho imperante el encuentro médico-ingeniero.
Hoy por hoy, en el producto final de una válvula cardíaca protésica intervienen profesionales de diversas áreas: cardiólogos, cardiocirujanos, ingenieros mecánicos, ingenieros electrónicos, ingenieros de sistemas, físicos, diseñadores industriales, entre otros; cada uno aporta su campo del saber, pero confluyen hacia un mismo objetivo.9 No obstante, queda una materia pendiente: lograr que estos tipos de dispositivos valvulares tengan la semejanza fisiológica lo más cercana posible a la de la válvula original.
CONCLUSIONES
Los resultados con las buenas válvulas «antiguas» fueron muy buenos en su momento histórico, al igual que con las buenas válvulas «modernas» en la actualidad. Las tasas de complicaciones como sangrado, endocarditis y trastornos de la prótesis son muy variables y no difieren entre las distintas PM ni entre las diferentes BP. Las BP y los homoinjertos aórticos tienen tasas similares de daño estructural valvular (DEV). Se desconoce la tasa de DEV del autoinjerto pulmonar.
Finalmente uno no puede dejar de coincidir con lo expresado por Rahimtoola cuando refiere que la historia de las VCP se puede resumir en que los avances importantes en este campo han significado incrementos en términos de mejoría de la morbilidad y mortalidad de los pacientes.10 Se debe continuar trabajando en la interrelación entre las diferentes especialidades médicas y no médicas para seguir avanzando en el campo de las prótesis valvulares cardíacas, en busca de una prótesis ideal.
REFERENCIAS BIBLIOGRÁFICAS
1. Azpitarte J, Alonso AM, García Gallego F, González Santos JM, Paré C, Tello A. Guías de práctica clínica de la Sociedad Española de Cardiología en valvulopatías. Rev Esp Cardiol 2000;53:1209-1278
2. Silva H, Bruno C, Albertal J. Prótesis valvulares. En: Bertolasi CA. Cardiología 2000. Buenos Aires: Ed. Médica Panamericana; 2001. Pp.2964-3000.
3. Branwald E. Cardiopatías valvulares. En Branwald E: Tratado de Cardiología. Vol II. México, D.F.: Ed. Interamericana; 1983. Pp. 1246-7.
4. Hufnagel CA, Harvey CP, Rabil PJ. Surgical correction of aortic insufficiency. Surgery 1954;35:673-83.
5. López González A. Evolución del diseño de las prótesis valvulares a lo largo de las últimas cinco décadas. Hospital Universitario Puerta del Mar, Cádiz (España). Revista de Cardiología y Cirugía Cardiovascular. [serie en Internet] 2002. Disponible en: http://www.portalesmedicos.com/portalcardio/revista/abril2002001_art/index.htm
6. Harken D, Soroff H, Taylor W, Lefemine A, Kupta S and Lunzer S. Partial and complete prostheses in aortic insufficiency. J Thor Cardiovasc Surg 1960;40:744-762.
7. Evansville Heart Center. Prosthetic Heart Valve Gallery. Disponible en: http://members.evansville.net/ict/prostheticvalveimagegallery.htm
8. Walther T, Falk V, Lehmann S, Gummert J. Stentless versus Conventional Biological Aortic Valves. Department of Cardiac Surgery, Heartcenter, Univerity Leipzig, Germany. Segundo Congreso Virtual de Cardiología (SCVC) 1º de Setiembre al 30 de Noviembre del 2001, FAC. Area temática: Valvulopatía. Disponible en: http://www.fac.org.ar/scvc/llave/surgery/walther/waltheri.htm
9. Bustamante J. Una Aproximación a la tecnología cardiovascular a través de la interdisciplinariedad: una necesidad latinoamericana. Acta Científica Venezolana 2003;5:11.
10. Rahimtoola SH. The next generation of prosthetic heart valves needs a proven track record of patient outcomes at 15 to 20 years. J Am Coll Cardiol 2003;42(10):1717-9.
Recibido: 17 de marzo de 2009.
Aprobado: 26 de junio de 2009.
Alejandro Villar Inclán. Hospital Clinicoquirúrgico «Hermanos Ameijeiras». Calle Padre Varela y San Lázaro, Centro Habana. La Habana, Cuba.
Correo electrónico: alejandro.villar@infomed.sld.cu