Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.45 n.1 Ciudad de la Habana ene.-mar. 2011
ARTÍCULO ESPECIAL
Surgimiento, evolución y principales resultados del Centro Nacional Coordinador de Ensayos Clínicos*
Emergence, development and main results of the National Coordinating Center of Clinical Trials
María Amparo Pascual LópezI; Gladys Jiménez RiveroII; Ania Torres PombertIII; Martha María Fors LópezIV; Isabel López ZayasV
IDoctora en Medicina. Especialista de I Grado en Bioestadística. Profesora Titular. Investigadora Titular. Centro Nacional Coordinador de Ensayos Clínicos (CENCEC). La Habana, Cuba.
IIBiotecnólogo de II nivel. Máster en Ciencias de la Computación. Investigadora Auxiliar. Centro Nacional Coordinador de Ensayos Clínicos (CENCEC). La Habana, Cuba.
IIIMáster en Ciencias de la Información. Instructora. Investigadora Agregada. Centro Nacional Coordinador de Ensayos Clínicos (CENCEC). La Habana, Cuba.
IVMáster en Farmacología Experimental. Investigadora Agregada. Centro Nacional Coordinador de Ensayos Clínicos (CENCEC). La Habana, Cuba.
VLicenciada en Gestión de Información en Salud. Centro Nacional Coordinador de Ensayos Clínicos (CENCEC). La Habana, Cuba.
RESUMEN
En la década de los 90, el desarrollo acelerado de la Industria Médico Farmacéutica cubana impuso la necesidad de crear estructuras que garantizaran la evaluación clínica de productos para su introducción a la práctica médica y posterior comercialización. Uno de los centros fundados para contribuir con estos fines fue el Centro Nacional Coordinador de Ensayos Clínicos. El presente trabajo recoge en síntesis las razones que motivaron la creación del centro y muestra, brevemente, su desarrollo organizacional por más de 17 años. Describe, además, los principales componentes del sistema de diseño y conducción de ensayos clínicos; así como los aportes más significativos de cada uno de ellos para el cumplimiento de sus objetivos como centro.
Palabras clave: Centro de Investigación por Contrato, evaluación clínica, Industria Médico Farmacéutica, ensayos clínicos, Cuba.
ABSTRACT
The fast development of the Cuban pharmaceutical industry in the 90´s prompted the creation of structures to assure the clinical evaluation of products for their introduction into the medical practice and their further marketing. The National Coordinating Center of Clinical Trials was one of the most important centers founded to accomplish these objectives. The present paper showed in short the reasons behind the emergence of this center and its organizational development for more than 17 years. It also described the main components of the design and the conduction of clinical trials as well as their most significant contributions to fulfill the set objectives.
Key words: Center of research under contract, clinical evaluation, medical pharmaceutical Industry, clinical trials, Cuba.
INTRODUCCIÓN
Durante la década de los 50 tuvo lugar uno de los fenómenos más importantes en la medicina y en la investigación clínica: el surgimiento del ensayo clínico controlado como metodología portadora de la evidencia necesaria para la toma de decisiones, en la práctica médica, para evaluar diferentes procederes terapéuticos. El desarrollo de esta nueva metodología marcó un hito que ha trascendido el plano académico para dictar pautas en el ámbito regulatorio, con el máximo afán de protección de la salud de la población.1
El ensayo clínico es la metodología idónea para evaluar una terapéutica o intervención en humanos, comúnmente conocido como el estándar de oro,2 y constituye también un paradigma para el registro sanitario de tecnologías sanitarias en general.
En la actualidad, uno de los mayores retos que enfrenta la Industria Médico Farmacéutica y Biotecnológica una vez transcurrida la etapa de investigación preclínica, es justamente la etapa de evaluación clínica.3
La aplicación de un fármaco en la práctica médica requiere el desarrollo y evaluación previa de este, primero en animales (evaluación preclínica) y luego en sujetos humanos (evaluación clínica). La etapa preclínica incluye estudios de química-farmacéutica, farmacología y toxicología animal que aportan suficientes elementos de calidad, seguridad y eficacia para avalar el paso a la investigación clínica.
La investigación clínica comprende todo estudio que involucre pacientes, ya sea en la elucidación de aspectos etiológicos, diagnósticos, terapéuticos o pronósticos. Aquellas investigaciones clínicas que permiten evaluar la utilidad y seguridad de agentes para el tratamiento y diagnóstico de las enfermedades, se conocen como ensayos clínicos terapéuticos y/o diagnósticos respectivamente; y son considerados estudios prospectivos en seres humanos, que comparan el efecto y valor de una intervención nueva con una intervención control.4
El ensayo clínico, experimento diseñado en cuidadosa observancia de la ética, en el que los sujetos se asignan a las diferentes intervenciones de manera aleatoria y simultánea (en un mismo período de tiempo), son supervisados también simultáneamente. Este tipo de estudio que permite la evaluación de la eficacia y seguridad de un fármaco o producto en sujetos humanos, se fundamenta en: comparaciones con el patrón terapéutico o diagnóstico; la existencia de al menos 2 grupos concurrentes de pacientes a comparar entre sí; con tratamientos aleatorizados y enmascarados; con un diseño muestral específico y el posterior análisis estadístico de los datos obtenidos.5
La evaluación clínica, etapa previa al registro, se compone de varias fases:6
- Fase I. Seguridad y tolerancia. Farmacocinética y Farmacodinámica.
- Fase II. Efectos, seguridad, tolerancia y otros aspectos farmacológicos.
- Fase III. Eficacia, seguridad y tolerancia.
Una vez que se registra el producto en investigación se desarrolla, por lo general, una cuarta fase:
- Fase IV. Estudios post registro y fármacovigilancia.
El desarrollo acelerado y cada vez más competitivo de la Industria Médico Farmacéutica y Biotecnológica en los últimos 20 años más, la existencia de un ambiente regulatorio con exigencias crecientes, ha obligado a la búsqueda de soluciones para obtener resultados de mayor calidad y eficiencia. Como resultado de lo antes expuesto surge un tipo de institución, típica de países del primer mundo, especializada en la realización de dichos estudios conocida como Organización de Investigación por Contrato, más conocidas por su nombre y siglas en inglés (Contract Research Organisation-CRO). Dichas instituciones aportan ventajas en cuanto a costo, calidad y velocidad de la evaluación clínica, etapa que requiere mayor cantidad de recursos y esfuerzo.7
A la investigación desarrollada por este tipo de organización se le conoce como investigación contratada y está relacionada con la planificación, organización y conducción de los ensayos clínicos; además de emplear un conjunto de procedimientos organizativos que contribuyen a su ejecución.
Los ensayos clínicos favorecen, de igual forma, al seguimiento post comercial de un producto médico; a la introducción de nuevas modificaciones a las terapéuticas en las prácticas médicas; a la educación de los médicos para fomentar el sentido crítico y la correcta evaluación del uso de medicamentos, de otras terapias médicas y de medios de diagnóstico. También contribuyen a elevar la calidad de los servicios médicos mediante la aplicación de los métodos más avanzados en el diagnóstico, tratamiento y evaluación de las enfermedades en estudio.
El desarrollo de la Biotecnología y la obtención de productos médico farmacéuticos desde la década de los 80,8 en Cuba, es bien conocido. Estos productos han requerido ensayos clínicos para ser registrados y comercializados tanto dentro como fuera del país.
Tradicionalmente cada centro productor asumía no solo la evaluación preclínica, sino también la evaluación clínica de sus productos, de forma directa con los hospitales. Algunos ensayos clínicos se realizaron con éxito, con la calidad requerida en el diseño y conducción, y aportaron resultados válidos; pero la mayor parte confrontaban grandes dificultades desde el punto de vista científico y organizativo, se dilataban en tiempo y al final no alcanzaban los resultados exigidos por los registros sanitarios; aunque tuvieran posibilidades reales de ser registrados y comercializados.
Las exigencias cada vez mayores para el registro sanitario de los fármacos y productos biotecnológicos, particularmente en países desarrollados, obligaron a Cuba a trazar una estrategia que contribuyera al registro y comercialización; y lograr lo antes posible, a partir del momento de la obtención del producto, su rápida introducción en la práctica médica y la entrada de dividendos por su exportación.
Entre los objetivos de esta estrategia se encuentra la organización y desarrollo de la actividad reguladora en el país; proceso cada vez más exigente y riguroso, con una aproximación sucesiva a los estándares científicos internacionales. Simultáneamente a la reestructuración del marco regulatorio, se crea la infraestructura de evaluación de productos médico-farmacéuticos y biotecnológicos priorizados para el desarrollo: Química farmacéutica, Preclínica toxicológica y farmacológica.
Dentro de esta infraestructura surge la necesidad de una institución que permitiera la evaluación clínica de nuevos productos que por su carácter priorizado, requerían su rápido registro sanitario en el país y fuera de él. A fines de 1991, se crea una organización para el diseño y conducción de los ensayos clínicos concebida como centro nacional y red de coordinación: el Centro Nacional Coordinador de Ensayos Clínicos (CENCEC): http://www.cencec.sld.cu
El presente trabajo, basado en un análisis documental de fuentes institucionales e informes técnicos no publicados, propone realizar un acercamiento a la evolución del CENCEC desde su origen, así como los principales resultados obtenidos en 17 años de existencia (1991-2008).
Surgimiento del CENCEC
En el marco del proceso de reestructuración, la Comisión Central de Productos Priorizados realizó un levantamiento en todos los centros de investigación de aquellos posibles fármacos que tenían posibilidades de ser registrados, en el cual se encontraron los siguientes resultados:
- Un número elevado de productos con ensayos clínicos diseñados, iniciados y coordinados por los propios productores, en ejecución o concluida esta, pendiente de procesamiento y análisis estadístico de los datos o en elaboración del informe final, con una duración muy larga de cada etapa.
- En algunos casos se inició el ensayo clínico sin haber concluido la fase preclínica o la química farmacéutica.
- Estudios en su mayoría monocéntricos con largos períodos de inclusión de pacientes.
- Dificultades en el rigor científico y metodológico de su diseño y ejecución.
- Estudios en los cuales no se aplicaban las buenas prácticas clínicas ni se realizaba el aseguramiento de calidad.
EL CENCEC, concebido como unidad de ciencia y técnica, con carácter nacional y de forma inmediata como parte de una red de coordinación que abarca todo el país, se crea por la Resolución Ministerial 10 del año 1992;a a partir de la Resolución del Consejo de Ministros 627 del 30 de Noviembre de 1991.b Su propósito era diseñar y organizar la ejecución de los ensayos clínicos que evalúan los diferentes productos para el registro y la comercialización de medicamentos, reactivos, productos biológicos, instrumental, equipos y procedimientos terapéuticos; así como la realización de ensayos comparativos epidemiológicos, todo ello en rigurosa observancia de las buenas prácticas clínicas y a un costo razonable.c
El CENCEC se crea como unidad presupuestada, de alto nivel científico, subordinada al Ministerio de Salud Pública (MINSAP), con personalidad jurídica propia y como parte de la política del MINSAP para dar respuesta al desarrollo clínico de los productos priorizados que requerían de ensayos clínicos. Con el desarrollo y perfeccionamiento de su estructura y funciones de manera progresiva, el CENCEC logró paulatinamente una mayor organización y mejores resultados que le hicieron merecedor de otras categorías.c,d
Objetivos y funciones del CENCEC
El CENCEC surge con el objetivo de "asegurar la evaluación clínica de los productos médico farmacéuticos y biotecnológicos priorizados con todo rigor ético, científico y metodológico de acuerdo con los estándares internacionales y con la eficiencia requerida, para obtener el registro en Cuba y fuera de Cuba con el fin de ser comercializados".1
Para alcanzar este objetivo realiza y contribuye en el diseño, aspectos éticos, organización, coordinación, conducción, aseguramiento global de la calidad, manejo de datos, análisis estadístico y elaboración del informe final para el registro sanitario del producto. Los estudios de evaluación de nuevas tecnologías en salud, así como el apoyo al Ministerio de Salud Pública en la realización de investigaciones clínicas que se requieran para dar solución a algún problema de salud de mayor trascendencia (epidemia u otra situación de emergencia o necesidad), constituyen de igual forma objetivos del centro.
Un propósito importante, a partir de su creación, fue conformar una red de ensayos multicéntricos que contara con un conjunto de instituciones en las diferentes especialidades donde se ejecutaran los estudios. Esta red permite la realización de ensayos clínicos multicéntricos en el país con el fin de aumentar la eficiencia, alcanzar los resultados a mayor velocidad y con los estándares de calidad requeridos. Todo lo cual fue posible por disponer de un sistema de salud único y contar con la infraestructura y preparación científica adecuada del personal de la salud en todas las provincias.9
Entre los principales servicios científico-técnicos que se ofrecen en el CENCEC se encuentran los siguientes:
1. Asesoría en la estrategia de evaluación clínica del producto.
2. Asesoría en asuntos regulatorios (revisión de la información preclínica, asesoría en la preparación del expediente clínico para la presentación al registro sanitario).
3. Servicio total o parcial en el diseño y conducción de ensayos clínicos terapéuticos y diagnósticos:
- Diseño y elaboración de protocolos o revisión de protocolos elaborados por el productor (incluye el Cuaderno de Recogida de Datos).
- Selección de investigadores y sitios clínicos.
- Convocatoria y garantía de dictamen de comités de revisión y ética.
- Planificación, adquisición y distribución de los recursos materiales.
- Diseño estadístico del estudio, diseño de la muestra y del análisis estadístico.
- Conducción de la ejecución (seguimiento de la marcha de la inclusión y actualización al promotor).
- Actividades de aseguramiento de la calidad interna (visitas de evaluación inicial, inicio, controles de calidad y cierre a los sitios).
- Actividades de aseguramiento externo de la calidad en todas las etapas del estudio (auditorías).
- Manejo de datos que incluye la programación de las bases de datos, la entrada, rectificación y limpieza de los datos así como un control de calidad para la liberación de las bases antes de realizar el procesamiento estadístico.
- Procesamiento estadístico con los paquetes estadísticos adecuados.
- Elaboración del informe final con el productor y el investigador clínico principal.
- Talleres de uniformación de criterios y de discusión del informe final con todos los investigadores participantes.
Evolución y resultados principales de los componentes de la organización
El diseño y metodología de los ensayos clínicos realizados en el CENCEC se ha adherido al patrón de oro que requieren estos estudios. La mayor parte de los mismos ha sido concebida, desde el punto de vista científico, como estudios controlados que transcurren por las diferentes fases hasta alcanzar la confirmación de eficacia. Posteriormente, se han diseñado estudios post comercial.e
Sin embargo, en los primeros años se apreciaba una serie de problemas relacionados con el diseño y planificación de los estudios clínicos. Existían demoras excesivas en la etapa de planificación y rechazo por parte de la Agencia Reguladora de Medicamentos (ARM) de los expedientes técnicos de los productos; pues una vez concluido el protocolo, el trámite de autorización de inicio no era aprobado debido a que faltaba información preclínica o químico-farmacéutica o la existente no era suficiente como para aprobar el inicio del estudio clínico.
Para fortalecer esta debilidad tuvo lugar el primer cambio importante en el CENCEC: la creación de un grupo de asuntos regulatorios que se encargaría de evaluar la información preclínica disponible en los expedientes de las nuevas solicitudes y recomendar o no el inicio de la elaboración de un protocolo para el ensayo clínico.
Se desarrollaron, además, una serie de estrategias con vistas a mejorar el diseño de los estudios. Se pueden mencionar entre las más destacadas:
- Creación de una guía de protocolo de ensayo clínico, en especial para la fase III.
- Discusión colectiva de las propuestas de protocolo recibidas y/o elaboradas.
- Entrenamiento y capacitación de todo el personal involucrado.
- Trabajo conjunto con los centros promotores y los investigadores clínicos para la discusión y perfeccionamiento de los diseños y los protocolos.
- Interacción con los registros sanitarios, tanto de medicamentos como de equipos médicos, para el perfeccionamiento de cada fase.
- Creación de un Comité de Calidad para la evaluación del diseño y la primera versión del protocolo, así como proponer las recomendaciones para continuar o no.
Desde el punto de vista organizativo de los ensayos, la función de la Red Nacional Coordinadora de Ensayos Clínicos concebida desde la creación del centro, ha sido determinante en este sentido. La conducción de los ensayos clínicos implica un esfuerzo y dedicación importante en los aspectos organizativos, el carácter nacional del centro obliga a que las actividades relacionadas con la organización vayan más allá del alcance interno de la institución; por esta razón las actividades de coordinación, conducción y aseguramiento de la calidad, entre otras, se realizan a través de la red y alcanzan un carácter extra institucional.
Los ensayos multicéntricos se realizan a través de la aplicación de un único protocolo en varios sitios clínicos de un país, región o del mundo.1,8 Se requiere una coordinación especializada, uniformación de criterios, monitoreo y obtención de datos de forma centralizada. Sus objetivos fundamentales son: lograr una mayor velocidad en la inclusión de pacientes para obtener los resultados, y lograr que la eficacia sea más cercana a la efectividad.5
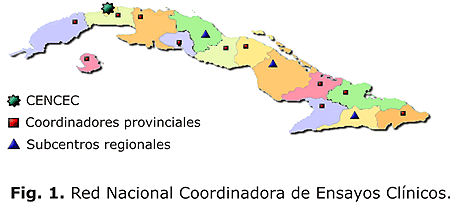
La red tiene sus unidades funcionales en las facultades de ciencias médicas del país (fig. 1), con más de 30 profesionales, que comparten la docencia con la conducción de los ensayos.
Estos estudios clínicos se ejecutan en los servicios asistenciales de los hospitales adscriptos a las facultades de cada territorio. Para su adecuado funcionamiento la red está estructurada en subcentros y grupos de coordinación en tres y nueve provincias, respectivamente; y todos se encuentran subordinados, en cuanto a metodología, al CENCEC. Tienen como responsabilidad la coordinación, aseguramiento de calidad y formación de recursos humanos para la investigación clínica en su territorio.
Para la realización de ensayos clínicos el CENCEC utiliza, además, la Red Nacional de Unidades Clínicas para la Ejecución de los Ensayos Clínicos, que está conformada por unidades hospitalarias de todo el país con el fin de fomentar el desarrollo de ensayos multicéntricos, cubrir la demanda de solicitudes de ensayos clínicos, acelerar la inclusión de pacientes y por consiguiente el proceso de desarrollo del producto y posterior registro.9 Esta red repercute también en beneficios en cuanto a conocimientos y habilidades de los investigadores para la realización de ensayos.
La organización de redes de sitios clínicos por especialidades está creada en algunas de ellas: Oncología, con más de 10 años de experiencia y una gran número de sitios clínicos, funciona en coordinación con el Grupo y Unidad de Oncología del Ministerio de Salud Pública, para la realización de ensayos clínicos específicos sobre cáncer; y la de Psiquiatría, existe en menor número de sitios clínicos, pero dos de ellos con reconocimiento internacional por el cumplimiento de buenas prácticas clínicas y con la participación activa del Grupo Nacional de la Especialidad y la Dirección de Salud Mental del MINSAP.f
Para asegurar la calidad y cumplimiento de las Normas de Buenas Prácticas Clínicas que se establecen en las investigaciones clínicas, se inició un proyecto de certificación de los sitios clínicos en el cumplimiento de dichas normas. Este proceso consta de 2 partes: la preparación para la certificación de sitios clínicos para ensayos clínicos, que la lleva a cabo el CENCEC y la certificación de los sitios que la realiza el CECMED, una vez que el CENCEC los declara listos en su preparación. Hasta el momento se ha iniciado la preparación de 10 unidades en diferentes provincias del país, de las cuales, dos han obtenido ya la certificación: Centro Nacional de Toxicología (CENATOX) y el Centro de Investigaciones Médico Quirúrgicas (CIMEQ).g
Otros resultados organizativos sonV los siguientes:
- Revisión y adecuación de la estructura organizacional del Centro y de la Red de Coordinación, a las tendencias internacionales de los CRO y a la experiencia nacional. Para ello:
- Se crearon nuevos grupos de trabajo: grupos de diseño, análisis y procesamiento de datos, aseguramiento de la calidad, organización y unidad de cooperación internacional.
- Se definieron nuevos perfiles profesionales y sus funciones en la conducción de ensayos clínicos, de acuerdo con el estado del arte de los ensayos clínicos aplicados y acorde con la dirección integral de proyectos.
- Se crearon puestos de trabajo especializados como gerentes de proyectos, asistentes de investigación clínica (monitoreo), responsables de manejo de datos, responsables de análisis estadístico, auditores de la calidad, responsables de organización y conducción, etcétera.
- Inicio del Plan de Acción Magistral con cronograma y control periódico de cumplimiento de los ensayos a través de las visitas de chequeo mensuales y el reporte al productor.
- Sistema de Control de la Marcha de los Ensayos Clínicos de forma automatizada para dar seguimiento a la conducción de los ensayos clínicos en toda la red.
- Trabajo de integración con algunos centros productores como el Centro de Inmunología Molecular (CIM) y el Centro de Ingeniería Genética y Biotecnología (CIGB), en colaboración estrecha con el CECMED, para la conducción de los ensayos clínicos con los requerimientos y creación de procedimientos de forma conjunta.
- Talleres nacionales de unificación de criterios que son organizados para el inicio de los ensayos multicéntricos, previo al inicio de la ejecución del ensayo clínico en la red.
- Establecimiento de relaciones con los proveedores para la elaboración de procedimientos de perfeccionamiento en la planificación de recursos materiales, aseguramiento y distribución.
Otro grupo de importantes cambios estructurales, organizativos y funcionales ha tenido lugar en el centro, los que han modificado positivamente algunos de los componentes esenciales de este como:
- la planificación y distribución de insumos para toda la red nacional desde el CENCEC, que prevé la disponibilidad y necesidad de recursos o insumos médicos por sitio clínico. Estos se adquieren de manera centralizada por el centro y se distribuye a través del servicio certificado de distribución de insumos para el ensayo clínico de la Red Nacional de Distribución de FARMACUBA.
- el manejo de datos y el procesamiento estadístico, concebidos desde la planificación del ensayo y que comprende desde la creación de los cuadernos de recogida de datos, el diseño y validación de las bases de datos, entrada de los datos hasta el procesamiento estadístico.
- el aseguramiento de la calidad cuyos primeros pasos estuvieron relacionados con la implementación de las Buenas Prácticas Clínicas emitidas por el CECMED (1992), hasta lograr la conformación de la Unidad Independiente de Aseguramiento de la Calidad (1995), y más tarde la implementación de un Sistema de Gestión de la Calidad (2006), certificado posteriormente (2008), por la Norma ISO 9001 por la Oficina Nacional de Normalización (ONN) y el órgano internacional AENOR.
- los aspectos éticos en los ensayos clínicos, con la actualización y armonización de las Buena Prácticas Clínicas y el cuidado del cumplimiento de estas; en este sentido se destaca la participación del CENCEC desde el 2001 en el grupo de trabajo para la Armonización de las Buenas Prácticas Clínicas en la región de las Américas.10
- la formación de recursos humanos del centro, la red y el Sistema Nacional de Salud (SNS) que se inició impartiendo seminarios, conferencias y talleres hasta crear la Unidad de Desarrollo Académico y diseñar una "Estrategia curricular para el desarrollo y actualización de los recursos humanos en ensayos clínicos"h para el desarrollo de competencias a corto, mediano y largo plazo. Destacan en este aspecto 4 ediciones del Diplomado Nacional de Ensayos Clínicos hasta el 2007, y el actual proceso de acreditación de la Maestría de Ensayos Clínicos.
- la cooperación internacional dirigida sobretodo a la capacitación del personal del centro, la red y el SNS en materia de ensayos clínicos, el intercambio de experiencias entre Cuba y otros países, el aumento de la visibilidad y el prestigio internacional de la organización.
- el registro público cubano de ensayos clínicos, disponible en http://registroclinico.sld.cu, surgido como respuesta a un requisito internacional, que establece el registro público de todo ensayo clínico previo a su ejecución para garantizar la transparencia de los hallazgos posteriores.
Resultados de la evaluación clínica: ensayos clínicos realizados en el periodo 1992-2008
La evaluación clínica de los productos médico farmacéuticos y biotecnológicos constituye la misión fundamental del centro, por lo que se muestra una síntesis de los resultados más importantes.
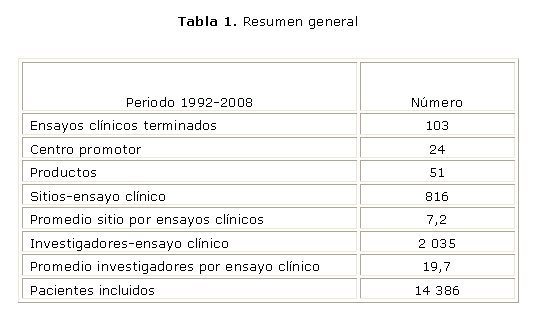
Los ensayos clínicos terminados por la organización teniendo en cuenta los centros promotores, los productos evaluados y sus categorías, los sitios e investigadores clínicos involucrados y los pacientes incluidos se muestran en la tabla 1.
En el periodo de análisis se concluyeron 103 ensayos clínicos, con un total de 51 productos evaluados correspondientes a 24 centros promotores. El número total de sitios clínicos-ensayos clínicos fue de 816 y participaron un total de 2 035 investigadores. Se incluyeron más de 14 000 pacientes en todo el período.
Si se analiza según el centro promotor (tabla 2), el Centro de Ingeniería Genética y Biotecnología (CIGB), el Centro de Inmunología (CIM) y el Centro Nacional de Investigaciones Científicas (CNIC) constituyen el 65 % del total de ensayos terminados. Los productos de estos centros representan el 50 % mientras que el 50% restante se reparte entre otros centros del polo científico del oeste y otras instituciones.
La participación del CENCEC en ensayos clínicos internacionales es de un poco más del 7 % del total de los estudios terminados. Esto se debe a la misión fundamental por la que fue creado el centro y la red: evaluación de productos biotecnológicos y médico farmacéuticos cubanos priorizados para el desarrollo, que han mantenido e incrementado la demanda en todos estos años.
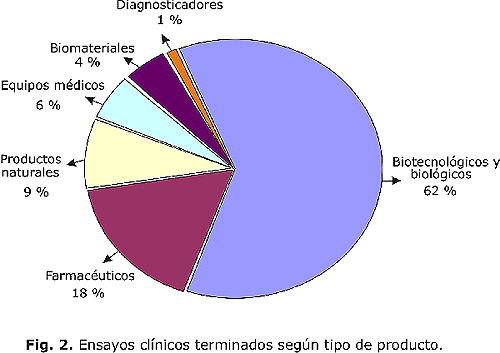
El mayor porcentaje de estudios terminados se concentra en los productos biotecnológicos con el 62 %, seguido de los ensayos realizados con productos farmacéuticos (18 %). Esto se explica por la tendencia de la Industria Biotecnológica a desarrollar cada vez más moléculas novedosas de origen biotecnológico que requieren ensayos clínicos para su registro y comercialización (fig. 2).
El impacto que ha tenido la labor del CENCEC en el registro sanitario de los productos ha contribuido a la obtención de este en Cuba, en una o más indicaciones, y en algunos casos con el registro internacional, lo que repercute en la posible comercialización de los productos fuera del país con el consiguiente impacto económico para el desarrollo integral de la sociedad.
En la tabla 3, se muestran los resultados de la evaluación en la Agencia Reguladora. Del total de productos evaluados se logró el registro sanitario de 26, de los cuales 6 productos se extendieron a todo el país para su uso clínico. Además, en 11 productos se logró la extensión al uso clínico por ser productos ya registrados.
Sin duda, la influencia positiva en el SNS es también un resultado importante de la actividad realizada por el CENCEC, que se traduce en beneficios como:
- Mejoría en los indicadores de salud que se modificaron por los resultados de la introducción de nuevos productos o de un producto registrado en una nueva indicación.
- Cambios en los patrones de atención médica de la enfermedad en que se evaluó el producto, ya que se exigen para la aceptación del protocolo del ensayo clínico, los mejores estándares de diagnóstico, evaluación y tratamiento de la enfermedad; y la introducción de nuevos métodos para el diagnóstico, nuevas tecnologías de evaluación y nuevas terapéuticas asociadas al producto en estudio como los tratamientos concomitantes o tratamientos activos utilizados en los grupos controles.
- Las solicitudes del Ministerio de Salud Pública para solucionar problemas graves de salud como epidemias, sustitución de importaciones e introducción y evaluación de nuevas tecnologías han contribuido a la toma de decisiones importantes.
- Formación y perfeccionamiento de los recursos humanos que participan en el estudio, tanto en la especialidad médica como en materias propias al ensayo clínico, puesto que se requiere estudiar aspectos del estado del arte de la enfermedad o entidad en evaluación; así como en otros campos de la investigación como son las Buenas Prácticas Clínicas, aspectos éticos y los principios de la medicina basada en la evidencia que contribuye a un mayor rigor científico y, por ende, a una mejor atención a los pacientes.
CONSIDERACIONES FINALES
EL CENCEC fue creado en la década de los 90 para garantizar el diseño y ejecución de los ensayos de productos cubanos, emergentes en el mercado nacional e internacional, que necesitaban ser evaluados. Este objetivo ha sido alcanzado y ha superado las expectativas. El centro ha evolucionado positivamente de acuerdo con las tendencias internacionales y los requerimientos crecientes de la Industria Médico Farmacéutica y Biotecnológica cubana, así como en la satisfacción de las necesidades del SNS del país en investigaciones clínicas.
Un aspecto vital en el fortalecimiento del centro, fue la implementación de la Red Nacional Coordinadora de Ensayos Clínicos que abarca todo el SNS, y garantiza mayor eficiencia y rapidez a la realización de ensayos clínicos.
El CENCEC y su red constituyen una organización integral abarcadora de todo el país, diferenciados del resto de las instituciones similares en el mundo (centros de investigaciones por contrato). Algunas características diferenciadoras son el alcance nacional, el compartir funciones de servicios científicos con investigación académica y de salud, así como el perfeccionamiento de los recursos humanos.
La revisión y adecuación a las tendencias internacionales en materia de investigación por contrato en ensayos clínicos ha contribuido a mantener actualizada la organización cubana. Las funciones propuestas desde la creación del centro son de servicio completo, lo cual solo lo realizan los centros de investigación por contrato de gran alcance, global y multinacional. Estas funciones se han consolidado, han supuesto cambios en la estructura y organización, según las tendencias en el mundo y las condiciones del país.
La muestra más fehaciente del logro de los objetivos trazados desde el inicio es el total de ensayos clínicos terminados que contribuyeron al registro sanitario de un grupo importante de productos biotecnológicos y farmacéuticos, la participación activa del sistema de salud en el programa de ensayos clínicos y la modificación de indicadores de salud, de patrones de atención médica y perfeccionamiento de la masa crítica del personal de la salud.
Constituye un reto para el CENCEC mantener y superar la calidad alcanzada en su estructura y delimitación de funciones a fin de garantizar un proceso de evaluación clínica acorde con los estándares internacionales.
La demanda creciente por parte de la industria y la necesidad de realizar más investigación con fines salubristas, lleva a la organización a buscar soluciones eficientes para alcanzar metas no pensadas hace 18 años.
REFERENCIAS BIBLIOGRÁFICAS
1. Pocock SJ. Clinical Trial: a practical approach. Chichester: John Wiley and Sons; 2004.
2. Calva-Mercado JJ. Estudios clínicos experimentales. Sal Púb Méx. 2000;42(4). Disponible en: http://www.scielosp.org/pdf/spm/v42n4/2883.pdf
3. Pascual MA, Jiménez G, Fors M, López I, Rodríguez O, Torres A, et al. La organización de los ensayos clínicos en Cuba: Influencia en el desarrollo de los productos de la Industria Médico-Farmacéutica y Biotecnológica y en el Sistema de Salud de Cuba. Premio Anual de la Salud, Concurso Nacional. Enero, 2010.
4. Friedman LM, Furberg CD, DeMets DL. Fundamentals of clinical trials. 2da ed. Littleton: PSG Publishing Company; 1985.
5. Laporte JR. Principios Básicos de Investigación Clínica. Barcelona: Ergon SA; 1993.
6. ICH Harmonised Tripartite Guideline. ICH E8 General considerations for clinical trials. Geneva: ICH Steering Committee; 1997.
7. Schuchman M. Comercializing Clinical Trials-Risks and Benefits of the CRO Boom. N Engl J Med. 2007;357(14):1365.
8. Lage A. Connecting immunology research to public health: Cuban biotechnology. Nature Immunol. 2008;9(2):109-12.
9. Los Ensayos Clínicos Multicéntricos. La Organización de los Ensayos Clínicos en Cuba. Libro Resumen del II Taller Internacional de Diseño y Conducción de Ensayos Clínicos. Varadero: CENCEC; 2003.
10. Organización Panamericana de Salud. Buenas Prácticas Clínicas: Documento de las Américas. OPS [citado 12 ene 2009]. Disponible en: http://www.paho.org/spanish/ad/ths/ev/GCPSp-hp.htm
Recibido: 5 de octubre de 2010.
Aprobado: 13 de noviembre de 2010.
Dra. María Amparo Pascual López. Centro Nacional Coordinador de Ensayos Clínicos (CENCEC). La Habana, Cuba. Correo electrónico: map@infomed.sld.cu
*Tomado del Suplemento Especial No. 2 de la Revista Cubana de Farmacia, Vol. 45, 2010.
aResolución 10 Ministerio Salud Pública 1992.
bResolución 627 Consejo de Ministros 1991.
cResolución 72/2000 Ministerio de Ciencia y Tecnología y Medio Ambiente: "Unidad de investigación desarrollo".
dResolución 25/2004 Ministerio de Ciencia y Tecnología y Medio Ambiente. Inscripción del centro y red de coordinación nacional en el Registro de "Entidades de Ciencia e Innovación Tecnológica".
eEstado actual de la Investigación Clínica para evaluación de agentes terapéuticos y diagnósticos: Cumplimiento de Normas Internacionales y situación en Cuba. Trabajo presentado en la Reunión de Directivos del Polo Científico del Oeste, 1999.
fProyecto Ramal: Formación de recursos humanos en ensayos clínicos con drogas psicofarmacológicas (CENCEC).
gProyecto Ramal: Certificación de sitios clínicos para la realización de ensayos clínicos en servicios hospitalarios y unidades asistenciales del SNS (CENCEC).
hProyecto Ramal: "Estrategia curricular para el desarrollo y actualización de los recursos humanos en Ensayos Clínicos" (CENCEC).