Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión impresa ISSN 0034-7515
Rev Cubana Farm vol.45 no.3 Ciudad de la Habana jul.-set. 2011
PRODUCTO NATURAL
Formulación de comprimidos de tamarindo por el método de granulación húmeda
Formulation of tamarind tablets using the wet granulation method
Jesús Rafael Rodríguez AmadoI, Ariadna Lafourcade PradaII, Julio César Escalona ArranzIII
I Licenciado en Ciencias Farmacéuticas. Profesor Auxiliar. Universidad de Oriente Cuba.
II Licenciado en Ciencias Farmacéuticas. Instructor. Universidad de Oriente, Santiago de Cuba, Cuba.
III Licenciado en Ciencias Farmacéuticas. Asistente. Universidad de Oriente. Santiago de Cuba, Cuba.
RESUMEN
El objetivo de este trabajo fue la formulación de tabletas farmacéuticas para lo cual se empleó como principio activo el extracto blando de las hojas de la especie Tamarindus indica L. Se utilizó el método de elaboración de tabletas por granulación húmeda a escala de laboratorio. Se prepararon 3 formulaciones en las que se varió las cantidades de lactosa, Aerosil®, celulosa microcristalina y croscarmelosa sódica. Se obtuvieron 3 formulaciones con características adecuadas para el proceso de producción de tabletas, de las cuales la número 3 fue la que mostró mejor calidad tecnológica. Se encontró una relación directa entre la cantidad de desintegrante añadido y el tiempo de desintegración, por lo que deberá estudiarse el efecto de este excipiente para la optimización de esta formulación.
Palabras clave: tamarindo, tabletas, granulación húmeda, extracto blando.
ABSTRACT
The objective of this paper was to prepare tablets using Tamarindus indica L. leaf soft extract as active ingredient. The classic method for manufacturing tablets by means of wet granulation at lab scale was used. Three formulations were prepared in which the quantities of excipients lactose, Aerosil®, microcrystalline cellulose and croscarmellose sodium varied. Three formulations were obtained with adequate characteristics in the manufacturing process but the number 3 exhibited the best technological quality. For further optimization of this formulation, the effect of the excipient must be studied because there was direct relationship between the added amount of disintegrant and the disintegration time.
Key words: Tamarind, tablets, wet granulation, soft extract.
INTRODUCCIÓN
En la actualidad los objetivos fundamentales de la investigación con plantas medicinales están encaminados a identificar plantas con actividad farmacológica, el descubrimiento de nuevas entidades terapéuticas así como de nuevas moléculas activas para el tratamiento de las enfermedades.1 Así se ha incrementado sustancialmente la demanda mundial de los productos de hierbas o plantas medicinales.2 Según la Organización Mundial de la Salud aproximadamente entre el 70 y 80 % de las poblaciones mundiales confían en la medicina no convencional en la atención primaria de salud. Esta estrategia está fundamentada en los criterios etnobotánicos o etnofarmacológicos.3
La selección de especies vegetales para la investigación teniendo en cuenta los criterios etnofarmacológicos permite poner un medicamento de origen vegetal en el mercado relativamente rápido.4 Se afirma que mientras para poner un medicamento con un principio activo sintético en el mercado se necesitan alrededor de 22 900 candidatos, en el caso de los productos naturales, cuando se siguen los criterios etnofarmacológicos, la cantidad se reduce a unos 400.1
La especie Tamarindus indica L. o tamarindo; como se conoce comúnmente, es una planta muy utilizada en India, Pakistán, las islas del Caribe y especialmente en Cuba, donde resulta la que más utiliza la población para el tratamiento de las afecciones hepáticas.5 Se ha reportado en el extracto fluido de las hojas la presencia de polifenoles y flavonoides6 y microelementos como hierro, cobre y selenio que le confieren una fuerte actividad antimicrobiana7 antioxidante8 y hepatoprotectora.9 Se ha comprobado además el efecto regenerador hepático del extracto de las hojas de tamarindo y se ha demostrado que este es dosis dependiente.10 Se ha reportado además para los extractos de las hojas de esta especie un efecto inhibidor de radicales libres y modulador de la producción de óxido nítrico en presencia de toxicidad aguda.11
Teniendo en cuenta los referentes anteriores y la necesidad de desarrollar un producto con actividad hepatoprotectora, ya que en el Cuadro Básico de Medicamentos de Cuba no existe un medicamento de este tipo, el objetivo de este trabajo fue la formulación de tabletas con el extracto blando de tamarindo (EBT) para el tratamiento de las hepatitis y otras afecciones hepáticas.
MÉTODOS
Preparación del extracto blando
Se prepara el extracto fluido de las hojas según Norma Ramal de Salud Pública.12 El EBT se obtiene concentrando a vacío en un roto evaporador (KIKA WERKE GMBH & Co., Alemania), a temperatura de 40 ± 2 ºC hasta aproximadamente un cuarto del volumen inicial.
Evaluación de la calidad del extracto blando
Se evaluaron las características organolépticas, sólidos totales solubles y la densidad relativa según procedimiento descrito en la norma.13
Selección de los excipientes: se seleccionaron 6 excipientes de los más utilizados en la preparación de formas farmacéuticas sólidas: celulosa microcristalina (MC): (Microcell MC 101 USP 28 Blanver, Brasil) lactosa monohidratada (Lac): (Contero Excipients, Nueva Zelanda), polivinilpirrolidona (PVP): (Kolidón 25, Basf, Alemania), dióxido de silicio coloidal: (Aerosil® V-200 Degusa, Bélgica), croscarmelosa sódica(CC): (AcDiSol Blanver, Brasil) y estearato de magnesio (EM): (Derive SA, Alemania).
Método de preparación de los granulados y tabletas
Se siguió el método clásico de granulación húmeda a escala de laboratorio.14 Se fijó la fuerza de compresión tomando como referencia la penetración del punzón superior (3 mm) y se comprimieron las tabletas en una máquina excéntrica (Manesty, UK), utilizando punzones planos biselados de 12,7 mm, para obtener tabletas de 600 mg con 20 % de extracto blando. Se prepararon 5 réplicas de cada formulación de las tabletas. Las tabletas se envasaron en frascos de PVC de alta densidad con tapa inviolable y se almacenaron en lugar seco y fresco. La tabla 1 muestra la composición de cada formulación.
Evaluación de las propiedades físico-mecánicas del granulado
Se determinaron las densidades de vertido y de asentamiento por el método de las probetas. Se calcularon los índices de compresibilidad (IC) y de Haussner (IH), así como la velocidad de flujo (Vf) y el ángulo de reposo (Ar) utilizando las metodologías reportadas en la literatura.14,15
Humedad residual: se realizó por el método gravimétrico, utilizando una balanza gravimétrica Sartorius modelo SA 325, Alemania. Se calculó la humedad residual (Hr) en tanto por ciento dividiendo la masa final entre la inicial por 100.14
Tamaño de partícula: la evaluación de tamaño de partícula (TP) se realizó por el método de los tamices1414 empleando tamices de 800, 500, 400, 325, 200, 100 y 50 mm. Se utilizó una balanza técnica digital (Sartorius TE 3102s) para las pesadas y un equipo vibrador THYL-1 de fabricación alemana en posición 7, por 15 min.
Evaluación de la calidad de las tabletas
Masa promedio: se realizó por el método clásico reportado en la USP 3016 para suplementos dietéticos utilizando una balanza analítica digital Sartorius TE 3102s.
Altura de la tableta: se midió la altura (H) utilizando un micrómetro (MK 0-25; Rusia) según Iraizoz y otros.14 Se reportó la media y la desviación estándar de 10 determinaciones.
Dureza: se determinó la resistencia a la fractura diametral (Du) por el método clásico14 utilizando un durómetro de Monsanto. Se reporta la media y la desviación estándar de 10 determinaciones.
Friabilidad: se realizó por el método clásico14 utilizando un friabilómetro Roche. Se reporta el porcentaje de friabilidad (Fr) y la desviación estándar.
Tiempo de desintegración: se realizó por el método clásico16 utilizando para ello un equipo desintegrador Eureka, de fabricación alemana.
Procesamiento estadístico de los resultados
Se realizó la prueba ANOVA de clasificación simple, para evaluar diferencias significativas entre las variables respuestas estudiadas y se aplicó la prueba de rangos múltiples de Duncan para evaluar los grupos diferentes. Se utilizó un nivel de significación de 5 %. Para el análisis se utilizó el software StatGraphic Plus versión 5.0 para Windows, de StatEase Co. Minneapolis USA.
RESULTADOS
Determinación de los parámetros de calidad del extracto blando
El EBT obtenido presentó una consistencia viscosa, con fuerte olor a fruta madura, sabor ácido y un color marrón oscuro. Se obtuvo un valor de densidad de 1,369 ± 0,055 g/mL; 66,23 ± 1,22 % de sólidos totales y un pH de 3,18 ± 0,1 cuando se disuelve 1g de EBT en 15 mL de agua.
Evaluación de los parámetros de calidad de los granulados
Los resultados obtenidos durante la caracterización de las 3 formulaciones estudiadas, así como los resultados del análisis estadístico se presentan en la tabla 2.
Determinación de las propiedades físico mecánicas de las tabletas
La tabla 3 muestra los valores de los parámetros de calidad determinados en las tabletas para cada formulación así como los resultados del análisis estadístico realizado.
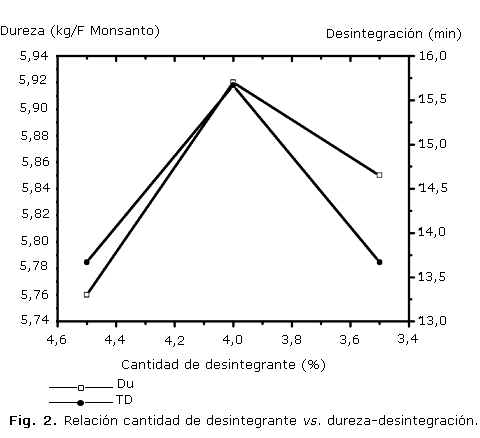
En la figura 1 se muestra el comportamiento de las variables friabilidad y tiempo de desintegración en relación con la dureza, mientras que en la figura 2 se presenta el comportamiento de la dureza y el tiempo de desintegración con respecto a la cantidad de desintegrante utilizado en cada formulación.
DISCUSIÓN
Evaluación de la calidad del extracto blando
El EBT presentó las propiedades habituales que para este producto se han observado por los autores, elemento que indica la uniformidad del proceso de preparación, proceso que en estos momentos se encuentra en fase de estandarización.
Evaluación de la calidad de los granulados
Las 3 formulaciones muestran buena Vf y buen IC, con una Hr 3 %, propiedades que permiten que las 3 formulaciones puedan ser utilizadas en un proceso de fabricación de comprimidos de acuerdo con la literatura especializada.14
El análisis estadístico mostró diferencias significativas entre las medias de las 3 formulaciones en todas las variables respuestas. La prueba de Duncan indicó que el IH y el IC de la formulación 3 fueron diferentes estadísticamente de los de las formulaciones 1 y 2, siendo la número 3 la que presentó los mejores valores de estas propiedades.14
De las 3 formulaciones la número 3 fue la que mostró mejores propiedades de flujo y compresibilidad (menores valores de IC, IH, Ar y mayor valor de Vf) según la literatura especializada.14
El estudio de la Hr mostró que el menor valor se obtiene en la formulación 3, y el TP de esta formulación resultó intermedio entre las formulaciones 1 y 2. El test de Duncan mostró homogeneidad en el TP de las formulaciones 2 y 3, pero la número 2 con un mayor valor de humedad residual. La distribución del tamaño de partícula en las 3 formulaciones fue normal (valores de curtosis y asimetría estandarizadas entre ±2, data no reportada).17
La presencia de mayor cantidad de Aerosil® en la formulación 3 justifica los buenos valores de empaquetamiento de esta, así como las buenas propiedades de flujo, a esto coadyuva también que esta formulación posee mayor cantidad de lactosa, excipiente para compresión directa.18
Evaluación de la calidad de las tabletas
El análisis de Du (tabla 3) mostró que no existen diferencias significativas entre las medias de las 3 formulaciones. La Du aumenta en el orden 1< 3< 2, y todos son buenos valores según la literatura especializada.19 La formulación 3 mostró el menor valor de Fr y resultó significativamente diferente del resto de las formulaciones (prueba de Duncan, tabla 3).
Se obtuvo TD muy buenos en todas las formulaciones.14 Se encontró diferencias significativas entre las formulaciones 1 y 3 en relación con la dos. En el nivel superior e inferior de adición de desintegrante (CC) se obtienen valores más bajos que en el centro, aspecto que puede estar relacionado con la mayor dureza de esa formulación y que constituye un elemento a tener en cuenta en futuros diseños para la optimización del aglutinante y el desintegrante en la formulación.
La masa promedio mostró homogeneidad en las 3 formulaciones. Sin embargo, se encontraron diferencias significativas entre los valores de H de las tabletas para las 3 formulaciones, esto ocurre por las diferencias que se producen en el llenado de la matriz debido a las diferencias en el empaquetamiento, producidas por una mayor fricción interparticular, elemento demostrado en las diferencias del ángulo de reposo y la velocidad de flujo de los granulados de cada formulación.14
La Fr se mantiene en todos los casos por debajo del 1 % y con muy poca variabilidad como consecuencia del aumento de Du. La figura 1 muestra el comportamiento de las variables Fr y TD en relación con la Du. El TD se mantuvo constante para valores de Du por debajo de 5,85 (kg/F Monsanto) y aumenta para valores superiores, lo cual está determinado por el aumento de la Du y la disminución de la cantidad de CC en la formulación 3.
La figura 2 muestra que en el centro de adición del desintegrante (3,5 %) los valores de Du y TD son más altos que en los extremos, lo cual puede estar relacionado con posibles interacciones de los materiales resinosos presentes en el extracto blando, con la CC y el PVP, por lo que para la optimización futura de esta formulación se deberá tener en cuenta en el estudio la región de 3,5 a 4 % de desintegrante, que produce tabletas duras que se desintegran muy bien.
En conclusión, se obtuvieron tabletas partiendo del extracto blando de las hojas de la especie Tamarindus indica L con buena calidad tecnológica. De las 3 formulaciones ensayadas, la formulación número 3 presentó la mejor calidad tecnológica. Se observó que al aumentar la cantidad de desintegrante aumenta el tiempo de desintegración, por lo que deberá estudiarse el efecto de este excipiente para la optimización de esta formulación.
REFERENCIAS BIBLIOGRÁFICAS
1. Sharapin N. Fundamentos de tecnología de productos fitoterapéuticos. Santa Fe de Bogotá: Secretaría Ejecutiva Convenio Andrés Bello; 2000. p. 173.
2. Calixto, JB, Efficacy, Safety, Quality Control, Marketing and Regulatory Guidelines for Herbal Medicines (Phytotherapeutic Agents), Braz. J Med Biol Res. 2000;33:179.
3. Chan K. Some Aspects of Toxic Contaminants in Herbal Medicines. Chemosphere. 2003;52:1361.
4. García MJ, Santos D. Formas orales sólidas (III). En: Monografias galénicas. Madrid: Laboratorios Glaxo; 1993.
5. Roig JT. Plantas medicinales, aromáticas y venenosas de Cuba. La Habana: Ed. Científico Técnica; 1974.
6. Dehesa M, Jauregui O, Cañigueral S. Estudio por HPLC-MS/MS de compuestos fenólicos presentes en las hojas de Tamarindus indica L. Rev Fitoterapia. 2006;6(Supl 1):116.
7. Escalona JC, Péres R; Urdaneta I, Camacho MI, Rodríguez AJ, Licea I. Antimicrobial activity of extracts from Tamarindus indica L. leaves. Phcog Mag. 2010;6:242-7.
8. Komutarin T. Extract of the seed coat of Tamarindus indica L. inhibits nitric oxide production by murine macrophages in vitro and in vivo. Food Chem Toxicol. 2004;42(4):649-58.
9. Pimple BP, Kadam PV, Badgujar NS, Bafna AR, Patil MJ. Protective effect of Tamarindus indica linn against paracetamol-induced hepatotoxicity in rats. Indian J Pharm Sci. 2007;69:827-3.1
10. Escalona JC. Estudio químico farmacéutico de las hojas del Tamarindus indica L. Valoración teórica de la actividad de los flavonoides. Disertación. Santiago de Cuba: ISCM Santiago de Cuba; 2005.
11. Ramos A, Visozo A, Piloto J, García A, Rodríguez CA, Rivero R. Screening of antimutagenicity via antioxidant activity in cubans medicinal plants. J Ethnopharmacol. 2003;87(2-3):241-6.
12. Ministerio de Salud Pública. NRSP 311/91 Medicamentos de origen vegetal. Extractos fluidos y tinturas. Proceso tecnológico. La Habana, Cuba. 1991.
13. Ministerio de Salud Pública. NRSP 312/91 Medicamentos de origen vegetal. Extractos fluidos y tinturas. Métodos de ensayo. La Habana, Cuba. 1991
14. Iraizoz A, Bilbao RO, Barrios MA. Conferencias de Tecnología Farmacéutica II. La Habana: IFAL. Universidad de La Habana, ENPES; 1992.
15. Gibson M, editor. Pharmaceutical Preformulation and Formulation. A practical guide from candidate drug selection to commercial dosage form. Washintong: Interpharm CRC. DC; 2004.
16. United States Pharmacopoeial Convention. USP XXX. United States Pharmacopoeia Convention. 30 ed. New York: Pharm Convention; 2007.
17. Mongomery DC. Design and analysis of experiments. New York: John Wiley; 1984.
18. Rowe RC, Sheskey PJ, Owen SC, editors. Handbook of Pharmaceutical Excipient. Boca Ratón, Florida: Pharmaceutical Press and American Pharmacists Association; 2007.
19. Liberman HA, Lachman L, editors. Pharmaceutical dosage forms. Tablets. New York: Marcel Dekker; 1981.
Recibido: 15 de febrero de 2011.
Aprobado: 8 de abril de 2011.
MSc. Jesús Rafael Rodríguez Amado. Universidad de Oriente. Patricio Lumumba s/n Santiago de Cuba, Cuba. Correo electrónico: jimmy@cnt.uo.edu.cu