Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión impresa ISSN 0034-7515
Rev Cubana Farm vol.46 no.1 Ciudad de la Habana ene.-mar. 2012
ARTÍCULO ORIGINAL
Evaluación de la dimensión fractal reactiva de los glicinatos de magnesio, manganeso y zinc
Evaluation of the reactive fractal dimension of magnesium, manganese and zinc glycinates
Julie Fernanda Benavides Arevalo, Gloria ElenaTobón Zapata
Universidad de Antioquia. Facultad de Química Farmacéutica, Medellín, Colombia.
RESUMEN
Introducción: complejos de glicina con los cationes magnesio, manganeso y zinc podrían ser parte de una formulación de un suplemento nutricional que proporcione una adecuada absorción de los metales en el organismo sin generar molestias gastrointestinales.
Objetivo: realizar una aproximación a la solubilidad de los complejos de glicina con los cationes magnesio, manganeso y zinc.
Métodos: se efectuaron estudios de disolución y análisis de imagen. Se realizó la síntesis y la verificación de formación de los complejos por espectroscopia infrarroja, calorimetría de barrido diferencial, análisis termogravimétrico y difracción de rayos X de polvos.
Resultados: se obtuvieron por análisis de imagen los descriptores: circularidad, diámetro de Feret y dimensión fractal; esta última se relacionó con el proceso de disolución en agua, para obtener dos propiedades relacionadas: la dimensión fractal superficial y la dimensión fractal reactiva.
Conclusiones: los resultados muestran que el proceso de disolución de los glicinatos, se realiza a través de los poros o grietas de la superficie de las partículas de estos y que son aptos para su empleo en formulaciones nutricionales como fuentes de magnesio, manganeso y zinc.
Palabras clave: glicina, glicinatos, dimensión fractal, estudios de disolución.
ABSTRACT
Introduction: Complexes of glycine and cations magnesium, manganese and zinc, could be included in the formulation of a nutritional supplement that provides adequate absorption of these metals into the body without gastrointestinal disturbances.
Objective: to study the solubility of complexes of glycine and cations manganese, zinc and magnesium.
Methods: dissolution and image analysis studies were performed. The synthesis and verification of the formation of complexes were carried out by infrared spectroscopy, differential scanning calorimetry, thermal gravimetric analysis, and X-ray diffraction of dust.
Results: the image analysis showed some descriptors such as circularity, the Ferret diameter and the fractal dimension. The latter was related to the water dissolution process in order to obtain two associated properties, that is, the surface fractal dimension and the reactive fractal dimension,
Conclusions: these results showed that the dissolution of glycinates occurs through the pores or cracks found in their particle surfaces and that these complexes are suitable for use in nutritional formulations as sources of magnesium, manganese and zinc.
Key words: glycine, glycinate, fractal dimension, dissolution studies.
INTRODUCCIÓN
Los metales son elementos químicos simples, cuya presencia e intervención es imprescindible para la actividad de las células, el control del metabolismo, la regulación de funciones hormonales y el transporte de sustancias a través de membranas. No pueden ser sintetizados por el organismo, por lo cual se deben ingerir en la dieta; sin embargo, los modernos hábitos alimentarios tienden a favorecer el consumo de alimentos con bajas concentraciones de metales. La mayoría de los suplementos dietarios disponibles para suplir la deficiencia de estos elementos, incluyen sus formas inorgánicas (cloruros, óxidos, carbonatos y sulfatos), que causan intolerancia gastrointestinal y afectan el proceso de absorción y el aprovechamiento metabólico de los metales en el organismo.1,2
A través de la quelación de los metales con enzimas, hormonas, proteínas o aminoácidos, es posible lograr formas organometálicas, que pueden ser fácilmente absorbidas por las vellosidades intestinales, y pasar así al torrente sanguíneo.3 A través de experimentos realizados, se ha comprobado que la absorción de los quelatos de aminoácidos y metales, es muy superior a la de cualquier otro tipo de compuesto con metales.4-6
Este trabajo tiene el objetivo de realizar una aproximación a la solubilidad de glicinatos de magensio, manganeso y zinc, considerándose la evaluación de la dimensión fractal reactiva (DR), (empleando análisis de imagen y el perfil de disolución en medio acuoso), como parte de un proyecto que pretende elaborar un suplemento nutricional que contiene oligoelementos ligados a aminoácidos, así como la síntesis y la verificación de la formación de los complejos por espectroscopia infrarroja (FTIR), calorimetría de barrido diferencial (DSC), análisis termogravimétrico (TGA) y difracción de rayos X de polvos (DRXP).
MÉTODOS
Síntesis de los complejos
Para la síntesis de los glicinatos se empleó glicina 98,5 % (SIGMAALDRICH), carbonato de magnesio, sulfato de manganeso y óxido zinc (Merck). La relación metal ligando fue de 1:2 y se realizó conforme a procedimientos ya descritos.6,7 Los complejos precipitaron como polvos microcristalinos y fueron removidos por filtración, utilizando papel de filtro Advantec MFS No. 131. Se secaron los cristales a 25 ± 2 °C, por 72 h y luego se pasaron por tamices Tyler® ASTM E11 No. 140, No. 120 y No. 80.
Determinación de la humedad y el contenido de metal
En los glicinatos la humedad se obtuvo en una balanza OHAUS MB200, utilizando 5 g de muestra, a una temperatura de 85 °C durante 15 min, condiciones establecidas para compuestos similares en la USP 32 NF 27.8
El contenido de metal se determinó por absorción atómica, en un equipo Analyst 300, marca PerkinElmer, con lámparas de magnesio, manganeso y zinc, Lumina TM Lamp, marca CURTIS INDACHRON.
Análisis de imágenes
Para el análisis de imagen se utilizó un microscopio óptico marca BOECO adaptado a un computador con cámara digital, de diseño propio y validado.9 Las microfotografías se tomaron con un objetivo de 10X, con una resolución de 320 × 240 píxeles, con 100 proyecciones de partículas de cada complejo y de cada tamiz, suspendidas en silicona. Las imágenes fueron tratadas con el software Image J para obtener los descriptores: diámetro de Feret, circularidad y dimensión fractal (D). El cálculo correspondiente para obtener la dimensión fractal de superficie (DS), se obtuvo conforme a lo descrito en la literatura.6,10 DR se obtiene a partir de la eficiencia de la disolución de los tres tamaños de partícula para cada glicinato.6,11
La distribución del tamaño de partícula se realizó por el método de la USP 32 NF 27 y el tamaño de partícula promedio por fracción se obtuvo mediante el empleo de un software de desarrollo propio.9,12
Espectroscopia infrarroja, análisis calorimétrico y difracción de rayos X de polvos
Las mediciones fueron realizadas al ligando libre y a los complejos sin tamizar. Los espectros IR se obtuvieron en un espectrofotómetro Spectrum Bx, por transformada de Fourier marca Perkin Elmer, entre 4 000 y 500 cm-1 en pastillas de KBr. Los estudios de DSC se realizaron en un calorímetro DSC 200 PC-phox, marca Netzsch, en un intervalo de 25 a 500 °C a 10 °C/min, con el empleo de crisoles de aluminio en atmósfera de aire. El TGA se llevó a cabo en un analizador termogravimétrico TA Instruments Hi-Res TGA 2950, con flujo de 40 mL min-1 en atmósfera de aire, en un rango de temperatura entre 25 y 500 °C, a una velocidad de calentamiento de 10 °C min-1.
La DRXP fue realizada en un difractómetro de rayos X para polvos marca Rigaku, operado a 40 kV y 30 mA, provisto de una fuente de Cu (l= 1,5418 Å), realizando un barrido 2 theta de 3 a 50° a una velocidad de barrido de 2°/min.
Estudios de disolución
Se realizaron los ensayos de disolución para las tres fracciones de cada complejo y se desarrollaron conforme a las metodologías descritas en la USP 32 NF 27, utilizando un equipo disolutor Tipo II (paletas), a 75 rev/min y a 37 °C. Considerando el contenido de metal en cada complejo, se ensayó una dosis equivalente al requerimiento diario nutricional de cada metal (6 mg de Mg, 2 mg de Mn y 10 mg de Zn) en 900 mL de agua desionizada.13,14 La toma de muestras se realizó a intervalos de 10 min durante 60 min, y se determinó por absorción atómica, el porcentaje disuelto de metal en el tiempo, para lo cual se utilizó una curva de calibración realizada según la metodología contenida en la USP 32 NF 27 y con estándares de magnesio, manganeso y zinc (Merck)8. Los resultados corresponden a los promedios de tres replicas, considerando la desviación estándar.
RESULTADOS
La humedad en los glicinatos de magnesio, manganeso y zinc fue de 1,60 ± 0,11 %; 1,00 ± 0,10 % y 1,40 ± 0,12 %, respectivamente; estos resultados son menores al 5 %, lo cual indica que los complejos pueden ser utilizados en procesos industriales farmacéuticos y no presentarán problemas durante el almacenamiento.
En cuanto al contenido de metal, este fue de 12 % de Mg, 27 % de Mn y 26 % de Zn; lo que sirvió de base para suponer una composición para los glicinatos de Mg(gly)2.2H2O, Mn(gly)2 y Zn(gly)2.0,5 H2O.
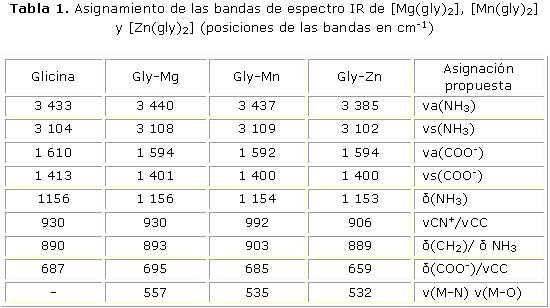
Los espectros vibracionales de glicina libre y los complejos con magnesio, manganeso y zinc, se realizaron basados en referencias generales, y la asignación se efectuó con respecto a otras moléculas y complejos relacionados.15,16 En La tabla 1 se muestran las asignaciones propuestas para las vibraciones del ligando libre y los complejos.
La DSC de la glicina presenta tres picos: endotérmico en 35,4 °C, exotérmico en 74,6 °C y endotérmico en 256,4 °C (atribuido al punto de fusión).
El glicinato de magnesio (Gly-Mg), presenta dos picos endotérmicos a 249,0 °C y a 443,8 °C, relacionados en el TGA con pérdidas de 19,35 y 58,29 %, atribuidas a la liberación de dos moléculas de agua fuertemente ligadas, y a la liberación de CO2 y NO. El residuo de 22,36 %, corresponde a MgO.17,18
El glicinato de manganeso (Gly-Mn) presenta un pico exotérmico que comienza en 390,9 °C, que está acompañado en el TGA de una pérdida de 36,62 %, asociada a la liberación de CO2 y NO. El residuo de 43,31 % corresponde a MnO2.17,19
El glicinato de zinc (Gly-Zn) presenta tres picos endotérmicos a 114,7; 242,6 y 261,2 °C, acompañados en TGA de pérdidas de 3,27; 28,66 y 36,58 %, que corresponden a la pérdida de una molécula de agua, la descomposición de las moléculas de ligando y a la liberación de CO2 y NO, dejando como residuo ZnO correspondiente a una pérdida de 31,49 %.17,20
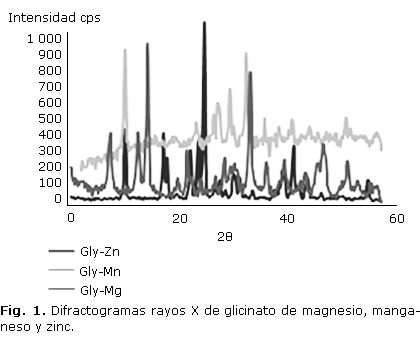
En la figura 1, se muestran los DRXP de los complejos, en ninguno de ellos se observan rastros del ligando libre, y se evidencia la cristalinidad de todos los complejos.
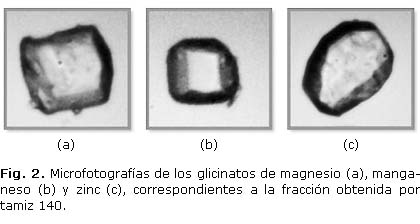
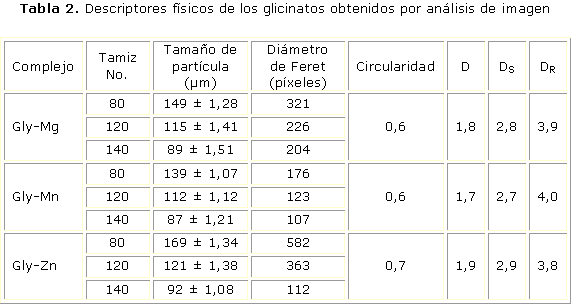
Las microfotografías de los glicinatos, fracción correspondiente al tamiz 140, se muestran en la figura 2, y en la tabla 2 se presenta el tamaño de partícula promedio para cada fracción de cada complejo, además de los promedios de los descriptores físicos obtenidos por análisis de imagen.
El diámetro de Feret mide la distancia entre los pares de líneas paralelas tangentes a la silueta de una partícula en dos dimensiones.21 El complejo de manganeso presenta la menor magnitud de diámetro de Feret y a su vez menor polidispersidad. El complejo de zinc es el de mayor diámetro de Feret y mayor polidispersidad. La circularidad determina la rugosidad del contorno y también de la elongación de una partícula.22 La circularidad de los tres complejos está entre 0,6 y 0,7, lo cual indica que las partículas tienden a ser esféricas y de contorno liso, este resultado concuerda con el obtenido para D y DS.6,9 Los resultados próximos a 2 de D y mayores de 2 para DS, en los tres glicinatos, indican la presencia de partículas de perímetro no rugoso. A su vez, estos últimos descriptores se emplean para referir la forma, la geometría de una partícula, el grado de irregularidad que presenta la partícula y su similitud con otra de tamaño diferente, lo cual, junto con la dimensión fractal reactiva se asocian con el proceso de disolución.6,10
Se realizó la disolución de los glicinatos en máximo a los 60 min, y se presentó a los 20 min la mayor tendencia ascendente del proceso. La figura 3 muestra los perfiles de disolución para los glicinatos de magnesio, manganeso y zinc. En la velocidad de la disolución fue determinante el tamaño de partícula, presentando para las partículas de menor tamaño la mayor disolución. El porcentaje máximo de disolución alcanzado se obtuvo para la fracción obtenida con el tamiz No. 140, siendo de 87,51; 90,11 y 82,39 %, para los glicinatos de magnesio, manganeso y zinc.
DISCUSIÓN
Los espectros IR del aminoácido libre y de los complejos, indican que la molécula de glicina actúa como un ligando coordinado a los iones metálicos a través del grupo carboxilo. Los picos bien definidos entre 3 440 y 3 385 cm-1, en el espectro de glicina y en los glicinatos, son asignados a la vibración del grupo amino; las bandas entre 3 102 y 3 109 cm-1 están relacionadas a las vibraciones asimétricas de este mismo grupo. Después de la complejación, en todos los glicinatos se observan desplazamientos de bandas relacionadas con la unión del metal al grupo carboxílico. Las vibraciones asimétrica y simétrica del grupo carboxilo a 1 610 y 1 413 cm-1, se desplazan en los tres complejos, lo que evidencia que este grupo está involucrado en la unión con el metal. Los estiramientos de Mg-O, Mn-O y Zn-O, se asignan respectivamente a las vibraciones localizadas en 557, 535 y 532 cm-1, de acuerdo con informes previos.15,16
Por DSC y TGA se encontraron residuos de los óxidos de los tres cationes, lo que concuerda con lo reportado.17-20
La difracción de rayos X muestra la cristalinidad de los glicinatos, la diferencia entre ellos y la ausencia de ligando libre.
La fracción más predominante en los tres glicinatos corresponde a la obtenida por el tamiz No. 80, además, las partículas de las fracciones de cada uno de los complejos presentan autosimilitud, y el comportamiento de las fracciones de cada tamaño (en todos los glicinatos), presentan un resultado coherente y predecible.
En los tres glicinatos DR tiene un valor mayor que DS, esto implica que el proceso de disolución ocurre selectivamente en grietas superficiales de las partículas o a través de poros. Los resultados de DR, para los tres glicinatos están entre 3,8 y 4,0; y aunque DR usualmente presenta valores entre 2 y 3, el mayor valor encontrado no es inesperado ya que en reacciones catalíticas, como son las catálisis ácido-base y electrostáticas de los aminoácidos, se amplía el rango a valores entre 0,2 y 5,8.23
La alta eficiencia del proceso de disolución se ve favorecida por el menor tamaño de partícula y por la presencia de grietas superficiales, al mejorar estas dos características se espera una mayor solubilidad. Los resultados encontrados muestran que los complejos aquí descritos son una alternativa viable para la suplementación de metales.
Agradecimientos
Los autores expresan sus agradecimientos a Laboratorios Mineralin, Medellín, Colombia por su contribución al desarrollo de este trabajo.
REFERENCIAS BIBLIOGRÁFICAS
1. Hanikenne M, Merchant S, Hamel P. Transition metal nutrition: a balance between deficiency and toxicity. The Chlamydomonas: organellar and metabolic processes. 2nd ed. Ottawa: David Stern; 2009. p. 333-99.
2. Violante A, Ricciardella M, Pigna M, Capasso R. Effects of organic ligands on the adsorption of trace elements onto metal oxides and organo-mineral complexes. In: Huang PM, Gobran GR, eds. Biogeochemistry of trace elements in the rhizosphere. Amsterdam: Elsevier; 2005. p. 157-82.
3. Casanueva E, Kaufer M, Pérez A, Arroyo P. Nutriología Médica. México, DF: Panamericana; 1995. p. 329-421.
4. Abdessamad Arbaoui, Redshaw C, Sanchez-Ballester NM, Elsegood MRJ, Hughes DL. Bimetallic copper(II) and zinc(II) complexes of acyclic Schiff base ligands derived from amino acids. Inorganica Chimica Acta. 2011;365:96-102.
5. Niklas N, Wolf S, Liehr G, Anson CE, Powell AK, Alsfasser R. Ni(II), Cu(II) and Zn(II) complexes of a bifunctional bis(picolyl) amine (bpa) ligand derived from glycine. Inorganica Chimica Acta. 2000;314:126-32.
6. Tobón G, Benavides J, Flórez O. Copper glycinate: an approach to its solubility. Rev Cubana Farm [Internet]. 2009;43(1). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75152009000100005&lng=es
7. O´Brien P. The preparation and characterization of the geometric isomers of a coordination complex: cis- and trans glycinate copper complex (II). J Chem Educ. 1982;59:1052-3.
8. United States Pharmacopeial Convention. Physical test and Determinations. The official compendia of standards USP 32 NF 27 Dietary supplements. Rovkville: Mack Printing; 2010. p. 1057-120.
9. Tobón G, Flórez O, Baena J. Validación de la Técnica de Análisis del tamaño de partículas por medio de un microscopio de luz óptica asistido por un computador personal. Vitae. 2006;13:85-95
10. Farin D, Avnir D, Reactive Fractal Surface. J Phys Chem. 1987;91:5517-21.
11. Farin D, Avnir D. Use of fractal geometry to determine effects of surface morphology on drug dissolution. J Pharm Sci. 1992;81:54-7.
12. United States Pharmacopeial Convention. Physical test and Determinations. The official compendia of standards USP 32-NF 25. Particle size distribution estimation by analytical sieving. Rockville: Mack Printing; 2010.
13. United States Pharmacopeial Convention. Physical test and Determinations. The official compendia of standards USP 32-NF 27. Dissolution. Rockville: Mack Printing; 2010.
14. Valores de referencia diarios y nivel de ingesta máximo tolerable de vitaminas, minerales y oligoelementos para suplementos dietarios. República de Colombia, Ministerio de la Protección Social. Decreto 3249 de 2006.
15. Fischer G, Cao X, Cox N, Francis M. The FT-IR spectra of glycine and glycylglycine zwitterions isolated in alkali halide matrices. Chemical Physics. 2005;313:39-49.
16. Wagner C, Baran E. Vibrational spectra of Zn(II) complex of the amino acids with hydrophobic residues. Spectrochimica Acta. 2009;72:936-40.
17. Casale A, Robertis A, Stefano C, Gianguzza A, Patan G, Rigano C, Sammartano S. Thermodynamic parameters for the formation of glycine complexes with magnesium(II), calcium(II), lead(II), manganese(II), cobalt(II), nickel(II), zinc(II) and cadmium(II) at different temperatures and ionic strengths, with particular reference to natural fluid conditions. Thermochimica Acta. 1995;255:109-41.
18. Morozov S, Malkov A, Malygin A. Synthesis of Porous Magnesium Oxide by Thermal Decomposition of Basic Magnesium Carbonate. Russian J General Chemistry. 2003;73:33-42.
19. Mrozek R, Rzczyñska Z, Sikorska-Iwan M. Thermal analysis of manganese (II) complex with glycine. J Thermal Analysis Calorimetry. 2001;63:839-46.
20. Kanari N, Mishra D, Gaballah I, Dupré B. Thermal decomposition of zinc carbonate hydroxide. Thermochimica Acta. 2004;410:93-100.
21. Bouwmana A, Bosmaa J, Vonkb P, Wesselinghc J, Frijlinkd H. Which shape factor(s) best describe granules. Powder Technology. 2004;146:66-7.
22. Huang L, Tong W. Impact of solid state properties on develop ability assessment of drug candidates. Advanced Drug Delivery Reviews. 2004;56:321-34.
23. Cheung K, Wong W, Ma D, Lai T, Wong K. Transition metal complexes as electrocatalystsdevelopment and applications in electro-oxidation reactions. Coordination Chemistry Reviews. 2007;251:2367-85.
Recibido: 13 de octubre de 2011.
Aprobado: 16 de noviembre de 2011.
Julie Fernanda Benavides Arevalo. Universidad de Antioquia. Facultad de Química Farmacéutica, Ciudad Universitaria, oficina 5-108. Medellín, Colombia. Correo electrónico: getobon@farmacia.udea.edu.co