Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm vol.49 no.2 Ciudad de la Habana abr.-jun. 2015
ARTÍCULO ORIGINAL
Reacciones adversas no descritas en embarazadas de Cuba
Non-described adverse reactions in pregnant women in Cuba
MSc. Juan Antonio Furones Mourelle,I MSc. Dalilis Druyet Castillo,II MSc. Ángel Francisco López Aguilera,III MSc. María Aida Cruz Barrios,I MSc. Giset Jiménez LópezIV
I Escuela Nacional de Salud. La Habana, Cuba.
II Ministerio de Salud Pública. La Habana, Cuba.
III Facultad de C. Médicas Julio Trigo, La Habana, Cuba.
IV Centro de Control Estatal de la Calidad de Medicamentos y Equipos médicos. La Habana, Cuba.
RESUMEN
Introducción: el perfil de seguridad de los medicamentos en las embarazadas es incompleto, porque estas se excluyen de los ensayos clínicos. El propósito de la Farmacovigilancia es detectar reacciones adversas nuevas a medicamentos.
Objetivo: caracterizar las reacciones adversas no descritas en embarazadas en Cuba.
Método: se realizó un estudio descriptivo y transversal. El universo fue las reacciones adversas medicamentosas en embarazadas registrada en la base de datos del sistema de Farmacovigilancia cubano, la muestra fue de 126 reacciones no descritas reportadas de 2003 a 2012. Las variables fueron datos demográficos, reacción adversa, gravedad, sistema de órganos, medicamento, grupo farmacológico, nivel de atención y notificador; se consideró reacción adversa medicamentosa no descrita, aquella que no aparece en el Formulario Nacional de Medicamentos. El análisis estadístico fue descriptivo.
Resultados: las reacciones adversas no descritas predominaron en gestantes de 20 a 30 años (57 %), con edad gestacional sin precisar (77 %). El 2003 fue el año de mayor reporte (26,0 %). Las reacciones indeseables más frecuentes fueron cefalea, taquicardia y náuseas (7,9 %), las moderadas (52,3 %), que afectaron el sistema nervioso central (21,4 %), producidas por antimicrobianos (23 %), Prenatal® (14,2 %) y fármacos con categoría de riesgo B (33 %) en el embarazo, reportadas más por médicos (67 %) del nivel secundario de salud (56 %).
Conclusiones: las reacciones adversas medicamentosas no descritas en embarazadas representaron una pequeña proporción de las notificadas en la década estudiada, con características similares a las reacciones adversas descritas solo para gravedad, categoría de riesgo del fármaco en embarazo y profesional notificador.
Palabras clave: reacción adversa medicamentosa, embarazada, farmacovigilancia, farmacoepidemiología, estudio poscomercialización.
ABSTRACT
Introduction: The safety profile of drugs in pregnant women is incomplete because they are excluded from the clinical assays. The purpose of pharmacosurveillance is to detect new adverse drug reactions.
Objective: To characterize the non-described adverse reactions in pregnant women in Cuba.
Method: A descriptive and cross-sectional study was conducted and the universe of study was adverse drug reactions in pregnant women reported to the database of the Cuban pharmacosurveillance system. The sample was made up of 126 non described reactions reported from 2003 to 2012. The variables were demographic data, adverse reaction, severity, system of organs, medication, pharmacological group, level of care and notification. Non described adverse reaction was considered as that one not included in the National Formulary of Drugs. The statistical analysis was descriptive.
Results: Non described adverse reactions predominated in pregnant women aged 20 to 30 years (57%), with imprecise gestational age (77%). The most reported year (26%) was 2003. The most common undesirable reactions were headache, tachycardia and nauseas (7.9%), the mild reactions (52.3%) affected the central nervous system (21.4%) caused by antimicrobials (23%), Prenatal® (14.2 %) and risk B drugs (33%) in pregnancy reported more by physicians (67%) of the secondary health care level (56%).
Conclusions: Adverse drug reactions which are not described in pregnant women represented a small portion of the notified ones in the studied decade, with similar characteristics to those of described adverse reactions in terms of severity, category of drug risk in pregnancy and notifying professional.
Keywords: adverse drug reaction, pregnancy, pharmacosurveillance, drug epidemiology, post-market study.
INTRODUCCIÓN
Desde el siglo pasado, la introducción de medicamentos en el mercado farmacéutico a nivel mundial, se incrementó de forma exponencial. Este aumento, no siempre se acompañó de una evaluación pertinente de la relación beneficio-riesgo, que unido a un uso irracional, acrecentó las reacciones adversas medicamentosas (RAM), que impactó en la morbilidad y mortalidad.1
La tragedia de la talidomida en embarazadas, ocasionó más de 10 000 casos de focomelia y acaparó el interés de los gobiernos y la comunidad científica en todo el mundo sobre el problema de la seguridad de los medicamentos. El acontecimiento contribuyó, a que ocho años más tarde, la Organización Mundial de la Salud (OMS) propusiera la creación de un centro de Farmacovigilancia internacional en Uppsala, Suecia.2
La Farmacovigilancia es la ciencia y las actividades relativas a la detección, evaluación, comprensión y prevención de los efectos adversos de los medicamentos u otro problema relacionado con ellos.3 Su principal objetivo es identificar las RAM no descritas y su método de investigación más usado es el reporte espontaneo de efectos indeseables.4
La reacción adversa no descrita, es aquella que no aparece en la rotulación del producto o que no ha sido comunicada a la autoridad sanitaria por el laboratorio que obtuvo el registro del producto al momento de solicitarlo. El elemento predominante en este caso es que el fenómeno sea desconocido. El análisis de las RAM no descritas contribuye de forma decisiva a completar el perfil de seguridad de los fármacos.5
Las embarazadas son una población con características especiales para el uso de medicamentos, por el peligro potencial que tienen los fármacos de producir efectos teratogénicos y por constituir un factor de riesgo para presentar reacciones adversas a ellos, producto de los cambios fisiológicos que ocurren durante este periodo que alteran los procesos farmacodinámicos y farmacocinéticos de los medicamentos, por lo que por razones éticas se excluyen las gestantes de los ensayos clínicos precomercialización.6
Como consecuencia existe insuficiente información sobre la seguridad de los medicamentos que se prescriben a embarazadas para tratar enfermedades crónicas como hipertensión arterial, diabetes, epilepsia y otras, como las que aparecen durante el embarazo.7
La exposición a medicamentos durante el embarazo es elevada. Entre un 44,2 y un 99,5 % de las mujeres embarazadas, toman algún medicamento en este período. El número medio de fármacos durante el embarazo varía entre 2,6 y 13,6 fármacos por gestante. Un estudio realizado en esta población especial encontró que el 26,6 % de las embarazadas reciben medicamentos dañinos en potencia para el feto y un 28,7 % medicamentos sin clasificación teratogénica.8-10 Una investigación realizada en ocho policlínicos, de Cuba, se encontró que más del 95 % de la gestantes se expusieron a fármacos, con una media que varió de 2,1 a 2,5 medicamentos según trimestre del embarazo.11
Cuba es miembro de la Red Internacional de Farmacovigilancia de la OMS desde el año 1994.12 El Sistema de Farmacovigilancia cubano se ubica entre los diez países con mayor tasa de reporte de efectos indeseables por millón de habitantes a nivel mundial13 y posee entre sus áreas de trabajo priorizado las poblaciones más vulnerables de padecer RAM, como las embarazadas. Sin embargo, no dispone de información sobre las peculiaridades de las RAM no descritas en gestantes, que constituya una base científica de referencia para realizar futuras investigaciones en este campo y que contribuya a perfeccionar el perfil de seguridad de los fármacos. El objetivo de la investigación fue caracterizar las reacciones adversas no descritas en embarazadas en Cuba.
MÉTODOS
Se realizó un estudio descriptivo y transversal, de serie de casos en Farmacovigilancia. El universo estuvo constituido por todas la RAM en embarazadas registradas en la base de datos FarmaVigiC del Sistema de Farmacovigilancia cubano, se seleccionó una muestra, de forma intencional, de 126 RAM no descritas reportadas entre el 1ro de enero de 2003 al 31 de diciembre de 2012, producidas por fármacos incluidos en el Formulario Nacional de Medicamentos de Cuba (FNM) y por la vacuna anti H1N1, Pandermix®. Se excluyeron las RAM por sangre y hemoderivados, así como por Medicina Natural y Tradicional. La categoría de riesgo en el embarazo de los medicamentos se clasificó según la Escala de riesgos definidos por la Administración de Drogas y Alimentos de Estados Unidos (FDA, por sus siglas en inglés).14
Las variables utilizadas fueron las características demográficas, las RAM no descrita, el sistema de órgano afectado, el medicamento y su categoría de riesgo en el embarazo, el grupo farmacológico, la gravedad, el profesional notificador y el nivel de atención de salud. Se consideró RAM no descrita, aquellas que no aparecen documentadas en el FNM de Cuba, versiones 2003, 2006 y 2011.
La información se obtuvo de la Base de datos Nacional de Farmacovigilancia, denominada FarmaVigiC. La confiabilidad de la Base se sustenta en la calidad de la notificación, con tres filtros de revisión, realizados por farmacoepidemiólogos y profesionales expertos en la actividad, a nivel municipal, provincial y nacional, según los procedimientos normalizados de trabajo.15 No se modificaron las clasificaciones y juicios de valor de los diferentes campos presentes en la base de datos.
Para caracterizar las RAM se trabajó con la reacción principal de la notificación, que define la gravedad de la misma. Para el análisis de la información, se aplicó la estadística descriptiva. Las medidas de resumen fueron frecuencia relativa y absoluta. Los datos se procesaron mediante el software SPSS versión 21.
Se solicitó autorización a la Unidad Coordinadora Nacional de Farmacovigilancia (UCNFv) para utilizar los datos en esta investigación. Los datos personales de los pacientes son confidenciales y sólo se utilizaron con fines científicos.
RESULTADOS
En la tabla 1 se aprecia que se detectaron 126 RAM no descritas, que representaron el 7,8 % de las 1 608 notificaciones en embarazadas que contiene la FarmaVigiC, en el período de estudio. Los años con mayor notificaciones de efectos indeseados fueron 2003 con 33 (26 %), 2012 con 26 (21 %) y 2010 con 23 (18 %).
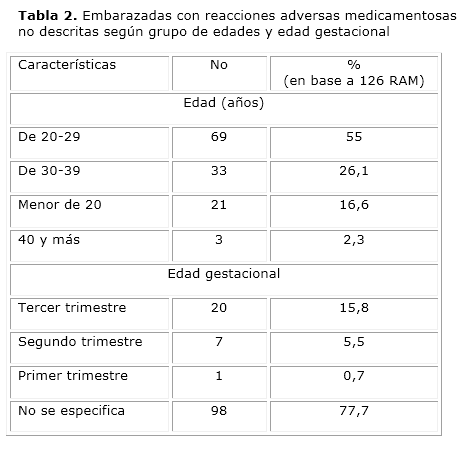
El grupo de edad de 20 y 29 años con 69 (55 %) pacientes, fue el más afectado por las RAM no descritas, seguido por el grupo de 30 y 39 años, con 33 (26,1 %). No se especificó la edad gestacional en 98 mujeres (77 %), mientras que 20 (15,8 %) gestantes estaban en el tercer trimestre del embarazo (tabla 2).
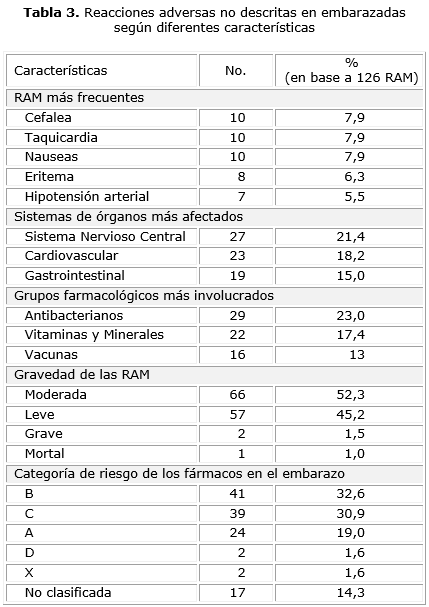
En la tabla 3 se muestra las diferentes características de las RAM no descritas en embarazadas. Los tipos de RAM más notificadas fueron cefalea, taquicardia y náuseas, con 10 (7,9 %) reportes cada una, seguido de eritema (6,3 %) e hipotensión arterial (5,5 %). Además se presentaron rubefacción (5,5 %), vómitos (5,0 %), somnolencia y disnea con 4,0 % cada una, entre otros efectos no deseados.
El sistema nervioso central con 27 (21,4 %) reportes, fue el sistema de órgano más afectado por las RAM no descritas y los grupos farmacológicos con más notificaciones fueron los antimicrobianos (23,0 %). También se encontró que las hormonas (6,4 %), antivirales (6,3 %), soluciones electrolíticas (5,5 %), antihipertensivos (4,7 %) y antianémicos (2,3 %), fueron grupos con una presencia importante en los efectos indeseados estudiados.
Predominaron las RAM moderadas en 66 casos para el 52,3 %. Se reportó una mortal por paracetamol en una gestante de 18 años, sin verificación por necropsia y las graves fueron cianosis por penicilina G sódica y disnea por Prenatal®.
Los medicamentos fueron clasificados con categoría de riesgo B en 41 (32,5 %) RAM, mientras que, en 18 reacciones adversas (14,3 %) los fármacos no poseen clasificación de riesgo en el Formulario Nacional de Medicamentos.
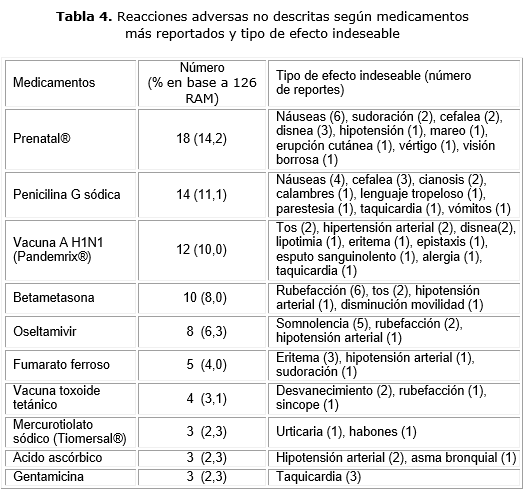
Los fármacos más involucrados en las sospechas de reacciones adversas fueron las tabletas Prenatal® (retinol, fumarato ferroso, ácido fólico) con 18 notificaciones para el 14,3 %, la penicilina G sódica con 14 (11,1 %) y la vacuna Anti H1N1 (Pandemrix®), con 12 (9,5 %) reportes. Los otros medicamentos más notificados aparecen en la tabla 4. Otros 46 (36, %) medicamentos se asociaron con una o dos RAM no descritas. Algunos de ellos fueron esparmoforte® (dipirona más calmilofilina), metildopa, dinitrato de isosorbide, cefalexina, fosfomicina, nistanina y penicilina procaínica, entre otros.
El nivel de atención secundaria de salud con 70 (56 %) RAM no descrita, fue el que mayor reporte realizó, seguido del nivel primario con 56 (44 %). El nivel terciario no reportó RAM.
Los profesionales sanitarios que notificaron efectos adversos no descritos en embarazadas fueron los médicos con 85 (67 %) reportes, licenciados en farmacia 25 (20 %), licenciados en enfermería 10 (8 %), técnicos en farmacia 4 (3 %), así como los estomatólogos y técnicos en enfermería con 1 (1 %) respectivamente.
DISCUSIÓN
Las investigaciones disponibles que abordan las características de las sospechas de RAM en embarazadas, se centran en su mayoría, en el riesgo teratogénico de los medicamentos. Pocos estudios describen los efectos perjudiciales de los fármacos en las embarazadas y son menos los que tienen como propósito identificar o caracterizar las RAM no descritas.
La notificación anual de reacciones adversas no descritas en las embarazadas, presentó una frecuencia irregular en el sistema de Farmacovigilancia de Cuba. Los años 2003, 2010 y 2012 fueron los de mayor número de notificaciones, los cuales aglutinaron 82 reacciones adversas, para el 65 % de los reportes. En los otros años, la notificación de efectos indeseados no descritos descendió a nivel nacional. Similares resultados encuentra una investigación realizada en Cuba de 2003 a 2007, que abarco todos los tipos de RAM en gestantes.16
La distribución de las RAM por año puede atribuirse a varios factores. El año 2003, se considera como de consolidación del sistema de Farmacovigilancia, impulsado por la Red de Farmacoepidemiología, en el que se reportaron más de 15 000 reacciones adversas procedentes de toda la población.17 Mientras que el 2010 y 2012, coincidieron con eventos que estimularon el reporte, como la vigilancia activa de la vacuna anti H1N1 y del oseltamivir, así como la aplicación de estrategias, para incrementar la notificación de efectos adversos importantes, de baja frecuencia de aparición y no descritos.18,19
El predominio de la edad de las gestantes con RAM no descritas fue de 20 a 29 años de edad. Ello puede ser consecuencia, que son estas edades, las que se consideran adecuadas para el embarazo, por el desarrollo biológico y psicológico que presenta la mujer.20
El estudio detectó, que en la base de datos no se contaba con la edad gestacional de las embarazadas en casi el 80 % de los casos. Los medicamentos pueden dañar al feto en cualquier momento del embarazo, pero el período de mayor riesgo es el primer trimestre,21 análisis que no se pudo efectuar por no disponer del dato. La boleta oficial de notificación de RAM de Cuba, no cuenta con un acápite específico para esta información, por lo que el Sistema de Farmacovigilancia, debe valorar incluir esta variable en el modelo de reporte, que permita que el dato se ofrezca de forma sistemática por el notificador.
La cefalea, taquicardia, náuseas, eritema e hipotensión arterial, representan más de la tercera parte de todas la RAM no descritas detectadas en el estudio. Los resultados coinciden parcialmente, con un estudio realizado en Cuba que caracteriza todas las RAM en las embarazadas y encuentra como frecuente la constipación, el vómito, la cefalea, la náusea y la episgastralgia.16 Las diferencias pudieran deberse al tipo de RAM estudiadas, ya que la investigación con que se compara, incluye todas las reportadas.
El sistema nervioso central (SNC), el cardiovascular (SCV) y el digestivo fueron los órganos más dañados. La afectación del SNC, estuvo relacionada con la somnolencia por oseltamivir. La afectación del SCV, estuvo determinada por la taquicardia, asociada más a antimicrobianos, en particular a gentamicina. Los antibióticos como los aminoglucósidos, pueden bloquear la resorción del magnesio en el Asa de Henle, alterar la función de la bomba sodio—potasio dependiente en las células del corazón, causar despolarización de la membrana y desencadenar taquiarritmia.22
La afectación del sistema digestivo se relacionó con náuseas y vómitos por penicilinas y Prenatal®. Aunque esta sintomatología se puede observar en el embarazo, no se puede descartar su relación con fármacos, que por diferentes vías los pueden suscitar, como las penicilinas, que producen elevados niveles de triptasa en el organismo y provocan trastornos gastrointestinales.23
Los resultados encontrados en cuanto a sistemas de órganos afectados, coinciden de forma parcial con un estudio cubano,16 en donde el aparato digestivo fue el más afectado. No se encontró en la literatura consultada, investigaciones internacionales que abordaran esta variable en embarazadas.
Los antimicrobianos, las vacunas y las vitaminas y minerales representaron más del 50 % de los grupos farmacológicos involucrados en la RAM estudiada. Coinciden de forma parcial, con los resultados de una investigación realizada en Pakistán24 y otra en Cuba.16 Excepto para las vacunas, lo que puede explicarse, por la vacunación masiva contra el virus H1N1 en embarazadas, realizada en Cuba en 2010.
De acuerdo a la gravedad, predominaron las RAM moderadas, que coincide con lo reportado por el Sistema de Farmacovigilancia cubano en los últimos cinco años para la población en general.18,19 Este resultado es favorable, para la Farmacovigilancia, porque uno de sus objetivos es detectar los efectos adversos más graves, para caracterizarlos y prevenirlos y las embarazadas y para las embarazadas, porque al caracterizar RAM no descritas serias, se podrán diseñar y aplicar estrategias de prevención efectivas, para que las enfermedades causadas por medicamentos no afecten o afecten en menor magnitud su salud.
Los medicamentos con categoría de riesgo B, fueron los que predominaron, con estos resultados coinciden con dos estudios, uno cubano16 y otro realizado en Escocia.25 Una investigación ejecutada en Etiopia identifica, que los fármacos con categoría A, fueron los más representados.26 Las diferencias pueden atribuirse a universos y contextos diferentes de las investigaciones, como es la existencia del Programa Materno Infantil, que establece una atención diferenciadas y priorizada a todas las embarazadas en Cuba.27
Los medicamentos identificados como más asociados a RAM no descritas, coinciden de forma parcial con un estudio cubano que valoró todas las RAM en embarazadas del 2003 al 2007, que encuentra al Prenatal®, fumarato ferroso, metronidazol y lidocaína hiperbárica como los fármacos con mayor número de sospechas de RAM notificadas.16
La tableta Prenatal® ocupó el primer lugar de los fármacos capaces de producir RAM no descritas, lo que puede estar relacionado con el uso del medicamento durante el embarazo, según lo establece el Programa Materno Infantil, con el fin de reducir la vulnerabilidad de las gestantes de padecer anemia, secundaria a la elevada demanda de suplementos de vitaminas y minerales necesarios para el feto en formación.27 Otros estudios coinciden que en Cuba es el medicamento de mayor uso entre las gestantes.11,28
La penicilina G, fue otro fármaco con alto por ciento de notificaciones de RAM no descritas en embarazadas y en las boletas de notificación, la tercera parte fue prescrita por ruptura prematura de membrana. Este fármaco tiene clasificación de riesgo B en el embarazo, lo que puede condicionar una mayor prescripción relacionada con la notificación de RAM.
La vacuna Pandemrix® ocupó el tercer lugar entre los fármacos con sospecha de RAM no descritas. Este hallazgo puede atribuirse a la vacunación masiva a embarazadas, para prevenir la gripe producida por el virus de la Influenza A (H1N1) en el año 2010 con la finalidad de proteger este grupo poblacional y a la Farmacovigilancia activa del producto. Esta vacuna contiene Tiomersal®. La seguridad de las vacunas con este excipiente, fue materia de debate en el mundo, pero en la actualidad se acepta que no existe evidencia que produzcan neurotoxicidad, aunque las autoridades sanitarias de varios países prefieren vacunas que no lo contengan.29 Este excipiente pudo contribuir a efectos indeseables alérgicos detectados por Pandermic® en el estudio.
Las RAM no descritas reportadas por mercurotiolato sódico (Tiomersal®) fueron por administración tópica, previa a la cesárea. Aunque las reacciones de hipersensibilidad están descritas para el antiséptico como erupciones eritamotosas, vesiculares y maculopapulares,29,30 la urticaria y el habón no aparecen de forma explícita en el Formulario Nacional de Medicamentos.
Los profesionales de la salud deben estar atentos a todos las RAM no descritas de los fármacos más asociados con los efectos indeseables (tabla 4), para reportarlos y prevenir su aparición en embarazadas vulnerables de padecerlos.
El nivel secundario de atención de salud resultó la principal fuente de emisión de los reportes de RAM. El resultado no coincide con un estudio cubano, que abarcó 5 años en todas las RAM en embarazadas,15 ni con los informes anuales de la UCNFv,17,18 que identifican a la atención primaria de salud, como el de mayor número de notificaciones de RAM. La embarazada tiene un seguimiento exhaustivo en la atención primaria, pero es remitida al nivel secundario por cualquier sospecha o complicación, relacionada o no con un medicamento, también este resultado puede estar asociado a la gravedad de RAM, ya que las clasificadas como moderadas y graves constituyeron más de la mitad de los reportes incluidos en el estudio y estos últimos se reportan en mayor proporción desde el nivel de atención secundario de salud.31
Los médicos y los licenciados en farmacia fueron los profesionales que más RAM no descritas reportaron. Los datos demuestran, que la participación del médico fue elevada y está en concordancia con su perfil profesional, al realizar el diagnóstico de la enfermedad del paciente, entre ellos las RAM. Los resultados coinciden con los informes anuales del Sistema de Farmacovigilancia para todos los efectos adversos.18,19 Los datos exponen el grado de responsabilidad que asume el médico con la evaluación del beneficio-riesgo de los medicamentos y la motivación creciente de licenciados y técnicos en farmacia para participar en programas de salud.
Las reacciones adversas no descritas en embarazadas representan una pequeña proporción de todos los efectos indeseables notificados al sistema de Farmacovigilancia cubano en la década de 2003 a 2012. Las características de las RAM no descritas son similares a las RAM descritas en la base de datos cubana, en cuanto a gravedad, categoría de riesgo del fármaco en el embarazo y el profesional que las notifican, pero muestra peculiaridades distintivas para tipo de efecto indeseable y sistema de órganos más afectado, grupo farmacológico y medicamento que más la producen, así como el nivel de atención de salud de origen de la notificación.
REFERENCIAS BIBLIOGRÁFICA
1. Furones JA. Reacciones adversas, farmacovigilancia e interacciones medicamentosas. En: Vergel GM, Tasé MJ, Groning E. Farmacología. Proceso de Atención en Enfermería. La Habana: Editorial Ciencias Médicas; 2009. p. 52-88.
2. Herrera Comoglio R. Algunos casos en la historia de la Farmacovigilancia. En: Herrera Comoglio R, Alesso L. Farmacovigilancia, hacia una mayor seguridad en el uso de medicamentos. Uppsala: Upssala Monotoring Centre; 2012. p. 85-144.
3. Organización Mundial de la Salud. La Farmacovigilancia: garantía de seguridad en el uso de los medicamentos. Perspectivas políticas de la OMS sobre medicamentos.Ginebra: OMS; 2004, p. 9: 1-5.
4. Jiménez G, Alfonso I. Gestión del riesgo en farmacoepidemiología: En: Furones JA, Lara C, Barbado DM, Jiménez G, Pérez J, Cruz MA (ed) Farmacoepidemiología y uso racional de medicamentos. La Habana: Editorial Academia; 2010. p. 120-42.
5. Rodríguez MC, Vacca CP, Pérez J, Bignone I, Bergman M, Valsecia M, et al. Buenas prácticas de Farmacovigilancia para las Américas. Washington, DC.: Organización Panamericana de la Salud; 2011. p. 73.
6. Myla Moretti. Collection And Analysis Of Drug Safety Data In Pregnancy. Can J Clin Pharmacol. 2007;14(1)2007:e34-e36.
7. James M. Wooten. Adverse Drug Reactions: Part II. Southern Medical Journal 2010;103(11):1138-45.
8. Irvine L, Flynn RW, Libby G, Crombie IK, Evans JM. Drugs dispensed in primary care during pregnancy: a record-linkage analysis in Tayside, Scotland. Drug Saf. 2010 Jul 1;33(7):593-604.
9. Gagne J, Maio V, Berghella V, Louis D, Gonnella J. Prescription drug use during pregnancy: a population-based study in Regione Emilia-Romagna, Italy. Eur J Clin Pharmacol. 2008;64(11):1125-32.
10. Gawde SR, Bhide SS, Patel TC, Chauhan AR, Mayadeo NM, Sawardekar SB. Drug Prescription pattern in pregnant women attending antenatal out patient department of a tertiary care hospital. BJPR [Internet]. 2013 [citado 15 Mar 2014];3(1):[aprox. 11 p.]. Disponible en: http://www.sciencedomain.org/uploads/1370420189-11-Revised-manuscript_version2.pdf
11. Vergel Rivera G, Zapata Martínez A, García Roldán R, Turro Fuentes M, García Morales JC, Verdecia López T. Uso de medicamentos durante el embarazo en diferentes áreas de salud. Rev Cubana Med Gen Integr [revista en la Internet]. 2000 Dic [citado 29 Ago 2014];16(6):525-30 [aprox 6 p]. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-21252000000600001&lng=es
12. Jiménez López G, Alonso Orta I. Normas y procedimientos de trabajo del sistema cubano de Farmacovigilancia. La Habana: Minsap, Dirección de Medicamentos, Departamento de Farmacoepidemiología; 2012.
13. Hanna Pedersen & Sara-Lisa Fors. VigiBase-global reporting trends. Uppsala Reports. 2011;55:6-7.
14. Wen SW, Yang T, Krewski D, Yang Q, Nimrod C, Garner P, et al. Patterns of pregnancy exposure to prescription FDA C, D and X drugs in a Canadian population. J Perinatol [Internet]. 2008 May [citado 16 Mar 2014];28(5):[aprox. 10 p.]. Disponible en: http://www.nature.com/jp/journal/v28/n5/full/jp20086a.html
15. Minsap. Gestión de la base de datos del sistema cubano de Farmacovigilancia. PNO: 004. La Habana: Minsap; 2008.
16. Furones JA, López Verde L, Jiménez López G, Ávila Pérez J. Reacciones adversas por medicamentos en embarazadas, reportadas al sistema de farmacovigilancia de Cuba en los años 2003-2007. Rev Electron Biomed [Internet] 2011 [citado 16 Mar 2014];2:[aprox. 14 p.]. Disponible en: http://biomed.uninet.edu/2011/n2/furones.html
17. Jiménez G, Debesa F, González B, Ávila J, Pérez J. El sistema cubano de farmacovigilancia: seis años de experiencia en la detección de efectos adversos. Rev Cubana Farm [Internet]. 2006 [citado 15 Mar 2014];40(1):[aprox. 10 p.]. Disponible en: http://bvs.sld.cu/revistas/far/vol40_1_06/far02106.htm
18. Departamento Nacional de Farmacoepidemiología. Farmacovigilancia: informe anual 2010 [Internet]. La Habana: Minsap; 2010 [citado 15 Mar 2014]. Disponible en: http://files.sld.cu/cdfc/files/2011/03/fvinforme-anual-2010.pdf
19. Departamento Nacional de Farmacoepidemiología. Farmacovigilancia: informe anual 2012 [Internet]. La Habana: Minsap; 2012 [citado 15 Mar 2014]. Disponible en: http://files.sld.cu/cdfc/files/2013/02/balance-anual2012fv.pdf
20. Yogev Y, Melamed N, Bardin R, Tenenbaum-Gavish K, Ben-Shitrit G, Ben-Haroush A. Pregnancy outcome at extremely advanced maternal age. Am J Obstet Gynecol. 2010 Dic;203(6):558.e1-7.
21. Benzies KM. Advanced maternal age: Are decisions about the timing of childbearing a failure to understand the risks? CMAJ. 2008;178(2):1834.
22. Joosten MM, Gansevoort RT, Mukamal KJ, van der Harst P, Geleijnse JM, Feskens EJM, et al. Urinary and plasma magnesium and risk of ischemic heart disease. Am J Clin Nutr. 2013;97:1299-306.
23. Baron TH, Ramirez B, Richter JE. Gastrointestinal motility disorders during pregnancy. Ann Intern Med. 1993;118(5):366-75.
24.Lisbet-Rohra DK, Das N, Azam SI, Solangi NA, Memon Z, Shaikh AM, et al. Drug-prescribing patterns during pregnancy in the tertiary care hospitals of Pakistan: a cross sectional study. BMC Pregnancy Childbirth [Internet]. 2008 Jul [citado 14 Mar 2014];8(24):[aprox. 15 p.]. Disponible en: http://www.biomedcentral.com/1471-2393/8/24
25. Irvine L, Flynn RW, Libby G, Crombie IK, Evans JM. Drugs dispensed in primary care during pregnancy: a record-linkage analysis in Tayside, Scotland. Drug Saf. 2010 Jul 1;33(7):593-604.
26. Binyam K, Teferi G, Ashebir G. Assessment of drug use among pregnant women in Addis Ababa, Ethiopia. Pharmacoepidemiology and Drug Safety [Internet]. 2009;[citado 14 Mar 2014];18:462-8. Disponible en: http://www3.interscience.wile y.com/j our nal /1222 94688/abstract
27. Ministerio de Salud Pública. Manual de procedimientos diagnósticos y tratamiento en Obstetricia y perinatología. La Habana: ECIMED. 1991.
28. García Morales JC, Vergel Rivera G, Zapata Martínez A. Embarazo y medicamentos en un área de salud. Rev Cubana Med Gen Integr [Internet]. 1999 [citado 14 Mar 2014];15(3):[aprox. 10 p.]. Disponible en: http://scielo.sld.cu/pdf/mgi/v15n3/mgi01399.pdf
29. Sweetman SC (editor). Martindale The Complete Drug Reference. Thirty-sixth edition. London: Pharmaceutical Press; 2009. p. 1663.
30. Calvo Barbado DM, Cires Pujol M, Cruz Barrios MA, Delgado Martínez I, Domínguez Caballero JL, Furones Mourelle JA y col. Formulario Nacional de Medicamentos. La Habana: ECIMED, 2011. p. 325.
31. Chao A, Ávila J, Debesa F. Farmacovigilancia. En: Furones JA, Lara C, Barbado DM, Jiménez G, Pérez J, Cruz MA (ed). Farmacoepidemiología. Uso racional de medicamentos. La Habana: Editorial Academia; 2010. p. 98-117.
Recibido: 24 de julio de 2014.
Aprobado: 12 de septiembre de 2014.
Juan Antonio Furones Mourelle. Escuela Nacional de Salud. Calle 100 e/ E y Perla, Altahabana, Boyeros, La Habana, Cuba.
Correo electrónico: furones@infomed.sld.cu