Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina
versión On-line ISSN 1561-302X
Rev cubana med vol.54 no.2 Ciudad de la Habana abr.-jun. 2015
TEMA ACTUALIZADO
Las incretinas como nueva opción terapéutica en la diabetes mellitus tipo 2
Incretins as a new therapeutic option in the diabetes mellitus type 2
Dr. Félix Andrés Reyes Sanamé, Dra. María Luisa Pérez Álvarez, Dr. Ernesto Alfonso Figueredo, Dr. Yoslainy Céspedes Cuenca, Dr. Enrique Ardevol Proenza
Hospital General Docente "Dr. Guillermo Luis Fernández Hernández Baquero". Moa, Holguín, Cuba.
RESUMEN
En la actualidad se dispone de variados grupos farmacológicos para el control temporal de las cifras de glicemias de pacientes con diabetes mellitus tipo 2. Dentro de ellos están aquellos con efecto incretinas, que son péptidos de origen intestinal, caracterizados por estimular la producción y secreción de insulina en la célula beta del islote pancreático luego de su unión a receptores específicos. El péptido similar a glucagón tipo 1 (GLP-1) ha sido la incretina mejor estudiada y su deficiencia en estos pacientes ha podido comprobarse en varios estudios. La eficacia, en términos de hemoglobina glucosilada, ha mostrado ser inferior a la de la insulina, pero sin el potencial peligro de hipoglucemia, así como el efecto neutro o la disminución del peso corporal. Se realizó la presente revisión bibliográfica con el objetivo de actualizar los conocimientos sobre el papel de las sustancias con acción incretinas en el control metabólico de los pacientes con diabetes mellitus tipo 2, ya que se ha tornado complejo y requiere necesariamente de información y adiestramiento en el manejo de las modernas drogas que integran los dos grupos farmacológicos que favorecen el efecto de dichas hormonas, y así lograr mayor preparación del personal que se enfrenta cada día a esta preocupante enfermedad. No obstante, con el transcurrir del tiempo se aportarán datos clínicos concluyentes que demuestren su efectividad.
Palabras clave: diabetes mellitus de tipo 2, incretinas, péptido relacionado con el glucagón 1, dipeptidil peptidasa 4.
ABSTRACT
Today there are many pharmacological groups for the temporal control of blood glucose figures of patients with diabetes mellitus type 2. Among them are those with incretin effect, which are peptides of intestinal origin, characterized by stimulating the production and secretion insulin in the pancreatic islet beta cell after binding to specific receptors. The glucagon-like 1 (GLP-1) peptide has been best studied incretin and deficiency in these patients has been tested in several studies. The efficiency in terms of glycosylated hemoglobin has shown to be inferior to that of insulin, but without the potential danger of hypoglycemia as well as neutral effect or decrease in body weight. This literature review was conducted to update the knowledge on the role of incretin action substances in the metabolic control of patients with type 2 diabetes mellitus. It has become complex, requiring necessarily information and training to hand modern drugs that make up the two drug groups that favor the effect of these hormones, and thus achieve better preparation of staff faces every day this troubling disease. However, over time, conclusive clinical data demonstrating its effectiveness will be provided.
Key words: type 2 diabetes mellitus, incretins, glucagon-related peptide 1, dipeptidyl peptidase-4.
INTRODUCCIÓN
La diabetes mellitus tipo 2 (DM2) se considera una de las enfermedades crónicas con mayor impacto en la calidad de vida de la población mundial, constituye un verdadero problema de salud y pertenece al grupo de las enfermedades que producen invalidez física por sus variadas complicaciones multiorgánicas, con un incremento indudable en la morbilidad y la mortalidad en los últimos años, independientemente de las circunstancias sociales, culturales y económicas de los países.1-4
Durante los últimos años se han desarrollado nuevas moléculas farmacológicas para el tratamiento de estos pacientes y, en la actualidad, se dispone de un número creciente de herramientas terapéuticas que permiten alcanzar el control glucémico deseable en la gran mayoría de ellos, aunque solo de forma transitoria en muchos, debido a la progresión de esta compleja enfermedad. Unido a lo anterior, con frecuencia el tratamiento medicamentoso disponible está asociado a efectos indeseados, como el incremento de peso corporal, la aparición de hipoglucemias o la retención de líquidos, que pueden incrementar el riesgo cardiovascular en dichos afectados y limitan su optimización.5
En el variado arsenal terapéutico de la DM2, se encuentran los que consiguen reproducir o potenciar el efecto de las incretinas. Estos novedosos fármacos han sido autorizados para el tratamiento de los pacientes con esta enfermedad, solo o en combinación con otros antidiabéticos orales, sin embargo, se necesita realizar ensayos clínicos que intenten demostrar si este grupo de medicamentos pudiera tener cierta eficacia en prevenir la aparición de la diabetes en las personas con estados de prediabetes.6
Desde el punto de vista fisiológico, el eje entero-insular consiste en un sistema endocrino integrado por señales neurohumorales originadas en células neuroendocrinas especializadas del intestino, cuyo blanco de acción es el islote de Langerhans. La interacción de dichas hormonas intestinales con sus receptores en las células del páncreas endocrino, ocasiona cambios significativos en el metabolismo de los hidratos de carbono.
La historia del sistema entero-insular se remonta a los primeros años del siglo xx cuando, en 1902, se aisló la sustancia conocida como secretina a partir de fragmentos de intestino. Posteriormente, en 1906, Moore y otros, demostraron que era posible reducir la magnitud de la glucosuria, en perros, mediante la administración de extractos de origen intestinal. En la década de 1920, Zunz y Labarre introdujeron el término “incretina” para referirse a hormonas de origen gastrointestinal que se liberan en respuesta a la ingestión calórica y que estimulan la secreción por parte del páncreas endocrino.4 Posteriormente, en 1964, un estudio publicado en Lancet describió lo que hoy se conoce como el “efecto incretina”. Dicho efecto se refiere a una respuesta secretora de insulina significativamente mayor cuando una carga de glucosa es administrada por vía oral comparada con la administración intravenosa de una concentración equivalente de glucosa. Esto, sin duda, pone de manifiesto la participación de factores de origen gastrointestinal como mediadores de la respuesta secretora del páncreas y, por lo tanto, del metabolismo energético. Investigaciones más recientes concluyen que estos mediadores enteroendocrinos o incretinas son responsables de la producción y secreción de insulina en el estado posprandial hasta en 30-60 %.7,8
El objetivo de esta investigación fue actualizar los conocimientos sobre el papel que desempeñan las sustancias con acción incretinas en el control metabólico de los pacientes con diabetes mellitus tipo 2, ya que se ha tornado complejo y requiere necesariamente de información y adiestramiento en el manejo de las modernas drogas que integran los dos grupos farmacológicos que favorecen el efecto de dichas hormonas y, así, lograr mayor preparación del personal que se enfrenta cada día a esta preocupante enfermedad.
DESARROLLO
Se realizó una búsqueda en español e inglés en las bases de datos Scielo, EBSCO, Pud Med, Clinical Key y CUMED donde se analizó la situación actual del tratamiento de la diabetes mellitus tipo 2 y se halló que existe un gran arsenal de fármacos para su control, sin embargo, las evidencias indican que los fármacos con acción incretinas presentan un futuro prometedor en el tratamiento de esta compleja enfermedad.
¿Qué son las incretinas?
Las incretinas son hormonas intestinales liberadas al torrente circulatorio en respuesta a la ingestión de nutrientes. Participan en la homeostasia de la glucemia, regulando la secreción de insulina y glucagón de manera dependiente de la glucosa.9
Se han identificado las 2 principales incretinas: el péptido similar al glucagón-1 (GLP1) es escindido del pro glucagón, en células de la mucosa intestinal llamadas células L, y es secretado principalmente como un péptido amidado de 30 aminoácidos, GLP1 (7-36) NH2 (12). Las células L se encuentran distribuidas en el intestino delgado distal y colon. El péptido insulinotrópico dependiente de glucosa (GIP) es un péptido de 42 aminoácidos producido por las células K del duodeno y yeyuno. La secreción de GIP es estimulada por los niveles de concentración de glucosa y lípidos enterales. Su liberación es regulada por los productos de la digestión y actúa como un mecanismo de retroalimentación para señalizar al páncreas endocrino del flujo inminente de sustratos desde el intestino.10-12
¿Lo sombreado en amarillo son números que forman parte de esos nombres o son acotaciones?
¿Cuál es su mecanismo de acción?
Los receptores de GLP-1 pertenecen a la familia de receptores heptahélicos de membrana acoplados a proteínas G y transmiten sus señales al núcleo celular al incrementar las concentraciones intracelulares de iones de calcio y AMPc tras la unión del ligando con el receptor. Estos receptores se expresan en una mayor cantidad de tejidos, comparado con los receptores de GIP. De esta manera, estos se encuentran en la membrana de células alfa y beta de los islotes de Langerhans, neuronas del hipotálamo y mesencéfalo, miocardiocitos en los que se presume mejoran la fuerza contráctil en pacientes con infartos de miocardio recientes o en los sometidos a procesos de revascularización, tracto gastrointestinal y células de pulmón, riñones e hígado.7,13
Las concentraciones de GLP-1 son aproximadamente de 5-10 pmol/L en ayunas, mientras que en el estado posprandial, se incrementan hasta 15-50 pmol/L. Una vez que ha sucedido el acoplamiento de GLP-1 con su receptor, se activa la vía enzimática de la adenilato ciclasa (AC), lo que resulta en el incremento de las concentraciones intracelulares de iones de calcio y AMPc. En las células beta de los islotes pancreáticos, GLP-1 estimula todas las fases de secreción de insulina, incluyendo un aumento en la actividad de glucocinasa (GK), así como de la translocación de los canales GLUT2. Esta cascada de señales intracelulares provoca una rápida exocitosis de moléculas de insulina previamente sintetizadas y contenidas dentro de gránulos secretores en el citosol. Sin embargo, en una detallada revisión publicada por Drucker, en 2006, se hace manifiesto que la persistencia del estímulo de GLP-1 sobre su receptor, activa una segunda vía enzimática, de la cinasa de proteína A (PKA), con lo que estimula la transcripción del gen de la insulina para mayor producción de novo e, incluso, proliferación mitogénica de células beta.7,14,15
¿Cuáles son los efectos biológicos de las incretinas?
La GLP-1 ocasiona un aumento en la sensibilidad a la glucosa de las células alfa y beta, estimula la secreción de insulina solo en caso de hiperglucemia, disminuye la glucosa plasmática posprandial y en ayunas, inhibe la secreción de glucagón, salvo en caso de hipoglucemia; inhibe la secreción de ácido gástrico y actúa sobre el hipotálamo al producir sensación de saciedad y reducir la ingesta alimentaria (tiene efecto sacietógeno, y probablemente afecte el peso a largo plazo). Disminuye la hemoglobina glucosilada (HbA1c), enlentece el vaciado gástrico. Al mismo tiempo, diversos estudios in vitro y en animales han mostrado que la GLP-1 induce la proliferación y neogénesis de la célula del islote pancreático e inhibe su apoptosis; lo que sugiere un efecto protector de la reserva funcional de esta glándula.16-20
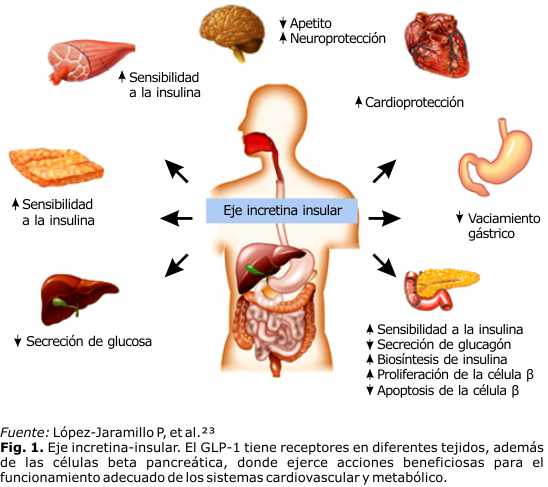
Se considera que el GLP-1, es una molécula de resistencia y longevidad, pues se le han descubierto ciertas acciones citoprotectoras, sobre todo al nivel cardiovascular y cerebral. Estudios experimentales en modelos animales con miocardiopatía dilatada han demostrado que la perfusión con GLP-1 produce la mejoría de varios parámetros cardiovasculares como la fracción de eyección, la resistencia periférica, vasodilatación y una mejoría de la disfunción endotelial (aumentando la captación de glucosa y la contractibilidad ventricular). También se ha observado en modelos animales, que los tratados con GLP-1 antes del fenómeno de isquemia-reperfusión, el área que se obtuvo de isquemia y de necrosis fue inferior. Tiene efectos demostrados sobre la reducción de la presión arterial (sistólica y diastólica) y las concentraciones lipídicas (particularmente LDL-C), de hecho, se ha propuesto al GLP-1 y a análogos con capacidad de unión a su receptor cerebral, y de acción más prolongada, como posibles agentes terapéuticos en la enfermedad de Alzheimer y en otros procesos neurodegenerativos del sistema nervioso central y periférico. Esta última propiedad de péptido está basada en su demostrada acción neurotrófica en células neuronales en cultivo a las que protege contra la apoptosis inducida por glutamato y contra el daño oxidativo y su capacidad para modificar el proceso precursor de la proteína beta amiloide y reducir, en neuronas del hipocampo, in vitro, y en función de la dosis, los niveles de la propia proteína. En relación con esto se ha documentado, en ratones, que el GLP-1 es un potente neuroprotector y su receptor cerebral ha sido relacionado con el aprendizaje, puesto que aquellos animales con sobreexpresión del GLP-1 en el hipocampo muestran mayor capacidad de memorización (Fig. 1).21-25
Las formas biológicamente activas de GLP-1 y GIP tienen una vida media plasmática de apenas unos minutos (< 2 min), porque son objeto de la acción proteolítica de la enzima dipeptidil peptidasa IV (DPP IV) (Fig. 2).23,26 Esta enzima puede localizarse en la membrana de las células del endotelio vascular, así como en una forma soluble en plasma. Al igual que GIP, el GLP-1 es escindido en la posición Ala2 de la cadena peptídica, por lo que es posible afirmar que el GLP-1 biológicamente activo, representa solo 10-20 % del GLP-1 plasmático total.27
¿Cuál es la relación entre incretinas y diabetes mellitus tipo 2?
El efecto incretina está reducido severamente (o tal vez ausente) en los pacientes diagnosticados de diabetes mellitus tipo 2. De forma interesante, la secreción de GLP-1 en respuesta a la ingestión de alimentos parece estar reducida también en el sujeto obeso, no diabético. La pérdida de peso normaliza los niveles séricos del péptido.28
A pesar de la secreción disminuida de GLP-1, sus acciones insulinotrópicas y antiglucagón están preservadas, pero parece que la potencia biológica de la incretina se encuentra disminuida cuando se le compara con sujetos sanos. Administrado en dosis suprafisiológicas, el GLP-1 puede normalizar la sensibilidad pancreática a la presencia de la glucosa.
Junto con la afectación/pérdida del efecto incretina en la diabetes, existe hiperglucagonemia que no es suprimida por la presencia de la glucosa. La secreción de GIP parece ser normal en el enfermo diabético dependiente de insulina, pero la influencia que ejerce sobre la secreción pancreática de insulina se encuentra severamente afectada. La afectación de la acción biológica del GIP pudiera ser consecuencia de la enfermedad diabética y también se ha visto en la diabetes secundaria a la pancreatitis crónica.29
Las acciones defectuosas de las incretinas en la DM2 pueden ser restauradas parcialmente mediante un control glucémico estricto después de insulinoterapia intensiva. De todo lo anterior se puede concluir que la afectación del efecto incretinas contribuye a la disrupción de la regulación de la secreción de las hormonas pancreáticas en la DM2. Por lo tanto, la patogénesis de dicha enfermedad parece incluir una disfunción de ambas incretinas. Luego, un aumento del efecto incretinas pudiera representar una solución terapéutica eficaz en los pacientes diabéticos.
En correspondencia con estas observaciones, se han desarrollado agonistas del receptor al GLP-1, formas sintéticas de las incretinas que son resistentes al efecto proteolítico de la DPP-4 e inhibidores de la DPP-4, como nuevas alternativas al tratamiento farmacológico de la DM2. Se espera que estos fármacos minimicen la ganancia de peso corporal, reduzcan el número de complicaciones hipoglucémicas, y eviten el agotamiento de las células, al promover el incremento del número de ellas en el islote.30,31
FÁRMACOS CON ACCIÓN INCRETINAS
Agonistas GLP-1 (propiedades farmacológicas)
Fármacos comercializados en varios países: exenatide y liraglutide.
Exenatide (Baietta®)6,32-35
Se trata de un producto sintético derivado de un péptido de 39 aminoácidos llamado exendina 4, muy a fin a los receptores de GLP-1, que se obtiene a partir de la saliva del reptil Heloderma suspectum o monstruo de Gila. Debido a que posee una homología cercana al 53 % con el GLP-1 de los mamíferos, se ha explotado como agonista de los receptores de esta incretina. Fue el primero que la Food and Drug Administration (FDA) aprobó para su uso clínico en abril de 2005. Además, gracias a que la posición 2 en la secuencia proteica del exenatide está ocupada por una glicina (mientras que el GLP-1 nativo tiene una alanina en esta posición), es resistente a la acción proteolítica de la dipeptidil peptidasa IV y logra, con ello, una vida media plasmática de hasta 4 horas tras su administración subcutánea, y una duración total en plasma hasta de 6 horas, lo que le confiere un efecto insulinotrófico 63 % mayor que el GLP-1 nativo.
Otras características:
- Exenatide no potencia de forma aguda la actividad de la insulina en individuos no diabéticos.
- Tiene alto costo económico.
- Su efectividad en la diabetes tipo 2 está demostrada como monoterapia o como tratamiento añadido a metformina, sulfonilureas, la combinación de ambas o tiazolidinedionas para lograr reducción adicional de casi el 1 % en la HbA1c y disminución del peso corporal en cerca de 4 kg en un año.
- Se administra por vía subcutánea en dosis de 5-10 µg 2 veces al día.
Sus principales efectos secundarios son: náuseas, vómitos, dolor de cabeza, dispepsia y se han descritos algunos casos con pancreatitis.
- Recientemente se desarrolló una forma de presentación que se puede emplear una vez a la semana.
Liraglutide (NN2211)27,36-38
En un intento por prolongar la vida media plasmática del GLP-1, luego de sintetizar una molécula idéntica por medio de tecnología de ADN recombinante humano, se le une de manera no covalente a albúmina. Con esto se logra que la liberación de GLP-1 a partir del sitio de aplicación sea lenta y continua. La adición de la molécula de albúmina ha sido posible gracias a la colocación de una ácido graso con 16 carbonos en la posición Lis26 de la cadena de GLP-1. Además, el liraglutide posee una sustitución Arg34Lis.
Otras propiedades:
- Solo de 1-2 % de la dosis total administrada circula en plasma en forma libre lo que le confiere al fármaco una vida media de 10-14 horas.
- Se administra 1 vez al día por vía subcutánea con efectos similares a los del exenatide.
- Tiene alto costo económico.
- Disminuye la HbA1c alrededor de 0,5 a 1 %.
- Produce una pérdida de peso de 2 a 3 kg en 6 meses de tratamiento.
Contraindicada en paciente con historia familiar o personal de carcinoma tiroideo.
- Las náuseas, las diarreas, el dolor de cabeza y los vómitos parecen ser los efectos adversos más frecuentes.
- En monoterapias, no producen hipoglucemias, tampoco ocasionan hiperplasias de células c en humanos, ni pancreatitis.
- La presencia de anticuerpos no son significativas.
EN FASE DE INVESTIGACIÓN
Albiglutide7,39
Se trata de un análogo de GLP-1 contenido en un polipéptido derivado de albúmina capaz de activar al receptor de GLP-1 y obtener potenciar la secreción pancreática de insulina con la consiguiente mejoría en la homeostasis de la glucosa. Asimismo, es una molécula resistente a la inactivación enzimática por parte de la DPP IV. Entre los datos con que se cuenta, se sabe que el efecto inductor de la saciedad de este compuesto es de intensidad menor, comparado con otros análogos de incretina, lo cual podría ser atribuido a un bloqueo por parte de la barrera hematoencefálica, por su mayor peso molecular. La Dra. Jessica Matthews y su equipo han publicado ya un estudio fase II en el que analizan la seguridad y la tolerabilidad de este fármaco en pacientes con DM2, así como sus características farmacocinéticas y farmacodinámicas.
Hasta el momento se sabe que:
- Los resultados son favorecedores en términos de glucosa plasmática de ayuno así como posprandial.
- La larga vida media de la molécula podría implicar una administración semanal, lo cual sería muy atractivo para mejorar el apego del enfermo al tratamiento.
- Las reacciones adversas observadas con más frecuencia durante el desarrollo clínico fueron: náuseas, diarrea y reacciones en el lugar de la inyección.
Están en desarrollo otros medicamentos agonistas de GLP1, tales como Taspoglutide y lixisenatide, de uso subcutáneo, con efectos beneficiosos como baja incidencia de hipoglicemia y reducción del peso corporal.40
Inhibidores de la dipeptidilpeptidasa-4
La DPP-4 es una glicoproteína de 766 aminoácidos transmembrana, también conocida como adenosina desaminasa o CD26. Los inhibidores de la DPP-4 son cianopirrolidinas con interacciones clave con el complejo de la DPP-4 que permiten la inhibición competitiva. La DPP-4 se expresa en la superficie de varios tipos de células incluyendo monocitos y linfocitos. Es una enzima aminopeptidasa sérica que inactiva la GLP-1, el GIP y otras proteínas in vivo a través de la escisión del dipéptido aminoácido N-terminal. La dimerización de la proteína es necesaria para la actividad catalítica y la función de la enzima depende de su glicosilación.41
Son varios los sustratos de la DPP-4 e incluyen péptidos que contienen prolina o alanina, tales como factores de crecimiento, quimioquinas, neuropéptidos y péptidos vasoactivos. La inhibición de la enzima DPP-4 también modula la actividad de varios factores cardioactivos, neuropéptidos y células estromales derivadas del factor-1 (SDF-1).41 Por su afinidad para una amplia gama de sustratos, la DPP-4 no es específica para GLP-1 y, por lo tanto, tiene el potencial para mediar una amplia gama de efectos pleiotrópicos (tanto positivos como negativos), independientes de GLP-1. Otros ejemplos de enzimas con actividad similar a DPP-4 incluyen la proteína de activación de fibroblastos, DPP-2, DPP-8 y DPP-9; por lo tanto, se cree que los inhibidores de la DPP-4 son selectivos para esta, pero que además podrían ser inhibidores de otras enzimas similares a la DPP-4.42
Los inhibidores de la DPP-4 disponibles en la actualidad incluyen sitagliptina, saxagliptina, linagliptina, vildagliptina, alogliptina y teneligliptina. Los tres primeros se aprobaron en los Estados Unidos y en gran parte del mundo para el tratamiento de la diabetes mellitus tipo 2. Ya ha sido aprobado el uso de la vildagliptina en Europa y América Latina y de la alogliptina y la teneligliptina, en Japón. La linagliptina también ha sido aprobada por la FDA y por las agencias regulatorias de otros países. Se encuentra disponible en algunos países para uso en pacientes adultos con DM2 para mejorar el control glucémico, ya sea como monoterapia o en asociación con metformina, sulfonilureas o tiazolidinedionas o en asociación con metformina + sulfonilureas. Otros miembros de esta clase de medicamentos se encuentran en fase III de ensayos clínicos e incluyen dutogliptina y gemigliptina. Los diversos inhibidores de la DPP-4 son únicos en su metabolismo, excreción y potencia y como resultado de lo anterior, en las dosis diarias recomendadas. La saxagliptina, la sitagliptina y la vildagliptina se metabolizan por vía hepática y se eliminan por vía renal. De manera interesante, la linagliptina se excreta principalmente por vías no renales con un mínimo de metabolismo hepático, por lo que los ajustes de la dosis no son necesarios en el contexto de enfermedad renal o hepática, lo que la convierte en el inhibidor recomendable para pacientes con esas enfermdades.23,43-45
En la tabla se expone el perfil de los inhibidores de la DPP-4.11,23,44,46-50
CONCLUSIONES
La terapia con fármacos que potencian el efecto de las hormonas incretinas ofrece una opción alternativa a las drogas hipoglucemiantes de las que se dispone actualmente para el tratamiento de la DM2 con buena eficacia, escasas reacciones adversas y un perfil favorable sobre el peso corporal. Aunque en los estudios disponibles, los agonistas GLP 1 y los inhibidores de la DPP-4 parecen seguros, deberán seguir siendo evaluados en estudios a largo plazo en práctica clínica para testificar su efectividad y poder de seguridad, así como para determinar su exacto papel entre todas las actuales opciones disponibles para el tratamiento de la DM2.
REFERENCIAS BIBLIOGRÁFICAS
1. Batista Moliner R, Ortega González LM, Fernández López G. Diabetes Mellitus. Manejo y consideraciones terapéuticas. RESUMED. 1998 [citado 7 May 2011];11(1). Disponible en: http://www.bvs.sld.cu/revistas/res/vol11_1_98/res02198.htm
2. Tejeda Dilou Y, Río Monier Y, Lardoeyt Ferrer R, Nuñez Copo AC. Propuesta de una estrategia preventivo-educativa para la interacción genoma-ambiente en la aparición de la diabetes mellitus de tipo 2. Rev MEDISAN. 2013 [citado 7 May 2011];17(7):1095-2003. Disponible en: http://scielo.sld.cu/pdf/san/v17n7/san10177.pdf
3. Camero Machin JC, Curbelo Fajardo JC, Martínez Núñez M, Novales Amado A, Trasanco Delgado M. Efectividad de una intervención educativa en adultos mayores diabéticos: Policlínico "Raúl Sánchez", Pinar del Río 2007. Rev Ciencias Médicas. 2008 [citado 7 May 2011];12(2):1-12. Disponible en: http://scielo.sld.cu/pdf/rpr/v12n2/rpr11208.pdf
4. Mora Linares O, Pérez Rodríguez A, Sánchez Barrero R, Mora Linares L, Puente Maury V. Morbilidad oculta de prediabetes y diabetes mellitus de tipo 2 en pacientes con sobrepeso y obesos. Rev MEDISAN. 2013 [citado 7 May 2011];17(10):6095-7001. Disponible en: http://scielo.sld.cu/pdf/san/v17n10/san111710.pdf
5. Orlandi Gonzales N, Álvarez Seijas E, Gonzales Calero TM, Gonzales Padilla K. Guías de prácticas clínicas. Diabetes Mellitus tipo 2. La Habana: Editorial de Ciencias Médicas; 2012.
6. Hernández Yero A, Torres Herrera O, Carrasco Martínez B, Nasiff Hadad A, Castelo Elías-Calles L, Pérez Pérez L, et al. Tratamiento farmacológico de la prediabetes. Rev Cubana Endocrinol. 2011 [citado 14 Mar de 2014];22(1):36-45. Disponible en: http://scielo.sld.cu/pdf/end/v22n1/end080111.pdf
7. Stempa Blumenfeld O. Incretinas: Un nuevo paradigma en el tratamiento de la diabetes mellitus tipo 2. Rev Endocrinol Nutr 2009 [citado 26 Abr 2014];17(2):84-90. Disponible en: http://www.medigraphic.com/pdfs/endoc/er-2009/er092f.pdf
8. Lazo Roblejo Y, Lores Delgado D. Las incretinas: nueva alternativa terapéutica para el control glucometabólico de la diabetes mellitus de tipo 2. Rev MEDISAN. 2012 [citado 26 Abr 2014];16(3):1-6. Disponible en: http://scielo.sld.cu/pdf/san/v16n3/san15312.pdf
9. Mendioza-Contreras JR, García-Álvarez J. Mecanismos neuroendocrinos de la cirugía metabólica en el tratamiento de la diabetes mellitus tipo 2. Rev Hosp Jua Mex. 2012 [citado 26 Abr 2014];79(3):187-192. Disponible en: http://www.medigraphic.com/pdfs/juarez/ju-2012/ju123i.pdf
10. Quintanilla-García C, Zúñiga-Guajardo S. El efecto incretina y su participación en la diabetes mellitus tipo 2. Rev Med Inst Mex Seguro Soc. 2010 [citado 26 Abr 2014];48(5):509-20. Disponible en: http://www.medigraphic.com/pdfs/imss/im-2010/im105h.pdf
11. Cox ME, Rowell J, Corsino L, Green JB. Dipeptidyl peptidase-4 inhibitors in the management of type 2 diabetes: safety, tolerability, and efficacy. Drug, Healthcare and Patient Safety. 2010 [citado 26 Abr 2014];2(1):7-19. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3108711/pdf/dhps-2-007.pdf
12. Martín-Dominguez V, González-Casas R, Mendoza-Jiménez-Ridruejo J, García-Buey L, Moreno-Otero R. Pathogenesis, diagnosis and treatment of non-alcoholic fatty liver disease. Rev Esp Enferm Dig. 2013 [citado 26 Abr 2014];105(7):409-20. Disponible en: http://scielo.isciii.es/pdf/diges/v105n7/punto_vista.pdf
13. Sung Yoon J, Woo lee H. Understanding the cardiovascular effects of incretin. Diabetes Metab J. 2011 [citado 26 Abr 2014];35(5):437-43. Disponible en: http://synapse.koreamed.org/Synapse/Data/PDFData/2004DMJ/dmj-35-437.pdf
14. Bayón C, Barriga MA, Litwak L. Incretinas, incretinomiméticos, inhibidores de DPP IV. Rev Endocrinol Metab. 2010 [citado 26 Abr 2014];47(1):36-51. Disponible en: http://www.scielo.org.ar/pdf/raem/v47n3/v47n3a06.pdf
15. Carrillo-Esper R, Muciño-Bermejo MJ. Tratamiento quirúrgico de la diabetes mellitus tipo 2. Rev Mex Cir y Cir 2014 [citado 26 Abr 2014];82(2):219-30. Disponible en: http://www.redalyc.org/pdf/662/66231034015.pdf
16. Cervera Peris M, Crespi Monjo M. Tratamiento farmacológico de la diabetes, de la obesidad, y de otros componentes del síndrome metabólico. Nutr Hosp. suplementos 2010 [citado 26 Abr 2014];3(1):72-82. Disponible en: http://www.redalyc.org/pdf/3092/309226767009.pdf
17. Lanzarini SE, Csendes AJ, Lembach H, Molina JC, Papapietro K, Araya V. Cirugía metabólica: ¿una nueva alternativa para el tratamiento de la diabetes mellitus tipo 2? Rev Hosp Clín Univ. Chile. 2010 [citado 26 Abr 2014];21(1):128-34. Disponible en: https://www.redclinica.cl/Portals/0/Users/014/14/14/Publicaciones/Revista/cirugia_metabolica_y_diabetes.pdf
18. Vásquez-Machado M, Ulate-Montero G. Regulación del peso corporal y del apetito. Acta Méd Costarric. 2010 [citado 26 Abr 2014];52(2):79-89. Disponible en: http://www.redalyc.org/pdf/434/43415519005.pdf
19. García Zenón T, Villalobos Silvas JA. Malnutrición en el anciano: parte II, obesidad la nueva pandemia. Med Int Mex. 2012[citado 26 Abr 2014];28(2):154-61. Disponible en: http://www.medigraphic.com/pdfs/medintmex/mim-2012/mim122g.pdf
20. Gómez Corrales JD, Latorre Sierra G. Evaluación del paciente obeso. Med Labor. 2010 [citado 26 Abr 2014];16(8):355-72. Disponible en: http://www.medigraphic.com/pdfs/medlab/myl-2010/myl107-8c.pdf
21. Nauck M, Vilsboll T, Gallwitz B, Garber A, Madsbad S. Incretin-based therapies: viewpoints on the way to consensus. Diabetes Care. 2009 [citado 26 Abr 2014];32(Suppl 2):s223-231. Disponible en: http://care.diabetesjournals.org/content/32/suppl_2/S223.full.pdf+html
22. Menéndez Torre E, Lafita Tejedor FJ, Artola Menéndez S, Núñez Cortes JM, Alonso García A, Puig Domingo M, et al. Recomendaciones para el tratamiento farmacológico de la hiperglucemia en la diabetes tipo 2. Clin Invest Arterioscl. 2011 [citado 26 Abr 2014];23(1):40-8. Disponible en: http://www.searteriosclerosis.org/resources/archivosbd/clinica_documentos_guias/0beefe2b4d18b6d4d26d1a53b315e148.pdf
23. López-Jaramillo P, Velandia C, Castillo G, Sánchez T, Álvarez J. Análogos de incretina e inhibidores de la DPP-4: ¿qué papel desempeñan en la prevención primaria de las enfermedades cardiovasculares? Rev Colomb Cardiol. 2013 [citado 26 Abr 2014];20(5):287-99. Disponible en: http://www.scielo.org.co/pdf/rcca/v20n5/v20n5a6.pdf
24. Wu S, Sun F, Zhang Y, Yang Z, Hong T, Chen Y, et al. The cardiovascular effects of glucagon-like peptide-1 receptor agonists: a trial sequential analysis of randomized controlled trials. J Clin Pharmacol Ther. 2014 [citado 26 Abr 2014];39(1):7-13. Disponible en: http://onlinelibrary.wiley.com/doi/10.1111/jcpt.12102/pdf
25. Best JH, Hoogwerf BJ, Herman WH, Pelletier EM, Smith DB, Wenten M. Risk of cardiovascular disease events in patients with type 2 diabetes prescribed the glucagon-like peptide 1 (GLP-1) receptor agonist exenatide twice daily or other glucose-lowering therapies. Diabetes Care. 2011 [citado 26 Abr 2014];34(1):90-5. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3005487/pdf/zdc90.pdf
26. Politi MT, Isolabella D. nuevas drogas en el tratamiento de la obesidad y el sobrepeso. Rev Arg Nutr. 2013 [citado 26 Abr de 2014];14(3):182-92. Disponible en: http://www.revistasan.org.ar/pdf_files/trabajos/vol_14/num_3/RSAN_14_3_182.pdf
27. Zuñiga-Guajardo S, Aldrete Velasco J, Alexanderson Rosas EG, Arechavaleta Granell MR, García García E, García Hernández PA, et al. Liraglutida en el contexto actual del tratamiento de la diabetes tipo 2. Med Int Mex. 2011 [citado 26 Abr 2014];27(2):141-59. Disponible en: http://www.medigraphic.com/pdfs/medintmex/mim-2011/mim112g.pdf
28. Almaguer Herrera A, Miguel Soca PE, Será CR, Mariño Soler AL, Oliveros Guerra RC. Actualización sobre diabetes mellitus. CCM. 2012 [citado 26 Abr 2014];16(2):1-32. Disponible en: http://www.medigraphic.com/pdfs/correo/ccm-2012/ccm122i.pdf
29. Hernández Rodríguez J, Licea Puig ME, Castelo Elías-Calles L. Medicamentos que favorecen la pérdida de peso y el control metabólico en las personas obesas con diabetes mellitus tipo 2. Rev Cubana Endocrinol. 2013 [citado 26 Abr 2014];24(2):323-52 Disponible en: http://scielo.sld.cu/pdf/end/v24n3/end08313.pdf
30. Ochoa C. El intestino delgado, las incretinas y el metabolismo Glucídico en la diabetes mellitus. Rev Cubana Aliment Nutr. 2012 [citado 26 Abr 2014];22(2):301-13. Disponible en: http://www.revicubalimentanut.sld.cu/Vol_22_2/Articulo_22_2_301_313.pdf
31. Nazar JC, Herrera FC, González AA. Manejo preoperatorio de pacientes con Diabetes Mellitus. Rev Chil Cir. 2013 [citado 26 Abr 2014];65(4):1-12. Disponible en: http://www.scielo.cl/pdf/rchcir/v65n4/art13.pdf
32. Bastarrachea RA, Montero JC, Saavedra-Gajardo V, Cerda-Flores R, Machado-Domínguez A, Comuzzie AG. Objetivos moleculares para diseñar nuevos fármacos para el tratamiento de la diabetes tipo 2 y la obesidad. Rev Méd Chil. 2008 [citado 26 Abr 2014];136(1):107-17. Disponible en: http://www.scielo.cl/pdf/rmc/v136n1/art14.pdf
33. Carrera Boada CA, Martínez-Moreno JM. Current medical treatment of diabetes type 2 and long term morbidity: how to balance efficacy and safety? Nutr Hosp. 2013 [citado 26 Abr 2014];28(Supl 2):3-13. Disponible en: http://scielo.isciii.es/pdf/nh/v28s2/02articulo01.pdf
34. Fernández Landó L, Casellini CM. Ensayos clínicos de exenatida y su rol en el tratamiento de la diabetes tipo 2. Medicina (Buenos Aires) [Revista en Internet]. 2009 [citado 10 Ene 2015];69(4):[aprox. 27p]. Disponible en: http://www.scielo.org.ar/pdf/medba/v69n4/v69n4a06.pdf
35. Bunck Mathijs C, Diamant M, Eliasson B, Corner A, Shaginian RM, Heine RJ, et al. Exenatide Affects Circulating Cardiovascular Risk Biomarkers Independently of Changes in Body Composition. Diabetes Care. 2010 [citado 10 Ene 2015];33(8):1734-7. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2909051/pdf/zdc1734.pdf
36. Del Olmo González E, Carrillo Pérez M, Aguilera Gumpert S. Actualización del tratamiento farmacológico de la diabetes mellitus tipo 2. Inf Ter Sist Nac Salud. 2008 [citado 10 Ene 2015];32(1):1-16. Disponible en: http://www.msssi.gob.es/en/biblioPublic/publicaciones/docs/vol32_1ActuaTratDiabetesMellitus.pdf
37. Brunetti L, Kalabalik J. Management of Type-2 Diabetes Mellitus in Adults: Focus on Individualizing Non-Insulin Therapies. Pharmacotherapy. 2012 [citado 10 Ene 2015];37(12):687-96. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3541864/pdf/ptj3712687.pdf
38. Saucedo R, Basurto L, Zárate A, Hernández M, Olvera D. Actualización sobre el manejo de la diabetes. Acta Méd Angel. 2012 [citado 10 Ene 2015];10(4):214-9. Disponible en: http://www.medigraphic.com/pdfs/actmed/am-2012/am124i.pdf
39. Pérez Morán MJ, Prats Olivan P, Tabacov A, García Luque A. Evaluación positiva de medicamentos: Diciembre 2013, Enero y Febrero 2014. Sanid Mil. 2014 [citado 10 Ene 2015];70(2):98-102. Disponible en: http://scielo.isciii.es/pdf/sm/v70n2/nota_tecnica.pdf
40. Piya MK, Tahrani AA, Barnett AH. Emerging treatment options for type 2 diabetes. Br J Clin Pharmacol. 2010 [citado 10 Ene 2015];70(5):631-644. Disponible en: http://onlinelibrary.wiley.com/doi/10.1111/j.1365-2125.2010.03711.x/pdf
41. Ta NN, Schuyler CA, Li Y, Lopes-Virella MF, Huang Y. DPP-4 (CD26) Inhibitor Alogliptin Inhibits Atherosclerosis in Diabetic Apolipoprotein E-Deficient Mice. J Cardiovasc Pharmacol. 2011 [citado 10 Ene 2015];58(2):157-66. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3155015/pdf/nihms-294762.pdf
42. Dicker D. DPP-4 Inhibitors. Impact on glycemic control and cardiovascular risk factors. Diabetes Care. 2011[citado 10 Ene 2015];34(Suppl 2):s276-278. Disponible en: http://care.diabetesjournals.org/content/34/Supplement_2/S276.full.pdf+html
43. Gallwitz B. Linagliptin—A novel Dipeptidyl peptidase Inhibitor for Type 2 Diabetes Therapy. Clin Med Ins Endocrinol Diabetes. 2012 [citado 10 Ene 2015];5(1):1–11. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3411498/pdf/cmed-5-2012-001.pdf
44. Johansen OE, Neubacher D, Von Eynatten M, Patel S, Woerle HJ. Cardiovascular safety with linagliptin in patients with type 2 diabetes mellitus: a pre-specified, prospective, and adjudicated meta-analysis of a phase 3 programme. Cardiovascular Diabetology. 2012[citado 10 Ene 2015];11(3):1-10. Disponible en: http://www.biomedcentral.com/content/pdf/1475-2840-11-3.pdf
45. Kishimoto M. Teneligliptin: a DPP-4 inhibitor for the treatment of type 2 diabetes. Diabetes Obes Metab. 2013 [citado 10 Ene 2015];6:187-95. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3650886/pdf/dmso-6-187.pdf
46. Mkele G. Dipeptidyl peptidase-4 inhibitors: their role in the management of type 2 diabetes. S Afr Fam Pract. 2013[citado 10 Ene 2015];55(6):508-10. Disponible en: http://www.tandfonline.com/doi/pdf/10.1080/20786204.2013.10874407
47. Rivas Alpizar E, Zerquera Trujillo G, Hernández Gutiérrez C, Vicente Sánchez B. Manejo práctico del paciente con diabetes mellitus en la Atención Primaria de Salud. Revista Finlay. 2011 [citado 10 Ene 2015];1(3):229-51. Disponible en: http://revfinlay.sld.cu/index.php/finlay/article/view/69/1232
48. López G. Diabetes mellitus: tratamiento. Medwave. 2010 [citado 10 Ene 2015];10(2):1-7. Disponible en: http://www.medwave.cl/medios/medwave/febrero2010/PDF/1/10.5867medwave.2010.02.4406.pdf
49. Fadini GP, Boscaro E, Albiero M, Menegazzo I, Frison V, Kreutzenberg S, et al. The Oral Dipeptidyl Peptidase-4 Inhibitor Sitagliptin Increases Circulating Endothelial Progenitor Cells in Patients With Type 2 Diabetes. Diabetes Care. 2010 [citado 10 Ene 2015];33(7):1607-9. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2890368/pdf/zdc1607.pdf
50. Schweizer A, Dejager S, Foley JE, Couturier A, Ligueros-Saylan M, Kothny W. Assessing the cardio–cerebrovascular safety of vildagliptin: meta-analysis of adjudicated events from a large Phase III type 2 diabetes population. Diabetes, Obes Metab. 2010 [citado 10 Ene 2015];12(6):485-94. Disponible en: http://onlinelibrary.wiley.com/doi/10.1111/j.1463-1326.2010.01215.x/pdf
Recibido: 10 de febrero de 2015.
Aceptado: 25 de abril de 2015.
Dr. Félix Andrés Reyes Sanamé. Hospital General Docente “Dr. Guillermo Luis Fernández Hernández Baquero”. Moa, Holguín. Cuba.
Correo electrónico: felixandresreyes10@moa.hlg.sld.cu