Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Pediatría
versión On-line ISSN 1561-3119
Rev Cubana Pediatr v.82 n.1 Ciudad de la Habana ene.-mar. 2010
Interferón gamma recombinante como alternativa terapéutica en niños con artritis idiopática juvenil
Recombinant gamma Interferon as a therapeutical alternative in children with juvenile idiopathic arthritis
Cecilia Coto Hermosilla,I Idrian García García,II Gisou Díaz Rojo,III Iraldo Bello Rivero,IV Cimara Bermudez Badell,V Gloria Valera Puente,VI Dolores Cantero Oceguera,VII Víctor Hernández González,VIII Melba Méndez Méndez,IX Santa Gómez Conde,X Hugo Nodarse Cuní,XI Pedro López Saura XII
IEspecialista de II Grado en Reumatología. Hospital Pediátrico «Pedro Borrás Astorga», Servicio de Reumatología. La Habana, Cuba.
IIMáster en Ciencias Farmacéuticas. Centro de Investigaciones Biológicas, División de Ensayos Clínicos. La Habana, Cuba.
IIIMáster en Matemáticas. Centro de Investigaciones Biológicas, División de Ensayos Clínicos. La Habana, Cuba.
IVDoctor en Ciencias Biológicas. Centro de Investigaciones Biológicas, División de Ensayos Clínicos. La Habana, Cuba.
VDoctora en Veterinaria. Centro de Investigaciones Biológicas, División de Ensayos Clínicos. La Habana, Cuba.
VIEspecialista en Pediatría y Reumatología. Hospital Pediátrico «Pedro Borrás Astorga», Servicio de Reumatología. La Habana, Cuba.
VIIEspecialista en Pediatría y Reumatología. Hospital Pediátrico «Pedro Borrás Astorga», Servicio de Reumatología. La Habana, Cuba.
VIIIEspecialista en Pediatría y Reumatología. Hospital Pediátrico «Pedro Borrás Astorga», Servicio de Reumatología. La Habana, Cuba.
IXEspecialista en Pediatría y Reumatología. Hospital Pediátrico «Pedro Borrás Astorga», Servicio de Reumatología. La Habana, Cuba.
XEspecialista en Pediatría y Reumatología. Hospital Pediátrico «Jorge Luis Miranda», Servicio de Reumatología. Santa Clara, Cuba.
XIMáster en Ciencias Farmacéuticas. Centro de Investigaciones Biológicas, División de Ensayos Clínicos. La Habana, Cuba.
XIIDoctor en Ciencias Biológicas. Especialista de II Grado en Bioquímica Clínica. Centro de Investigaciones Biológicas, División de Ensayos Clínicos. La Habana, Cuba.
RESUMEN
INTRODUCCIÓN. La artritis idiopática juvenil (AIJ) es una enfermedad del colágeno caracterizada por sinovitis crónica y síntomas extraarticulares, de inicio antes de los 16 años de edad. El interferón gamma (INFγ) mostró eficacia en un ensayo anterior con pacientes resistentes o intolerantes a las otras terapias disponibles, por lo que se decidió evaluar su eficacia y seguridad como medicamento modificador de la evolución de esta enfermedad.
MÉTODOS. Se realizó un ensayo clínico abierto, no controlado, en el que se administró INFγ por vía intramuscular en dosis de 50 000 UI/kg (hasta 1 x 106 UI) durante 2 años. En el ensayo se incluyeron 20 pacientes con AIJ: 5 tenían la forma pauciarticular; 9, la poliarticular y 6, la sistémica.
RESULTADOS. Al final del tratamiento, 13 pacientes (65 %) se evaluaron como respondedores. El número de articulaciones afectadas, los síntomas sistémicos y los valores de eritrosedimentación y del cuestionario de calidad se redujeron significativamente. Igualmente disminuyó el número de pacientes que continuó consumiendo esteroides, así como la dosis de éstos. El tratamiento fue bien tolerado, excepto en 2 pacientes.
CONCLUSIONES. El INFγ disminuye la expresión de la quimiocina CCR-4 en los niños, pero no en los adultos con la enfermedad. Es posible concluir que esta citocina puede ser una alternativa terapéutica eficaz en pacientes con AIJ; para confirmarlo se necesitan estudios controlados más extensos.
Palabras clave: Interferón gamma recombinante, artritis idiopática juvenil, articular, sistémica, quimiocina.
ABSTRACT
INTRODUCTION: The juvenile idiopathic arthritis (JIA) is a collagen entity characterized by chronic synovitis and extra-articulation symptoms appearing before the 16 years old. Gamma Interferon (gamma-INF) showed its effectiveness in a prior trial with resistant and intolerant patients to other available gamma-INF therapies, thus authors assessed its effectiveness and safety as a modifier drug of the course of this entity.
METHODS: An open clinical, no-controlled trial was carried out administering gammaINF by intramuscular route in doses of 50 000 IU/kg (up to 1 x 106 IU) during two years. Trial included 20 patients with JIA: five had the pauciarticular type; nine had the polyarticular one and six had the systemic one.
RESULTS: At treatment termination, 13 patients (65%) were assessed as respondents. Figure of involved joints, the systemic symptoms and the erythrosedimentation values, and the quality questionnaire significantly decreased, as well as the figure of patients to continue consuming steroids and its dosage. Treatment was well tolerated, except 2 patients.
CONCLUSIONS: Gamma-INF decrease the expression of CCR-4 chemokine in children, but not in adults ones presenting this entity. We conclude that this cytokine may be an efficient therapeutical alternative in patients with JIA; for its confirmation it is necessary more extent controlled studies.
Key words: Recombinant gamma Interferon, juvenile idiopathic arthritis, articular, systemic, chemokine.
INTRODUCCIÓN
La artritis idiopática juvenil (AIJ), antes conocida como artritis crónica juvenil o artritis reumatoide juvenil, es una afección que causa inflamación articular y que comienza antes de los 16 años de edad. Los tres tipos mayores de AIJ son: pauciarticular, que afecta a 4 o menos articulaciones, poliarticular, que afecta a 5 o más articulaciones, y sistémica, que afecta al menos a una articulación pero causa también la inflamación de órganos internos. Las deformidades articulares y la discapacidad crónica son consecuencias de la AIJ persistentemente activa. En la patogénesis de la AIJ pueden estar involucrados factores tales como una inadecuada regulación inmunitaria y producción de citocinas, predisposición genética, infecciones virales latentes o inmunodeficiencias.1 Los tratamientos convencionales que incluyen antiinflamatorios no esteroideos (AINE), fármacos modificadores antirreumáticos (ARME, antirreumáticos modificadores de la enfermedad; DMARD en inglés), corticoesteroides y agentes citostáticos, no son siempre efectivos y se asocian A importantes toxicidades.2 Recientemente, los inhibidores del factor de necrosis tumoral (TNF) alfa producen una mejoría significativa en pacientes con AIJ poliarticular,3 pero se asocian a la aparición de infecciones por microorganismos oportunistas y de malignizaciones.4,5
El interferón gamma (IFNγ) es una citocina producida primariamente por linfocitos Th1 con propiedades tanto proinflamatorias como antiinflamatorias.6 El predominio de sus acciones positivas o negativas en pacientes con artritis reumatoide (AR) depende de las dosis aplicadas, del momento de la acción y del equilibrio inmunológico del individuo. Puede contribuir a la reorientación del patrón migratorio de las células inflamatorias en la AIJ y producir reparación y remodelación tisular.7 Los ensayos clínicos con IFNγ recombinante en adultos con AR muestran resultados inconsistentes,8-10 aunque sin progresión de la enfermedad. En niños, Pernice y cols. observaron mejoría clínica en 7 de 9 pacientes con AIJ sistémica tratados con IFNγ además del tratamiento convencional.11 En un estudio cubano anterior, se obtuvo una respuesta clínica satisfactoria en 8 de 10 niños, resistentes o intolerantes a todos los otros tratamientos disponibles en ese momento. La descontinuación del prolongado régimen con corticoesteroides fue posible en 7 de 8 casos que previamente lo recibían, y se observó mejoría hematológica sin eventos adversos graves.12 Este precedente justificó el presente estudio, en el cual el IFNγ se usó como una opción alternativa, inductor de la remisión de la enfermedad.
MÉTODOS
Se realizó un ensayo clínico abierto, no controlado, en el cual intervinieron los Servicios de Reumatología de los Hospitales Pediátricos «Pedro Borrás Astorga» (La Habana) y "Jorge L. Miranda"(Santa Clara). El estudio fue aprobado por los Comités de Revisión y Ética de dichas instituciones y por el Centro Estatal para el Control de la Calidad de los Medicamentos (CECMED). Además cumplió con los requisitos de la Declaración de Helsinki.
Pacientes. Se incluyeron pacientes con AIJ activa de cualquier subtipo, de uno y otro sexo y menores de 16 años, de acuerdo con los criterios de la Asociación de Reumatología Americana (ARA) (ahora Universidad Americana de Reumatología),13 con el consentimiento informado escrito de sus padres o tutores. Los criterios de exclusión fueron el embarazo, la insuficiencia renal y otras afecciones médicas coexistentes graves.
Intervenciones. Todos los pacientes recibieron IFNγ recombinante (Heberon Gamma R®, Heber Biotec, La Habana) por vía intramuscular, en dosis de 50 000 UI/kg (máximo: 1 000 000 UI): diariamente durante 4 semanas, luego 3 veces por semana durante 3 meses, y finalmente 2 veces por semana hasta completar 2 años de tratamiento. Esta dosis se basó en el estudio anterior realizado en esta indicación.12 Después de iniciado el tratamiento no se permitió ningún otro ARME, solo se usaron AINE ante síntomas de artritis activa, artralgias o recaídas leves. Se continuaron utilizando los corticoesteroides en la misma dosis, en los pacientes que se encontraban recibiéndolos, o para tratar síntomas sistémicos no controlados con AINE. Su uso se redujo gradualmente según la evolución clínica individual, en un régimen de 1,25 mg cada 4 días, de no existir signos de la enfermedad.
Seguimiento y evaluaciones. Los pacientes permanecieron hospitalizados durante los primeros 7 días de tratamiento para una mejor valoración de eventos adversos inmediatos. Con posterioridad, se siguieron mensualmente de manera ambulatoria. Se consideró respuesta completa (remisión de la enfermedad) cuando todas las señales de inflamación articular o síntomas sistémicos desaparecieran, con normalización de los parámetros hematológicos e interrupción de la administración de corticoesteroides si se estaban utilizando. Se definió respuesta parcial cuando los signos y síntomas disminuyeron un 50 % o más, con reducción de la dosis de corticoesteroides pero persistencia de las alteraciones hematológicas. La definición de mejoría incluyó tanto la respuesta completa como la parcial. Cualquier otra observación se consideró N respuesta. Se utilizó una versión en español validada,14 del Childhood Health Assessment Questionnaire (CHAQ) Index para determinar el grado de discapacidad funcional.
Como complemento molecular de los resultados clínicos se midió el receptor de quimiocinas CCR-4, que se expresa en células tipo Th2 en los sitios de inflamación articular. Éste se cuantificó en células mononucleares de sangre periférica heparinizada antes del tercer mes de tratamiento y después de éste, utilizando el método de reacción en cadena de la polimerasa reverso-transcriptasa (RT-PCR, sigla en inglés).
Estadística. Se utilizó el programa SPSS para Windows, versión 11.5. Para los análisis clínicos y hematológicos pareados entre antes y después del tratamiento se utilizó la prueba de Wilcoxon. La normalización de parámetros hematológicos se analizó mediante la prueba de Mc Nemar. En las determinaciones de CCR-4 se aplicó la prueba de comparaciones múltiples de Dumm. El nivel de significación seleccionado fue 0,05.
RESULTADOS
Se incluyeron 20 pacientes. Catorce de ellos completaron los 2 años de tratamiento con IFNγ. Dos pacientes (uno con tipo poliarticular y uno con pauciarticular) salieron debido a reacciones adversas antes de los 6 meses; 2 (tipo sistémico) tuvieron progresión de la enfermedad entre los 12 y 18 meses, y otros 2 (uno con tipo poliarticular y uno con pauciarticular) abandonaron en el primer mes y se perdió el contacto con ellos. La forma clínica predominante de la AIJ fue la poliarticular (8 pacientes), seguida por la pauciarticular y sistémica, presentes en 6 pacientes cada una (tabla 1). Prevaleció la inflamación en las articulaciones de manos (18 pacientes), tobillos (14) y rodillas (10). Solo un paciente fue positivo del factor reumatoideo y de anticuerpos antinucleares. Los AINE (ej.: ácido acetilsalicílico) y los corticoesteroides eran los tratamientos más utilizados en la inclusión. Otros tratamientos incluían metotrexato, sales de oro, cloroquina y ciclofosfamida.
Tabla 1. Características demográficas y de la enfermedad de los pacientes
(n = 20)
| Característica | Valores* |
| Edad (años) | 8 ± 4 (2-15) |
| Sexo femenino | 12 (60 %) |
| Color de piel blanco | 11 (55 %) |
| Duración de la AIJ en meses | 36 ± 31 (2-108) |
| Presentación clínica | |
| Poliarticular | 8 (40 %) |
| Pauciarticular | 6 (30 %) |
| Sistémica | 6 (30 %) |
| Peso (kg) | 27 ± 11 (15-51) |
| Talla (cm) | 124 ± 18 (95-159) |
| Factor reumatoideo | 0 |
| Anticuerpos antinucleares | 1 (5 %) |
| Terapia medicamentosa al momento de la inclusión | |
| AINE | 12 (60 %) |
| Corticoesteroides | 8 (40 %) |
| Metotrexato | 5 (20%) |
| Otros ARME | 5 (20 %) |
AINE: Antiinflamatorios no esteroideos; ARME: antirreumáticos modificadores de la enfermedad.
* Los datos se expresan como media ± DE (rango) o número de pacientes (%).
Durante el tratamiento, el número de articulaciones afectadas disminuyó significativamente (p < 0,0001); al año, ya la mediana tuvo valor cero (tabla 2). Los signos y síntomas articulares desaparecieron en 10 pacientes, 3 de ellos con 17 a 18 articulaciones afectadas al inicio. Seis pacientes presentaron síntomas sistémicos, cada uno con al menos 4 síntomas, entre los que sobresalió la fiebre intermitente y la hepatoesplenomegalia con 6 y 5 pacientes afectados, respectivamente. Al mes 12 sólo dos pacientes continuaban con síntomas y salieron del ensayo debido a la progresión de éstos. Se logró la interrupción del uso de corticoesteroides en 4 de 8 casos o la reducción de su dosis (2 de 8). Ese tratamiento no se requirió en ningún otro paciente. La dosis de esteroides se redujo más del doble (p = 0,030). El índice de discapacidad CHAQ también se redujo (p = 0,018), y normalizó en 11/14 pacientes evaluados. La eritrosedimentación disminuyó de manera notable (p = 0,007); en el 82 % de los pacientes normalizó al final (p = 0,021). La anemia se corrigió en 6 de 8 pacientes.
Tabla 2. Evaluaciones clínicas y hematológicas
| Evaluación | Inicial | 6 meses | 12 meses | 24 meses |
| N | 20 | 16 | 16 | 14 |
| Articulaciones afectadas† | 6 ± 14 (1-21) | 1 ± 6 (0-16) | 0 ± 4 (0-11) | 0 ± 1 (0-11) |
| Articulaciones con dolor† | 5 ± 10 (0-19) | 0 ± 2 (0-11) | 0 ± 0 (0-10) | 0 ± 0 (0-3) |
| --- con inflamación† | 4 ± 8 (1-20) | 1 ± 6 (0-11) | 0 ± 4 (0-11) | 0 ± 1 (0-11) |
| --- con calor† | 4 ± 3 (0-7) | 0 ± 0 (0-2) | 0 ± 0 (0-4) | 0 |
| Fiebre intermitente‡ | 6 (100 %) | 2 (33,3 %) | 1 (16,7 %) | 0 |
| Hepatoesplenomegalia‡ | 5 (83,3 %) | 0 | 0 | 0 |
| Rash‡ | 3 (50 %) | 0 | 0 | 0 |
| Mialgias‡ | 3 (50 %) | 2 (33,3 %) | 0 | 0 |
| Pericarditis‡ | 3 (50 %) | 0 | 2 (33,3 %) | 0 |
| Adenopatías‡ | 3 (50 %) | 0 | 0 | 0 |
| Tratamiento con esteroides | 8 (40 %) | 5 (31,3 %) | 6 (30,0 %) | 2 (14,3 %) |
| Dosis corticoesteroides* (mg) | 12,5 ± 29,4 | 15,0 ± 20,0 | 12,5 ± 20,0 | 5,0 ± 5,0 |
| Índice de discapacidad CHAQ* (0-3) | 0,6 ± 1,2 | 0,5 ± 0,6 | 0,0 ± 0,6 | 0,0 ± 0,1 |
| Hemoglobina (g/L) | 11.4 ± 2.4 | 11,8 ± 1,4 | 12,0 ± 1,4 | 11,9 ± 1,4 (10,4-13,6) |
| Eritrosedimentación* (mm/h) | 40 ± 49 | 20 ± 20 | 21 ± 12 | 20 ± 10 |
| Leucocitos totales | 9,2 ± 4,1 | 8,8 ± 2,8 | 10,0 ± 3,4 | 8,4 ± 1,0 |
| Conteo de plaquetas | 230 ± 47 | 240 ± 57 | 228 ± 49 | 235 ± 78 |
Los datos se expresan como mediana ± RQ (rango) o número de pacientes (%).
* p < 0,05, † p < 0,01 (prueba pareada de Wilcoxon [24 meses frente a la inicial]).
‡ Porcentajes con respecto a los 6 pacientes con síntomas sistémicos.
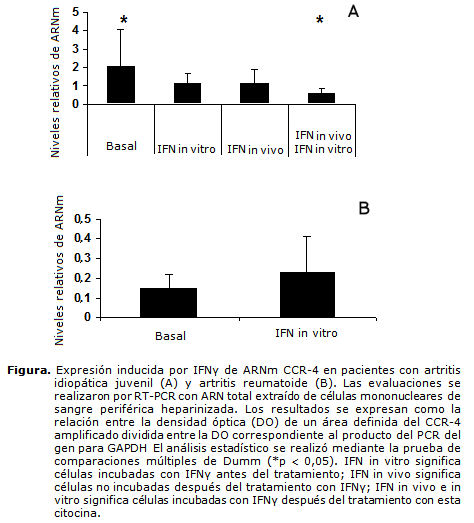
A los 6 meses se obtuvo respuesta completa o parcial en el 75 % de los pacientes por intención de tratar, mejoría que se mantuvo elevada (65 %) al final del estudio. Los respondedores fueron 4 de 6 (66,7 %) tanto para AIJ sistémica (2 respuesta completa) como pauciarticular (4 respuesta completa) y 5 de 8 (62,5 %) para la forma poliarticular (4 respuesta completa), como se muestra en la tabla 3. Por otra parte, el tratamiento con IFNγ in vivo e in vitro redujo la elevada expresión basal de este receptor en la AIJ (figura A). En contraste, in vitro tiende a sobreexpresar la baja expresión inicial de CCR-4 en 5 controles adultos con AR, no tratados con IFN (figura B).
Tabla 3. Evaluación global
(n = 20; las salidas del estudio se consideraron como no respuesta)
| Respuesta | 6 meses | 12 meses | 24 meses |
| Completa | 5 (25 %) | 7 (35 %) | 10 (50 %) |
| Parcial | 10 (50 %) | 6 (30 %) | 3 (15 %) |
| No respuesta | 5 (25 %) | 7 (35 %) | 7 (35 %) |
Los datos se expresan como número de pacientes (%).
Con respecto a la seguridad, 12 pacientes presentaron eventos adversos (tabla 4). Los más frecuentes fueron los esperados síntomas catarrales, en su mayoría leves y sólo dos clasificados como graves (hipoplasia medular y taquicardia) en 2 pacientes diferentes que fueron retirados del ensayo. No hubo afectaciones en el crecimiento y desarrollo mental.
| Evento adverso | Frecuencia (%) |
| Síntomas pseudogripales | |
| Fiebre* | 8 (40 %) |
| Cefalea | 6 (30 %) |
| Escalofríos | 5 (25 %) |
| Artralgias/mialgias* | 4 (20 %) |
| No ganancia de masa corporal | 1 (5 %) |
| Dolor precordial | 1 (5 %) |
| Hipoplasia medular | 1 (5 %) |
| Cianosis | 1 (5 %) |
| Taquicardia | 1 (5 %) |
| Pacientes con al menos un efecto adverso | 12 (60 %) |
*Asociación temporal al tratamiento con IFNγ, no a la enfermedad.
DISCUSIÓN
Los resultados satisfactorios obtenidos en 13 de 20 pacientes sugieren que el IFNγ pueda considerarse otra alternativa terapéutica en niños con AIJ. Para la forma sistémica, presentación clínica más grave, 4 de 6 pacientes fueron respondedores, incluyendo 2 remisiones totales. Las mejorías articulares y sistémicas se presentaron desde los primeros meses de tratamiento, reflejado en la calidad de vida por la disminución del índice de discapacidad. La suspensión o la reducción de la dosis de corticoesteroides fue otro resultado importante, ya que su uso prolongado se asocia a reacciones adversas, tales como retardo del crecimiento, osteoporosis, complicaciones oculares, edemas e inmunodeficiencia.2 La terapia con IFNγ tuvo un perfil de seguridad adecuado, y prevalecieron reacciones adversas bien conocidas para los interferones.15 En la AIJ los valores elevados de eritrosedimentación y una anemia pronunciada son consecuencias del proceso inflamatorio articular y de la medicación supresora de la médula ósea. En este estudio, en la mayoría de los pacientes se normalizaron la hemoglobina y la eritrosedimentación.
Los efectos moleculares del IFNγ sobre la etiopatogenia de la AR parecen ser contradictorios.16 El IFNγ se considera una citocina proinflamatoria que puede activar los macrófagos sinoviales.17 Sin embargo, puede antagonizar o interferir el efecto de otras moléculas proinflamatorias como IL-1.16 La resistencia a la artritis inducida por colágeno está regulada por la supresión de IL-17 mediada por IFNγ.18 Los ratones deficientes del receptor de IFNγ presentan la artritis con mayor frecuencia.19 En pacientes con AR activa se ha observado una baja expresión inducida de IFNγ en sangre periférica, mientras que su aumento se correlaciona con mejoría clínica.20 Esta proteína previene la destrucción ósea y la degradación del cartílago, inhibe la síntesis de colágeno y la proliferación de fibroblastos.21
El IFNγ puede promover otras acciones antiinflamatorias a través de la modulación de los receptores de quimiocinas.22 La elevada expresión de CCR-4 al parecer correlaciona con una mayor duración de la enfermedad;23 pero este papel patogénico puede regularse negativamente mediante la acción del IFNγ según nuestros hallazgos, los cuales contribuyen a definir diferencias fisiopatológicas entre la artritis juvenil y la adulta.
De los agentes biológicos aprobados para el tratamiento de la AR, la mayoría se basa en la acción del IFNα. De ellos, solo el etanercept, receptor soluble recombinante del TNF, está indicado en la AIJ. Sin embargo, dicho fármaco está contraindicado en pacientes predispuestos a infecciones, con infecciones recurrentes o recientes, sepsis o tumores previos,5 y en ocasiones el desenlace puede ser fatal.24 Lo anterior limita su administración a niños predispuestos a sepsis debido al uso continuado de corticoesteroides y metotrexato. Estos pacientes podrían obtener beneficios del tratamiento con IFNγ, ya que en edades tempranas la generación de una respuesta inmune débil puede ser muy perniciosa.
Los resultados obtenidos evidencian que el tratamiento de la AIJ con IFNγ recombinante, previamente descrito para pacientes muy avanzados, refractarios a otros procedimientos, puede extenderse a pacientes con enfermedad menos avanzada y prevenir así el deterioro funcional y la aparición de deformidades. Se justifica por tanto la realización de un estudio multicéntrico, controlado, a doble ciegas.
AGRADECIMIENTOS
Los autores desean agradecer a las doctoras Esther Cabrera y Cristina Rodríguez del Hospital Pediátrico «Dr. Ángel Arturo Aballí», así como a las doctoras Lourdes Franco y María González del Hospital Pediátrico de Centro Habana, por la remisión de pacientes al sitio de la investigación. Los autores recibieron gratuitamente el IFNγ de Heber Biotec, La Habana. El Ministerio de Salud Pública de Cuba facilitó la atención médica de los pacientes, incluyendo los procedimientos diagnósticos y otros medicamentos.
REFERENCIAS BIBLIOGRÁFICAS
1. Cassidy JT. Juvenile rheumatoid arthritis. In: Harris ED Jr, Budd RC, Genovese MC, Firestein GS, Sargent JS, Sledge CB, editors. Harris: Kelley's Textbook of Rheumatology. Chapter 96. 7th edition. St. Louis: W.B. Saunders, an imprint of Elsevier; 2005. Pp.1579-97.
2. Shanahan JC, St. Clair EW. Rheumatoid arthritis. In: Rakel RE, Bope ET, editors. Rakel: Conn's Current Therapy. Section 15: The Locomotor System. 58th edition. St. Louis: W.B. Saunders, an imprint of Elsevier; 2006. Pp. 1181-222.
3. Lovell DJ, Giannini EH, Reiff A, Jones OY, Schneider R, Olson JC, et al. Long-term efficacy and safety of etanercept in children with polyarticular-course juvenile rheumatoid arthritis: interim results from an ongoing multicenter, open-label, extended-treatment trial. Arthritis Rheum 2003;48:218-26.
4. Brassard P, Kezouh A, Suissa S. Antirheumatic drugs and the risk of tuberculosis. Clin Infect Dis 2006;43:717-22.
5. Enbrel prescribing information. [web site] Immunex Corporation, Seattle, Washington, USA. Available from: http://www.enbrelinfo.com/
6. Mühl H, Pfeilschifter J. Anti-inflammatory properties of pro-inflammatory interferon-g. Internat Immunopharmacol 2003;3:1247-55.
7. Pilette C, Fort J, Rifflet H, Cales P. Anti-fibrotic effects of interferons. Mechanisms of action and therapeutic prospects. Gastroenterol Clin Biol 1997;21:466-71.
8. Lemmel EM, Brackertz D, Franke M, Gaus W, Hartl PW, Machalke K, et al. Results of multicentric placebo controlled double-blind randomized phase III clinical study of treatment of rheumatoid arthritis with recombinant interferon gamma. Rheumatol Int 1988;8:87-93.
9. German Lymphokine Study Group. Double blind controlled phase III multicenter clinical trial with interferon-g in rheumatoid arthritis. Rheumatol Int 1992;12:175-85.
10. Veys EM, Menkes CJ, Emery P. A randomized, double-blind study comparing twenty-four-week treatment with recombinant interferon-g versus placebo in the treatment of rheumatoid arthritis. Arthritis Rheum 1997;40:62-8.
11. Pernice W, Schuchmann L, Dippell J, Suschke J, Vogel P, Truckenbrodt H, et al. Therapy for systemic juvenile rheumatoid arthritis with gamma-interferon: a pilot study of nine patients. Arthritis Rheum 1989;32:643-6.
12. Coto C, Varela G, Hernandez V, del Rosario M, Lopez-Saura P. Use of recombinant interferon gamma in pediatric patients with advanced juvenile chronic arthritis. Biotherapy 1998;11:15-20.
13. Cassidy JT, Levinson JE, Bass JC, Baum J, Brewer EJ Jr, Fink CW, et al. A study of classification criteria for a diagnosis of juvenile rheumatoid arthritis. Arthritis Rheum 1986;29:274-81.
14. Coto C, Varela G, Mendez M, Hernandez V, Cantero D. Validación de la versión cubana en español del cuestionario de evaluación de salud (CHAQ) en niños cubanos con artritis reumatoidea juvenil. Rev Cub Reumatol 1999;1:41-53.
15. Vial T, Descotes J. Clinical toxicity of the interferons. Drug safety 1994;10:115-50.
16. Rosloniec EF, Latham K, Guedez YB. Paradoxical roles of IFN-gamma in models of Th1-mediated autoimmunity. Arthritis Res 2002;4:333-6.
17. Klimiuk PA, Yang H, Goronzy JJ, Weyand CM. Production of cytokines and metalloproteinases in rheumatoid synovitis is T cell dependent. Clin Immunol 1999;90:65-78.
18. Chu CQ, Swart D, Alcorn D, Tocker J, Elkon KB. Interferon-gamma regulates susceptibility to collagen-induced arthritis through suppression of interleukin-17. Arthritis Rheum 2007;56:1145-51.
19. Zhao YX, Tarkowski A. Impact of interferon-gamma receptor deficiency on experimental Staphylococcus aureus septicemia and arthritis. J Immunol 1995;155:5736-42.
20. Hasler F, Daeyer JM. Diminished IL-2-induced gamma-interferon production by unstimulated peripheral-blood lymphocytes in rheumatoid arthritis. Br J Rheumatol 1988;27:15-20.
21. Harrop AR, Ghahary A, Scott PG, Forsyth N, Friedland A, Tredget EE. Effect of g interferon on cell proliferation, collagen production and procollagen mRNA expression in hypertrophic scar fibroblasts in vitro. J Surg Res 1995;58:471-7.
22. Bello I, Rizo MR, Badel CB, Blanco E, Valenzuela C, del Rosario M, et al. In vitro interferon gamma regulation of CCR-3 mRNA expression in peripheral blood leukocytes from atopic asthmatics. Clin Exp Med 2001;1:75-80.
23. Thompson SD, Luyrink LK, Graham TB, Tsoras M, Ryan M, Passo MH, et al. Chemokine receptor CCR4 on CD4+ T cells in juvenile rheumatoid arthritis synovial fluid defines a subset of cells with increased IL-4:IFN-gamma mRNA ratios. J Immunol. 2001;166:6899-906.
24. Sexton P, Harrison AC. Susceptibility to nontuberculous mycobacterial lung disease. Eur Respir J. 2008;31:1322-33.
Recibido: 4 de septiembre de 2009.
Aprobado: 26 de noviembre de 2009.
Idrian García García. Centro de Investigaciones Biológicas, División de Ensayos Clínicos, La Habana, Cuba.
Correo electrónico: idrian.garcia@cigb.edu.cu