Introducción
En las dos últimas décadas de este Milenio se han realizado múltiples investigaciones que han actualizado la importancia de la participación de la microbiota intestinal (MI) y su microbioma en la salud y la enfermedad, su asociación con la nutrición y en particular, su participación en los primeros 1000 días de vida, que incluye desde el momento de la concepción hasta el final de los dos años de edad.1,2,3
Los primeros 1 000 días de vida comprenden: 270 días de gestación, 365 días del primer año de nacido y otros 365 días del segundo año, para completar los 1000 días. Esta etapa es decisiva para el desarrollo cognitivo, lenguaje, destrezas emocionales y sociales del ser vivo.4,5,6,7
En este período, ocurre la formación de órganos y tejidos, potencialidades físicas e intelectuales. Es importante destacar la relación con el desarrollo neurológico, pues el cerebro, logra alcanzar 87 % de su tamaño y sus conexiones neuronales a los tres años de edad representan 80 % desde el momento de nacimiento, resultado de un crecimiento exponencial de las sinapsis neuronales. En el crecimiento y desarrollo cerebral resulta de vital importancia la nutrición y experiencias emocionales enriquecedoras. En este período la relación de la MI con el medio ambiente, adquiere un gran interés por su participación, basado en el papel del eje microbiota-intestino-cerebro, por lo que ha sido evaluado como un período crítico, con la significación de ventana epigenética en base a los aspectos nutricionales, ambientales y emocionales.5,7,8
En estos primeros 1000 días de vida, hay tres elementos decisivos con repercusión para la salud del neonato. Estos son: el modo del parto, la alimentación y la exposición a antibióticos. En este contexto la cesárea, la lactancia artificial y el antibiótico en período prenatal y posnatal representan factores de riesgo. Influyen también en la salud del niño, el tiempo de nacimiento (a término o prematuridad), condiciones ambientales (contacto con familiares y mascotas) y localización geográfica (norte vs sur de Europa; Europa vs. África).9,10,11
Es importante destacar que la MI actúa como primer estímulo fisiológico para el desarrollo del sistema inmune. El animal axénico (libre de microbiota) o el recién nacido se caracterizan por la ausencia de tejido linfoide intestinal maduro. En adición, tanto en el humano, como en el animal, se precisa de la implantación y posterior colonización microbiana en el tubo digestivo para demostrar las funciones del sistema inmune.
La inicial colonización del intestino es necesaria para los eventos de adaptación inmunológica que ocurren en el período neonatal, estos incluyen la función de protección de enterocitos y las funciones de respuestas inmunes innatas y adaptativas, entre las cuales participan la secreción de IgA polimérica, la respuesta de células T-auxiliadora y la tolerancia oral.12
Es objetivo de este artículo es revisar evidencias importantes sobre el significado de la relación entre la microbiota Intestinal y los primeros 1 000 días de vida y repercusión de los principales factores de riesgo.
Métodos
Se revisaron las publicaciones sobre microbiota intestinal y primeros 1 000 días de vida, en español e inglés en las bases de datos PubMed, Google Scholar y Scielo, desde enero 2005 a febrero 2020. Se emplearon los términos de microbiota intestinal, microbiomas, primeros 1000 días de vida, factores de riesgo, enterocolitis necrosante, probióticos y prebióticos.
Análisis e integración de la información
La MI y su microbioma es un conjunto de microorganismos compuesto por bacterias, hongos, virus, protozoos y arqueas, constituido principalmente por bacterias anaerobias, incluye más de 1000 géneros bacterianos y 600 especies. Su población sufre cambios en su composición y diversidad en el curso de la vida, desde recién nacido, infancia, adolescencia, adultez y ancianidad.12
LA MI es considerada un órgano metabólico virtual,1 cuyas funciones en los cambios químicos y biológicos que se producen continuamente en las células vivas de un organismo como la nutrición, y la protección, son indispensables para la salud. Su participación en los eventos de homeostasis ejerce una decisiva repercusión en el desarrollo del niño, en particular en el curso de los primeros de 1000 días de vida y en el resto de su infancia.12,13
Proceso de colonización intestinal
Reconocidos distintos factores han sido argumentados sobre el proceso de implantación y colonización de la MI del recién nacido, donde la participación de la figura materna es decisiva. Entre estos se derivan el modo del parto, contacto con la piel y lactancia. En años más recientes se han realizado investigaciones para precisar nuevos rasgos en la vida temprana.11) Los mismos son agrupados en factores prenatales y posnatales, los cuales pueden participar de forma aislada o asociados, según las determinantes del niño.12,13,14
Los factores prenatales o determinados por el medio ambiente prenatal son:
Factores maternos: incluye administración de fármacos: como antibióticos y bloqueadores H-2, estrés, dieta, higiene oral y peso materno.
Existencia prenatal de microbiota intestinal.
Modo del parto: normal por vía vaginal y cesárea.
Factores posnatales:
Tiempo de gestación
Tipo de alimentación: lactancia materna o fórmula artificial. El tipo de alimentación fue el primer factor conocido que influyó mucho en el establecimiento bacteriano, ya que la lactancia materna mejora la colonización intestinal por bifidobacterias y lactobacilos, en contraste con la alimentación con fórmula
Uso de medicamentos antibióticos: los administrados con más frecuencia reducen la diversidad y retrasan la colonización de la MI
Contacto con la piel de la madre y medio ambiente (mascotas).11,12,13,14
En este trabajo se abordan los sguientes factores: 1) la gestación, 2) el recién nacido y modo del parto: nacidos pretérmino y la cesárea 3) la alimentación con énfasis en la lactancia materna y la introducción de alimentos sólidos y 4) administración de antibióticos, aun desde posibles tratamientos de la madre en la etapa prenatal.
1. Gestación
El embarazo es un proceso fisiológico complejo asociado con diferentes situaciones hormonales, inmunológicas y de peso corporal. El microbioma intestinal de la madre cambia durante el curso del embarazo, en especial en el último trimestre, bajo influencias hormonales y presumiblemente en relación con la exposición microbiana del feto. Así mismo, significativos cambios inmunes ocurren durante el embarazo que tienen efecto en la microbiota, la cual participa de forma activa en procesos metabólicos con repercusión en eventos de disbiosis ‒evento producido por una desviación de la ecología intestinal normal‒ como ocurre en la obesidad, síndrome metabólico y diabetes.1 Dichos cambios metabólicos que suceden durante el embarazo influyen en la composición de la microbiota del recién nacido.
Recientemente se conoce que la disbiosis materna contribuye a la patogénesis de la preeclampsia por traslocación bacteriana, por eventos de alteración de la permeabilidad intestinal e inflamación de bajo grado producida.2 Además de la preeclampsia, otras complicaciones del embarazo, como la eclampsia, repercusión en el crecimiento uterino y nacimiento pretérmino se correlacionan con infecciones bacterianas y disbiosis.3
Es importante destacar la edad gestacional como factor participante en el establecimiento de la MI del recién nacido,15) pues influye en la elevada variabilidad de su constitución. La prematuridad determina en el proceso de implantación de una microbiota inmadura. Algunos expertos sostienen que el proceso de formación de la colonización intestinal y su alteración en el recién nacido es dependiente de los rasgos de la microbiota materna durante el embarazo o hasta tal vez antes de esa condición.4,15
El criterio sobre la esterilidad de la placenta es hoy día discutido. Se ha desarrollado la hipótesis de “colonización en el útero”, pero no se ha podido sustentar la existencia de microbiomas en el interior del medio fetal sano.16 Sin embargo, estudios de expertos han demostrado la presencia de comunidades microbianas únicas en el líquido amniótico y la placenta, que podrían aportar el inóculo inicial para la colonización intestinal, también se han encontrado en la membrana fetal y meconio.14,17 El concepto de “microbiota intrauterina” fundamenta su origen en el intestino de la madre, relacionado con los cambios que ocurren durante el embarazo en la MI materna, con eventos de traslocación bacteriana, demostrados en estudios experimentales en animales y con datos que sustentan el hecho de que los microbios intestinales maternos pueden ser transportados a la leche materna.17,18
1. El recién nacido y modo del parto
Las investigaciones han puesto en evidencia nuevas diferencias entre el parto natural por vía vaginal y el nacimiento por cesárea, y la participación clave en la salud del proceso inicial de colonización de la MI, modulado desde los primeros días de vida.19 En este período, la microbiota es limitada, con una diversidad escasa de microorganismos, con predominio de bifidobacterias, con la peculiaridad de que cada niño tiene una microbiota única en relación con el perfil de las especies bacterianas que lo constituyen, lo que determina que la composición de la MI es específica para cada huésped.20
El modo del nacimiento tiene un importante impacto en la composición y estructura de la MI. El patrón de colonización y diversidad de los primeros tres meses de vida se asocia al modo del parto.21
En el recién nacido por parto vaginal hay predominio de Bifidobacterium spp y reducción de Enterococcus y Klebsiella spp, a diferencia del recién nacido por cesárea. Estos desacuerdos comienzan a desaparecen entre los 6 a 9 meses del nacimiento. Así mismo, en el parto por vía vaginal se observa mayor diversidad bacteriana, con concentraciones más elevadas de especies de bacteroides, particularmente B. fragilis.10
La MI equilibrada, es expresión de microbiota saludable, la cual participa en la promoción y maduración del sistema inmune, lo que no acontece cuando no se alcanza el referido equilibrio, que predispone a distintos eventos, como infecciones gastrointestinales severas durante la infancia22) (Cuadro 1).
Cuadro 1 Desarrollo temprano microbiota intestinal
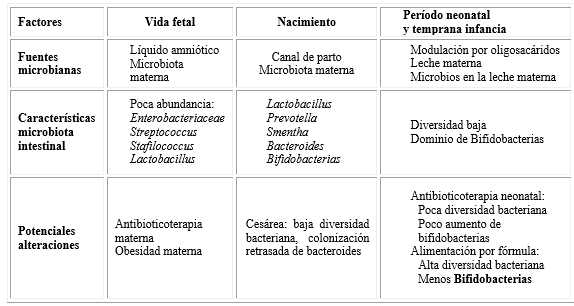
Fuente: Modificado de Rautava S. Microbial composition of the initial colonization of newborns. In: Isolauri I, Sherman PM, Walker WA, editors. Intestinal microbiome: Functional aspects in health and disease. Switzerland: Karger AG, Basel; 2017.22
Estudios recientes han permitido reafirmar la participación del modo del parto con el proceso de colonización e implantación de la MI en el recién nacido; la forma de nacimiento puede afectar su microbioma.23
En amplia investigación realizada en hospitales ingleses publicada en 2019 se informa que los niños nacidos por vía vaginal, tienen la mayor parte de su microbiota, constituida con microbios procedentes del intestino materno, a diferencia de los nacidos por cesárea, en los cuales la población bacteriana del intestino se relaciona con el medio ambiente hospitalario,20,24 aspecto que llamó la atención sobre la composición de la microbiota, pues en su mayor parte no procedía de la microbiota vaginal, como clásicamente se había descrito, así mismo, la administración de antibióticos previo a la cesárea afectó la composición de la MI de los niños.
El estudio comprendió 596 niños (314 nacidos por vía vaginal y 282 por cesárea), con análisis de muestras de heces a los 7, 14 y 21 días después del nacimiento. Los recién nacidos por cesárea carecían de cepas bacterianas comensales, y la composición bacteriana era a expensas de Enterococcus y Klebsiella, microorganismos que predominaban en el medio hospitalario, sin embargo, en los recién nacidos por parto normal era a expensas de bacterias comensales. Esta investigación demostró que el modo del parto afecta la composición de la MI durante el período neonatal, la lactancia y parte de la primera infancia.19,25
Es importante exponer que la composición de la MI en la primera semana de nacimiento se asocia con el número de infecciones respiratorias durante el primer año de vida.26 Así mismo, se ha considerado que el nacimiento por cesárea está muy estrechamente relacionado con la incidencia de obesidad, alergias, asma y enfermedades autoinmunes, como diabetes. y enfermedades neurológicas.24,27,28,29,30
Nacidos pretérmino
En estos niños (< 37 semanas de edad gestacional o< 2500 g de peso al nacer, o ambos), la presencia de MI aberrante ha sido evaluada como elemento fundamental en la patogenia de la enterocolitis necrosante (ECN) y la sepsis tardía del recién nacido, importantes causas de morbilidad y mortalidad. La ECN, cuyo mecanismo aún continúa sin ser esclarecido, es la más severa afección intestinal adquirida por el niño pretérmino, reconocida como una afección inflamatoria que podría ser mediada por microorganismos del intestino, aunque no se ha determinado con precisión. Son factores predisponentes la poca diversidad de la microbiota asociada a retraso en el proceso de colonización de bacterias anaerobias31) (Cuadro 2).
Cuadro 2 Microbiota intestinal y riesgo de enfermedad

Fuente: Modificado de Rautava S. Microbial composition of the initial colonization of newborns. In: Isolauri I, Sherman PM, Walker WA, editors. Intestinal microbiome: Functional aspects in health and disease. Switzerland: Karger AG, Basel; 2017.22
Estos criterios han servido de apoyo para argumentar el uso de los probióticos como moduladores de la MI en la ECN.32,33 Novedoso tratamiento que tiene la intención de lograr resultados beneficiosos que permitan prevenir la migración bacteriana a través de la mucosa intestinal con exclusión competitiva de bacterias patógenas y mejoría de los mecanismos de respuesta inmunológica.34,35) En número limitado de estudios, se planea la necesidad de reducción del riesgo de morbilidad y mortalidad por ECN severa y otras sepsis graves de las primeras semanas de nacido, incluida la sepsis nosocomial, por lo que los expertos han planteado la necesidad de nuevos estudios más uniformes para arribar a mejores conclusiones.34,35) Por otra parte, se ha observado en los niños con muy bajo peso al nacer (˂1500 g) ‒a partir de la secuenciación de la subunidad del gen 16S ARNr‒ gran riesgo de disbiosis de la microbiota, mejoría con el uso de probióticos que proporciona significativo aumento de Firmicutes con reducción de Proteobacterias y mayor frecuencia de Streptococcaceae y Lactobacillaceae.34,35
Parto por cesárea
El reconocido que el proceso de colonización microbiana del intestino en el neonato, es dependiente del modo de parto. Las tendencias muestran en los nacidos por parto vaginal, implantación precoz, con desarrollo adecuado en la composición y diversidad de la microbiota, la cual suele ser tardía en los nacidos de parto por cesárea, que se ha relacionado con exposiciones hormonales, físicas, bacterianas y médicas de distintas causas durante el nacimiento, lo cual determina que pueden repercutir en la salud del recién nacido.30)
En el nacimiento por cesárea electiva, se desarrolla una MI aberrante, productora de disbiosis, capaz de repercutir de manera perjudicial en la salud del niño. Es preciso enfatizar en los efectos a corto plazo que incluyen alteraciones en el desarrollo inmunológico, con posibilidad de aumentar el riesgo de alergia, asma y repercusión en la población de las bacterias comensales de la MI.36)
Se ha considerado que estas alteraciones tempranas pueden conducir a eventos metabólicos, inmunológicos y epigenéticos con importantes efectos en el desarrollo.
Es importante destacar que la cesárea es un procedimiento común de cirugía que puede salvar la vida de la madre y el niño, argumento reconocido por la OMS, aunque esta institución sostiene desde 1985 el criterio del Comité de Expertos de profesionales de la salud, que la tasa ideal debe variar entre 10 y 15 %,37) sin embargo, a nivel mundial hay un evidente progresivo aumento, tanto en países desarrollados, como en vías de desarrollo.
En 2018, la revista Lancet38) informó sobre el modo de parto en 169 países del orbe (98,4 % del total de nacidos), el número de cesáreas fue casi el doble (21,1 %) en 2015, en relación con los nacidos en el año 2000 (12,1 %).
La región de América Latina y el Caribe presenta la mayor tasa mundial de cesárea, ha alcanzado un promedio de 44,3 %. Los países con más elevado índice son República Dominicana (58,4 %), Brasil (55,5 %), Venezuela (52,4 %), Chile (46,9 %), Paraguay (45,9 %) y Ecuador (45,5 %). Este aumento global fue diez veces mayor que en las regiones de África occidental y central (4,1 %).
Llama la atención que la relación de aumento es a expensas de instituciones privadas en relación con las públicas (rango 6 a 1),39) y en mujeres con mayor nivel educacional y menor riesgo obstétrico, lo cual es representativo de las posibilidades de acceso al procedimiento. Aunque los beneficios del parto por cesárea para las madres y recién nacidos han sido definidos, dicho modo de parto resulta innecesario en múltiples ocasiones.40 Se enfatiza en la repercusión epidemiológica del parto por cesárea, para llamar la atención en la comunidad médica sobre sus demostrados efectos perjudiciales y en particular la afectación de la salud en relación con el desarrollo de la MI y consecuencias.41
3. Alimentación: lactancia e introducción alimentos sólidos
La alimentación es un elemento clave para regular la MI, por su activa participación en el proceso de colonización durante la lactancia y a partir del momento de introducción de los alimentos sólidos, importantes estados desde el nacimiento y durante el transcurso de los primeros 1000 días de vida.42)
Hoy día, está demostrado que la leche materna no es estéril y es reconocida su naturaleza prebiótica al contener oligosacáridos, (HMO sigla en inglés) y condición probiótica, por su contenido en bacterias (Lactobacillus y Bifidum). Estas ventajosas propiedades son capaces de modificar la composición de la MI, pues los prebióticos ejercen efecto selectivo para estimular el crecimiento de bacterias ácido lácticas en el colon, mientras los probióticos pueden crear nichos ecológicos para crecimiento bacteriano de especies específicas.42,43) Lo anterior, permite afirmar que la leche materna es capaz de modificar la estructura de la MI en el niño lactado por la madre, por la vía de su efecto prebiótico o probiótico, lo que se demuestra en la diversidad y riqueza bacteriana de la MI, que difiere de las de aquellos que reciben lactancia artificial con proporción de Firmicutes más baja y mayor de Proteobacterias y Bacteroidetes.
Una característica de la leche materna es su variación individual, pues en ocasiones puede contener Streptococcus, Stafilococcus, Propionibacterias, bacterias productoras del ácido láctico y Bifidobacterias. La composición en oligosacáridos es única para cada madre lactante. Los HMO tienen un efecto sobre grupos microbianos específicos en la leche humana y participan en el desarrollo de la composición de la MI en el niño.44,45)
En los niños nacidos por parto por cesárea y con exposición a antibiótico intraparto se observa que la lactancia materna limita los efectos perjudiciales posibles y favorece el desarrollo de un perfil de microbiota más similar a la de los niños nacidos por parto vaginal o que no han recibido exposición a antibióticos, argumento que apoya los beneficios de la lactancia materna exclusiva.45
En el curso de los primeros 1000 días de vida, el momento de introducción de alimentos sólidos en la dieta determina que la microbiota se transforme paulatinamente en su composición, al estar asociada en mayor proporción a Bacteroides, Ruminococcus y proporción más baja en Prevotella, para ir adquiriendo progresivamente hasta los dos años de edad el patrón de la microbiota del adulto, aunque en ocasiones por otras condiciones como prematuridad, bajo peso al nacer, enfermedades intestinales o influencias socioculturales y ambientales,46) puede prolongarse hasta los tres años o más, cuando ya alcanza estabilidad y una composición en la microbiota similar a la edad adulta.47,48)
Bäckhedy y otros49) confirman en niños suecos los criterios sobre los riesgos de la alimentación temprana en el primer año de vida, por la desfavorable repercusión en la composición de la MI del lactante, similar al efecto del parto por cesárea y exposición a antibiótico, capaces de producir daño a la salud con el desarrollo de distintas enfermedades.
Se ha observado a los 12 meses de edad, que la administración precoz de alimentos (<3 meses de edad) demuestra la hipótesis de predisposición a sobrepeso y obesidad, asociado a alteración de la MI y aumento en la producción de ácido butírico, aunque no en los restantes ácidos grasos de cadena corta (AGCC) A partir de los seis meses de edad, momento aconsejado para la introducción de alimentos sólidos, y en la medida en que los niños consumen dietas más complejas, emergen sucesivamente asociaciones entre los patrones dietéticos y la microbiota resultará similar al adulto.42)
Administración de antibióticos
El antibiótico es una indiscutible arma terapéutica para combatir de manera exitosa las infecciones bacterianas y restaurar la salud humana. Representa el medicamento más comúnmente administrado en el recién nacido y lactante en el curso de los primeros 1000 días de vida, que incluye exposición en la etapa prenatal, cuando es administrado a la madre durante el período de gestación, por enfermedad o por profilaxis intraparto y realizado de manera habitual en las cesáreas, para evitar infecciones quirúrgicas y por otras indicaciones, en especial, antes del pinzamiento del cordón umbilical con paso a la placenta en el acto del parto. Así mismo, en la etapa posnatal el antibiótico es usado para salvar la vida en infecciones graves de los neonatos.50,51
El efecto deletéreo de los antibióticos en la composición del microbioma intestinal, puede ser transitorio o a largo plazo y dependientes del tipo, vía, dosis y tiempo de administración del antibiótico.52
La influencia de los antibióticos sobre la MI, conceptualizada como un órgano metabólico, ha sido demostrada en múltiples estudios en la etapa prenatal y posnatal por la producción de cambios metabólicos, en especial en los tres primeros meses de vida, que puede reiterarse por nuevas indicaciones, capaces de producir un desequilibrio temprano y provocar una “microbiota obesogénica”, al contribuir al desarrollo de sobrepeso y posterior obesidad.
En su mecanismo se describe el efecto en la Ml de la fermentación de complejos de carbohidratos indigeribles con formación de AGCC, que incluyen ácidos butírico, propiónico y acético, los cuales son utilizados por los colonocitos del huésped como fuente de energía. Los AGCC y otros metabolitos microbianos pueden también influenciar en la secreción de péptidos derivados del intestino, y así mismo, en la regulación de la motilidad, absorción de nutrientes, saciedad y homeostasis energética.53)
La repercusión de los antibióticos en la MI es disímil, con mayor incidencia en la disminución de la diversidad y riqueza filogenética, incremento de la abundancia de Proteobacterias, incluidas las Enterobacteriaceae, que conducen a disbiosis asociada a estado proinflamatorio y una mayor expresión de los genes de resistencia bacteriana a los antibióticos.52
Otros efectos adversos frecuentes, incluyen, la referida resistencia al antibiótico y sobrecrecimiento microbiano a expensas de diferentes bacterias patógenas, entre las cuales se destaca por su severidad el Clostridium difficile, en especial, cuando la administración es prolongada o por micosis, como Candida albicans ssp.50)
Tratamiento de la microbiota intestinal
La afectación del microbioma en el recién nacido y en especial el nacido prematuro, requiere de tratamiento específico para su recuperación y evitar el desarrollo de enfermedades en corto, mediano y largo plazo. Estos tratamientos pueden lograrse con la administración de efectivas unicepas o multicepas de probióticos y posible asociación a prebióticos, en especial ante la exposición a antibióticos, como conducta necesaria para dar solución a la existencia de un “microbioma más débil”, con capacidad de desarrollar disbiosis aguda.
Hasta el presente se han utilizado distintas cepas de probióticos en los últimos años para reducir ECN, sepsis y mortalidad en los recién nacidos prematuros, pero los resultados han sido variables, desde mejoría, eficacia limitada o poco alentadores, lo que ha determinado que no se disponga de probiótico específico o combinados que hayan demostrado su efectividad respaldados por los resultados alcanzados para su efectiva indicación.33,34,35
Recientemente el Comité de Nutrición de la Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátrica y la Sociedad Española de Probióticos y Prebióticos (febrero 2020) han publicado ambas,54 documento con las pautas que acredita el uso de una combinación (triple terapia) de cepas de probióticos, basado en estudios de evidencia por la eficacia probada en ensayos clínicos con Bifidobacterium infantis Bb-02 (DSM 33361), Bifidobacterium, BB-12® y Streptococcus thermophilus, TH-4® en una dosis de 3,0 a 3,5 x 108 unidades formadoras de colonias (UFC) para cada cepa para el tratamiento de ECN (incidencia de 1 por cada mil nacidos vivos). Estos probióticos. producidos por un reconocido laboratorio de Dinamarca, reducen la evolución de ECN y además, pueden aplicarse como producto preventivo en la prematuridad. Esta recomendación resulta de trascendencia promisoria para el tratamiento y reducción de las tasas de ECN, con una incidencia actual entre 5 y 15 % en los prematuros de bajo peso al nacer (moderados a tardíos [32 a 37 semanas] y muy prematuros [28 a 32 semanas]).55) La comunicación del Comité referido reportó una reducción de 50 % del riesgo de ECN.
Los expertos de la comunidad científica han creado el concepto “Origen y desarrollo de la salud y la enfermedad”,56) relacionado con los primeros 1000 días de vida. Este concepto representa una apertura a una serie de factores, como nutrición, ecología, condiciones socioeconómicas y estilo de vida, que tienen una repercusión demostrada en el genoma por su participación en la programación del estado de salud e intervenir en los riesgos que pueden desarrollarse en el curso de la vida.56,57)
La naturaleza brinda a la especie humana las mejores condiciones para su reproducción y perpetuación, dota a la mujer con las mejores condiciones para la salud humana mediante la maternidad por parto normal (vaginal) y lactancia materna exclusiva. Así mismo, en los primeros 1000 días de vida, los eventos relacionados con la nutrición resultan de gran importancia, pues entre el 50-70 % de la energía producida por los alimentos absorbidos a través del intestino es consumida por el cerebro, lo que ratifica el valor de la alimentación y una buena nutrición, para los riesgos cognitivos y desarrollo físico. En este contexto se ha establecido la relación natural de la MI en este período de vida y los referidos indicadores que participan como factores determinantes.2,57)
Es de importancia resaltar la repercusión en la MI del parto por cesárea debido a las alteraciones en el proceso de colonización de la MI. La cesárea se ha convertido en un procedimiento muy frecuente, que puede salvar la vida de la madre y del niño, pero también desencadenar riesgos para la salud del neonato, pues en muchas ocasiones puede ser una innecesaria práctica que debe ser solucionada. En este aspecto, es obligado recordar que la OMS ha planteado la trascendencia de las elevadas tasas de cesárea en países desarrollados y en vías de desarrollo, correspondiendo las más altas a los países de la región latinoamericana, ante lo cual es preciso acometer acciones por la comunidad médica para alcanzar las tasas recomendadas de 10-15 %.36,37)
Se ha enfatizado en la participación de la disbiosis como evento de riesgo a consecuencia de la alteración de la MI, relacionada con el curso de la lactancia artificial, exposición a antibiótico y el administrar precozmente alimentos sólidos. La demostración de específicos probióticos, asociados en multicepas para su empleo en la prematuridad resulta de gran trascendencia pues abre un futuro promisorio ante una microbiota inmadura, útil también para el tratamiento de la ECN y de la sepsis grave tardía del prematuro y recién nacido, con dicha bioterapia.58)
Los primeros 1 000 días de vida representan una etapa decisiva en el desarrollo humano por sus relaciones con la salud y enfermedades a mediano y largo plazo, donde la influencia de la MI juega un papel determinante.
El proceso de implantación y colonización microbiana del intestino participa en la programación de eventos metabólicos e inmunológicos relacionados con la microbiota, los que son influenciados por factores fundamentales, como el modo del nacimiento, alimentación, y exposición a antibióticos durante la etapa prenatal y posnatal. Estos factores son decisivos para alcanzar un equilibrio del ecosistema intestinal y la obtención de una microbiota sana o contrariamente repercutir en la producción de distintas enfermedades.
Hay evidencias acerca la participación del parto por cesárea, la lactancia artificial y el tratamiento con antibiótico como importantes factores de riesgo por alteración del normal patrón de desarrollo, en comparación con aquellos niños nacidos por vía vaginal, amamantados por la madre y no expuestos a antibióticos.
Es necesario la eficaz restauración de la disbiosis mediante tratamiento con simbióticos (bioterapia específica con probióticos y prebióticos) en el curso de la etapa posnatal, en especial en el recién nacido prematuro. Se llama la atención acerca de la trascendencia del control y cuidados adecuados del embarazo, parto normal, lactancia materna exclusiva, momento establecido de introducción de alimentos sólidos y adecuada conducta del uso de antibióticos prenatal y posnatal para evitar las etapas de ventanas desfavorables que resultan nocivas para el crecimiento y desarrollo del niño en el período en los primeros 1000 días de vida.
Finalmente, en las conclusiones, se expone el valor de la microbiota intestinal en los primeros 1000 días de vida para la salud del niño, influenciada por condiciones de normalidad como el parto vaginal y la lactancia materna e implicaciones clínicas relacionadas con factores de riesgo mencionado. Es importante el tratamiento con probióticos multicepas y prebióticos para la recuperación de la microbiota en el niño en enfermedades como la enterocolitis necrosante y estados de sepsis grave.














