Introducción
La obesidad infantil constituye actualmente uno de los problemas de salud pública más importantes, tanto en los Estados Unidos de América, donde aproximadamente la tercera parte de los niños y adolescentes tienen sobrepeso u obesidad,1,2 como en otros países desarrollados3 y en aquellos en vías de desarrollo;4 con una clara influencia familiar, ya que tener un padre obeso aumenta el riesgo de obesidad de dos a tres veces y hasta 15 veces si ambos padres lo son5 y una asociación potencial con trastornos en las relaciones interpersonales en la infancia, alteraciones psicosociales y el desarrollo de enfermedades crónicas posteriores, lo cual hace de suma importancia establecer los mecanismos que predisponen al niño a desarrollar esta condición.6,7
Se ha descrito la influencia de factores ambientales, como estilos de vida sedentarios y la ingesta calórica excesiva en el desarrollo de la obesidad, los cuales, si bien explican solo una parte de la enfermedad, son parte fundamental del tratamiento, debido a que son potencialmente modificables.5 (Fig.).
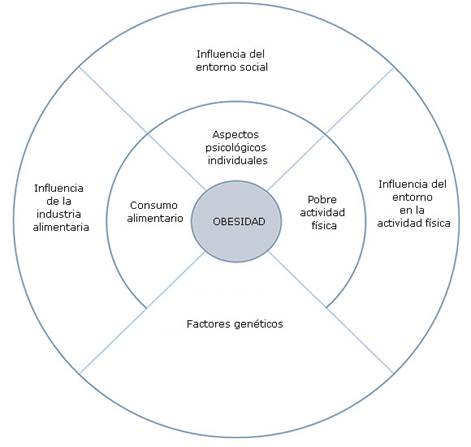
Fig.- La obesidad constituye una enfermedad crónica, con múltiples factores causales que pueden estar interrelacionados entre sí.
Existe evidencia actual sobre la contribución de la herencia genética al riesgo de desarrollar obesidad mediante la identificación de numerosos polimorfismos relacionados con la regulación del peso corporal,8,9) sin embargo, al igual como ocurre con otros fenotipos complejos, el aspecto genético explica parcialmente la variación total de algunos parámetros antropométricos ampliamente utilizados en los estudios como el Índice de masa corporal (IMC), por lo cual existe una necesidad urgente de establecer nuevos modelos que identifiquen el mecanismo complejo del aumento patológico de peso en el tiempo.10
La presente revisión, tiene como objetivo obtener información recientemente publicada acerca de la interacción entre los genes y el medio ambiente en la obesidad infantil.
Métodos
Se realizó una búsqueda bibliográfica entre enero del 2016 y septiembre del 2021 en la base de datos Medline a través del motor de búsqueda Pubmed utilizando los términos: ("Obesity"[Mesh] OR "Obesity"[tiab]) AND ("Child"[Mesh] OR children[tiab] OR pediatr*[tiab] OR "Adolescent"[Mesh] OR adolescen*[tiab] OR teen*[tiab] OR youth*[tiab]) AND ("Environment"[Mesh] OR environment*[tiab]) AND ("Genes"[Mesh] OR gene*[tiab]).
Se usaron los filtros para obtener las publicaciones por título, resumen y texto completo. Se recuperaron inicialmente 390 artículos y finalmente 154 al considerar solamente los publicados en los últimos 5 años. De estos, se seleccionaron los que tuvieron relevancia para la presente revisión.
Análisis e integración de la información
La influencia de los genes sobre los cambios del peso corporal,11 puede ser explicada por los diferentes tipos de variantes genéticas asociadas a la obesidad,8,9 su frecuencia en la población y el efecto de estas sobre el fenotipo. Se estima que los factores genéticos explicarían entre el 40-75 % de la variación del IMC12 tomando como referencia el resultado de los estudios de asociación del genoma completo, que han identificado más de 300 genes relacionados, no solamente con este indicador, sino también con el índice cintura/cadera (ICC) y la adiposidad.13
Una de las principales limitaciones de la mayoría de estos estudios, es que incluyen el IMC como resultado principal, pero no tuvieron en cuenta otras variables, que ya podrían estar presentes antes del desarrollo de la obesidad y que podrían influir en su aparición, como por ejemplo, los factores psicosociales.14 Asimismo, es importante tener en cuenta que, según el resultado de algunos estudios, los rasgos y patrones relacionados con el tiempo dedicado a la actividad física y el hábito sedentario, también parecerían estar influenciados por factores genéticos.15
Por otro lado, algunos estudios recientemente publicados, informan que los individuos genéticamente predispuestos tienen un mayor riesgo de tener una IMC más alto y, que la predisposición genética combinada con los factores ambientales, ha contribuido a aumentar la incidencia de obesidad; sin embargo, también se ha visto que el IMC ha aumentado, tanto para los individuos genéticamente predispuestos como para los que no lo son, lo que sugiere que los factores ambientales, podrían tener una mayor influencia en el desarrollo de la obesidad que los factores genéticos.16
Variantes genéticas asociadas a la obesidad
El factor hereditario tiene un papel clave en el desarrollo de la obesidad infantil, con una tasa de heredabilidad de hasta 70 %, mayor en niños que en adultos.17 Los factores ambientales, si bien influyen, se consideran solo un desencadenante, ya que la susceptibilidad genética al aumento de la adiposidad es necesaria para que un individuo se vuelva obeso,18 tal como lo demuestra Silventoinen y otros,19 quienes realizaron una revisión sistemática en gemelos y niños adoptados y concluyen que los factores ambientales influyeron moderadamente en la variación del IMC solo hasta los 13 años.
Otros investigadores, han demostrado que el estado nutricional materno durante la gestación, la diabetes gestacional, el tabaquismo materno, el peso aumentado al nacer, el aumento rápido de peso del lactante o las prácticas inadecuadas de alimentación, favorecen el desarrollo de la obesidad en etapas posteriores de la vida.20,21,22,23,24,25,26 Por lo tanto, los factores ambientales “obesogénicos” deben asociarse con variables de diferentes alelos de riesgo para producir la obesidad poligénica o común.27
Estudios recientes han identificado más de 50 loci genéticos, con ciertas variantes asociadas a la regulación del peso y la acumulación del tejido adiposo, que resultan en formas poligénicas de obesidad.17 Además, se ha demostrado que cada individuo con obesidad poligénica, tendría su propio conjunto específico de variantes genéticas, diferentes a otros individuos con obesidad,28 lo que le confiere una susceptibilidad genética individual, capaz de interactuar con diferentes factores ambientales y provocar estados de bienestar o enfermedad.10
A continuación, se describen las principales variantes genéticas descritas en la literatura.
Gen FTO (asociado con la masa grasa y obesidad)
Localizado en la posición 16q12.2 del cromosoma 16, se expresa en el núcleo arqueado del hipotálamo, zona responsable del control del apetito y el metabolismo de ácidos grasos.29 Diferentes estudios han comunicado la asociación positiva entre el genotipo AA del polimorfismo del gen rs9939609 FTO y el riesgo de sobrepeso u obesidad en niños y adolescentes brasileños,30 la relación entre el alelo A y el aumento de la masa grasa y el IMC en niños escoceses,31 la mayor tendencia de ingesta de alimentos con mayor contenido graso y pérdida del control de ingesta de alimentos en niños y adolescentes americanos portadores del genotipo AT o AA32 y, la preferencia por una dieta a base de carne en niños y adolescentes chinos portadores del genotipo AA en comparación con los portadores del genotipo TT que preferían una dieta a base de vegetales.33
Estudios en población brasileña34 y en afroamericanos35 no han encontrado relación entre polimorfismos del gen FTO y la obesidad y postulan que el origen étnico podría influir en dicha asociación, asimismo, las intervenciones dietéticas asociadas al ejercicio, tendrían influencia sobre la susceptibilidad genética a la obesidad en niños portadores del genotipo de riesgo rs9939609 FTO.36
Por otro lado, la evaluación de múltiples polimorfismos del gen FTO (rs1121980, rs9930506 y rs99399609),27 ha señalado en adultos la expresión de dos haplotipos dispares de las variantes del gen FTO: un haplotipo de riesgo TCGA y un haplotipo protector CTAT, además de la asociación entre el polimorfismo del gen FTO rs9939609 y ciertas complicaciones de la obesidad como hipertensión arterial y resistencia a insulina (RI).37
Leptina
Hormona sintetizada por los adipocitos con un rol clave en la regulación de la ingesta de alimentos y el equilibrio energético, cuyo déficit congénito puede producir obesidad mórbida, hiperfagia severa, hiperisulinemia o diabetes mellitus tipo 2 (DM2).17
Se ha demostrado una fuerte asociación entre los niveles circulantes elevados de leptina con el aumento de masa grasa en obesos y con dificultades para la disminución de peso, lo cual podría estar relacionado con la presencia de los polimorfismos 11761556 A/C (en el gen de leptina) y rs1137100 A/G (en el gen del receptor de leptina).38 Otro estudio que evaluó los polimorfismos del gen del receptor de leptina 223, 492 y 1019 demuestra, en primer lugar, que las combinaciones más frecuentes en niños con obesidad fueron AG/GG/GA, AG/GG/GG y AG/GG/GA y, en segundo lugar, que los parámetros antropométricos y las concentraciones séricas de leptina y adiponectina se correlacionan con el genotipo variante 223. Las conclusiones de este estudio plantean que si bien los polimorfismos 223,1019,492 y 976 del gen del receptor de leptina pueden modular el estado nutricional, tanto en niños normales como aquellos con sobrepeso y obesidad, también dependen de factores ambientales, nutricionales y sociales.21
Factor de necrosis tumoral alfa (TNF-α)
Es una citocina proinflamatoria, con un papel catabólico en la infección y el cáncer, además de ser un mediador de caquexia con hiperlipidemia asociada, ya que participa en el metabolismo lipídico y provoca hipertrigliceridemia por disminución de la actividad de la lipoproteína lipasa y por aumento de la síntesis de ácidos grasos de novo. Es capaz de regular la expresión y secreción de leptina y, algunos estudios han demostrado una alta expresión en sujetos obesos y correlación con hiperinsulinemia.17 Se ha identificado una sustitución G/A en la región promotora (G-308) del gen TNF-α,39 y encontrado que el polimorfismo G-308 A de este gen se asocia a hipertensión arterial, concentraciones de leptina e hipercolesterolemia, por lo que resulta un síndrome metabólico (SM) en un estudio,40 a diferencia de otras investigaciones, que demuestran correlación entre el alelo 308 G y riesgo de obesidad.41,42
Existen otras publicaciones que no han demostrado en sus resultados, una correlación entre el polimorfismo 308 G>A del gen TNF-α y obesidad en sujetos iraníes,43 así como su hallazgo con mayor frecuencia en niños rumanos con peso normal,23 por lo cual, a pesar de que la obesidad constituye un estado inflamatorio sistémico, el papel del polimorfismo 308 G>A del gen TNF-α, aún no se ha establecido completamente.
Receptor de melanocortina 4 (MC4R)
El gen MC4R, al igual que el gen FTO, cumple un papel regulador en el control de la ingesta de alimentos y el equilibrio energético. El polimorfismo rs17782313 del gen MC4R se asoció a obesidad en adultos, niños europeos y mexicanos, con un efecto sinérgico con el gen FTO44,45 y, ha demostrado un efecto importante sobre el tamaño corporal y la distribución de grasa y además, que el genotipo C/C se asocia a un IMC más alto.46
Un descubrimiento reciente muy importante, es la asociación entre el polimorfismo rs17782313 del gen MC4R y la adiponectina en niños chinos, que sugiere que la adiponectina participaría en la mediación del efecto del gen MC4R sobre la obesidad.47 Asimismo, este polimorfismo demuestra un rol clave en el control de la conducta alimentaria en un estudio reciente donde niñas obesas que portaban el alelo C de este genotipo expresaron una menor capacidad de respuesta a la saciedad y puntuaciones más altas de alimentación no controlada en comparación con las no portadoras, mientras que los niños obesos portadores del mismo alelo presentaron un menor valor gratificante de los alimentos en comparación con los no portadores.48 Por otro lado, una investigación en recién nacidos griegos evaluó las variantes de riesgo FTO y MC4R y concluyó que cerca del 80 % de la población griega, estaría genéticamente predispuesta al desarrollo de obesidad en etapas posteriores de la vida.49 Adicionalmente, otros autores han demostrado que la expresión de los genes MC4R y FTO, puede ser modulada tanto por la dieta como por la actividad física.50
Ectoenzima nucleótido pirofosfato fosfodiesterasa (ENPP1)
Este gen, también denominado glicoproteína 1 de membrana plasmática (PC-1) se ubica en el cromosoma 6q23.2 y su rol, junto al de sus polimorfismos en el metabolismo energético y la fisiología en el tejido adiposo, ha sido extensamente estudiados. Se ha informado el papel potencial del polimorfismo rs997509 como factor contribuyente en el desarrollo de DM2 en individuos obesos51 y la asociación entre el polimorfismo K121Q (rs1044498), tanto en la RI, como a DM2 en adultos52 y, en niños obesos y destaca en estos últimos, su papel potencial en la alteración inicial del metabolismo de la glucosa y la insulina y el posterior desarrollo de la obesidad,53 sin embargo, otros estudios no han encontrado relación entre el polimorfismo K121Q y la RI en individuos pakistaníes con DM2,54 sugiriendo que la raza podría influir en esta asociación.
Otros genes relacionados con la obesidad
El receptor gamma del proliferador activado de peroxisoma (PPAR ɣ), también denominado NR1C3, se expresa fundamentalmente en los adipocitos, regula su diferenciación y además cumple un papel importante en el metabolismo energético.55. Se ha demostrado la asociación con obesidad en adultos jóvenes46 y la presencia del polimorfismo Pro12A1a con el riesgo de obesidad, RI, DM2 y eventos cardiovasculares.17
El gen de la enzima convertidora de angiotensina (ACE) se localiza en el brazo largo del cromosoma 17 (17q23) y ha demostrado tener un papel potencial en el desarrollo de obesidad.56 Se postuló una posible relación funcional entre los genes PPARɣ y ACE, teniendo en cuenta que PPARɣ regula el sistema renina-angiotensina mediante la modulación transcripcional de renina, angiotensinógeno, ACE y el receptor 1 de angiotensina II;57 sin embargo, los resultados obtenidos son aún contradictorios.
Estudios realizados han demostrado que, el polimorfismo I/D se asoció a glucosa elevada,58 mientras que, en niños, se encontró que tanto los portadores del polimorfismo I/I,59 como aquellos con polimorfismo D/D, tuvieron parámetros antropométricos más altos. Si bien, hay publicaciones que informan una relación insignificante entre el polimorfismo I/D y obesidad en pacientes con DM2,60 también se ha demostrado que los genotipos I/D podrían influir de diferente manera, según sea portador del alelo I, sobre los parámetros específicos del metabolismo en adolescentes obesos sometidos a tratamiento con estilos de vida saludables.56
Los genes del glutatión S-transferasa (GST), son enzimas de fase II que participan en la desintoxicación de compuestos electrófilos tanto intrínsecos como extrínsecos.61 Los primeros cambios en la obesidad, la enfermedad de hígado graso no alcohólico (NAFLD) y DM tipo 2 se han relacionado con la expresión aberrante de GST hepática.62 Asimismo, los polimorfismos GSTM1, GSTT1 y GSTP1, que producen una actividad alterada de GST, se han asociado a mayor riesgo de DM 2 por un mecanismo todavía no bien establecido,62,63 aunque se ha planteado que en población coreana el polimorfismo GSTM1 no se asoció con mayor riesgo de obesidad.61
La interleucina 6 (IL-6) juega un papel crítico en la vía de señalización inflamatoria y su alta concentración circulante se ha asociado con la obesidad y el tejido adiposo visceral.64,65 Sus variantes genéticas, pueden alterar tanto la función como la expresión de los genes asociados con la ingesta y el gasto de energía, lo cual podría explicar la asociación entre polimorfismos de un solo nucleótido y los fenotipos de obesidad.66 Un metaanálisis recientemente publicado, concluyó que el polimorfismo 174G> en la región promotora del gen de IL-6 se asocia a un incremento significativo del riesgo de obesidad,64 mientras que otro estudio realizado en niños caucásicos, determina mayor frecuencia de los genotipos 572CC, 19CC y 174CG en obesos y limita al genotipo 174CC como un actor protector para obesidad infantil.67
Genética y su relación con el entorno
Rasgos individuales
Las primeras investigaciones sobre susceptibilidad individual a la obesidad tuvieron resultados muy relevantes, como el de Carr y otros,68 quienes evaluaron la relación entre 44 polimorfismos de genes candidatos de sistemas opioides, dopamina y serotonina con el refuerzo alimentario y el IMC y encuentran que el polimorfismo rs6314 del gen del receptor 2 A de serotonina, parecía relacionarse con un aumento o disminución del riesgo de desarrollar un IMC alto en las personas con un refuerzo alimentario alto o bajo respectivamente, de ahí que establecieron la hipótesis de que el alelo A podría asociarse con una respuesta exagerada a la estimulación con serotonina, probablemente por una sensibilidad disminuida a la sensación de saciedad. Por el contrario, en presencia de una alta motivación para comer, esta mutación se asocia a un aumento del IMC.
Otro estudio realizado en niños genotipados para el alelo de 7 repeticiones del gen del receptor 4 de dopamina (DRD4 7), encuentra que las niñas portadoras, consumían más calorías derivadas de grasas cuando vivían en condiciones socioeconómicas adversas, en comparación con las no portadoras; mientras que cuando pertenecían a estratos socioeconómicos más altos, ingerían menos calorías derivadas de las grasas en comparación con las no portadoras.69
Adicionalmente, una investigación en preescolares canadienses que evaluó la asociación entre la sensibilidad materna y el riesgo de sobrepeso/obesidad según sean portadores o no del DRD4 7, informa que los portadores del alelo que estaban expuestos a una baja sensibilidad materna a temprana edad, tienen mayor riesgo de desarrollar sobrepeso/obesidad con una evidencia particular del efecto de susceptibilidad diferencial en las niñas, lo cual sugiere que, muy temprano en el desarrollo, el alelo DRD4 7 podría aumentar la sensibilidad a múltiples señales ambientales relevantes para la regulación del peso en edades posteriores de la vida.70
Medio ambiente
Se han descrito varios factores ambientales que tendrían impacto sobre el desarrollo en etapas precoces de la vida y que aumentan la predisposición para padecer enfermedades crónicas.
Factores preconcepcionales
En los últimos años, la prevalencia de sobrepeso y obesidad en mujeres en edad fértil ha aumentado en forma dramática, ha llegado a superar 30 % en algunos países desarrollados,71 aumenta el riesgo durante el embarazo de presentar diabetes gestacional, preeclamsia, parto prematuro, parto por cesárea y uso de antibióticos, además del aumento de riesgo de tener un producto con alto o bajo peso al nacer y el consiguiente desarrollo de sobrepeso o disfunción metabólica, explicados por los mecanismos de programación fetal.72
Se ha descrito una correlación positiva entre el IMC materno, previo a embarazo, y alteraciones en la metilación del ADN durante la vida temprana que predisponen al desarrollo de enfermedades metabólicas y crónicas como NAFLD, obesidad, DM2 y enfermedad renal crónica en la descendencia a través de la, programación fetal,73 así como una expresión diferencial de genes relacionados con el metabolismo de glucosa, lípidos, proteínas, insulina y mediadores inflamatorios y reactividad vascular en fetos a término de mujeres con sobrepeso y obesidad.74 Adicionalmente, un estudio donde se comparó, la metilación diferencial en el ADN extraído de los leucocitos de la sangre del cordón umbilical de recién nacidos con padres obesos y padres no obesos, encuentra que tanto la obesidad paterna como la materna se asocian con patrones de metilación alterados en su descendencia.75
Entorno intrauterino
La vida fetal constituye un período crítico donde factores, como la exposición intrauterina a la obesidad materna, pueden jugar un papel importante en la programación metabólica y afectar el desarrollo posnatal y aumentar el riesgo de desarrollar obesidad en la edad pediátrica y adulta;76 RI, enfermedad cardiovascular y NAFLD.77,78 Las células madre mesenquimales, derivadas del cordón umbilical de recién nacidos de madres obesas, demostraron una mayor capacidad para convertirse en adipocitos, lo cual sugiere que las células progenitoras que son capaces de diferenciarse en tejido adiposo, músculo esquelético o los condrocitos, ya podrían estar anormalmente programas desde la etapa intrauterina.76,79
La programación metabólica se produce a través de eventos epigenéticos por interacciones genético-ambientales y se ha demostrado que la nutrición materna puede alterar la metilación del ADN en tejidos infantiles como células bucales y sangre del cordón umbilical,80 por lo que abre la posibilidad de determinar el riesgo de desarrollar obesidad mediante el uso de predictores como la presencia de la metilación del gen NRF1 (gen del factor respiratorio nuclear 1) en saliva, como se demostró en niños hispanos.81
Un estudio muy interesante realizado en Gambia, sobre diadas madre-infante, determina que la variación estacional (lluviosa vs seca) en la dieta materna en el momento de la concepción, altera la metilación del ADN de metaalelos epiestables (EM) en lactantes de 2 a 8 meses de edad. Estos cambios se correlacionaron con las concentraciones plasmáticas maternas de vías claves donantes de metilo como metionina, colina, folato, homocisteína y vitaminas del grupo B.82 Es importante tener en cuenta que la metilación de los EM se produce estocásticamente durante la embriogénesis temprana y es muy sensible a factores como la nutrición materna y la obesidad. Este establecimiento muy precoz de grupos metilo en EM específicos, permite que esta metilación se mantenga de forma estable a través de los diferentes linajes celulares durante la diferenciación, pero aún no está claro si la nutrición materna, la obesidad o la ganancia de peso durante el embarazo, podrían modificar en forma permanente los patrones de metilación de tal manera que puedan causar cambios permanentes en la expresión genética.82
Tipo de parto
El parto por cesárea aumenta el riesgo de desarrollar sobrepeso y obesidad infantil en pacientes menores de 5 años, de 6 a 15 años y en adultos jóvenes de 20 a 28 años,83 así como DM 2 en adultos, en comparación con el parto vaginal, probablemente por cambios en la microbiota intestinal de la descendencia que puede provocar aumento en el almacenamiento de energía de la dieta e inflamación crónica inducida por lipopolisacáridos bacterianos, con aumento de la adiposidad y alteración en el metabolismo de la glucosa en el huésped.84 Las diferencias en los patrones de metilación del ADN entre los niños nacidos por cesárea y los nacidos por parto vaginal, también se han propuesto para explicar esta asociación, teniendo en cuenta estudios que han demostrado una mayor metilación global en los nacidos por cesárea85 y otros que analizan todo el genoma e identifican 343 loci que estaban nominalmente metilados en forma diferencial entre los neonatos nacidos por ambas vías.86 El hallazgo del aumento de riesgo de sobrepeso a los 12 meses de edad, cuando la cesárea fue programada, en comparación con la cesárea de emergencia,87 demuestra la necesidad de más estudios para definir completamente el rol del tipo de parto sobre el riesgo de obesidad.
Tipo y duración de lactancia
Los primeros mil días de vida, constituye el período de máxima susceptibilidad de los individuos y el tipo de nutrición durante esta etapa, puede afectar el desarrollo normal y provocar alteraciones permanentes, tales como la obesidad, a través de la programación metabólica.88 El análisis de células de la mucosa bucal encuentra una asociación entre la duración de la lactancia y la metilación del ADN, en forma positiva con el gen del receptor X retinoide alfa (RXRA) (relacionado con el metabolismo) y en forma negativa con el gen de leptina (control del apetito), lo que explicaría el efecto protector de la lactancia materna en el desarrollo de obesidad.89. Por el contrario, el mayor contenido de calorías y proteínas en las formulas infantiles, puede provocar un aumento rápido de peso en la infancia y podría programar a los niños para desarrollar obesidad mediante alteraciones epigenéticas.89,90
Interacción padres-niños
El desarrollo biológico, psicológico y social depende de la interacción padres-hijo desde las etapas iniciales de la vida y, su alteración, principalmente en la relación madre-niño, se asocia con un mayor riesgo de obesidad y consumo incrementado de alimentos con alto contenido calórico en edades posteriores.10,91,92 Además, la investigación de la sensibilidad materna como factor ambiental, plantea que la susceptibilidad diferencial, a través de ciertos genotipos, podrían afectar tanto la conducta alimentaria como el riesgo de desarrollar obesidad; como se informa en el seguimiento longitudinal de dos familias holandesas con dos adolescentes, que detecta un efecto moderador del genotipo 5-HTTLPR en la relación entre los síntomas depresivos y el incremento en el consumo de alimentos relacionado con los sentimientos (alimentación emocional) en ambos sexos en los hermanos más pequeños, mientras que en los hermanos mayores, este efecto es solo en las mujeres. Asimismo, evidencia actual demuestra que el polimorfismo 5-HTTLRR está asociado al desarrollo de depresión y al aumento del riesgo de desarrollar obesidad.93
Influencia familiar
Un entorno familiar positivo, puede influir en el establecimiento de conductas beneficiosas para la salud a través del modelo de roles y la provisión de alimentos saludables94 de tal manera que la capacidad de los niños de imitar a los demás y aprender mediante la observación, podría explicar el tipo de conducta alimentaria desarrollada.95 Se ha registrado la relación entre la frecuencia de comidas familiares con la ingesta de nutrientes, el riesgo de obesidad, las malas prácticas de alimentación y la presencia de desórdenes psicosociales en todos los grupos de edad96 y se ha demostrado una relación positiva entre las comidas familiares frecuentes y un mayor consumo de alimentos saludables como frutas, verduras y alimentos ricos en calcio.97
El tipo de crianza puede generar entornos que favorezcan una alimentación saludable o, promover una alimentación desordenada con alto riesgo de desarrollar sobrepeso y obesidad. Hay algunos estudios que relacionan la restricción parental y el sobrepeso infantil, así como los ambientes de “alta presión” para ingerir mayor cantidad de alimentos con la incapacidad de los niños para regular el consumo de energía asociado a la menor ingesta de frutas y verduras,10 mientras que otros han demostrado que existen factores genéticos que influyen en el apetito.98
Género
Según el género, existen diferencias biológicas y neurológicas que se asocian a un metabolismo y un comportamiento diferentes (preferencias y patrones alimentarios), que provoca que hombres y mujeres desarrollen obesidad de diferente forma,8 una distribución del tejido adiposo, principalmente subcutánea en las mujeres, con un probable rol protector para el desarrollo del SM99 y de tipo visceral (dentro de la cavidad abdomino-pélvica) en los varones.100) Adicionalmente, se ha demostrado que las mujeres sanas, tienen un tamaño reducido de los adipocitos intraperitoneales en 20-30 % en relación con los del depósito subcutáneo, a diferencia de los varones sanos, quienes tienen un tamaño similar de adipocitos en ambas áreas; lo cual es relevante, si se considera que los adipocitos más grandes poseen una tasa de lipólisis más alta, con mayor expresión de adipocinas proinflamatorias y aumento de RI.99
Un metaanálisis de 32 estudios de asociación del genoma completo (GWAS) con un seguimiento de 16 locis en 29 estudios adicionales, identifica 13 locis significativos de todo el genoma asociados al índice cintura cadera (ICC), de los cuales 7 mostraron un dimorfismo sexual marcado, todos con un mayor efecto sobre el ICC en mujeres en comparación con los hombres.101 Estudios recientes, que realiza combinaciones únicas de cromosomas sexuales en modelos animales y variaciones naturales de cromosomas sexuales en humanos, muestra la influencia importante de los cromosomas sexuales sobre el riesgo de obesidad, el metabolismo lipídico y la inflamación.102
La evidencia también demuestra que el procesamiento de los sentimientos de hambre y saciedad por el cerebro son específicos según el género. En las mujeres exhibiendo respuestas más intensas a los estímulos gustativos en la ínsula y a los estímulos visuales en la corteza occipito-temporal durante el ayuno en relación con los hombres,10 lo que sugeriría una respuesta más fuerte a los estímulos externos en las primeras.
Influencia socioeconómica
Los indicadores clásicos del nivel socieconómico (NSE): nivel educativo, ingresos y ocupación, pueden predecir diferentes indicadores de salud incluyendo obesidad, HTA, DM2, SM y mortalidad en niños y adultos, siendo la primera (y principalmente la educación materna) la variable más importantemente asociada a la obesidad. Sin embargo, la asociación entre el NSE y la obesidad infantil varía de un país a otro según su situación económica (ingresos altos, medios o bajos), de tal manera que, en los países con ingresos más altos, la adiposidad se correlaciona negativamente con el NSE, mientras que en los países con ingresos más bajos ocurre lo contrario.103,104 En grupos con NSE más bajo, las prácticas poco saludables de alimentación infantil, incluyendo el inicio de alimentación complementaria antes de los 4 meses de edad; el uso de fórmulas durante los primeros 6 meses y acostar al niño con un biberón; fueron factores prevalentes y se asociaron positivamente con adiposidad a cualquier edad.105 Los niños de padres con bajo NSE, usualmente realizan menos ejercicio físico y pasan más tiempo frente a pantallas (televisión o videojuegos), además de vivir en vecindarios con abundantes fuentes de alimentos que promueven una alimentación poco saludable con poca ingesta de frutas y verduras frescas y mayor consumo de comida rápida y; con altos índices de criminalidad, obstaculizando aún más el desarrollo de actividades al aire libre.106 Además, el desempleo en los padres, aumenta el riesgo de desarrollar sobrepeso y obesidad en sus hijos, al promover conductas alimentarias no saludables y sedentarismo, mientras que el empleo materno a tiempo completo también se asocia a mayor riesgo de obesidad en países en desarrollo.107
Se han descrito varias vías potenciales que explican la asociación entre la situación socioeconómica desfavorable y la obesidad infantil, que incluyen mecanismos conductuales, biológicos y la salud mental. El estrés, la ansiedad y el menor bienestar, relacionados con un NSE bajo, afectan negativamente el consumo de calorías, la actividad física, el sedentarismo y el sueño, favoreciendo el desarrollo de obesidad. Los niños comparten frecuentemente, no solo con sus familiares, sino con otros miembros de su comunidad, patrones y estilos de vida similares que pueden influir en su ganancia de peso, llegando incluso a usar los alimentos como una forma de afrontar el estrés y la ansiedad, lo cual podría ser explicado por el hallazgo de la relación entre experiencias adversas durante la niñez y una menor disponibilidad del receptor dopaminérgico D2 (DR2), que puede provocar una sobre alimentación para compensar las respuestas de recompensa atenuadas.103
Otros mecanismos potenciales que se relacionan con situaciones estresantes asociadas un NSE desfavorable, pueden provocar alteraciones en las regiones de recompensa extendidas asociadas con la adicción a los alimentos e incluyen epigenética, longitud de los telómeros y desregulación del sistema nervioso autónomo, que puede tener impacto en los problemas emocionales y del comportamiento, así como en la dificultad para dormir, todos los cuales pueden asociarse a ganancia de peso en los niños.103,108,109
Conclusiones
La obesidad infantil es uno de los problemas de salud pública más importantes a nivel mundial, no solamente por asociarse a múltiples complicaciones médicas, sino por su impacto en la salud psicosocial de la población.
Si bien clásicamente se ha relacionado con estilos de vida no saludables, estos por sí mismos, no explican completamente el comportamiento de esta condición en la población.
Aunque los estudios de asociación del genoma completo, han permitido identificar múltiples polimorfismos asociados a la obesidad, estos solo explicarían entre el 40 al 75 % de la variación del IMC, principal indicador utilizado por la mayora de estudios para definir obesidad
Actualmente hay suficiente evidencia para concluir que existe una interacción entre los genes y el medio ambiente para el desarrollo de la obesidad infantil, e incluso se ha informado que esta interacción estaría influenciada por una susceptibilidad individual y que es necesario realizar más estudios para entender completamente el mecanismo involucrado.














