Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Obstetricia y Ginecología
versión impresa ISSN 0138-600X
Rev Cubana Obstet Ginecol vol.38 no.1 Ciudad de la Habana ene.-mar. 2012
TESIS
Un análisis de largo plazo del comportamiento de la cirugía conservadora del cáncer de mama
A long-term analysis of the conservative surgery behavior in breast cancer
MSc. Dra. Daisy Hernández Durán,I MSc. Dr. Orlando Díaz Mitjans,I MSc. Dra. María del Rosario Abreu VázquezII
I Hospital Ginecobstétrico "Ramón González Coro". La Habana, Cuba.
II Instituto Nacional de Gastroenterología. La Habana, Cuba.
RESUMEN
Introducción: en los últimos años la cirugía conservadora se ha consolidado como un procedimiento válido en el tratamiento de un determinado grupo de pacientes con cáncer de mama, pues permite conseguir un control local satisfactorio con una menor mutilación, sin modificar la supervivencia ni el índice de metástasis a distancia.
Objetivo: determinar los resultados de la cirugía conservadora del cáncer de mama según variables seleccionadas en el período 1991-2009.
Métodos: se realizó un estudio retropestivo longitudinal a mujeres diagnosticadas y tratadas de cáncer de mama a las que se les realizo cirugía conservadora (n=77), que cumplieron con los criterios de inclusión y exclusión establecidos. El análisis descriptivo de los datos se realizó mediante distribuciones de frecuencias absolutas y relativas. La estimación de las curvas de supervivencia global y libre de recidivas se realizó mediante el método de Kaplan-Meier.
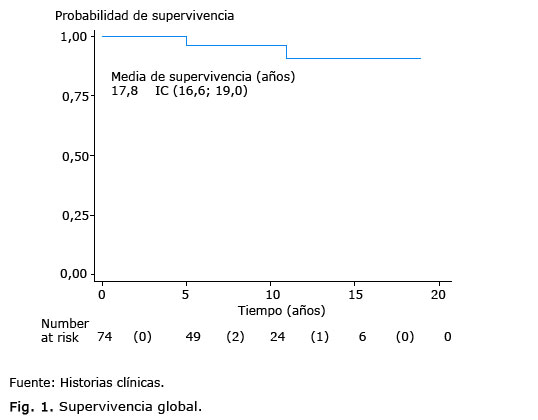
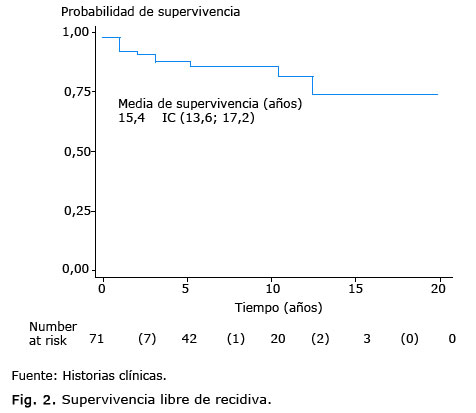
Resultados: el grupo de edad 40 a 59 años fue el predominante para 67,6 %. Solo el 10,4 % de las pacientes tuvieron antecedentes de primera línea positivos de cáncer de mama. La etapa clínica IIA predominó con un 54,5 %, y el tipo histológico más frecuente, el carcinoma ductal infiltrante para un 84,4 %. La supervivencia global para nuestras pacientes fue de un 95 % a los 5 años, el intervalo libre de recidiva fue de un 87,5%.
Conclusiones: nuestros resultados no difieren de los encontrados en los estudios a nivel mundial.
Palabras clave: cirugía conservadora, cáncer de mama, tumorectomía, cuadrantectomía.
ABSTRACT
Introduction: In past years the conservative surgery became consolidated as a valid procedure in treatment of a determined group of breast cancer patients, thus allows to achieve a satisfactory local control with a lesser level of mutilation, neither modifying the survival nor distant metastasis index from a distance.
Objective: To determine the results of conservative surgery of breast cancer according to the variables selected during 1991-2009.
Methods: a longitudinal and retrospective study was conducted in women diagnosed and treated due to breast cancer who underwent conservative surgery (n=77), fulfilling the established inclusion and exclusion criteria. Data descriptive analysis was performed by absolute and relative frequency distribution. The estimation of global survival curves and free of relapse was performed by Kaplan-Meier method.
Results: The 40 to 59 age group was the predominant one for a 67.6 %. Only the 10.4% of patients had first line positive backgrounds of breast cancer. The IIA clinical stage predominates with a 54.5 % and the more frequent histological type, the infiltrating ductal carcinoma for a 84,4 %. The 5-years global survival for our patients was of 95 % and the interval free relapse was of 87.5 %.
Conclusions: Our results not differ from those found in studies at world level.
Key words: Conservative surgery, breast cancer, tumorectomy, quadrantectomy.
INTRODUCCIÓN
Cada año se diagnostican en el mundo más de un millón de casos de cáncer de mama y fallecen por esta causa 548 mil mujeres.1 El perfil de esta epidemia, sin embargo, está cambiando. Habiendo surgido en las regiones más desarrolladas del planeta, ahora está afectando de manera creciente a las mujeres de los países de menores recursos. Hoy, más del 55 % de las muertes por cáncer de mama se presentan en los países de ingresos bajos y medios.2 En 2020, alrededor de 7 % de los casos de esta enfermedad se presentarán en el mundo en desarrollo.1
Dentro del esquema general del tratamiento del cáncer de mama, hasta ahora ha sido la cirugía el arma principal y habitualmente de inicio en el arsenal terapéutico. En los últimos 30 años ha ocurrido un perfeccionamiento de las técnicas quirúrgicas del cáncer de mama, alejándose de técnicas mutilantes e incorporando la cuadrantectomía y la lumpectomía, esto es posible debido a la comprensión que para los tumores primarios pequeños diagnosticados en el momento actual no es necesario el uso de la mastectomía radical extensa para localmente erradicar el tumor, la efectividad de otras terapias adyuvantes como la radioterapia, quimioterapia y la hormonoterapia, y la preocupación por la calidad de vida de la mujer.1-4
Los resultados óptimos de la cirugía conservadora en los setenta llevaron a cambiar el término de la historia natural del cáncer de mama; surgió el concepto de la existencia de micrometástasis, incluso en tumores menores de un centímetro y la extirpación del tumor primario tiene poca influencia en el pronóstico. Esta observación y la aparición de nuevos y eficaces fármacos antineoplásicos, así como los recientes conocimientos de la biología molecular del cáncer, cimentaron en forma definitiva el paradigma del cáncer mamario como una enfermedad sistémica donde la cirugía no es la solución, tal vez lo será el tratamiento sistémico con quimioterapia, hormonoterapia, inmunoterapia y, a largo plazo, terapia génica.2-4
En los últimos años la cirugía conservadora se ha consolidado como un procedimiento válido en el tratamiento de un determinado grupo de pacientes con cáncer de mama, pues permite conseguir un control local satisfactorio con una menor mutilación, un buen resultado estético, obtener una máxima información oncológica y un máximo control de la enfermedad local sin modificar la supervivencia ni el índice de metástasis a distancia. La intencionalidad de la cirugía conservadora debe ser radical sobre la enfermedad locoregional.
La recurrencia locorregional es la piedra que se tendría que acabar de pulir para aumentar la eficacia de la técnica.
MÉTODOS
Se realizó un estudio retrospectivo longitudinal con mujeres diagnosticadas y tratadas de cáncer de mama en el Hospital "Ramón González Coro" con el objetivo de determinar los resultados de la cirugía conservadora del cáncer de mama según variables seleccionadas en el período de1991 hasta 2009.
Universo y muestra
El universo estuvo constituido por las 312 mujeres a las que se les realizó cirugía por diagnostico de cáncer de mama que acudieron al servicio de mastología del Hospital "Ramón González Coro" desde el año 1991 hasta el año 2009. La población objeto de estudio quedó conformada por todas a las que se les realizo cirugía conservadora (n=77).
Criterios de inclusión:
Todas las pacientes que fueron sometidas a cirugía conservadora y tuvieron seguimiento en este hospital.
Criterios de exclusión:
- Pacientes que fueron sometidas a cirugía radical de mama.
- Pacientes que no tuvieron seguimiento en nuestro hospital.
- Pacientes que abandonaron el tratamiento oncoespecífico.
- Pacientes que abandonaron el seguimiento en nuestro hospital.
- Pacientes con enfermedades intercurrentes descompensadas que contraindicaran cualquier tratamiento oncoespecífico.
Los datos se obtuvieron de las historias clínicas para lo cual se confeccionó una planilla de recolección de datos con este fin (anexo). Los datos secundarios obtenidos del llenado de la planilla se introdujeron en una base de datos en formato Excel XP y se procesaron los datos mediante el software estadístico SPSS. El análisis descriptivo de los datos se realizó mediante distribuciones de frecuencias absolutas y relativas. La estimación de las curvas de supervivencia global y libre de recidivas se realizó mediante el método de Kaplan-Meier. Las curvas de supervivencia se compararon mediante el método de Log Rank. Se consideró un nivel de significación del 5 %.
RESULTADOS
En cuanto a las variables epidemiológicas (tabla 1), encontramos que el grupo de edad desde 40 a 59 años fue el predominante con un 67,6 %, la raza blanca predominó para un 77,9 % del total de los casos y el 16,9 % de las pacientes fumaban.
Los factores reproductivos (tabla 2), la edad de la menarquia en el 23,4 % fue menor de 12 años; la menopausia fue mayor en la mujer de más de 50 años para un 24,7 %; la nuliparidad y baja paridad estuvo presente en el 44,1 % de las pacientes, la edad del primer parto fue mayor de 30 años en el 2,6 %. En cuanto a la lactancia el 49,3 % de las pacientes no lactaron y el 1,3 % uso tabletas anticonceptivas.
Tabla 2. Factores reproductivos
| Variables | No. | % |
| Edad de la menarquia (años) | ||
| Menor de 12 | 18 | 23,4 |
| 12 y más | 59 | 76,6 |
| Edad de la menopausia (años) | ||
| Menor de 40 | 10 | 13,0 |
| 40-44 | 7 | 9,1 |
| 45-49 | 41 | 53,2 |
| 50-55 | 17 | 22,1 |
| 55 y más | 2 | 2,6 |
| Número de partos | ||
| Nulípara | 9 | 11,6 |
| 1 | 25 | 32,4 |
| 2 | 29 | 37,6 |
| 3 y más | 20 | 25,9 |
| Edad del primer parto (años) | ||
| Menor de 20 | 26 | 33,8 |
| 20-24 | 34 | 44,2 |
| 25-29 | 15 | 19,5 |
| 30-34 | 2 | 2,6 |
| Lactancia | ||
| Si | 39 | 50,6 |
| No | 38 | 49,3 |
| Uso de anticonceptivos | ||
| ACO | 1 | 1,3 |
| DIU | 2 | 2,6 |
| No | 74 | 96,1 |
n=77
En la historia médica (tabla 3) encontramos que el 45,4 % no padecía de ninguna enfermedad y en el grupo de enfermas la diabetes mellitus y los trastornos tiroideos estuvieron presentes en el 1,2 % de las pacientes respectivamente. Solo el 10,4 % de las pacientes tuvo antecedentes de primera línea positivos de cáncer de mama.
| Variables | No. | % |
| Antecedentes patológicos personales | ||
| Hipertensión arterial | 19 | 24,6 |
| Asma bronquial | 5 | 6,4 |
| Diabetes mellitus | 1 | 1,2 |
| Hipertensión y diabetes | 5 | 6,4 |
| Trastornos tiroideos | 1 | 1,2 |
| Otras patologías | 8 | 10,3 |
| Sin antecedentes | 35 | 45,4 |
| Antecedentes de patología mamaria | ||
| Mastopatía fibroquística | 7 | 9 |
| Fibroadenoma | 8 | 10,3 |
| Cáncer de mama | 3 | 3,8 |
| Sin antecedentes | 59 | 76,6 |
| Antecedentes familiares de cáncer de mama | ||
| No | 69 | 89,6 |
| Sí | 8 | 10,4 |
n=77
La etapa clínica predominante fue la etapa IIA con un 54,6 %. No tuvimos ningún caso en etapa 0, IIIC, IV. El tipo histológico más frecuente fue el carcinoma ductal infiltrante para un 84,4 %.
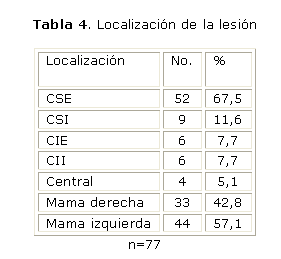
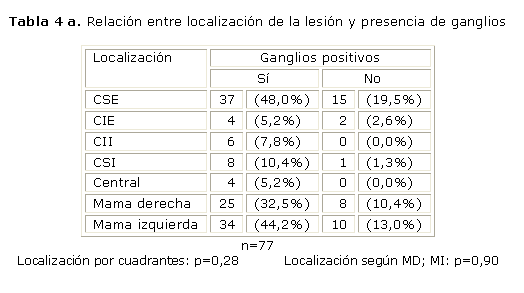
A continuación mostramos nuestros resultados en cuanto a la localización de la lesión y su relación con la presencia de ganglios (tablas 4 y 4 a).
En cuanto a la localización del tumor, la mama izquierda fue la más comprometida en el 57,1 %. Respecto a la localización por cuadrantes, encontramos que el tumor se localiza con mayor frecuencia en el cuadrante supero-externo 67,5 %. Estas localizaciones están más relacionadas con la presencia de ganglios para un 44,2 % y 48 % respectivamente.
Respecto al tamaño del tumor (tabla 5) se encontró que el 64 % se encontraba en el grupo de 2,1 a 5 cm y su relación con la presencia de ganglios (tabla 5 a) fue de un 46,7 %.
En la tabla 6 mostramos el uso de poliquimioterapia en nuestro estudio.
En nuestra serie solo el 6,4 % de las pacientes usaron quimioterapia neoadyuvante y el 85,7 % la usaron como tratamiento adyuvante.
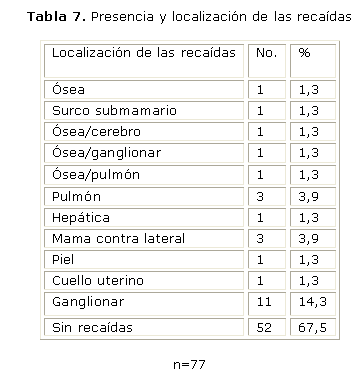
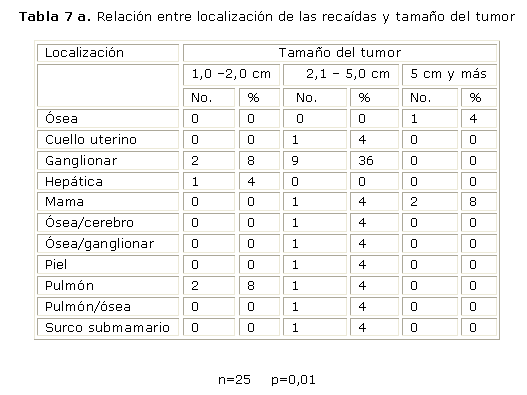
A continuación mostramos la presencia y localización de las recaídas (tabla 7) y su relación con el tamaño del tumor (tabla 7 a).
En esta serie se encontró que el sitio de localización más frecuente de recaídas fue el ganglionar para un 14,3 %, seguido por la mama contralateral, pulmón y ósea para un 3,9 % respectivamente.
En cuanto a la relación de las recaídas con el tamaño del tumor, se observó que las metástasis eran más frecuentes cuando el tumor era mayor de 2,1 cm.
A continuación se muestra la supervivencia global para estas pacientes (Fig. 1), un 95 % a los 5 años, y de un 90 % a los 10 años.
El intervalo libre de recidiva (Fig. 2), fue de un 87,5 % a los 5 años y de un 80 % a los 10 años.
DISCUSIÓN
El cáncer de mama es extremadamente raro entre las mujeres menores de 20 años y poco común en mujeres menores de 30 años. Su incidencia se incrementa con la edad sobre todo antes de los 50 años. Estos hallazgos sugieren fuertemente el papel de las hormonas reproductivas en la etiología del cáncer de mama, porque otros cánceres no hormono dependientes no muestran estos cambios en el declinar de la curva de incidencia alrededor del tiempo de la menopausia.5
Las mujeres de la raza blanca tienen ligeramente mayores probabilidades de padecer de cáncer del seno que las mujeres de la raza negra. Sin embargo, las mujeres de la raza negra tienen mayores probabilidades de morir de este tipo de cáncer. A diferencia de otras muchas enfermedades el riesgo de cáncer de mama está positivamente asociado con niveles socioeconómicos altos; mujeres de bajo nivel socioeconómico tienen más tendencia a tener más hijos y tenerlos a edades más tempranas que las mujeres con nivel socioeconómico alto. Muchas de la diferencias en los rangos de cáncer de mama entre las mujeres afroamericanas y blancas no son más que el reflejo de las diferencias raciales en la distribución de las clases sociales.6,7
Aunque no se ha encontrado una relación directa entre el fumar y el cáncer de mama, numerosos estudios han valorado extensivamente su relación. El inicio del hábito de fumar en la adolescencia cuando el tejido mamario es altamente sensible a la influencias carcinogénicas, ha sido asociado con un incremento del riesgo en un gran estudio de casos controles.8
Edades muy tempranas de menarquia se relacionan consistentemente con un incremento elevado del riesgo de cáncer de mama, algunos estudios sugieren que los niveles hormonales pueden ser mayores a través de la vida reproductiva entre aquellas mujeres que tuvieron menarquia precoz.9 En cuanto a la edad del primer parto, las nulíparas tienen un riesgo incrementado de cáncer de mama en comparación con las multíparas. En la mayoría de los estudios epidemiológicos una edad joven en el primer embarazo a término predice un bajo riesgo a través de la vida de cáncer de mama. La reducción del riesgo después del embarazo comparado con la nuliparidad no es inmediata pero toma de 10 a 15 años en manifestarse.10 De hecho el riesgo de cáncer de mama se incrementa en la primera década después del primer embarazo.11 La proliferación de células mamarias durante el primer embarazo resulta en diferenciación en células mamarias maduras preparadas para la lactancia, pero también pueden llevar al crecimiento de células mutadas y un riesgo excesivo en la próxima década. El primer embarazo está asociado a cambios permanentes en el epitelio glandular mamario y cambios en las propiedades biológicas de las células mamarias. Después de la diferenciación del embarazo, las células epiteliales tienen un ciclo celular más largo y pasan más tiempo en G1, la fase que permite la reparación del DNA.12 Mientras más largo el intervalo desde la menarquia al primer embarazo, mayor efecto adverso del primer embarazo.13 Mientras más tarde la edad del primer embarazo, más posibilidades que errores del DNA ocurran y sean propagados con la proliferación de la glándula mamaria durante el embarazo. Un mayor número de nacimientos está consistentemente relacionado con un bajo riesgo de cáncer de mama; cada nacimiento adicional más allá del primero reduce el riesgo a largo plazo de cáncer de mama. Sin embargo en algunos análisis esto no ha sido independiente de la edad temprana del primer hijo, la mayoría de la evidencia indica un efecto independiente de la multiparidad.14
Tan temprano como en 1926, fue hecho el planteamiento que una mama nunca usada para lactancia es más propensa a convertirse en cancerosa, esta hipótesis esta en relación con el conocimiento de la fisiología y carcinogénesis mamaria,15 también con patrones de variación internacional en la incidencia de cáncer de mama: cifras más bajas en poblaciones en las cuales la lactancia es más común y de más larga duración. Un estudio de casos y controles soporta la reducción en el riesgo en la lactancia materna de mayor duración, pero los hallazgos tienen variaciones sustanciales al nivel de reducción del riesgo. Los resultados más fuertes plantearon al menos un 50 % en la reducción del riesgo para las mujeres que lactaron por 2 años o más, pero esto fue en mujeres con alta multiparidad.16
A las mujeres que se les practicó una ooforectomía bilateral antes de los 45 años tienen aproximadamente la mitad del riesgo de cáncer de mama en comparación con aquellas que tuvieron una menopausia natural a los 55 años o más. El riesgo de cáncer de mama se incrementa en un 3 % por año de demora en la edad de la menopausia.17,18
Según un análisis de 54 estudios epidemiológicos, se registró un leve aumento del riesgo de cáncer de la mama cuando las mujeres tomaban los anticonceptivos orales combinados y durante los 10 años siguientes después de haber dejado de tomarlos.19
La diabetes mellitus tipo 2 se ha sugerido incrementa el riesgo; la hiperinsulinemia, puede promover cáncer de mama, porque la insulina puede ser un factor de crecimiento para células cancerígenas en el cáncer de mama.20-23
Se cree que la susceptibilidad genética es responsable, aproximadamente, del 5 al 10 % de todos los carcinomas de mama,24 lo cual coincide con los resultados de nuestra investigación. El estudio poblacional más grande para estimar el riesgo de cáncer de mama asociado con la historia familiar fue realizado en Suecia e involucró 2 660 mujeres.25
Nuestros hallazgos coinciden con varios autores que también encontraron el carcinoma ductal infiltrante como el tipo histológico más común.26-28
En cuanto a la localización del tumor, la mama izquierda fue la más comprometida, hallazgo que difiere con lo encontrado en el estudio realizado en el Hospital D. A. Carrión.29 Respecto a la localización por cuadrantes, encontramos que el tumor se localiza con mayor frecuencia en el cuadrante supero-externo, tal como se reporta en diferentes estudios, por encontrarse en este lugar el mayor porcentaje de glándula mamaria.30-32 Muchos estudios han indicado que los nódulos axilares son más comunes cuando los tumores están localizados hacia la porción lateral de la mama más que en la región medial.33,34 El incremento de la toma de ganglios axilares para tumores de localización lateral en comparación con los mediales es comúnmente relacionado con el drenaje preferencial de algunos tumores mediales a los nódulos de la mamaria interna.30 El tamaño macroscópico (diámetro máximo) de las neoplasias primarias infiltrantes se considera como uno de los más importantes factores pronósticos, y junto con la afectación ganglionar constituyen dos de los tres criterios utilizados para el estadiaje. Hay actualmente una relación directa entre tamaño tumoral y la probabilidad de metástasis ganglionares axilares;35 estas metástasis están presentes en el 26 % de los tumores de 1 cm o menos de diámetro, comparado con el 78 % en los de más de 10 cm de diámetro. Las pacientes en las que el tumor es de 2 cm o menos de diámetro máximo tienen un pronóstico y una supervivencia significativamente mejor comparada con las pacientes con tumores más grandes.35
En los últimos años, debido a que en la mayoría de pacientes la decisión relacionada con el tratamiento sistémico puede basarse en datos clínicos e histológicos, ha habido una tendencia a favorecer la administración de tratamiento quimioterápico u hormonal previo al tratamiento locorregional. Los ensayos clínicos han demostrado que este tipo de pautas "neoadyuvantes" incrementan el porcentaje de pacientes con estadios I-II de cáncer de mama que pueden someterse a tratamiento conservador.36 Además, cierta proporción de pacientes con enfermedad localmente avanzada, pueden ser aceptadas para cirugía conservadora de la mama siguiendo a la respuesta al tratamiento sistémico previo.36 La quimioterapia adyuvante reduce el riesgo de recurrencia entre un 22 y un 37 %, y el riesgo de muerte entre un 14 y un 27 % dependiendo de la edad de las pacientes. El aumento de la supervivencia global que se produce con la quimioterapia adyuvante es más significativo a los 10 años que a los 5 años tanto en mujeres premenopáusicas y posmenopáusicas.37
Las recaídas del cáncer de mama pueden ser vistas en gran variedad de órganos. Los sitios más comunes son el hueso, pulmón e hígado. La afectación ganglionar influye notoriamente sobre la supervivencia. Cuando los ganglios no están afectados, los porcentajes de supervivencia a los 10 años en la mayoría de las estadísticas superan el 70 %, mientras que cuando lo están las tasas son mucho más bajas.38
El tamaño clínico del tumor primario es altamente correlacionado con el pronóstico. Los datos de Koscielny y otros 39,40 del Instituto Gustave-Roussy, ilustran este punto. Ellos estudiaron a 248 pacientes con cáncer de mama tratados en su institución encontrando una relación directa entre el tamaño del tumor y la probabilidad de metástasis.
Al comparar nuestros hallazgos con los encontrados en una investigación realizada en el INOR por la Dra. Sánchez,41 la sobrevida global a los 5 años fue de un 95,4 % y a los 12 años de un 76 %, y el intervalo libre de recidiva a los 5 años fue de un 82 % y a los 12 años de un 70 %. En un metaanálisis con 32 825 pacientes se reporta una sobrevida global a los 5 años de un 91 % y a los 10 años de un 78 %.42
La evolución de un nódulo maligno no tratado oportunamente se dirige a la progresión linfática y hemática o ambas, metástasis en órganos vitales y finalmente la muerte, por regla general antes de los 5 años de ser palpado dicho nódulo.
Ficha de recolección de datos
Nombre y apellidos:
HC:
Edad:
Fecha del diagnóstico:
Edad de la menopausia:
Edad de la menarquía:
Raza:
Hábitos tóxicos:
APP:
APF:
Gestaciones:
Partos:
Abortos:
Edad del primer parto:
Lactancia materna:
Anticonceptivos:
Motivo de consulta:
Síntoma principal:
Enfermedad mamaria anterior:
Localización de la lesión:
Tamaño del tumor:
Adenopatías:
TNM:
Etapa clínica:
Fecha de la operación:
Técnica quirúrgica:
Complicaciones de la cirugía:
Anatomía patológica:
Ganglios:
RTT:
QTT:
TAM:
Metástasis y localización:
Año de la recidiva:
Año del fallecimiento:
REFERENCIAS BIBLIOGRÁFICAS
1. Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer. 2010;127:2893-917.
2. Schopper D, de Wolf C: How effective are breast cancer screening programmes by mammography? Review of the current evidence. Eur J Cancer. 2009;45:1916-23.
3. Thorat Mangesh A, Rangole Ashvin, Nadkarni Mandar S, Parmar Vani, Badwe Rajendra A. Revision Surgery for Breast Cancer. Cancer. Supplement October 15, 2008;113(8).
4. Adams C, Grey N, Magrath I, Miller A, Torode J. The World Cancer Declaration: is the world catching up? Lancet Oncol. 2010;11:1018-20.
5. Pike MC, Spicer DV, Dalimoush L, Press MF. Estrogens, progestogens, normal breast cell proliferation, and breast cáncer risk. Epidemiol Rev. 1991;15:48-65.
6. Aziz Z, Iqbal J, Akram M, Anderson BO. Worsened oncologic outcomes for women of lower socio-economic status (SES) treated for locally advanced breast cancer (LABC) in Pakistan. Breast. 2010;19:38-43.
7. Kerr DJ, Midgley R. Can we treat cancer for a dollar a day? Guidelines for low-income countries. N Engl J Med. 2010;363:801-03.
8. Paolo Boffetta, Philippe Autier. Is breast cancer associated with tobacco smoking? BMJ. 2011;342:d1093.
9. Kelsey JL, Gammon MD, John EM. Reproductive factors and breast cancer. Epidemiol Rev. 1993;15:233-43.
10. Bruzzi P, Negri E, La Vecchia C. Short term increase in risk of breast cancer risk in a large cohort of woman. Am J Epidemiol. 1998;147:636-43.
11. Pike MC, Krailo MD, Henderson BS, Casagrande JT, Hoel DG. Hormonal risk factors, "breast tissue age", and the age-incidence of breast cancer. Nature. 1983;303: 767-70.
12. Russo J, Tay LK, Russo IK. Differentiation of the mammary gland and susceptibility to carcinogénesis. Breast Cancer Res Treat. 1982;2:5-73.
13. Rosner B, Colditz G. Extended mathematical model of breast cancer incidence in the Nurses´ Health Study. J Natl Cancer Inst. 1996;88:359-64.
14. La Vecchia C, Negri E, Boyle P. Reproductive factors and breast cáncer: an overview. Soz Praventivmed. 1989;34:101-7.
15. Lane-Claypon JE. A further report on cancer of the breast, with special reference to its associated antecedent conditions. London: Ministry of Health; 1926.
16. Romieu J, Hernández-Ávila M, Lazcano E, López L, Romero-Jaime R. Breast cáncer and lactation history in Mexican women. Am J Epidemiol. 1996;132:17-26.
17.Collaborative Group on Hormonal Factors in Breast Cancer. Breast cancer and hormonal contraceptives: collaborative reanalysis of individual data on 53,297 women with breast cancer and 100,239 women without breast cancer from 54 epidemiological studies. Lancet. 1996; 47:1713-27.
18. Colditz GA, Stampfer MJ, Willett WC. Reproducibility and validity of self-reported menopausal status in a prospective cohort study. Am J Epidemiol. 1987;126:319-25.
19. Breast cancer and hormonal contraceptives: Collaborative reanalysis of individual data on 53 297 women with breast cancer and 100 239 women without breast cancer from 54 epidemiological studies. Lancet. 1996;347(9017):1713-27.
20. Gunter MJ, Hoover DR, Yu H, Wassertheil-Smoller S, Rohan TE, Manson JE, et al. Insulin, insulin-like growth factor-I, and risk of breast cancer in postmenopausal women. J Natl Cancer Inst. 2009;101:48-60.
21. Xue F, Michels KB: Diabetes, metabolic syndrome, and breast cancer: a review of the current evidence. Am J Clin Nutr. 2007;86:s823-35.
22. Pisani P. Hyper-insulinaemia and cancer, meta-analyses of epidemiological studies. Arch Physiol Biochem. 2008;114:63-70.
23. Agnoli C, Berrino F, Abagnato CA, Muti P, Panico S, Crosignani P, et al. Metabolic syndrome and postmenopausal breast cancer in the ORDET cohort: A nested case-control study. Nutr Metab Cardiovasc Dis; 2009.
24. Sorlie T, Perou CM, Tibshirani R, Aas T, Geisler S, Johnsen H, et al. Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications. Proc Natl Acad Sci. 2001;98(19):10869-74.
25. Adami HO, Hansen J, Jung B, Rimsten A. Characteristics of familial breast cancer in Sweden absence of relation to age and unilateral versus bilateral disease. Cancer. 1981;48:1688.
26. Masood S, Vass L, Ibarra JA Jr. Breast pathology guideline. implementation in low- and middle-income countries. Cancer. 2008;113 (suppl 8):2297-304.
27. Del Casar JM, Martin A, Garcia C, Corte MD, Alvarez A, Junquera S, et al. Characterization of breast cancer subtypes by quantitative assessment of biological parameters: relationship with clinicopathological characteristics, biological features and prognosis. Eur J Obstet Gynecol Reprod Biol. 2008;141(2):147-52.
28. Garcia-Closas M, Hall P, Nevanlinna H, Pooley K, Morrison J, Richesson DA, et al. Heterogeneity of breast cancer associations with five susceptibility loci by clinical and pathological characteristics. PLoS Genet; 2008.
29. Rozas R, Rivas L, Carayhua D. Cáncer de mama en el Hospital Nacional "Daniel Alcides Carrión-Callao". Aspectos anatomopatológicos y epidemiológicos. Acta Cancerológica. 2002;31:89-92.
30. Thorat MA, Rangole A, Nadkarni MS, Parmar V, Badwe RA. Revision surgery for breast cancer: single-institution experience. Cancer. 2008;113 (suppl 8):2347-52.
31. Newton M, Bird P. Impact of parallel anesthesia and surgical provider training in sub-Saharan Africa: a model for a resource-poor setting. World J Surg. 2010;34:445-52.
32. Dick AW, Sorbero MS, Ahrendt GM, Hayman JA, Gold HT, Schiffhauer L, et al. Comparative effectiveness of ductal carcinoma in situ management and the roles of margins and surgeons. J Natl Cancer Inst. 2011;103:92-104.
33. Sakr RA, Poulet B, Kaufman GJ, Nos C, Clough KB. Clear margins for invasive lobular carcinoma: a surgical challenge. Eur J Surg Oncol. 2011;37:350-6.
34. Olson TP, Harter J, Munoz A, Mahvi DM, Breslin T. Frozen section analysis for intraoperative margin assessment during breast-conserving surgery results in low rates of re-excision and local recurrence. Ann Surg Oncol. 2007;14:2953-60.
35. Ribelles N, Torres E, Alba E. Factores pronósticos en cáncer de mama Rev Cancer 2002;16(4):127-37.
36. Van Nes JG, Putter H, Julien JP, Tubiana-Hulin M, van de Vijver MJ, Bogaerts J, et al. Preoperative chemotherapy is safe in early breast cancer, even after 10 years of follow-up; clinical and translational results from the EORTC trial 10902. Breast Cancer Res Treat. 2009;115:101-13.
37. Cancello G, Maisonneuve P, Rotmensz N, Viale G, Mastropasqua MG, Pruneri G, et al. Prognosis and adjuvant treatment effects in selected breast cancer subtypes of very young women (<35 years) with operable breast cancer. Ann Oncol. 2010;21:1974-81.
38. Smid M, Wang Y, Zhang Y, Sieuwerts AM, Yu J, Klijn JG, et al. Subtypes of breast cancer show preferential site of relapse. Cancer Res. 2008;68:3108-14.
39. Koscielny S, Tubiana M, Le M. Breast cancer: relationship between the size of the primary tumor and the probability of metastatic dissemination. Br J Cancer. 1984;49:709.
40. Koscielny S, Le M, Tubiana M. The natural history of human breast cancer: the relationship between involvement of axillary lymph nodes and the initiation of distant metastases. Br J Cancer. 1989;59:775.
41. Sánchez Varela I. Cirugía Conservadora en Cáncer de Mama [tesis]. La Habana: Facultad Manuel Fajardo; 1997.
42. Stuart-Harris R, Caldas C, Pinder SE, Pharoah P. Proliferation markers and survival in early breast cancer: A systematic review and meta-analysis of 85 studies in 32,825 patients. Breast. 2008;17:323-34.
Recibido: 3 de septiembre de 2011.
Aprobado: 18 de septiembre de 2011.
Daisy Hernández Durán. Hospital Ginecobstétrico Ramón González Coro. La Habana, Cuba. Calle 21 entre 4 y 6 Vedado. Plaza de la Revolución. Ciudad de la Habana. Correo electrónico: daysi.hdez@infomed.sld.cu