Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión On-line ISSN 1561-3054
Rev Cubana Med Trop v.51 n.3 Ciudad de la Habana jul.-dic. 1999
Instituto de Medicina Tropical "Pedro Kourí"
Producción y purificación parcial de la hemolisina principal (Neumolisina) de Streptococcus pneumoniae
Resumen
Se investigó la capacidad para producir la neumolisina de 36 cepas cubanas de Streptococcus pneumoniae. Se determinó que 94,44 % de las cepas son productoras de la enzima. Una de las cepas mejor productora fue cultivada en mayor escala y la neumolisina presente en el sobrenadante fue parcialmente purificada a través de una cromatografía de intercambio iónico en columna mono-Q. Este método permitió la recuperación de la enzima con un incremento de 4,39 veces en el grado de pureza y un rendimiento de 100 %.
Descriptores DeCS: HEMOLISINAS/aislamiento & purificación; STREPTOCOCCUS PNEUMONIAE/metabolismo.
El Streptococcus pneumoniae produce una hemolisina intracelular perteneciente a la familia de las hemolisinas tiol-dependientes, comúnmente denominada neumolisina. Ésta constituye la citolisina principal de S. pneumoniae y es conocida como uno de sus factores de virulencia y considerada por muchos investigadores como candidato antigénico para las técnicas serológicas empleadas en el diagnóstico de este microorganismo1,2 (Kanclerski K. Streptococcus pneumoniae haemolysin [Pneumolysin]: production, purification and use as antigen for diagnosis of pneumococcal pneumonia. Reproprint Aktiebolag. Stockholm 1987).
Al igual que otras citolisinas tiol-dependientes, la neumolisina es una molécula antigénica e induce respuesta de anticuerpos en animales inmunizados.3,4 Se conoce también que los pacientes con infecciones por neumococo desarrollan anticuerpos para la neumolisina, por esta razón, disponer de un método sensible que permita la determinación de estos anticuerpos, constituiría una valiosa herramienta en el laboratorio clínico.
Según estudios realizados por Kanclerski y Mollby, la mayoría de las cepas de S. pneumoniae producen neumolisina y ésta puede ser obtenida en el laboratorio mediante el empleo de métodos simples de purificación.1,5 Las preparaciones de neumolisina producidas de esta forma pueden ser utilizadas como antígeno en sistemas inmunoenzimáticos (ELISA) u otros métodos serológicos para el diagnóstico de infecciones causadas por S. pneumoniae. Sin embargo, los primeros intentos por utilizarla como sustrato antigénico condujeron a métodos poco sensibles y de baja reproducibilidad.6,7
Durante los últimos años, gracias al desarrollo de métodos serológicos más sensibles, renacen las espectativas de emplear la neumolisina en el diagnóstico de las infecciones neumocócicas y es también considerada como un elemento a ser incluido en una vacuna para humanos. El desarrollo de un conjugado neumolisina-polisacárido, a partir de tipos seleccionados de neumococo, podría ayudar a solucionar los problemas de la pobre inmunogenicidad de las vacunas hasta ahora ensayadas.4
El objetivo del presente estudio fue investigar cómo se comportaba la producción de neumolisina en cepas de S. pneumoniae circulantes en Cuba, para seleccionar las mejores productoras y utilizarlas en la estandarización de un método para su obtención y purificación en el laboratorio.
Métodos
Cepas de Streptococcus pneumoniae estudiadas
Tomando en consideración el alto porcentaje de cepas de neumococo productoras de neumolisina (99 %) reportado en la literatura,5 se realizó un estimado del número de cepas que se debían estudiar para conocer cómo se comportaba este carácter entre las cepas cubanas. Con 95 % de confiabilidad se definió que el grupo de estudio debía estar conformado por no menos de 26 cepas.
Procedentes de la colección del laboratorio de infecciones respiratorias agudas bacterianas (IRAB) del IPK fueron estudiadas 36 cepas de S.pneumoniae aisladas en el período comprendido entre 1992-1997. Casi todas provenían de líquido cefalorraquídeo (LCR) (29 cepas) y en sólo algunos casos de exudado ótico (1 cepa), ocular (1 cepa) y nasofaríngeo (1 cepa); además: 2 cepas aisladas de líquido pleural, una de hemocultivo y una obtenida a partir de esputo.
Estudio de la actividad hemolítica
Todas las cepas fueron primero cultivadas en agar sangre de carnero a 5 % (Difco) por 24 h a 37 oC y subcultivadas en 6 mL de caldo cerebro corazón (Difco), a igual temperatura durante 18 h sin agitación. Las células fueron removidas por centrifugación a 4 000 rpm x 15 min y los sobrenadantes fueron almacenados a -20 oC hasta su descongelación, para determinar en ellos la presencia de actividad hemolítica. Ésta fue titulada con el procedimiento descrito por Jacobs y otros,8 con algunas modificaciones.
Diluciones dobles seriadas de cada uno de los sobrenadantes, con un volumen final de 150 mL, fueron preparadas en placas de poliestireno de microtitulación, en buffer tris-salina 10 mM (pH = 7,4). Igual volumen de una suspensión de eritrocitos de carnero a 2 % (lavados 3 veces con buffer fosfato salina [PBS]) en buffer tris-salina 10 mM (pH = 7,4) fue añadido a todos los pocillos. Cada placa fue sellada e incubada por 2 h a 37 oC y con el objetivo de que los eritrocitos no lisados sedimentaran (formación de botón), las placas se colocaron a 4 oC durante la noche. Los títulos fueron definidos como el recíproco de la mayor dilución de los sobrenadantes capaz de producir lisis de 50 % de los eritrocitos. Esto fue determinado con la transferencia de 150 mL de los sobrenadantes a nuevas placas de microtitulación y se procedió a la lectura de la absorbancia a 540 nm en un lector microELISA.
Como control positivo se incluyó en el sistema una suspensión de eritrocitos de carnero a 1 %, lisados artificialmente con cloruro de amonio a 0,83 %, y como blanco del sistema se utilizó caldo de cerebro corazón y diluciones dobles seriadas de éste en buffer tris-salina.
Obtención de la neumolisina
Se seleccionó una de las cepas estudiadas, por la alta producción de la enzima, para la obtención de la neumolisina en mayor escala.
La cepa fue cultivada en 200 mL de caldo de cerebro corazón suplementado con 1 g/L de glucosa (pH = 7,4) e incubada a 37 oC durante 8 h con agitación constante. El cultivo fue utilizado para inocular 4 L del mismo medio y la incubación se llevó a cabo en iguales condiciones durante 18 h.
Las células fueron descartadas por centrifugación a 4 900 rpm x 35 min y el sobrenadante fue pasado a través de un filtro millipore 0,8 m m para remover los detritos celulares que pudieran quedar y a continuación fue concentrado hasta un volumen final de 60 mL (Amicon, XM 50); se esterilizó por filtración (filtro millipore 0,2 m m) y se le determinó el título de la actividad hemolítica.
Purificación parcial de la neumolisina
Para la purificación parcial de la neumolisina se emplearon 2 procedimientos cromatográficos diferentes, se usó el sistema de cromatografía líquida rápida de alta resolución (FPLC). Como primera alternativa se utilizó el método recomendado por Jacobs y otros8 para la purificación de la suolisina, hemolisina principal de Streptococcus suis y análoga de la neumolisina. Fue aplicado 1 mL del sobrenadante concentrado y filtrado, a una columna de gel filtración Hiload Superdex 200 16/60 (Pharmacia) con un flujo lineal de 3 cm/h y fue eluido con buffer salina fosfato 40 mM (pH = 7,2) con 0,5 M de NaCL.
Se colectaron fracciones de 2 mL a las que se aplicó el ensayo descrito con anterioridad para la comprobación de la actividad hemolítica. En este caso, como blanco del sistema, se utilizó el propio buffer de elución empleado en la cromatografía.
Se ensayó además una cromatografía de intercambio iónico, se aplicaron 2 mL del extracto crudo concentrado y filtrado a una columna mono Q HR16/10 (Pharmacia), equilibrada con buffer tris-HCl 0,05 M (pH = 7,5) con un flujo lineal de 150 cm/h. Las proteínas adsorbidas a la columna fueron eluidas con un gradiente lineal de 0-0,5 M de NaCl, concentradas por ultrafiltración (Amicon, XM 50) hasta 5 mL y se determinó la presencia de actividad biológica, mediante el ensayo descrito.
Se llevaron a cabo los cálculos de actividad específica, rendimiento y grado de pureza, como parámetros de control de la purificación, con el empleo de las fórmulas recomendadas para este objetivo.9
Determinaciones realizadas a la neumolisina purificada
Determinación de la concentración de proteínas: la concentración de proteínas fue cuantificada por el método de Lowry y otros, con el uso de albúmina de suero bovino como estándar.10
Inhibición de la actividad hemolítica: La especificidad de la actividad hemolítica fue verificada mediante la inactivación con colesterol y por oxidación con H2O2, en aquella fracción que mostró actividad una vez concluido el proceso de purificación.8,11 Para eso 0,5 mL de dicha fracción fueron tratados con 5 m L de H2O2 a 10 % y otros 0,5 mL fueron sometidos a la acción de 10 m L de colesterol a 5 % (en etanol 10 %). Ambos tratamientos se llevaron a cabo por 10 min a temperatura de laboratorio y se procedió de nuevo a la determinación de la actividad hemolítica. Se incluyó como control, buffer tris-salina al que se añadió H2O2 y colesterol para descartar los efectos de ambos reactivos sobre los eritrocitos.
La reversibilidad de ambos tratamientos fue probada después de la adición de un exceso de b -mercaptoetanol (hasta una concentración final de 2 %) e incubación a 20 oC durante 10 min, tras la cual otra vez fue titulada la actividad hemolítica.
Electroforesis en gel de poliacrilamida en presencia de duodesilsulfato de sodio (SDS-PAGE): Se procedió según el método de Laemmli,12 en presencia de SDS tanto en el gel concentrador como en el gel separador. La muestra fue resuspendida en igual volumen de buffer muestra y fue calentada a 100 oC durante 10 min. Se aplicaron 10-20 mL de las muestras y se incluyó en el gel un patrón de peso molecular (PM) (Sigma 14-66 KDa). La corrida se efectuó a voltaje constante, durante casi 2 h.
Resultados
Todas, excepto 2 (5,56 %) de las 36 cepas estudiadas, fueron capaces de lisar los eritrocitos de carnero en el ensayo utilizado para titular la actividad hemolítica. Lisaron los eritrocitos hasta la dilución 1/128, 3 cepas (8,33 %); 2 cepas lo hicieron hasta la dilución 1/32; y otras 2 cepas hasta la dilución 1/16. Títulos de actividad hemolítica menores fueron observados en las 27 cepas restantes. En 1 cepa se detectó actividad sólo en el sobrenadante sin diluir (tabla).
Tabla. Relación entre título de la actividad hemolítica, serotipo/serogrupo y tipo de muestra de procedencia de la cepa
| Cepa | Muestra de procedencia | Serogrupo/ serotipo | Título (actividad hemolítica) |
| 1 | LCR | 14 | 128 |
| 2 | LCR | 19 | 128 |
| 3 | LCR | 19 | 128 |
| 4 | LCR | 1 | 32 |
| 5 | LCR | 19 | 32 |
| 6 | Exudado ótico | 3 | 16 |
| 7 | Líquido pleural | 34 | 16 |
| 8 | LCR | 14 | 8 |
| 9 | LCR | -* | 8 |
| 10 | LCR | 14 | 8 |
| 11 | Líquido pleural | 11 | 8 |
| 12 | LCR | 14 | 8 |
| 13 | LCR | - | 8 |
| 14 | LCR | - | 8 |
| 15 | Hemocultivo | - | 8 |
| 16 | LCR | 23 | 4 |
| 17 | LCR | 6B | 4 |
| 18 | LCR | - | 4 |
| 19 | Exudado ocular | 19F | 4 |
| 20 | LCR | 8 | 4 |
| 21 | LCR | - | 4 |
| 22 | Exudado nasofaríngeo | 29 | 4 |
| 23 | LCR | 19 | 4 |
| 24 | LCR | 14 | 4 |
| 25 | LCR | 8 | 2 |
| 26 | LCR | - | 2 |
| 27 | LCR | 2 | 2 |
| 28 | LCR | 14 | 2 |
| 29 | LCR | 14 | 2 |
| 30 | LCR | 19F | 2 |
| 31 | LCR | - | 2 |
| 32 | LCR | - | 2 |
| 33 | LCR | 19 | 2 |
| 34 | LCR | 14 | Puro |
| 35 | LCR | 19 | 0 |
| 36 | LCR | - | 0 |
* Serotipo/serogrupo aún no determinado en el laboratorio.
El título fue definido como el recíproco de la mayor dilución donde se observó lisis de 50 % de los eritrocitos.
Las cepas 1, 2 y 3 resultaron ser las mayores productoras de la enzima (título: 128), así como las cepas 4 y 5 (título: 32) (tabla ). Todas tenían en común el provenir de LCR. La cepa 1 fue escogida para la producción de la enzima en el laboratorio, y el sobrenadante del cultivo, después de concentrado y filtrado, fue considerado como el extracto crudo de neumolisina. Éste mostró capacidad para lisar los eritrocitos hasta la dilución 1/32.
Como consecuencia de la cromatografía en columna de gel filtración Superdex 200 se colectaron 50 fracciones de 2 mL cada una. A partir de la fracción 10 y hasta la 40 se produjo un pico de proteínas (fig. 1) donde se concentró toda la actividad hemolítica (título 32).
Fig. 1. Perfil de elusión de la neumolisina, obtenido con la cromatografía
de exclusión molecular en Superdex 200 HR y con el uso de buffer
salina fosfato 40 mM (pH = 7,4) con 0,5 M de NaCl.
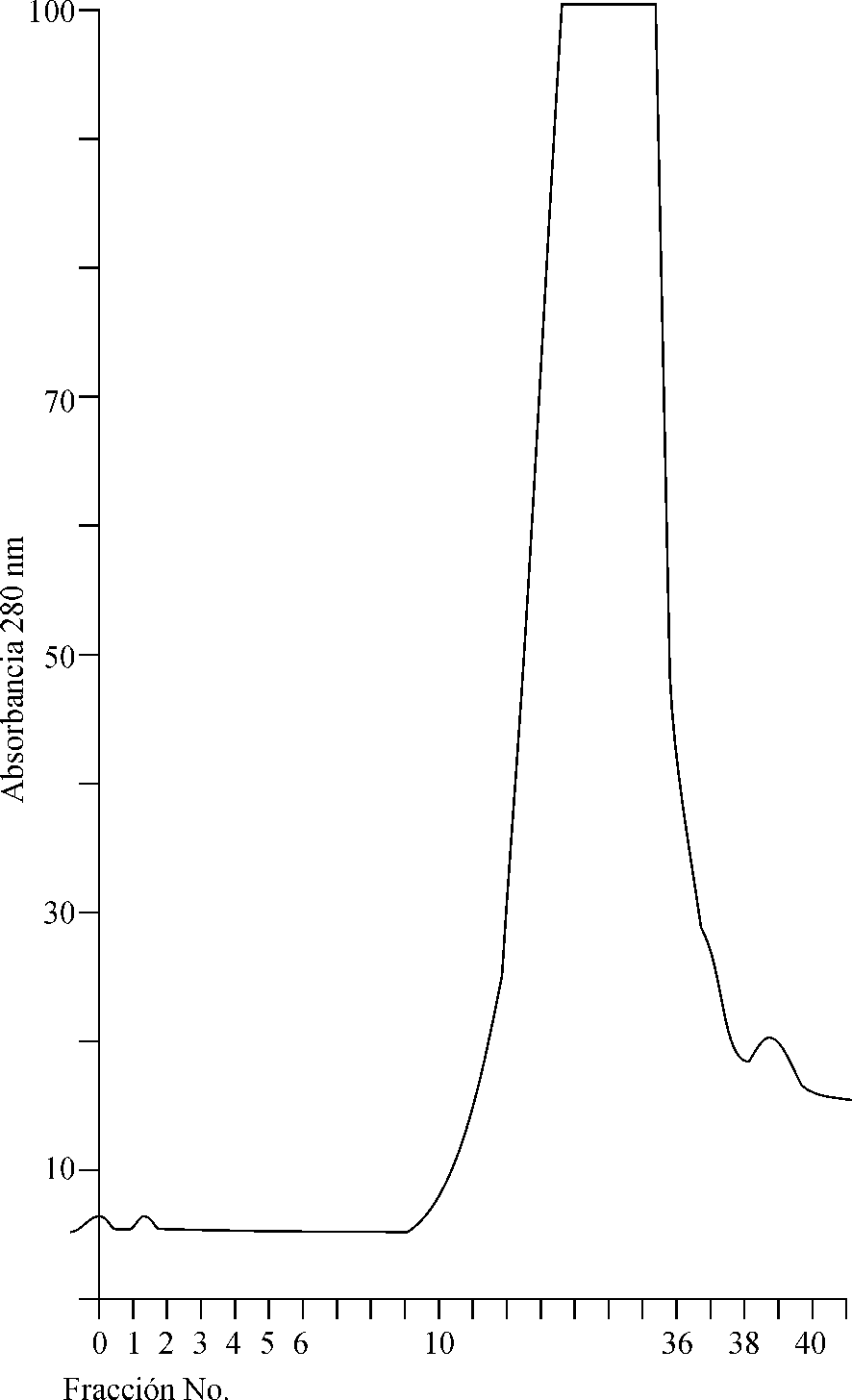
El resultado de la cromatografía de intercambio iónico, utilizada como segunda alternativa en la purificación parcial de la neumolisina, puede observarse en el cromatograma de la figura 2. En éste se definen 3 picos de proteínas: el pico 1 se corresponde con la neumolisina, como se pudo corroborar por la determinación de la actividad hemolítica (título de actividad hemolítica: 32); y los picos 2 y 3 se produjeron al aplicar el gradiente lineal de 0-0,5 M de NaCl y no mostraron actividad hemolítica. En estos picos eluyeron otras proteínas consideradas en este estudio como contaminantes, que inicialmente quedaron adheridas a la matriz pero fueron desprendidas al aumentar la fuerza iónica.
Fig. 2. Perfil de la elusión de la neumolisina, obtenido en la cromatografía
de intercambio iónico mediante una columna Mono Q HR 16/10 y un gradiente
lineal de 0-0,5 M de NaCl.
El SDS-PAGE no ofreció resultados claros (datos no mostrados). No se observó para las muestras el bandeo característico en este tipo de electroforesis, pero sí para el patrón de PM utilizado. Por esta razón, las muestras fueron aplicadas con reducción (b -mercaptoetanol) y sin reducción. Se sometieron a la electroforesis el extracto crudo y el pico 1 después de haber sido dializado contra PBS. A pesar de todas las variantes ensayadas fue imposible obtener resultados positivos, por lo que algún elemento, aún no identificado, pudo influir para modificar de alguna forma a la neumolisina, durante el proceso seguido para su obtención y parcial purificación, sin que se afectara por eso su actividad biológica.
Para corroborar entonces, que la actividad detectada en el pico 1 era por causa de la neumolisina se llevaron a cabo los tratamientos con colesterol y H2O2 detallados previamente. Como consecuencia de la incubación con colesterol la actividad biológica de la enzima se vio inhibida del todo, y la oxidación con H2O2 condujo a una disminución notable de la actividad, se observó lisis de los eritrocitos sólo hasta la dilución 1/4. La actividad biológica fue restaurada después de la incubación con b -mercaptoetanol en ambos tratamientos. El título para el primer caso retornó a su valor inicial (título: 32) y para el segundo, se incrementó sólo hasta un título: 8.
Discusión
Un antígeno exclusivo y común para casi todas las cepas de S. pneumoniae, capaz de inducir una respuesta de producción de anticuerpos, significa una mejor opción para el diagnóstico. La neumolisina constituye el candidato antigénico para este propósito, pues se ha demostrado que es producida en 99 % de los aislamientos clínicos de este microorganismo.5
Los resultados resumidos en la tabla reflejan que 94,4 % de las cepas cubanas estudiadas son productoras de la neumolisina, cifra inferior a la reportada por Kanclerski y Mollby.5 Sin embargo, resulta imposible hacer una comparación al respecto, pues a diferencia de estos autores, sólo se trabajó con una muestra pequeña, pues el objetivo fundamental era detectar las cepas capaces de una mayor producción de la enzima.
Las cepas estudiadas procedían en la mayoría de LCR porque este tipo de aislamiento es el que fundamentalmente llega al laboratorio, esto nos impide hacer un análisis sobre cómo se comporta la producción de neumolisina entre cepas aisladas de diferentes tipos de muestras. Según puede observarse en la tabla, las cepas con mayores títulos de actividad hemolítica fueron aisladas a partir de LCR, pero nótese también que títulos £ 4 fueron desarrollados por cepas de este mismo origen, e incluso la cepa no productora de actividad hemolítica fue recuperada de este tipo de muestra.
Los 3 aislamientos que se revelaron como mayores productores de la enzima, pertenecían a 2 de los serogrupos más frecuentes aislados en Cuba (cepa 1: sero-grupo 14, cepas 2 y 3: serogrupo 19).13 Estudios previos sobre este tema señalan que la capacidad de producción de la neumolisina no está correlacionada con el tipo de polisacárido capsular.14,15 Se seleccionó la cepa 1 por su magnífico crecimiento en las condiciones fijadas para el preinóculo.
Son varios los métodos de purificación reportados en la literatura para la obtención de preparaciones de neumolisina, pero casi todos conducen a una baja actividad biológica y a un pobre rendimiento.16-18 El método de la cromatografía en gel filtración utilizado en este trabajo había sido reportado por Jacobs y otros para la purificación de la suolisina, mediante el uso de una columna empaquetada de Superosa 12 con un rango de exclusión molecular menor de 300 KDa. En el caso de este estudio se lograron condiciones similares con una columna HiLoad Superdex 200, cuyo rango de exclusión oscilaba entre 30 y 250 KDa.
Para los efectos de la neumolisina, proteína de PM de 54 KDa, la selección de esta matriz es aplicable, sin embargo, los resultados no se correspondieron con los reportados por estos autores, pues se obtuvo sólo un pico entre las fracciones 10 y 40 donde se concentraba toda la actividad hemolítica. Por la poca resolución lograda con esta columna, esto debe responder a que todas las proteínas contaminantes que acompañan al material de interés están comprendidas dentro del rango de exclusión, por esa razón se decidió utilizar un método alternativo de purificación.
El uso de la cromatografía de intercambio iónico permitió un incremento de 4,39 veces en el grado de pureza de la enzima y condujo a su recuperación con una actividad específica de 4 x 102 UH/mL (UH: unidades hemolíticas). Se consideró que el empleo de este único método de purificación no permitió la recuperación de la enzima totalmente pura, no obstante, sí garantiza la eliminación de un gran número de contaminantes.
Para llegar a recuperar la neumolisina con un alto grado de pureza sería necesario aplicar al producto obtenido a través de la cromatografía de intercambio iónico, un método más específico como la cromatografía en Tiopropil Sepharose descrita por Kanclerski y Mollby,5 o una cromatografía de inmunoafinidad.
Los resultados obtenidos por medio de los tratamientos a los que se sometió el picol corroboran su identidad con la neumolisina, y están en total correspondencia con lo reportado por otros autores, quienes hacen referencia a que la acción citolítica de la neumolisina puede ser reversiblemente inactivada por la incubación con pequeñas cantidades de colesterol, o por la oxidación suave con peróxido de hidrógeno.8 También reportan estos autores que el efecto del colesterol no siempre puede ser revertido por la reducción con b -mercaptoetanol. Así sucedió en este caso, pues la actividad hemolítica fue restaurada, pero no del todo, para la muestra de la enzima que fue incubada con colesterol.
Se debe considerar que el haber estandarizado una metodología para la producción y purificación parcial de la neumolisina permitirá, a largo plazo, el desarrollo de otros métodos para el diagnóstico serológico de infecciones producidas por S. pneumoniae, en los cuales la neumolisina constituya el sustrato antigénico.
Summary
The capacity of 36 Cuban strains of Streptococcus pneumoniae to produce pneumolysin was studied, and 94.4 % of them were determined to be producers of that enzime. One of the best producers was cultured at a great scale and the pneumolysin found in the supernatan was partially purified through an ion-exchange chromatography in mono-Q column. This method made it possible to recover the enzime whose purity level increased by 4.39 with 100 % output.
Subject headings: HEMOLYSINS/isolation and purification; STREPTOCOCCUS PNEUMONIAE/metabolism.
Referencias bibliográficas
- Boulnois G. Pneumococcal protein and the pathogenesis of disease caused by Streptococcus pneumoniae J Gen Microbiol 1992;138:249-59.
- Paton J, Andrew P, Boulnois G, Mitchell T. Molecular analysis of the pathogenicity of Streptococcus pneumoniae: the role of pneumococcal proteins. Annu Rev Microbiol 1993;47:89-115.
- Lee C, Lock R, Andrew P, Mitchell T, Hansman D, Paton J. Protection of infant mice from challenge with Streptococcus pneumoniae type 19F by immunization with a type 19F polysaccharide-pneumolysin conjugate. Vaccine 1994;12:875-8.
- Alexander J, Lock R, Peeters C, Poolman J, Andrew P, Mitchell T. Immunization of mice with pneumolysin toxoid confers a significant degree of protection against at least serotypes of Streptococcus pneumoniae. Infect Immun 1994;62(12):5683-8.
- Kanclerski K, Mollby R. Production and purification of Streptococcus pneumoniae hemolysin (Pneumolysin). J Clin Microbiol 1987;25:250-3.
- Berntsson E, Broholm KA, Kaijser B. Serological diagnosis of pneumococcal disease with enzyme-linked inmunosorbent assay (ELISA). Scand J Infect Dis 1978;10:177-81.
- Barnett D, Amman A, Stenmark S, Wara D. Immunoglobulin G and antibodies to pneumococcal polysacharides detected by enzyme-linked immunosorbent assay. Infect Immun 1980;27:411-7.
- Jacobs A, Loeffen P, Berg J van den, Storm P. Identification, purification and characterization of a thiol-activated hemolysin (Suolysin) of Streptococcus suis. Infect Immun 1994;62:1742-8.
- Chávez P, Díaz J, Pérez U, Delfin J. Temas de enzimología. La Habana: Editorial Pueblo y Educación, 1990:41-2.
- Lowry O, Rosenbrough N, Farr A, Randall R. Protein measurement with the phenol reagent. J Biol Chem 1951;93:265-75.
- Cowell J, Bernheimer a. Antigenic relationships among thiol-activated cytolysins. Infect Immun 1997;16:397-9.
- Laemmli U. Cleavage of structural proteins during the assembly of the head of bacteriphage T4. Nature 1970;227:680-5.
- Pérez M, Tamargo I, Rodríguez O. Serotipaje de Streptococcus pneumoniae con el empleo del kit Pneumotest. Bol IPK 1997;7(14):109.
- Lorian V, Popola B. Pneumococci producing beta hemolysin on agar. Appl Microbiol 1972;24:44-7.
- Johnson M, Hamon D, Drew G. Isolation and characterization of pneumolysin negative mutants of Streptococcus pneumoniae. Infect Immun 1982;37:837-9.
- Shumway C, Klehanof S. Purification of pneumolysin. Infect Immun 1983;40:548-52.
- Johnson M. Properties of purified pneumococcal hemolysin. Infect Immun 1972;6:755-60.
- Paton J, Lock R, Hansman D. Effect of immunization whith pneumolysin on survival time of mice challenged with Streptococcus pneumoniae. Infect Immun 1983;40:548-52.
Recibido: 23 de junio de 1999. Aprobado: 30 de septiembre de 1999.
Lic. Gilda T. Toraño Peraza. Instituto de Medicina Tropical "Pedro Kourí". Apartado 601, Marianao 13, Ciudad de La Habana, Cuba. E-mail: era@ipk.sld.cu
1 Máster en Bacteriología-Micología. Licenciada en Microbiología. Investigadora Agregada.
2 Licenciado en Biología. Aspirante a Investigador.
3 Licenciada en Microbiología. Investigadora Auxiliar.
4 Especialista de II Grado en Microbiología. Investigadora Auxiliar.