Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión On-line ISSN 1561-3054
Rev Cubana Med Trop v.55 n.3 Ciudad de la Habana sep.-dic. 2003
Instituto de Medicina Tropical "Pedro Kourí"
Staphylococcus aureus resistente a la meticilina: detección de portadores entre niños hospitalizados y niños sanos de la comunidad
Lic. Ibis Trinidad Hernández Vadell,1 Lic. Gilda T. Toraño Peraza,2 Dra. Mabel González3 y Lic. Iliana González Bonet4
Resumen
Se realizó un estudio descriptivo puntual para la búsqueda de portadores nasales de cepas de Staphylococcus aureus resistentes a la meticilina (SARM), entre niños sanos atendidos en círculos infantiles y entre niños hospitalizados expuestos a uno de los factores de riesgo o más que predisponen para la colonización por este tipo de cepas; durante el período comprendido entre octubre de 2000 a febrero de 2001, en el municipio Marianao. Para el aislamiento primario de las cepas SARM se utilizó el medio oxacilina-manitol-sal-agar (OMSA) y a todas las cepas identificadas como S. aureus se les determinó la sensibilidad a drogas antimicrobianas por el método de Kirby-Bauer. Para identificar la resistencia a la oxacilina en las cepas recuperadas en OMSA se aplicaron los métodos: oxacillin salt-agar screening-plate y la determinación de la concentración mínima inhibitoria (CMI) en agar y en caldo. Se investigó la presencia del gen mecA mediante la reacción en cadena de la polimerasa en aquellas cepas que presentaron una CMI ³ 4 µg/mL de oxacilina. De los niños sanos, 0,35 % y de los hospitalizados, 2 % constituyeron portadores nasales de cepas SARM. Las cepas aisladas en ambos grupos de estudio mostraron índices altos de resistencia para la penicilina, tetraciclina y eritromicina por el método de Kirby-Bauer. Se identificó el gen mecA en una cepa SARM aislada de un portador nasal hospitalizado y se definió que su comportamiento se correspondía con el descrito para una cepa homorresistente para la oxacilina.
DeCS: STAPHYLOCOCCUS AUREUS; TEST DE SENSIBILIDAD MICROBIANA/ métodos; RESISTENCIA A LA METICILINA; NIÑO.
Durante los últimos 20 años, las cepas de Staphylococcus aureus resistentes a la meticilina (SARM) emergieron como los principales patógenos bacterianos resistentes a antibióticos, reportados en infecciones nosocomiales a través de todo el mundo. Se sugieren como factores de riesgo que seleccionan y condicionan la colonización por este tipo de cepas: las hospitalizaciones prolongadas, las intervenciones quirúrgicas, la permanencia en unidades de cuidados intensivos, el uso irracional de antibióticos y la proximidad al personal médico u otros pacientes colonizados o infectados por SARM, porque los portadores nasales de este tipo de cepas representan la fuente fundamental para su dispersión en el ambiente hospitalario.1-4
La importancia de la existencia de portadores nasales de SARM en la comunidad constituye, en cambio, un tema polémico. Las primeras cepas de este tipo se reportaron entre individuos adictos al uso de drogas intravenosas u otras sustancias por vía parenteral,5,6 sin embargo, durante los últimos años se hace cada vez más frecuente el reporte de infecciones provocadas por SARM en la comunidad, en individuos con poca o ninguna exposición a los factores de riesgo reconocidos como predisponentes para la colonización por este patógeno.6-10 El incremento de los reportes de SARM en la comunidad pone en evidencia cambios en la epidemiología de estas cepas, y ante estos, las instituciones de salud deben perfeccionar la vigilancia y las medidas de control para prevenir las infecciones producidas por cepas de SARM, dentro de las cuales, la búsqueda activa y la localización de los portadores nasales contribuyen significativamente a la prevención.
Una investigación recientemente realizada en el laboratorio de Infecciones Respiratorias Agudas Bacterianas (IRAB) del Instituto de Medicina Tropical "Pedro Kourí" (IPK), dirigida a determinar, por vez primera en Cuba, la circulación de cepas SARM entre portadores nasofaríngeos sanos, proporcionó evidencias sobre la posibilidad de que estas cepas comiencen a circular y se diseminen en la comunidad.11 Con el objetivo de corroborar tal hipótesis y contribuir al conocimiento de este tema en Cuba, se propuso un estudio descriptivo puntual en círculos infantiles del municipio Marianao y en una unidad de servicio de cardiología, terapia polivalente y neonatología del Hospital "William Soler", para investigar la existencia de portadores de cepas de SARM entre niños con exposición o no a los factores de riesgo identificados como predisponentes para la adquisición y/o colonización por este tipo de cepas.
Métodos
Universo de trabajo: se incluyeron 2 grupos de estudio. El primero estuvo integrado por niños sanos £ 6 años de edad atendidos en círculos infantiles, y el segundo, por niños hospitalizados, expuestos a un factor de riesgo o más, que predisponen para la colonización por cepas SARM.
Con 95 % de confiabilidad, tomando en consideración la positividad de los resultados de la investigación previa,11 se determinó el tamaño de la muestra para el primer grupo, con el objetivo de realizar un estudio representativo de un municipio de Ciudad de La Habana. Teniendo en cuenta que debían ser incluidos al menos 50 niños de 4 círculos infantiles del municipio Marianao, se tomaron muestras a 284 niños, durante los meses de octubre de 2000 a febrero de 2001, en los círculos infantiles: "Pequeños Constructores", "Capullitos de Alelí", "Antón Makarenko" y "Niños de Lídice". En el segundo grupo de estudio se incluyeron todos los niños que en el momento de la toma de la muestra se encontraban ingresados en los servicios de cardiología, terapia polivalente y neonatología del Hospital "William Soler" de Ciudad de La Habana (50 niños). En este caso las muestras fueron obtenidas en el transcurso de una semana, en mayo de 2001.
Obtención de las muestras: la toma de la muestra en ambos grupos se realizó a partir de la zona anterior de las fosas nasales, con hisopos de madera y algodón convencionales. Una vez tomados los exudados nasales, los hisopos fueron introducidos en tubos que contenían caldo triptona soya y estos fueron incubados a 37 ºC por 18 h.12 Se tomaron además, en el segundo grupo de estudio, exudados axilares.12 Para esto se embebieron previamente los hisopos en caldo triptona soya, se frotaron en ambas axilas, y se procedió de la misma forma descrita ya para los exudados nasales.
Aislamiento de SARM: transcurridas 18 h de incubación se tomó una asada del crecimiento obtenido en caldo triptona soya y se estrió sobre el medio oxacilina-manitol-sal-agar (OMSA) recomendado por Van Enk.13 Se procedió de esta forma tanto para los exudados nasales como axilares. Las placas de OMSA fueron incubadas a 35 ºC hasta 72 h, pero se examinó el crecimiento cada 24 h. Se consideraron cultivos positivos aquellos en los que se observaron colonias con características morfológicas típicas del género Staphylococcus y que produjeron cambio de coloración del medio (de rosado a amarillo) producto de la fermentación del manitol.13 Se picaron colonias con estas características y se aislaron en agar sangre para su posterior identificación. A las presuntas colonias de Staphylococcus se les realizó una coloración de Gram y se procedió a la identificación bioquímica en cada caso de acuerdo con las pruebas propuestas por Kloos y Bannerman.14 Las cepas identificadas como S. aureus se conservaron en leche descremada 20 %, a - 20 ºC.
Determinación de la susceptibilidad a antibióticos: a todas las cepas recuperadas en el medio OMSA e identificadas como S. aureus se les determinó la susceptibilidad a diferentes antimicrobianos por el método de Kirby-Bauer, según los procedimientos descritos en el documento M2-A7 del Comité Nacional de Normas de Laboratorio Clínico de los EE. UU. (NCCLS) de 2000.15 Se utilizaron en la prueba discos de la casa comercial Oxoid, de los antibióticos siguientes: penicilina (10 U), tetraciclina (30 µg), eritromicina (15 µg), cloranfenicol (30 µg), gentamicina (10 µg), oxacilina (1 µg), vancomicina (30 µg), ciprofloxacina (5 µg), ceftriaxona (30 µg), clindamicina (2 µg) y trimetoprín/sulfametoxazol (1,25/23,75 µg). Con el objetivo de detectar el fenotipo inducible de resistencia a clindamicina, los discos de eritromicina y clindamicina siempre se colocaron próximos (entre 15-20 mm).16 Como controles se utilizaron las cepas S. aureus (Cowan I) ATCC 25923, S. aureus ATCC 29213 y S. aureus ATCC 43300.
Confirmación de la resistencia a la oxacilina: las cepas que desarrollaron zonas de inhibición del crecimiento £ 10 mm alrededor de los discos de oxacilina en la prueba de susceptibilidad por el método de difusión en agar, se consideraron SARM.15 Para corroborar este resultado, independientemente de la información proporcionada por el Kirby-Bauer, se aplicaron a todas las cepas de S. aureus recuperadas en OMSA los métodos siguientes: oxacillin salt-agar screening-plate, determinación de la concentración mínima inhibitoria (CMI) para la oxacilina por los métodos de dilución en agar y microdilución en caldo, y determinación de la resistencia a la oxacilina (1 µg) por el método de difusión en disco e incubación simultánea a 35 y 42 ºC. Para aquellas cepas con una CMI ³ 4 µg/mL por el método de microdilución en caldo, se investigó además la presencia del gen mecA por la técnica de la reacción en cadena de la polimerasa (RCP). En todos los casos se utilizaron como controles las cepas de S. aureus ATCC 29213 y S. aureus ATCC 43300.
El método oxacillin salt-agar screening-plate y la determinación de la CMI, por el método de dilución en caldo y en agar, se llevaron a cabo en consecuencia con lo establecido por las normas del NCCLS de 2000.15,17 Para la confirmación de la resistencia a la oxacilina por el método de difusión en disco, se procedió de la misma manera que recomiendan las normas del NCCLS para el Kirby-Bauer, pero por cada cepa en estudio se sembraron 2 placas que fueron incubadas simultáneamente a 35 y 42 ºC durante 24 h. Se midieron los halos de inhibición del crecimiento en ambas placas y se consideraron positivas en esta prueba aquellas cepas para las cuales la diferencia de los diámetros de los halos de inhibición a las 2 temperaturas fue mayor que 4 mm (ê42 -35 ºC> 4 mm).18,19
La RCP se aplicó a todas las cepas que resultaron positivas por el método oxacillin salt-agar screening-plate o que toleraron hasta 4 µg/mL de oxacilina. Para la extracción del material génico se preparó una suspensión de cada cepa en estudio en 100 ó 200 µL de agua destilada estéril y se procedió de acuerdo con lo descrito por Tokue y otros.20 La RCP se realizó bajo las condiciones recomendadas por Salisbury. Se utilizaron para esto 15 µL del material génico obtenido para 50 µL de mezcla de reacción, la cual contenía: KCl 50 mM, Tris 10 mM (pH 8,3), MgCl2 3,75 mM, 200 µM de dNTPs, 5 pmol de los primers universales y se utilizó para la amplificación de la región mecA los primers descritos por Pedrari y otros,21,22 sintetizados en el Centro de Ingeniería Genética y Biotecnología (5'-GGG-ATC-ATA-GCG-TCA-TTA-TTC-3', 5'-AAC-GAT-TGT-GAC-ACG-ATA-GCG-3').
Determinación de producción de ß-lactamasa: la prueba se realizó por el método de nitrocefinasa cromógena a todas las cepas identificadas como S. aureus. Sobre las mismas placas donde se determinó la resistencia a la penicilina por el método de Kirby-Bauer y/o el oxacillin salt-agar screening-plate se añadió, sobre el crecimiento, la nitrocefina previamente preparada como indica el fabricante (BBL). Las placas se colocaron en la oscuridad durante 1 h y se consideraron cepas productoras de la enzima ß-lactamasa a todas aquellas en las que se observó cambio de coloración de amarillo a rojizo.23
Determinación de la resistencia a la amoxicilina y amoxicilina-ácido clavulánico: esta prueba se aplicó a todas las cepas que crecieron a concentraciones ³ 4 µg/mL de oxacilina, por el método de microdilución en caldo. Se procedió de la misma forma que se describe para el método de difusión en disco, y se utilizaron discos de amoxicilina (25 µg) y de amoxicilina/ácido clavulánico (20/10 µg).19 Las placas se incubaron a 35 ºC durante 24 h, al cabo de las cuales se midieron los halos de inhibición del crecimiento para ambos discos. Se consideraron cepas resistentes para la amoxicilina aquellas que produjeron halos £ 28 mm, y en el caso de la amoxicilina/ácido clavulánico a aquellas que produjeron halos ³ 20 mm. Se reportaron como positivas (resistentes pero por mecanismos diferentes al del gen mecA) para esta prueba a aquellas cepas en las que la diferencia entre los halos producidos para ambas drogas fue ³ 4 mm.15,19
Resultados
Como resultado de los exudados nasales tomados a los niños sanos en los círculos infantiles, se obtuvieron 140 cepas en el medio OMSA, de las cuales 28 fueron identificadas como S. aureus (20 %). Para el caso de los exudados tomados a los niños atendidos en el Hospital "Willian Soler", se recuperaron 32 cepas en el medio OMSA y de estas, 4 fueron identificadas como S. aureus (12,5 %). Se debe destacar aquí que no se recoge en tabla el número de aislamientos obtenidos a partir de los exudados axilares, pues solo 18 casos fueron positivos, y durante la identificación ninguna cepa se clasificó como S. aureus (tabla 1).
| Exudados nasales | Número de aislamientos | |
| Recuperados en OMSA | Identificados como S. aureus | |
| Niños sanos (n= 284) | 140 | 28 |
| Niños expuestos a factores de riesgo (n= 50) | 32 | 4 |
Los resultados de la determinación de la susceptibilidad a antimicrobianos por el método de Kirby-Bauer aparecen resumidos en las tablas 2 y 3. Para las cepas de S. aureus aisladas a partir de exudados nasales obtenidos de niños sanos la resistencia más elevada se presentó para la penicilina (96,43 %), tetraciclina (32,14 %) y eritromicina (25 %). Se observó, además, susceptibilidad intermedia para la eritromicina (14,28 %) y también para ceftriaxona (11,54 %) y ciprofloxacina (7,14 %). Ninguna cepa resultó resistente a oxacilina por el método de Kirby-Bauer. En el caso de las 4 cepas aisladas en OMSA a partir de exudados nasales obtenidos de niños expuestos a factores de riesgo, la resistencia mayor se obtuvo de igual forma para la penicilina (75 %) y eritromicina (50 %). Se observó también en este grupo una cepa con susceptibilidad intermedia para ceftriaxona, pero no para ciprofloxacina; solo una cepa (25 %) fue resistente a la oxacilina por el método de Kirby-Bauer. En ambos grupos de estudio todas las cepas resistentes a la penicilina fueron productoras de ß-lactamasa.
Tabla 2. Susceptibilidad antimicrobiana por el método de Kirby-Bauer, de cepas de S. aureus aisladas en medio OMSA (28 cepas), a partir de exudados nasales obtenidos de niños no expuestos a factores de riesgo
| Antibiótico | Resistencia | Sensibilidad intermedia | ||
| # de cepas | % | # de cepas | % | |
| Oxacilina | - | - | 1 | 3,57 |
| Penicilina | 27 (a) | 96,43 | - | - |
| Eritromicina | 7 (b) | 25 | 4 | 14,28 |
| Gentamicina | - | - | - | - |
| Trimetoprín-Sulfametoxazol | - | - | - | - |
| Tetraciclina | 9 | 32,14 | 2 | 7,14 |
| Cloranfenicol | 1 | 3,57 | - | - |
| Ciprofloxacina | - | - | 2 | 7,14 |
| Ceftriaxona | - | - | 3 | 11,54 |
| Clindamicina | - | - | 1 | 3,57 |
| Vancomicina | - | - | - | - |
(a): todas las cepas produjeron ß-lactamasas, (b): una de estas cepas presentó fenotipo inducible para la clindamicina
Tabla 3. Susceptibilidad antimicrobiana por el método de Kirby-Bauer, de cepas de S. aureus aisladas en medio OMSA (4 cepas) a partir de exudados nasales obtenidos de niños expuestos a factores de riesgo
| Antibiótico | Resistencia | Sensibilidad intermedia | ||
| No. de cepas | % | No. de cepas | % | |
| Oxacilina | 1 | 25 | - | - |
| Penicilina | 3(a) | 75 | - | - |
| Eritromicina | 2(b) | 50 | 1 | 25 |
| Gentamicina | - | - | - | - |
| Trimetropín-Sulfametoxazol | 1 | 25 | - | - |
| Tetraciclina | - | - | - | - |
| Cloranfenicol | - | - | 1 | 25 |
| Ciprofloxacina | - | - | - | - |
| Ceftriaxona | - | - | 1 | 25 |
| Clindamicina | 1 | 25 | - | - |
| Vancomicina | - | - | - | - |
(a): todas las cepas produjeron ß-lactamasas, (b): una de estas cepas presentó fenotipo inducible.
Resulta importante destacar que una de las cepas resistentes a la eritromicina en el primer grupo de estudio, mostró susceptibilidad intermedia para clindamicina; y una cepa resistente a la eritromicina del segundo grupo, lo fue también para la clindamicina. Ambas cepas manifestaron el fenotipo inducible de resistencia para clindamicina por el método de aproximación en disco descrito para S. aureus.16
La información obtenida a través de las diferentes pruebas utilizadas para confirmar la resistencia y/o susceptibilidad a la oxacilina de las cepas recuperadas en el medio OMSA, se muestran en la tabla 4. Al determinar la CMI en agar se detectan 3 cepas, provenientes de los exudados nasales realizados a niños sanos, que toleraron hasta 4 µg/mL de oxacilina y según lo establecido por el NCCLS pueden ser clasificadas como resistentes para este antibiótico.17 Sin embargo, como ya se señaló anteriormente, ninguna de estas cepas se reveló como resistente por el ensayo de Kirby-Bauer, y por otra parte, con la aplicación del método para la determinación de la CMI en caldo solo se detectó que una de estas cepas se comportó como resistente a la oxacilina (4 µg/mL), pero resultó negativa para el método oxacillin salt-agar screening-plate y no se detectó la presencia del gen mecA (fig.). Para esta cepa la resistencia estuvo limitada a la penicilina.
Tabla 4. Detección de cepas SARM a través de los diferentes métodos utilizados
| Cepas de S. aureus recuperadas en medio OMSA | Número de cepas clasificadas como resistentes a oxacilina por los diferentes métodos | |||||
| Difusión en disco | CMI en agar (³4 µg/mL) | Oxacillin salt-agar screening-plate (6 µg/mL) | Difusión en disco a 2 temperaturas (ê42-35 oC>4) | CMI en caldo (³4 µg/mL) | Detección del gen mecA | |
| Niños sanos (n= 28) | 0 | 3 | 0 | 0 | 1 | 0 |
| Niños del Hospital "William Soler" (n= 4) | 1 | 1 | 1 | 1 | 1 | 1 |
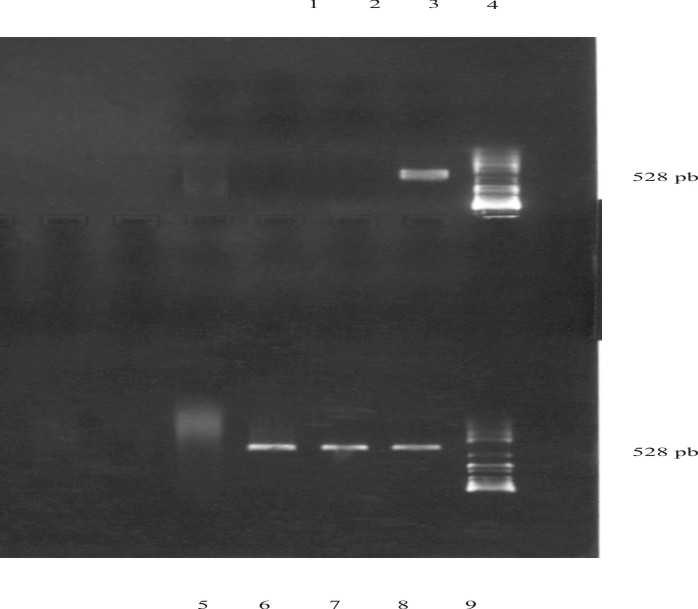
Fig. Resultados de la reacción en cadena de la polimerasa para determinar la presencia del gen mecA.
De las 4 cepas aisladas en el medio OMSA a partir del grupo de niños provenientes del Hospital, una sola cepa fue definida como resistente a la oxacilina por todos los métodos utilizados (tabla 4). En este caso se evidenció resistencia para penicilina y eritromicina.
La determinación de la resistencia a la amoxicilina y amoxicilina/ácido clavulánico (tabla 5) permitió demostrar que la cepa resistente a la oxacilina, aislada del grupo de niños sanos, era susceptible frente al disco de amoxicilina/ácido clavulánico.
Tabla 5. Resultados obtenidos en la determinación de la resistencia a la amoxicilina amoxicilina/ácido clavulánico
| Cepas | Halos de inhibición del crecimiento (mm) | |
| Amoxicilina (25 µg)(a) | Amoxicilina/ácido clavulánico(b) (20/10 µg) | |
| BRSA (cepa aislada del niño de círculo infantil) | 26 | 30 |
| SARM (cepa aislada del niño hospitalizado) | 21 | 28 |
(a): cepa resistente para amoxicilina: halo £ 28; (b): cepa sensible para amoxicilina/ácido clavulánico: halo ³ 20.
Discusión
Tomando en consideración las características del medio OMSA, se esperaba una correlación mayor entre los aislamientos obtenidos en este y las cepas finalmente identificadas como S. aureus.13 Sin embargo, aun con su empleo, es necesario el subcultivo en medios como agar sangre o agar nutriente, para confirmar la identidad de las colonias aisladas a través de los métodos convencionales, y la determinación de la susceptibilidad antimicrobiana para la oxacilina según los métodos recomendados por el NCCLS.15,17
El empleo de medios más generales para el aislamiento, como el agar sangre, de donde son después escogidas algunas colonias a las cuales se les determina la sensibilidad a la oxacilina, provoca una subestimación de los valores reales de colonización por SARM, pues hay enmascaramiento como consecuencia del sobrecrecimiento de la flora normal; o porque la probabilidad de ser seleccionada para las pruebas de sensibilidad a la oxacilina es la misma tanto para las colonias sensibles como para las resistentes. Teniendo en cuenta, además, que solo una minoría de las células (10-3-10-5) de una población de SARM expresa el fenotipo de resistencia, a menos que la selección o el aislamiento se realice por previa exposición al antibiótico, se puede señalar que a pesar de la baja selectividad del medio OMSA, su empleo se justifica como medio de aislamiento inicial, dada su elevada sensibilidad, pero no contribuye a eliminar etapas ulteriores durante la identificación.13,23
Por otro lado, aunque en el caso de este estudio no se obtuvo ninguna cepa de S. aureus a partir de los exudados axilares, sus autores consideran, que es necesario la obtención de más de un tipo de exudado cuando se realizan estudios para la localización de portadores de SARM (exudados nasales, faríngeos, axilares y perineales), pues según la experiencia de otros autores, un mismo paciente puede estar colonizado en más de un sitio, o este puede ser diferente en cada uno de los casos.12,24
Los elevados valores de resistencia encontrados frente a la penicilina y la eritromicina, se corresponden con lo que se ha venido reportando internacionalmente para cepas aisladas en ambiente hospitalario, y recuperadas de niños sanos.25 Resulta de interés la susceptibilidad intermedia detectada para la ciprofloxacina y la ceftriaxona, que si bien no alcanza altos índices, habla en favor de la imperiosa necesidad de una selección y uso más racional de estos antimicrobianos. Un resultado similar a este se obtuvo durante el estudio dirigido a determinar la circulación de cepas de SARM entre portadores nasofaríngeos sanos atendidos en círculos infantiles, al cual ya se ha hecho referencia.11
El hallazgo del fenotipo inducible de resistencia para clindamicina en 2 cepas parece realmente interesante e indica la necesidad de monitorear de cerca la resistencia a macrólidos, pues esta puede cruzar con la resistencia a lincosamidas (clindamicina), y llegar a convertirse en una problemática durante la elección del tratamiento alternativo de infecciones provocadas por cepas de SARM.16
Con respecto a la oxacilina, al aplicar el método de Kirby-Bauer, únicamente se detectó resistencia a este antibiótico para una cepa en el grupo de niños ingresados en el Hospital "Willian Soler", a pesar de que se podía esperar un mayor número de cepas resistentes, pues todas toleraron la concentración de oxacilina fijada en el OMSA utilizado para su aislamiento. Este resultado se corresponde con el conocimiento que se tiene acerca de que la difusión en disco no constituye un método definitivo para la detección de cepas de SARM y los resultados deben ser corroborados a través del método oxacillin salt-agar screening-plate y por la determinación de la CMI.19,21 Con la aplicación de estos últimos métodos se detecta, como ya se comentó en la sección de resultados, solo una cepa con CMI de 4 µg/mL para la oxacilina, por el método de microdilución en caldo, en el grupo de niños de la comunidad. Este resultado, unido a la información proporcionada por todos los métodos aplicados (tabla 4) induce, a incluir a esta cepa en la categoría borderline (BRSA), dentro de la cual se describen 2 grupos con bajos niveles de resistencia: borderline hiperproductora de ß-lactamasa y borderline heterorresistente.18
En cambio, el comportamiento positivo de la cepa aislada a partir del grupo de niños hospitalizados, en todas las pruebas utilizadas para confirmar la resistencia a la oxacilina, se corresponde con el descrito para un fenotipo homorresistente a esta droga (SARM), en el cual el principal mecanismo de resistencia que se reconoce es la disminución de la afinidad por el antimicrobiano como consecuencia de la producción de la PBP2a codificada por el gen mecA.19,26 Los resultados obtenidos con esta cepa en los diferentes métodos empleados para la determinación del fenotipo de resistencia reafirman 100 % de correlación descrito por otros autores, entre los resultados positivos que se obtienen por el método oxacillin salt-agar screening-plate y la demostración del gen mecA por RCP (tabla 4).19,21
La utilización de la prueba de difusión en disco con incubación simultánea a las 2 temperaturas (35 y 42 ºC) fue incluida en este estudio, precisamente con la intención de poder discernir entre ambos tipos de cepas en la categoría de borderline. Se describe que a la temperatura de 42 ºC se produce una inhibición de la PBP2a, en aquellas cepas que portan el gen mecA, pero también se han reportado resultados positivos para esta prueba en cepas borderline heterorresistentes, en las que no está presente el gen, pero sí otras PBB2 normales mutadas.18,19
Tomando en consideración el ensayo de las 2 temperaturas (tabla 4) y conociendo que la cepa resistente a la oxacilina, aislada del grupo de niños del círculo infantil, es productora de ß-lactamasa, los autores concluyen que esta pertenece al grupo de las denominadas borderline hiperproductora de ß-lactamasa. Para hacer esta afirmación se apoyaron también en los resultados obtenidos en la determinación de la resistencia a amoxicilina y a amoxicilina/ácido clavulánico (tabla 5). La resistencia para la amoxicilina y la susceptibilidad para amoxicilina/ácido clavulánico observadas en esta cepa, como consecuencia del carácter inhibidor del ácido clavulánico sobre las ß-lactamasas, constituye otra evidencia de que el mecanismo responsable de la resistencia a la oxacilina en este caso, es precisamente la producción de ß-lactamasa.
De acuerdo con la información ofrecida por todos los métodos utilizados, se determinó que 0,35 % de los niños sanos y 2 % de los niños hospitalizados, eran portadores de cepas resistentes a la oxacilina en el tracto respiratorio superior. Para el grupo de niños sanos, el porcentaje de colonización demostrado resultó inferior al reportado por Toraño y otros en un estudio similar realizado en el laboratorio IRAB del IPK (7,8 %), que constituye el único antecedente a esta investigación.11 Otro trabajo llevado a cabo en 2 círculos infantiles en Dallas, EE. UU., demostró también un porcentaje de colonización mayor (24 y 3 %) que el obtenido en este trabajo.27 Asimismo, en la literatura consultada se encontraron porcentajes que van desde 4,1 % al nivel comunitario en Trinidad Tobago, hasta 24 y 42 % en comunidades indígenas en Australia.12,28
El porcentaje de colonización encontrado entre los niños hospitalizados en el "William Soler" es también menor que el reportado por otros autores en estudios realizados en diferentes tipos de instituciones hospitalarias.25,28,29 Se debe señalar no obstante, que no resulta del todo apropiada esta comparación, pues los trabajos revisados en la literatura describen el aislamiento de SARM de muestras clínicas, y no se refieren a la búsqueda de estado de portador intrahospitalario, además debe tenerse en cuenta que este trabajo constituye un estudio descriptivo puntual cuyos resultados no resultan aún concluyentes. Haciendo estas consideraciones, se puede decir que en el momento en el cual se llevó a cabo esta investigación, no constituía un problema la circulación de cepas de SARM entre portadores nasales hospitalizados en el "William Soler"; pero se estima de gran importancia realizar un estudio más amplio para poder determinar con qué frecuencia se aíslan este tipo de cepas a partir de procesos infecciosos en este hospital.
A pesar de que el porcentaje de colonización encontrado es bajo, este resultado se suma a las evidencias que señalan a las cepas de SARM como un patógeno no solo limitado al ambiente hospitalario. Destacan por otra parte, la necesidad de la correcta selección y aplicación de los métodos útiles para la determinación de cepas BRSA, pues hasta el presente su frecuencia de aislamiento ha sido subestimada y no se ha reconocido debidamente el papel que estas pudieran desempeñar en la diseminación de la resistencia a la oxacilina en la comunidad.19,24
Summary
A descriptive punctual study was conducted to search for nasal carriers of Staphylococcus aureus strains resistant to methycilin (SARM) among sound children attended in nurseries and hospitalized children exposed to one or more risk factors predisposing to the colonization by this type of strains from October, 2000, to February, 2001, in Marianao municipality. For the primary isolation of the SARM strains, it was used the oxacillin-manitol-salt-agar (OMSA) and the sensitivity to antimicrobial drugs was determined in all strains identified as S. Aereus by using the Kirby-Bauer method. In order to identify the resistance to oxacillin in the strains recovered from OMSA, the oxacillin salt-agar screening -plate method and the determination of inhibitory minimum concentration (IMC) in agar and broth were applied. The presence of the mecA gene was nvestigated by polymerase chain reaction in those strains with an IMC ³ 4 mg/mL of oxacillin. Of the sound children, 0.35 % and of the hospitalized, 2 %, were nasal carriers of SARM strains. The strains isolated in both study groups showed high indexes of resistance to penicillin, tetracycline and erythromycin by the Kirby-Bauer method. The mecA gene was identified in a SARM strain isolated from a hospitalized nasal carrier and it was defined that its behaviour agreed with the one described for a strain homoresistant to oxacillin.
Subject headings: STAPHYLOCOCCUS AUREUS; MICROBIAL SENSITIVITY/methods; METHICILLIN RESISTANCE; CHILD:
Referencias bibliográficas
- Boyce J. Are the epidemiology and microbiology of methicillin-resistant Staphylococcus aureus changing?. JAMA 1998;279:623-4.
- Leibovici L, Schonheyder H, Pitlik S, Samra Z, Moller J. Bactaeremia caused by hospital-type micro-organisms during hospital stay. J Hosp Infect 2000;44:31-6.
- Gopal R. Risk factors for the spread of antibiotic-resistant bacteria. Drugs 1998;55:323-30.
- Casewell M. The nose: an understimated source of Staphylococcus aureus causing wound infection. J Hosp Infect 1998;40:3-11.
- Craven D, Rixigen A, Goularte T, Mc Cabe W. Methicillin-resistant Staphylococcus aureus bactaeremia linked to intravenous drug abusers using galery. Am J Med 1986;80:770-6.
- Pate K, Bannerman T, Feldman S. Methicillin-resistant Staphylococcus aureus in the community. Lancet 1995;346:978.
- O'Brien F, Pearman J, Graccey M, Riley T, Williams P, Grubb W. MRSA involve in an outbreak in a Wester Australiam Metropolitan hospital related to a strain prevalent in a remote area. In: Program and abstracts of the 8th International Symposium on Staphylococci and Staphylococcal infections; June 23-26, 1996; Aix-Les-Bains, France. Abstract p.100-5.
- Herold B, Inmuergluck L, Maranan M. Community-acquired methicilin-resistant Staphylococcus aureus in children with no identified predisposing risk. JAMA 1998; 279:593-8.
- Frank A, Marcinak J, Mangat P, Schreckenberger P. Increase in community-acquired methicillin-resistant Staphylococcus aureus in children. Clin Infect Dis 1999;29:935-6.
- Shahin R, Johnson I, Jamieson F, Mc Geer A, Tolkin J, Ford-Jones E. Methicillin-resistant Staphylococcus aureus carriage in a child care center following a case of disease. Arch Pediatr Adolesc Med 1999; 153:864-8.
- Toraño G, Quiñones D, Hernández I, Hernández T, Tamargo I, Borroto S. Portadores nasofaríngeos de Staphylococcus aureus resistente a la meticilina entre niños cubanos que asisten a círculos infantiles. Enferm Infect Microbiol Clin 2001;19:367-70.
- O'Brien F, Pearman J, Gracey M, Riley T, Grubb W. Community strain of methicillin-resistant Staphylococcus aures involved in a hospital outbreak. J Clin Microbiol 1999;37:2858-62.
- Van Enk R, Thompson K. Use of a primary isolation medium for recovery of methicillin-resistant Staphylococcus aureus. J Clin Microbiol 1992;30:504-5.
- Kloos W, Bannerman T. Staphylococcus and Micrococcus. In: Murray P, Baron E, Pfaller M, Tenovar F, Yolken R (ed.), Manual of Clinical Micrbiology, 6thed. Washington DC:American Society for Microbiology;1996. p.282-98.
- National Committee for Clinical Laboratory Standards. Performance Standards for antimicrobial disk susceptibility test. NCCLS document M2-A7. Villanova, Pensylvania: National Committee for Clinical Laboratory Standards; 2000.
- Sánchez M, Flint K, Jones R. Ocurrence of Macrolide-Lincosamide-Streptogramin resistances among Staphylococcal clinical isolates at University Medical Center. Is false susceptibility to new macrolides and clindamycin a contemporary clinical and in vitro testing problem? Diagn Microbiol Infect Dis 1993;16:205-213.
- National Committee for Clinical Laboratory Standards. Methods for dilution antimicrobial susceptibility test for bacteria that grow aerobicaly. NCCLS document M7-A5. Villanova, Pensylvania: National Committee for Clinical Laboratory Standards; 2000.
- Bantar C, Fernandez Canigia L, Smayevsky J, Bianchini H. Detection of oxacillin resistance by agar diffusion test at two temperatures in "borderline" Staphylococcus aureus In: Programme and abstracts of the 18th International Congress of Chemotherapy 1993; Stockholm, Sweden. Abstract 880.
- Nicola F, Bantar C, Fernandez Canigia L, Relloso S, Bianchini H, Smayensky J. Comparison of several methods to determine methicillin-resistance in Staphylococcus aureus with focus on borderline strains. Diag Microbiol and Infect Dis 2000;36:91-3.
- Tokue Y, Shoji S, Satoh K. Comparison of a polymerase chain reaction assay and a conventional microbiologic method for detection of methicilin-resistant Staphylococcus aureus. Antimicrob Agents Chemother 1992;36:6-9.
- Salisbury S. Genotypic detection of methicillin-resistant Staphylococci by multiplex PCR assay. Am J Clin Pathol 1997;107:368-73.
- Pedrari S, Ligozzi M, Fontana R. Genotypic identification of methicillin-resistant staphylococci by polymerase chain reaction. Antimicrob Agents Chemother 1991;35:2568-73.
- Hartman B, Tomansz A. Expresion of methicilllin resistance in heterogeneous strains of Staphylococcus aureus. Antimicrob Agents Chemother 1986;29:85-92.
- Suggs A, Maranan M, Boyle-Vavra S, Daum R. Methicillin-resistant and borderline methicillin-resistant asymptomatic Staphylococcus aureus colonization in children without identifiable risk factors. Pediatr Infect Dis 1999;18:410-4.
- Orrett F. Methicillin-resistance among Trinidian isolates of community and hospital strains of Staphylococcus aureus and their patterns of resistance to non-beta-lactam antibiotics. Jpn J Infect Dis 1999;52:238-41.
- Hiramatsu K. Molecular evolution of MRSA. Microbiol Immunol 1995;39:531-43.
- Adcock P, Pastor P, Medley F, Patterson J, Murphy T. Methicillin-resistant Staphylococcus aureus in two child care centers. J Infect Dis 1998;178:577-80.
- Alghaithy A, Bilal N, Gedebou M, Weily A. Nasal carriage and antibiotic resistance of Staphylococcus aureus isolates from hospital and non-hospital personnel in Abha, Saudi Arabia. Trans R Soc Trop Med Hyg 2000;94:504-7.
- Bradley S, Terpenning M, Ramsey M. Methicillin resistant Staphylococcus aureus: colonization and infection in a long-term care facility. Ann Intern Med 1991;115:417-22.
Recibido: 19 de julio de 2002. Aprobado: 20 de mayo de 2003.
Lic. Ibis Trinidad Hernández Vadell. Instituto de Medicina Tropical "Pedro Kourí". Apartado 601, Marianao 13, Ciudad de La Habana, Cuba. Correo electrónico: ibist@ipk.sld.cu
1 Máster en Bacteriología-Micología. Licenciada en Microbiología. Aspirante a Investigadora.
2 Máster en Bacteriología-Micología. Licenciada en Microbiología. Investigadora Agregada.
3 Máster en Infectología. Especialista de I Grado en Pediatría.
4 Máster en Microbiología General. Licenciada en Microbiología. Investigadora Auxiliar.














