Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión On-line ISSN 1561-3054
Rev Cubana Med Trop v.59 n.2 Ciudad de la Habana Mayo-ago. 2007
Laboratorio de Investigaciones del SIDA (LISIDA)
Fluido oral y orina como muestras alternativas en el diagnóstico confirmatorio de la infección por VIH-1
Lic. Otto Cruz Sui,1 Lic. María Teresa Pérez Guevara,2 Dra. Ana Luisa Lubián Caballero,3 Téc. Lucy Montano Tamayo4 y Dr. Eladio Silva Cabrera5
Resumen
Se evaluó el fluido oral y la orina como muestras opcionales en el diagnóstico confirmatorio del VIH-1 con el sistema DAVIH-BLOT (Laboratorios DAVIH, La Habana, Cuba), para lo cual se comparó con las correspondientes muestras de sueros en un grupo de 125 individuos. En el análisis de los patrones de bandas reveladas, los anticuerpos predominantes en las muestras positivas de fluido oral y orina contra la p34, p68, gp41 y gp120, no tuvieron diferencias con sus correspondientes sueros según la prueba de comparación de proporciones (p< 0,001). La sensibilidad y especificidad relativas del sistema resultaron de 100 % en el análisis del fluido oral; 98,75 y 100 %, respectivamente, en las muestras de orina. Estos resultados apoyan el empleo opcional del fluido oral y la orina que, con ligeras modificaciones introducidas en el sistema diagnóstico, pueden aplicarse para la confirmación de anticuerpos contra el VIH-1.
Palabras clave: Anticuerpos VIH, fluido oral, orina, prueba confirmatoria.
Los ensayos para determinar la infección por el VIH-1 se realizan principalmente mediante la detección de anticuerpos en el suero/plasma sanguíneo obtenido por punción venosa y se emplean en estudios epidemiológicos, investigativos o con fines diagnósticos.1,2 El uso de otras muestras como el fluido oral y la orina resultan útiles en estudios epidemiológicos,3-6 cuando no existen condiciones técnicas adecuadas para la recolección, el procesamiento y la conservación de las muestras,7,8 para realizar autoensayos9 y en estudios de niños recién nacidos.10 Las ventajas del empleo de estos fluidos corporales son diversas, en primer lugar se obtienen por métodos no invasivos, los cuales resultan mucho más aceptados por aquellos pacientes que rehúsan la extracción de sangre o con difícil acceso venoso, se reducen los costos asociados al apoyo logístico en el procesamiento de la muestra, así como la preparación técnica del personal profesional que participa.2 Además, hay una disminución de los riesgos biológicos de adquirir la infección por accidente del personal de salud; las características de las muestras de orina y fluido oral permiten realizar los ensayos en lugares con escasos recursos de laboratorio.11
Tanto la orina como el fluido oral y el resto de las secreciones, contienen cantidades detectables de inmunoglobulinas (Ig) específicas de diferentes clases. La IgG salivar proviene de la trasudación gingival que ocurre desde la red de capilares que está por debajo de la mucosa oral hacia la superficie de esta.12 En la orina también ocurre una extravasación de la IgG desde la red capilar hacia la mucosa.4 La presencia de IgG en estos fluidos brinda la posibilidad de utilizar técnicas de diagnóstico para detectar anticuerpos específicos contra el VIH-1, siempre que estos cuenten con la sensibilidad adecuada para este fin, lo cual constituye una alternativa de gran utilidad para diversos estudios. El objetivo del presente trabajo fue evaluar el empleo de fluido oral y orina para el diagnóstico confirmatorio de anticuerpos contra el VIH-1 con el sistema de western blot DAVIH-BLOT (Laboratorios DAVIH, La Habana, Cuba).
Métodos
Muestras
Se tomaron muestras de suero de 125 individuos y sus correspondientes fluidos orales y orinas, que incluían 80 seropositivos al VIH-1 y 45 negativos previamente diagnosticados por el sistema ELISA Vironostika HIV Uniform II Ag-Ac® (Organon Teknika, Holanda). Las positivas se confirmaron por el western blot de Laboratorios DAVIH. Las muestras de fluido oral se colectaron con el dispositivo comercial OraSure® según las instrucciones del fabricante y posteriormente se centrifugaron a 5 000 g durante 5 min y se congelaron a - 20 °C hasta el momento de realización del ensayo, lo cual no excedió las 72 h. Las muestras de orina se colectaron en frascos de cristal de 50 mL y se congelaron en las mismas condiciones.
Ensayo de western blot
Todas las muestras se evaluaron por el sistema DAVIH-BLOT (Laboratorios DAVIH, La Habana, Cuba; Reg. D 9504-05. CECMED) para la confirmación de anticuerpos contra el VIH-1. La evaluación de los sueros se realizó según las instrucciones del fabricante; mientras que para las muestras de fluido oral y orina se hicieron modificaciones en las diluciones como recomiendan algunos autores.13 De cada muestra de fluido oral se tomaron 400 µL y 1 500 µL de cada orina hasta completar un volumen de 2 mL con tampón de dilución (diluciones 1:5 y 4:1, respectivamente). El revelado de la reacción se realizó con el conjugado anti-IgG humana-peroxidasa diluido 1:500 y el sustrato diaminobencidina-H2O2 que emplea el estuche. Se tomó el criterio de positividad recomendado por el fabricante, el cual coincide con el de la Organización Mundial de la Salud, que considera una muestra positiva aquella que tenga anticuerpos contra al menos 2 bandas del gen env, negativa aquella que no tenga reactividad o solo aparece contra la p17, e indeterminada cuando no cumple con los criterios anteriores.14
Análisis estadístico
Se realizó una prueba de comparación de proporciones (Statistica® 6.0) de la frecuencia de anticuerpos contra los epítopes antigénicos de las bandas específicas del VIH-1 de los sueros positivos y sus correspondientes muestras de fluido oral y orina; y se calculó la media aritmética del número de bandas de los 3 tipos de muestras.
Resultados
Las muestras de suero, fluido oral y orina de los individuos seronegativos no revelaron ninguna banda en el western blot. Todos los fluidos orales correspondientes a los sueros positivos a VIH-1 se clasificaron como positivos y una de las muestras correspondientes de orina resultó indeterminada con un patrón de bandas que incluía la p34, p68 y gp160; el resto de las orinas se clasificaron como positivas. La sensibilidad y especificidad relativas del sistema DAVIH-BLOT fueron de 100 % para los fluidos orales y, 98,75 y 100 %, respectivamente, para las orinas.
La frecuencia de anticuerpos contra los epítopes antigénicos de las bandas específicas del VIH-1 y la media aritmética del número de bandas en los sueros positivos y sus correspondientes fluidos orales y orinas se exponen en la tabla 1. Los anticuerpos predominantes en las muestras positivas de fluido oral y orina contra la p34, p68, gp41 y gp120, no difieren de las muestras de suero según la prueba de comparación de proporciones (p< 0,001); mientras que contra p17 y p53 difieren solo en la orina y contra p24, p55 y gp160 difieren tanto en el fluido oral como la orina (p< 0,001). La media aritmética de bandas observadas fue de 8,16 en fluido oral y 7,7 en orina.
Tabla 1. Frecuencia de anticuerpos contra bandas específicas de VIH-1 en muestras de sueros positivos y sus correspondientes muestras de fluido oral y orina
| n= 80 | Genes estructurales | Gen gag | Gen pol | Gen env | Promedio del número de bandas | |||||
| Banda | p17 | p24 | p55 | p34 | p53 | p68 | gp41 | gp120 | gp160 | |
| Suero | 75 | 75 | 75 | 80 | 78 | 77 | 79 | 79 | 71 | 8,61 |
| Fluido oral | 74 | 66 | 63 | 79 | 78 | 77 | 79 | 79 | 58 | 8,16 |
| Orina | 64 | 46 | 62 | 78 | 72 | 75 | 77 | 79 | 66 | 7,7 |
En la tabla 2 se muestra la frecuencia del número bandas por western blot (hasta 9 bandas inmunogénicas posibles) de los sueros positivos a VIH-1 y sus correspondientes muestras de fluido oral y orina. En las muestras positivas de fluido oral 48,75 % (39 muestras) tuvo reactividad contra todas las bandas; y en las de orina solo 35 % (28 muestras) tuvo reacción con todas las bandas específicas.
Tabla 2. Frecuencia del número de bandas en muestras de fluido oral y orina
| Número de bandas presentes | ||||||||
| 9 | 8 | 7 | 6 | 5 | 4 | 3 | 2 | |
| Suero | 66 | 6 | 2 | 4 | 1 | - | 1 | - |
| Fluido oral | 39 | 25 | 9 | 6 | - | - | 1 | - |
| Orina | 28 | 15 | 23 | 7 | 3 | 1 | 2 | 1 |
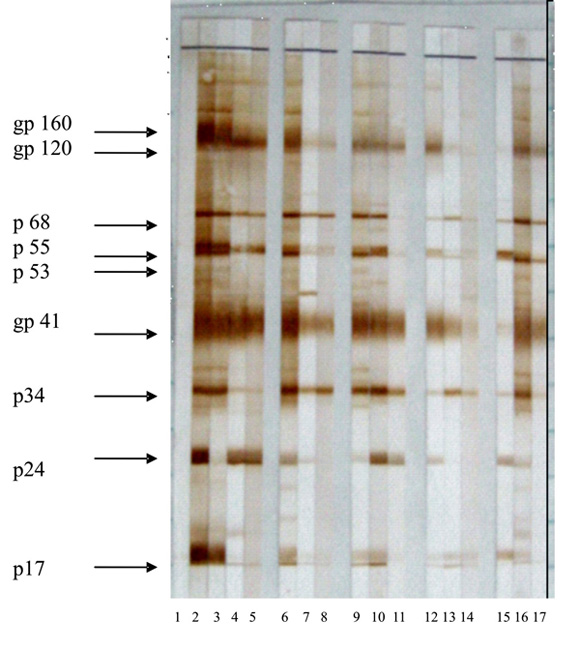
En la figura se muestra a modo de ejemplo, la reactividad de algunas muestras de sueros positivos a VIH-1 y su correspondiente fluido oral y orina, en las que se destaca una adecuada intensidad en las bandas correspondientes a los anticuerpos contra las glicoproteínas gp41 y gp120; sin embargo, existen mayores diferencias en cuanto a presencia e intensidad de la p24, p55 y gp160 de los sueros y sus correspondientes muestras de fluido oral y orina.
1: control negativo; 2: control positivo; 3, 6, 9,12 y 15: muestras de suero; 4, 7, 10,13 y 16: muestras de fluido oral; 5, 8, 11,14 y 17: muestras de orina.
Fig. Patrones de bandas en el DAVIH-BLOT.
Discusión
Los valores de sensibilidad y especificidad relativas de las muestras de sueros con sus correspondientes muestras de fluido oral y orina, resultaron útiles para confirmar la presencia de anticuerpos contra el VIH-1 con el sistema empleado y constituyen alternativas confiables para la detección de anticuerpos contra el VIH-1 cuando no se pueden obtener muestras de sangre o suero; lo cual se ha comentado en estudios anteriores.8
No hubo diferencias en la frecuencia e intensidad de la reactividad contra las glicoproteínas de envoltura (gp41 y gp120), al comparar todos los tipos de muestras según la prueba de comparación de proporciones. Estos resultados coinciden con lo informado por otros autores y asegura la efectividad del diagnóstico cuando se utiliza como criterio de positividad la presencia de al menos 2 glicoproteínas en el patrón de western blot.8,15
Es importante comentar que en individuos infectados con VIH, la IgG específica contra el virus es el isotipo predominante en muestras de saliva y orina, y puede encontrarse presente en una concentración de 102 a 105 veces menor que en el suero/plasma.12,16 Es por ello que se justifican las transformaciones introducidas en la realización del ensayo y se confirma que con la modificación en las diluciones realizadas en las muestras de fluido oral y orina se garantizó una mayor sensibilidad analítica, toda vez que se aumentó la concentración de IgG presente en estas.
Aunque en general se refiere como saliva al fluido utilizado para realizar el ensayo, lo que realmente se detecta es un fluido seroso rico en IgG que proviene de la trasudación de la sangre que irriga los capilares gingivales, y es por tanto una muestra análoga a las empleadas en los ensayos serológicos. Se plantea que la concentración de IgG en el fluido oral es alrededor de 1/400 de la del plasma; sin embargo, como consecuencia del efecto de la dilución de los fluidos provenientes de las glándulas salivares (saliva verdadera), es necesario una adecuación de los ensayos para poder detectar estas pequeñas cantidades de anticuerpos.
Muchos autores plantean que las actuales tecnologías desarrolladas en los diagnosticadores para detectar pocas cantidades de anticuerpos son seguras.2 Así por ejemplo, la FDA aprobó un dispositivo para la recolección de saliva en 1994 para la determinación de anticuerpos por ELISA, y el sistema de western blot OraSure3 para la confirmación de las muestras reactivas. Por otra parte, las pruebas orales rápidas para VIH comenzaron a introducirse a mediados de los años 90, y como en el caso del ELISA, la sensibilidad de estas pruebas para VIH en fluido oral necesitó ser aumentada y ajustada para disminuir el efecto de dilución de la saliva pura.2 En el caso del sistema DAVIH-BLOT se ajustó una dilución final 20 veces más concentrada de la muestra de fluido oral y al mismo tiempo una menor dilución del conjugado anti IgG humana-peroxidasa, lo cual aseguró un aumento de la señal de revelado y un consecuente incremento de la sensibilidad; resultados claramente visibles cuando se compara el promedio de 8,16 bandas en las muestras positivas de fluido oral con el de 8,61 de los sueros correspondientes.
En este estudio, se demostró también la presencia de anticuerpos contra el VIH-1 en muestras de orina correspondientes de seropositivos al VIH. Al igual que en la saliva, se plantea que la mayoría de los anticuerpos del tipo IgG detectados en este fluido provienen de la trasudación de los capilares del tracto renal y urinario.4,6 En el caso de los individuos infectados, estos hallazgos pudieran explicarse por un efecto directo del virus sobre el aumento de la permeabilidad capilar, que a su vez puede provocar una mayor afluencia de plasma a la orina; o indirectamente, por la inmunodeficiencia severa, los procesos inflamatorios asociados o una disfunción renal severa.17
Los resultados obtenidos con las muestras de orina no son óptimos como los encontrados en estudios de saliva o trasudado gingival, quizá porque la concentración de anticuerpos puede alterarse más fácilmente por los ritmos circadianos del individuo.6 Existen además otros factores que pudieran explicar un resultado falso negativo de una orina en relación con su correspondiente muestra positiva de suero, entre ellos se citan, el consumo de medicamentos diuréticos, la ingestión de grandes volúmenes de líquido, un pequeño intervalo entre la última micción y el momento de recolección de la muestra de orina, así como el propio estado de inmunodeficiencia.7
En condiciones normales, la concentración de anticuerpos en las muestras de orina puede ser hasta 105 veces menor que en el suero. Para la detección de esta baja concentración de IgG en la orina se pueden modificar los ensayos con un incremento del volumen de muestra,3 el tiempo de incubación,8 o añadir la muestra sin diluir.6 Este tipo de modificaciones han sido aplicadas con anterioridad3,13 y en el presente estudio se concentró el conjugado anti IgG humana-peroxidasa para amplificar la señal de revelado y se ajustó una dilución 4:1 de la muestra para aumentar considerablemente el volumen de la muestra sin eliminar una cantidad mínima de solución para amortiguar el pH.
Se conoce que el pH de la orina tiene una alta variabilidad de un individuo a otro que afecta la reacción antígeno-anticuerpo,2 (dependiente del pH) y disminuye la sensibilidad al aumentar la coloración de fondo por reacciones inespecíficas en el soporte de nitrocelulosa donde ocurre la reacción, razón por la que se optó por no emplear la muestra de orina pura. No obstante, se pueden analizar de manera exhaustiva las variables de volumen y pH de las muestras, en estudios posteriores. En ocasiones, la cantidad de anticuerpos presentes, pudiera en algunos casos no ser detectable o hallarse en menor proporción por el estadio serológico de la persona, como pudo haber sucedido en la muestra de orina que tuvo un resultado discordante.
Hay que destacar que la forma no traumática de toma de muestra en el caso de estos fluidos, resulta una alternativa útil que puede sustituir de manera eficaz la toma de muestra de sangre por venipuntura, en aquellos estudios que involucran infectados por VIH-1 en estadios terminales o para los estudios de casos pediátricos.10 Por otra parte, para la recolección del fluido oral se emplean dispositivos que resultan de fácil manipulación con un mínimo de entrenamiento del personal que va a tomar la muestra.15
Los resultados de los parámetros de sensibilidad y especificidad estudiados, apoyan el empleo alternativo de muestras fluido oral y orina en el ensayo DAVIH-BLOT para la detección de anticuerpos contra el VIH-1, porque el sistema convencionalmente utilizado en suero o plasma, demostró que con ligeras modificaciones introducidas, puede aplicarse de manera confiable para la confirmación de anticuerpos en este tipo de muestras.
Oral fluid and urine as alternative samples in confirmatory testing of HIV-1 infection
Summary
The objective of this report was to evaluate oral fluid and urine as optional samples for HIV-1 confirmatory test using DAVIH-BLOT system (Laboratorios DAVIH, La Habana, Cuba), for which they were compared with their corresponding serum samples in a group of 125 individuals. In band pattern analysis, predominant antibodies in positives oral fluid and urine samples against p34, p68, gp41, gp120, were no different from their corresponding sera according to the proportion comparison test (p<0,001). Relative sensitivity and specificity of this system were 100 % in oral fluid and 98, 75% and 100% in urine samples respectively. These results support optional use of oral fluid and urine that, with slight modifications in the diagnostic system, can be applied for HIV-1 antibody confirmation testing.
Key words: HIV-1 antibodies; oral fluid; urine; confirmatory test.
Referencias bibliográficas
1. CDC. Revised guidelines for HIV counseling, testing, and referral. MMWR Morb Mortal Wkly Rep 2001;50:1-57.
2. Constantine NT, Saville RD, Dax EM. Retroviral Testing and Quality Assurance: Essentials for Laboratory Diagnosis. Ann Arbor, MI: Malloy Printers; 2005.
3. Mylonakis E, Paliou M, Lally M, Flanigan TP, Rich JD. Laboratory testing for infection with the human immunodeficiency virus: established and novel approaches. Am J Med 2000;109:568-76.
4. Oelemann WM, Lowndes CM, Verissimo Da Costa GC, Morgado MG, Castello-Branco LR, Grinsztejn B, et al. Diagnostic detection of human immunodeficiency virus type 1 antibodies in urine: a brazilian study. J Clin Microbiol 2002;40:881-5.
5. Liu A, Kilmarx PH, Supawitkul S, Chaowanachan T, Yanpaisarn S, Chaikummao S, et al. Rapid whole-blood finger-stick test for HIV antibody: performance and acceptability among women in northern Thailand. J Acquir Immune Defic Syndr 2003;33(2):194-8.
6. Almeda J, Casabona J, Matas L, González V, Muga R, Sanz B, et al. Evaluation of a commercial enzyme immunoassay for HIV screening in urine. Eur J Clin Microbiol Infect Dis 2004;23:831-5.
7. Tribble DR, Rodier GR, Saad MD, Binson G, Marrot F, Salah S, et al. Comparative field evaluation of HIV rapid diagnostic assays using serum, urine, and oral mucosal transudate specimens. Clin Diagn Virol 1997;7:127-32.
8. Martínez PM, Torres AR, Ortiz de Lejazaru R, Montoya A, Martin JF, Eiros JM. Human Immunodeficiency Virus antibody testing by enzyme-linked fluorescent and western blot assays using serum, gingival-crevicular transudate and urine samples. J Clin Microbiol 1999; 37:1100-6.
9. Tiensiwakul P. Urinary HIV-1 antibody patterns by western blot assay. Clin Lab Sci 1998;11:336-8.
10. Flaitz CM, Hicks MJ, Carter AB, Rossmann SN, Demmler GJ, Simon CL, et al. Saliva collection technique for cytologic, microbiologic and viral evaluation in pediatric HIV infection. ASDC J Dent Child 1998;65:318-24.
11. Respess RA, Rayfield MA, Dondero TJ. Laboratory testing and rapid HIV assays: applications for HIV surveillance in hard-toreach populations. AIDS 2001;15(Suppl 3):S49-59.
12. Wu X, Jackson S. A longitudinal study of plasma and salivary antibodies in HIV-1 infection. Viral Immunol 2002;15:325-35.
13. Kay JW, Tan PL. Improving HIV-1 western blot: modification of a sensitive western blot for detection of HIV-1 antibodies in multiple specimen matrices, e.g. sera/plasma, DBSs, oral fluids, and urines. Int Conf AIDS 2000;13: MoOrA111.
14. WHO. Acquired immunodeficiency syndrome (AIDS): proposed WHO criteria for interpreting results from western blot assays for HIV-1, HIV-2, and HTLV-I/HTLV-II. Wkly Epidemiol Rec 1990;37:281-3.
15. Gallo D, George JR, Fitchen JH, Goldstein AS, Hindahl MS. Evaluation of a system using oral mucosal transudate for HIV-1 antibody screening and confirmatory testing. OraSure HIV clinical trials group. JAMA 1997;277:254-8.
16. Jackson S, Mestecky J, Goepfert PA, Mulligan M, Moldoveanu Z, Prince SJ, et al. Mucosal antibody responses in HIV-infected individuals. Isotype variations in seven external secretions. Conf Retroviruses Opportunistic Infect 2000;7:96.
17. Connell JA, Parry JV, Mortimer PP, Duncan RJS, McLean KA, Johnson AM, et al. Preliminary report: accurate assays for anti-HIV in urine. Lancet 1990;335:1366-9.
Recibido: 4 de enero de 2007. Aprobado: 30 de marzo de 2007.
Lic. Otto Cruz Sui. Laboratorio de Investigaciones del SIDA. Carretera de Jamaica y Autopista Nacional. Teléfono 047-862206. Correo electrónico: cicdc@infomed.sld.cu
1 Máster en Ciencias Bioquímicas. Licenciado en Biología. Investigador Auxiliar.
2 Máster en Ciencias Bioquímicas. Licenciada en Bioquímica. Investigadora Auxiliar.
3 Especialista de I Grado en Epidemiología. Investigadora Auxiliar.
4 Técnica Media en Análisis Químico.
5 Doctor en Ciencias. Especialista de II Grado en Microbiología. Investigador Auxiliar.