Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión On-line ISSN 1561-3054
Rev Cubana Med Trop v.63 n.2 Ciudad de la Habana mayo.-ago. 2011
ARTÍCULO ORIGINAL
Efecto del anticuerpo monoclonal 4B3 en la infección experimental por Cryptococcus neoformans
Effect of 4B3 monoclonal antibody on the experimental Cryptococcus neoformans infection
María Teresa Illnait-Zaragozí,I René Gato Armas,II Gerardo Félix Martínez Machín,III Anselmo Otero González,IV Jorge Sarracent Pérez,V Hermis Rodríguez Sánchez,VI Carlos Manuel Fernández Andreu,VII Iliana del Carmen Valdés HernándezVIII
IEspecialista de II Grado en Microbiología Médica. Máster en Bacteriología-Micología. Laboratorio de Micología, Instituto de Medicina Tropical "Pedro Kourí" (IPK). La Habana, Cuba.
IIEspecialista de I Grado en Microbiología Médica. Máster en Bacteriología-Micología. Laboratorio de Micología, IPK. La Habana, Cuba.
IIIEspecialista de II Grado en Microbiología Médica. Laboratorio de Micología, IPK. La Habana, Cuba.
IVDoctor en Ciencias. Centro de Estudios de Proteínas, Facultad de Biología, Universidad de La Habana. La Habana, Cuba.
VDoctor en Ciencias Biológicas. Laboratorio de Hibridomas, IPK. La Habana, Cuba.
VILicenciada en bioquímica. Master en Bacteriología-Micología. Laboratorio de Hibridomas, IPK. La Habana, Cuba.
VIIDoctor en Ciencias de la Salud. Laboratorio de Micología, IPK. La Habana, Cuba.
VIIILicenciada en Microbiología. Máster en Bacteriología-Micología. Laboratorio de Micología, IPK. La Habana, Cuba.
RESUMEN
Introducción: las frecuencias de recaídas y elevada letalidad de la criptococosis se mantienen altas, lo cual incentiva la búsqueda de nuevas estrategias terapéuticas.
Objetivos: evaluar el efecto del anticuerpo monoclonal 4B3 sobre la infección criptocócica en ratones BALB/c.
Métodos: se determinó la cinética de la concentración sérica del anticuerpo monoclonal para su administración intraperitoneal (500 µg), que fue medida por ELISA cuantitativo de doble anticuerpo. La capacidad protectora se observó mediante el registro de supervivencia de ratones BALB/c administrados con 500 µg de anticuerpo monoclonal 4B3 e inoculados con 2 x 102,2 células/mL de Cryptococcus neoformans, así como por evaluación de la diseminación de la levadura a los principales órganos diana. Se identificó el efecto del anticuerpo monoclonal 4B3 sobre la fagocitosis y lisis del microorganismo por células de la línea de macrófagos P338.D1.
Resultados: la dosis empleada fue suficiente para mantener valores séricos elevados del 4B3 (38 µg/mL) durante al menos 46 d. Se determinó que el 4B3 no confiere protección, lo cual potencia la diseminación del microorganismo y disminuye el tiempo de vida de los animales. El ensayo de fagocitosis mostró que el anticuerpo evaluado incrementa la actividad fagocítica de los macrófagos sin lograr un efecto fungicida.
Conclusiones: el anticuerpo monoclonal 4B3 estimula la fagocitosis de C. neoformans por macrófagos, pero sin efecto fungicida. Con ello favorece la diseminación de la levadura y disminuye el tiempo de vida de los ratones a la infección.
Palabra clave: Cryptococcus neoformans, anticuerpo monoclonal, protección.
ABSTRACT
Introduction: frequent relapses and high lethality of criptococcosis has encouraged the search for new therapeutic strategies.
Objectives: to evaluate the effect of the monoclonal antibody 4B3 on the cryptococcal infection in Balb/c mice.
Methods: the kinetics in serum concentration of the studied monoclonal antibody was determined for intraperitoneal administration (500 µg) by quantitative sandwich ELISA. In order to assess its protective capability, were administered 500 µg of 4B3 and innoculated 2 x 102.2 cells/mL of Cryptococcus neoformans. The survival of mice was recorded and the yeast dissemination to the main target organs was evaluated. Macrophages P338.D1 cell lines were used to measure the effect of the monoclonal antibody 4B3 on the phagocytosis and lysis of the microorganism.
Results: the used dose helped to keep high values (38 µg/m) of 4B3 in serum for at least 46 days. It was found that the monoclonal antibody does not give protection, which makes the microorganism dissemination possible, along with the reduction in the survival of mice. Finally, the phagocytosis test showed that 4B3 increased the phagocytic activity of macrophages without any fungicidal effect.
Conclusions: the monoclonal antibody 4B3 stimulates C. neoformans phagocytosis by macrophages without fungicidal effect, thus favoring yeast dissemination and decreasing the survival of mice due to cryptococcal infection
Key words: Cryptococcus neoformans, monoclonal antibody, protection.
INTRODUCCIÓN
Desde el descubrimiento de Cryptococcus neoformans por Sanfelice se han desarrollado innumerables estudios sobre esta levadura y la enfermedad que ocasiona, los cuales se ha intensificado a partir de la década de los ochenta del siglo pasado cuando pasó a ser una infección de mayor prevalencia con altas tasas de morbilidad y letalidad.1
A pesar de los avances en la terapia antifúngica, el elevado índice de muerte durante las infecciones por esta levadura permanece invariable entre 10 y 25 %, aun en los países de más alto desarrollo.2 Al menos un tercio de los pacientes que sobreviven, experimentan fallo terapéutico clínico y(o) micológico, lo que ha estimulado la búsqueda de nuevas alternativas como la inmunoterapia. Existen evidencias convincentes de que la inmunoterapia pasiva puede modificar el desarrollo de las infecciones criptococócicas en forma beneficiosa al hospedero.2
Diversos anticuerpos monoclonales (AcM) han sido licenciados para su uso clínico en la prevención del rechazo de órganos transplantados, en el tratamiento de las infecciones virales, el cáncer y otros. Asimismo, se ha demostrado que los AcM anti-glucuronoxilomanano (GXM), principal componente de la cápsula polisacarídica de esta levadura, promueven la opsonización, la fagocitosis e interfieren en la liberación de este polisacárido al disminuir sus niveles circulantes.3,4
En el Instituto "Pedro Kourí" (IPK) se obtuvo el AcM 4B3 de clase IgG1 con cadena ligera kappa, por inoculación de ratones Balb/c con GXM purificado.5,6 Este anticuerpo es capaz de reconocer el antígeno como parte de la estructura capsular íntegra de C. neoformans.7 El objetivo de este trabajo fue evaluar el efecto del AcM 4B3 sobre la infección criptocócica en ratones Balb/c.
MÉTODOS
Cepa: se empleó la cepa LMIPK 028 de C. neoformans ser. A, aislada de un paciente con sida, la cual ha sido ampliamente caracterizada en el laboratorio de micología del IPK.8
Inóculo: la cepa se cultivó en medio líquido de dextrosa Sabouraud a 37 ºC en agitación constante por 72-96 h, se centrifugó a 1 860 g durante 15 min y el sedimento fue lavado con NaCl 0,9 % (SSF). Finalmente se resuspendió en 0,5 mL de igual solución, ajustando la concentración celular en cámara de Neubauer a los valores deseados, como se especifica en cada experimento.
Animales: se utilizaron ratones Balb/c machos de entre 8 y 12 semanas de vida con 17 g de peso procedentes del Centro para la Producción de Animales de Laboratorio (CENPALAB), Cuba.
Cinética de las concentraciones séricas del AcM 4B3: se administró 500 µg del AcM 4B3 por vía intraperitoneal (ip) a 10 ratones. Se realizó extracción sanguínea a dos ratones cada vez a través del plexo retroorbitario cada 30 min las primeras 8 h y posteriormente los días 1, 2, 8, 17, 29, 37 y 46.3
Las concentraciones séricas del AcM en estudio se determinaron mediante ELISA directo tipo sandwich. La placa fue recubierta con anticuerpo policlonal de conejo anti-GXM durante toda la noche a 4 °C, se adicionó polisacárido purificado, se bloqueó con albúmina bovina fracción V a 1 % (Merck) y se incubó durante 1 h a 37 °C. Se evaluaron diluciones desde 1/500 (2 µg/mL) hasta 1/10 500 (0,09 µg/mL) del AcM 4B3 y diluciones seriadas al doble desde 1/100 hasta 1/800 de los controles positivo y negativo, así como los sueros en estudio. Se incubó 1 h a 37 °C, se lavó con solución salina-fosfato y se adicionó un conjugado anti-IgG de ratón peroxidasa (Amersham) 1/8 000 con suero fetal bovino 5 %. Después de incubar nuevamente en iguales condiciones se adicionó 1,2 ortofenilendiamina (Merck)/peróxido de hidrógeno (Sigma) y se detuvo la reacción a los 10 min con H2SO4 a 12,5 %. La lectura se realizó en lector Teknika a 492 nm. Los valores de densidad óptica (DO) de las diluciones del AcM se introdujeron en el programa Excel (Microsoft), para conformar una curva patrón que fue corregida a través de una línea de tendencia logarítmica. Sobre esta curva se hicieron coincidir los valores de DO de las muestras, que dio como resultado la concentración del AcM en estas.
Determinación de la capacidad protectora del AcM 4B3:
a) Supervivencia final: se emplearon 3 grupos de 10 ratones, a uno se le administró AcM 4B3 y los otros dos correspondieron a los controles. Los ratones se inocularon 24 h después con una dosis ip de 2 x 102,2 células de C. neoformans LMIPK 028 y se realizó observación diaria durante 60 d.
b) Carga fúngica en los principales órganos diana: se conformaron 3 grupos de 12 ratones cada uno, que recibieron reto con C. neoformans y AcM 4B3 o controles similares al ensayo anterior. Los días 7, 14 y 21 de la infección se sacrificaron 3 ratones de cada grupo para determinar el número de unidades formadoras de colonias por gramo de órgano (UFC/g) en cerebro, bazo y pulmón.
En ambos casos se aplicó un volumen de 0,5 mL ip y la cantidad de los anticuerpos monoclonales fue de 500 µg. Como controles se empleó SSF y el anticuerpo monoclonal irrelevante 4G3. Este último es un AcM anti-dengue 2, se purificó por similar procedimiento al AcM 4B3 y es de su misma clase e isotipo.9
Estudio del efecto del AcM 4B3 sobre la fagocitosis y lisis de C. neoformans por macrófagos murinos10
En los fondos de placas para cultivo celular de 24 pocillos (Costar), se colocaron cubreobjetos estériles y se recubrieron con células de la línea de macrófagos murinos P338.D1 en un volumen de 200 µL de medio RPMI-1640 (Hybri-Max). Después de incubar 30 min, se adicionó la cepa LMIPK 028 y AcM. Tras incubar 2 h, el medio de cultivo fue eliminado cuidadosamente, se extrajeron los cubreobjetos que se colocaron a 37 °C hasta secar. Las células se fijaron en metanol frío, teñidas con giemsa y observadas al microscopio (1 000x).
El índice de fagocitosis se calculó dividiendo el número de macrófagos con levaduras internalizadas o adheridas entre el número total de macrófagos por campo. Se visualizaron 8 campos por lámina y se promediaron los resultados de los duplicados de cada muestra.
Condiciones del ensayo: cantidad de células: 6 x 105 células/pozo (C. neoformans y macrófagos en proporción 1:1). Concentración final de AcM 4B3 y AcM 4G3: 20 µg/mL. Incubación: 37 °C en CO2 5 %. Controles: AcM 4G3 y SSF.
Para el examen de la acción fungicida de los macrófagos se utilizó una placa para cultivo celular de 96 pocillos (Costar). Se aplicaron las mismas concentraciones de células y anticuerpos que en el experimento anterior en un volumen final de 100 µL. Después de incubación durante 24 h, se realizó pipeteo vigoroso para desprender la totalidad de las células. Se les realizaron diluciones 1/1 000 y 1/10 000 al contenido de los pozos y se inoculó 10 µL en placas de agar dextrosa Sabouraud para conteo de las UFC.11 Los procedimientos se hicieron por duplicado.
Análisis estadístico: la supervivencia de los animales se analizó mediante la prueba de Kaplan-Meier y las diferencias entre los grupos por Log del rango. Para el resto de las variables en estudio se calcularon frecuencias absolutas y relativas y se realizó comparación de la media aritmética. En todos los casos se consideró significativo un valor de p< 0,05. Se utilizó el sistema estadístico NCSS 2004 (Number Cruncher Statistical Systems, Kaysville, Utah).
RESULTADOS
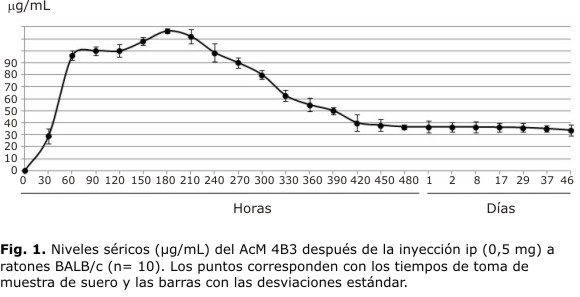
Cinética de las concentraciones séricas del AcM 4B3: se observó un rápido incremento de la concentración sérica del AcM 4B3 administrado por vía ip que alcanzó el pico máximo (119 µg/mL) a los 180 min. A partir de ese tiempo la concentración comenzó a disminuir hasta llegar a 38 µg/mL a los 480 min y se mantuvo con pocas variaciones hasta el día 46 (Fig. 1).
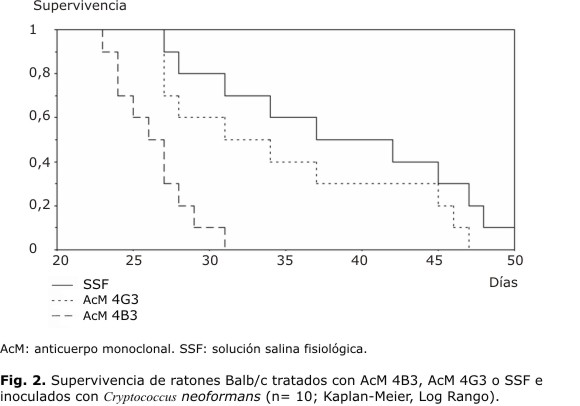
Determinación de la capacidad protectora del AcM 4B3: la administración de 500 µg de AcM 4B3 disminuyó el tiempo de supervivencia de los ratones infectados con C. neoformans al compararlos con los controles, lo cual fue estadísticamente significativo para una p< 0,05; no hubo diferencias entre AcM 4G3 y SSF (Kaplan-Meier log rango). En la figura 2 se observa que para el día 31 del experimento habían muerto todos los ratones a los que se le administró el AcM 4B3, mientras que en los grupos controles ese evento ocurrió más de 15 d después.
El conteo de UFC/g de tejido (tabla) no mostró evidencia de infección en el cerebro de los ratones de los grupos controles los días 7 y 14, sin embargo, los que recibieron el AcM 4B3 presentaron cifras elevadas desde el día 7. A los 21 d de infección ya había microorganismos en el cerebro de los tres grupos, aunque los animales tratados con el AcM en estudio, manifestaron cifras significativamente superiores (p< 0,05). Los pulmones de los ratones que recibieron AcM 4B3 mostraron conteos de UFC mayores que los grupos controles en los tres momentos analizados; esta diferencia fue estadísticamente significativa los días 7 y 21 (p< 0,05). La diseminación a bazo, fue elevada desde el primer día evaluado para los tres grupos de ratones y tuvo un comportamiento progresivo en el tiempo.
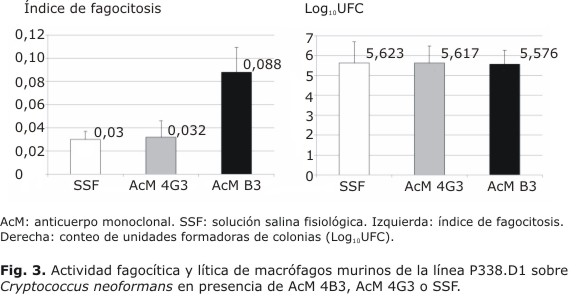
Estudio del efecto del AcM 4B3 sobre la fagocitosis y lisis de C. neoformans por macrófagos murinos: el índice de fagocitosis en el grupo con SSF fue de 0,03. Un valor similar mostraron aquellos que estuvieron en contacto con el AcM 4G3, sin embargo, en presencia del AcM 4B3 los macrófagos incrementaron la fagocitosis en casi 3 veces. Al determinar la acción fungicida se demostró que este último no promovió su incremento, porque las cifras de UFC no presentaron variaciones respecto a los controles (Fig. 3).
DISCUSIÓN
Estudios de protección con AcM anti-GXM han dado resultados divergentes. Algunos son capaces de incrementar el tiempo de supervivencia de ratones infectados, disminuir la multiplicación de la levadura en los tejidos, reducir los niveles séricos de polisacáridos e incluso modificar el desarrollo de la infección de forma favorable para el huésped. No obstante, el mecanismo de acción de tales AcM es multifactorial e involucra variados elementos de la respuesta inmune.12
Los componentes capsulares de C. neoformans son considerados la clave de sus determinantes de virulencia, lo que ha motivado su amplio uso en la obtención de AcM.13 Recientemente, Rodríguez y otros sugirieron que la estructura del polisacárido y consecuentemente sus funciones, varían de acuerdo con el método de purificación empleado en su obtención.14 Trabajos previos de caracterización del AcM 4B3 demostraron su capacidad de reconocer el GXM, ya sea en su forma purificada5 o como elemento de la cápsula íntegra.7
El estudio de cinética sérica del AcM 4B3 reveló un rápido y marcado incremento inicial de la concentración que demostró adecuada absorción por esa vía. El pico máximo, obtenido a los 180 min, correspondió con lo esperado para la dosis de AcM en relación con la volemia de los ratones. Llegado el momento en que empieza a agotarse el AcM del peritoneo, se registró una disminución en las concentraciones séricas como consecuencia de la redistribución hacia el espacio extravascular. Se llegó al equilibrio a los 480 min con 38 µg/mL, que se mantuvo con escasa variación hasta el final del experimento; tiempo incluso mayor al necesario para la observación de la infección experimental. La diferencia en la pendiente de la curva en sus porciones ascendente y descendente, sugiere mayor velocidad del paso del AcM del peritoneo al compartimiento vascular, que de este al espacio extravascular. Estos resultados concuerdan parcialmente con los de Lendvai y Casadevall quienes observaron el pico sérico máximo del AcM 18B7 a los 230 min, aunque solo registraron sus niveles hasta 240 min.15
Los resultados del estudio de la diseminación a los órganos coinciden con los del experimento de supervivencia en que el AcM 4B3 incrementa la infección criptocócica murina. Los reportes sobre la administración de AcMs anti-GXM a ratones inoculados con C. neoformans han mostrado variados resultados. Si bien algunos AcMs han sido protectores,2,16 otros, al igual que el AcM 4B3, han producido el efecto contrario, acelerando el desarrollo de la infección y disminuyendo el tiempo de vida de los ratones.2
No se conoce con exactitud el mecanismo mediante el cual algunos AcMs potencian la infección criptocócica.17 No obstante, se ha observado que los resultados de un experimento de protección pueden ser influenciados por diversas condiciones, algunas de ellas inherentes a la especificidad y el isotipo de los AcM como dos de las características más importantes que determinan la eficacia de los mismos.17 Estudios previos han demostrado que familias de AcM, con región variable idéntica pero de diferentes isotipos, difieren en su capacidad protectora, también que el incremento en sus cantidades en ocasiones provoca un efecto paradójico sobre la protección.18
Hasta el momento todas las cepas de C. neoformans aisladas en Cuba tanto de muestras clínicas humanas como ambientales que han sido caracterizadas pertenecen al serotipo A.19 Para el presente experimento se utilizó una cepa ampliamente estudiada en el laboratorio, a la que se había determinado la DL50 (1x102,2células) mediante el empleo del mismo modelo experimental.8 Para los estudios de protección se utilizó 2 veces la DL50, suponiendo que fuera potencialmente letal para 100 % de los ratones, sin ser demasiado elevada como para enmascarar un posible efecto beneficioso del AcM 4B3. Se administró 24 h antes del reto teniendo en cuenta otros trabajos similares.16,20 Este método tiene la ventaja de que se conoce exactamente la cantidad de microorganismos a los que va a enfrentar el AcM, pues la administración posterior al inóculo presupone un período en el cual la levadura puede multiplicarse fuera de la acción del anticuerpo problema. Por otra parte, los resultados del presente estudio de cinética indican que a ese tiempo ya existen concentraciones séricas elevadas del AcM administrado por vía ip.
Los resultados del presente trabajo coinciden con los de otros autores que encontraron incremento de la infección como consecuencia de la inmunización con una IgG1.18 No obstante, los AcM de esta clase han mostrado elevada capacidad protectora en múltiples estudios,2,11,17 lo cual sugiere que el isotipo no es la causa esencial del fallo del AcM 4B3 en la protección pasiva de los ratones infectados.
Los índices de fagocitosis están influidos por la relación efector/objetivo. Estudios previos en C. neoformans indican que los mejores resultados se obtienen cuando se enfrentan iguales cantidades del microorganismo y de macrófagos.10 Basados en esto, se utilizaron para el experimento suspensiones similares de macrófagos y levaduras, en número de 6 x 105 células/pozo, que son suficientes para crear una capa sobre los cubreobjetos sin aglomeración excesiva. Estos resultados concuerdan con los de Yuan y otros, quienes utilizaron un AcM de clase IgG3 que logró aumentar la capacidad de los macrófagos de fagocitar pero no la de provocar lisis de las levaduras.21 Presumiblemente, el AcM 4B3 incrementó la fagocitosis de los microorganismos por las células fagocíticas, que al ser incapaces de eliminarlos, solo lograron acelerar el desarrollo de la enfermedad al transportarlos hacia otros órganos causando mayor diseminación.
Los resultados finales de los ensayos in vivo señalan que la vía intraperitoneal permite la biodistribución rápida y eficiente del AcM 4B3, el cual logra altas concentraciones séricas durante un período relativamente largo; no obstante, este acelera la diseminación de C. neoformans y disminuye el tiempo de vida de los ratones Balb/c. Por su parte, los estudios in vitro demostraron que este AcM incrementa la fagocitosis de C. neoformans por los macrófagos de la línea P338.D1, pero no logra con ello un efecto fungicida. A pesar de los resultados adversos obtenidos, estos estudios han contribuido a una mejor comprensión de la patogenia de la infección criptocósica, al tiempo que no descartan el uso terapéutico de 4B3 porque su combinación con citocinas o drogas antifúngicas podrían potenciar su acción.
AGRADECIMIENTOS
A Maritza Pupo, Ricardo Marcet, Luis Morier y Virginia Capó del IPK por su valiosa colaboración en la realización de este trabajo.
REFERENCIAS BIBLIOGRÁFICAS
1. Lebeaux D, Lanternier F, Lefort A, Lecuit M, Lortholary O. Risk of fungal disease during systemic diseases. Presse Med. 2009;38:260-73.
2. Mukherjee J, Nussbaum G, Scharff MD, Casadevall A. Protective and nonprotective monoclonal antibodies to Cryptococcus neoformans originating from one B cell. J Exp Med. 1995;181:405-9.
3. Lendvai N, Qu XW, Hsueh W, Casadevall A. Mechanism for the isotype dependence of antibody-mediated toxicity in Cryptococcus neoformans-infected mice. J Immunol. 2000;164:4367-4.
4. Martínez LR, Moussai D, Casadevall A. Antibody to Cryptococcus neoformans glucuronoxylomannan inhibits the release of capsular antigen. Infect Immun. 2004;72:3674-9.
5. Rodríguez SH, Illnait MT, Otero A, Martínez GF. Anticuerpos monoclonales que reconocen al polisacárido capsular de Cryptococcus neoformans. Rev Cubana Med Trop. 2005;57:162-4.
6. Toraño GT, Rodríguez AW, Martínez MG. Evaluación del polisacárido capsular tipo específico de Cryptococcus neoformans como inmunógeno y antígeno control positivo. Rev Cubana Med Trop. 1998;50:207-8.
7. Gato AR, Martínez MG, Rodríguez SH, Otero A, Sarracent J, Illnait MT. Reconocimiento de células intactas de Cryptococcus neoformans por el AcM 4B3 antiglucuronoxilomanano. Rev Cubana Med Trop. 2006;58:156-61.
8. Illnait MT, Valdés IC, Fernández CM, Perurena M, Martínez MG. Determinación de la DL50 de una cepa de Cryptococcus neoformans utilizando diferentes vías de inoculación. Rev Panam Infectol. 2004;6:8-11.
9. Pupo-Antúnez M, Rodríguez H, Vázquez S, Vilaseca JC, Álvarez M, Otero A, et al. Monoclonal antibodies raised to the dengue-2 virus (Cuban: A15 strain) which recognize viral structural proteins. Hybridoma. 1997;16:347-53.
10. Mukherjee S, Feldmesser M, Casadevall A. J774 murine macrophage-like cell interactions with Cryptococcus neoformans in the presence and absence of opsonins. J Infect Dis. 1996;173:1222-31.
11. Mukherjee S, Lee SC, Casadevall A. Antibodies to Cryptococcus neoformans glucuronoxylomannan enhance antifungal activity of murine macrophages. Infect Immun. 1995;63:573-9.
12. Nakouzi A, Zhang T, Oscarson S, Casadevall A. The common Cryptococcus neoformans glucuronoxylomannan M2 motif elicits non-protective antibodies. Vaccine. 2009;27:3513-8.
13. Zaragoza O, Rodrígues ML, De Jesus M, Frases S, Dadachova E, Casadevall A. The capsule of the fungal pathogen Cryptococcus neoformans. Adv Appl Microbiol. 2009;68:133-216.
14. Rodrígues ML, Fonseca FL, Frases S, Casadevall A, Nimrichter L. The still obscure attributes of cryptococcal glucuronoxylomannan. Med Mycol. 2009;47:783-8.
15. Lendvai N, Casadevall A. Monoclonal antibody-mediated toxicity in Cryptococcus neoformans infection: mechanism and relationship to antibody isotype. J Infect Dis. 1999;180:791-801.
16. Mukherjee S, Lee S, Mukherjee J, Scharff MD, Casadevall A. Monoclonal antibodies to Cryptococcus neoformans capsular polysaccharide modify the course of intravenous infection in mice. Infect Immun. 1994;62:1079-88.
17. Zebedee SL, Koduri RK, Mukherjee J, Mukherjee S, Lee S, Sauer DF, et al. Mouse-human immunoglobulin G1 chimeric antibodies with activities against Cryptococcus neoformans. Antimicrob Agents Chemother. 1994;38:1507-14.
18. Torres M, Casadevall A. The immunoglobulin constant region contributes to affinity and specificity. Trends Immnunol. 2008;29:91-7.
19. Illnait MT, Martínez GF, Fernández CM, Boekhout T, Meis JF, Klaassen CH. Microsatellite typing of clinical and environmental Cryptococcus neoformans var. grubii isolates from Cuba shows multiple genetic lineages. PLoS ONE. 2010;5:e9124. doi:10.1371.
20. Duro RM, Thorkildson P, Kozel TR. Contribution of epitope specificity to the binding of monoclonal antibodies to the capsule of Cryptococcus neoformans and the soluble form of its major polysaccharide, glucuronoxylomannan. Clin Diagn Lab Immunol. 2003;10:252-8.
21. Yuan R, Casadevall A, Spira G, Scharff MD. Isotype switching from IgG3 to IgG1 converts a nonprotective murine antibody to Cryptococcus neoformans into a protective antibody. J Immunol 1995; 154:1810-6.
Recibido: 18 de febrero de 2011.
Aprobado: 28 de marzo de 2011.
María Teresa Illnait-Zaragozí. Instituto de Medicina Tropical "Pedro Kourí". Autopista Novia del Mediodía Km 6½, AP 601, Marianao 13. La Habana, Cuba. Fax: (53 7) 2 55 35 24. Correo electrónico: mtilnait@ipk.sld.cu