Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión impresa ISSN 0375-0760
Rev Cubana Med Trop vol.66 no.3 Ciudad de la Habana sep.-dic. 2014
ARTÍCULO ORIGINAL
Resistencia antimicrobiana en aislamientos clínicos de Klebsiella spp. y producción de B-lactamasas de espectro extendido en hospitales de Cuba
Antimicrobial resistance observed in clinical Klebsiella spp isolates and extended spectrum B lactamases in Cuban hospitals
Dra. Dianelys Quiñones Pérez,I Dra. Yenisel Carmona Cartaya,I MSc. Arnaldo Zayas Illas,II Téc. Miriam Abreu Capote,I Lic. Daniel Salazar Rodriguez,I Lic. Sandra García Giro,III Dra. Dalia Torres Tamayo,IV Nobumichi Kobayashi,V Aránzazu Valverde de Francisco,VI Dra. Rosa del Campo Moreno VI
I Instituto de Medicina Tropical "Pedro Kourí". La Habana, Cuba.
II Hospital "Juan Bruno Zayas". Santiago de Cuba, Cuba.
III Hospital "Vladimir I. Lenin". Holguín, Cuba.
IV Hospital Pediátrico "Octavio de La Concepción y la Pedraja". Holguín, Cuba.
V Departamento de Higiene. Universidad de Sapporo, Japón.
VI Hospital "Ramón y Cajal". Madrid, España.
RESUMEN
Introducción: el género Klebsiella causa brotes hospitalarios, por cepas multidrogorresistentes en diferentes continentes y conlleva a un aumento en la morbimortalidad.
Objetivos: identificar las especies de Klebsiella causantes de infecciones en hospitales cubanos, determinar la procedencia de los aislamientos según el servicio, y la susceptibilidad antimicrobiana, conocer la prevalencia de aislamientos productores de ß-lactamasas de espectro extendido (BLEE), y tipos, así como la susceptibilidad de los mismos a diferentes antimicrobianos de interés terapéutico.
Métodos: se realizó un estudio descriptivo en 448 aislamientos de Klebsiella spp. recibidos en el Laboratorio Nacional de Referencia de Microbiología del IPK (LRNM/IPK) procedentes de 40 hospitales de 12 provincias del país durante el período de 2010 a 2012. La identificación de las especies se realizó mediante pruebas bioquímicas convencionales y por la técnica de Espectrometría de masas MS MALDI-TOF. Se determinó la susceptibilidad a 15 antimicrobianos mediante el método E-test y la producción de BLEE mediante el método de discos combinados según las recomendaciones del Instituto de Estándares Clínicos y de Laboratorio. Los genes blaESBL se determinaron mediante la reacción en cadena de la polimerasa según protocolo descrito previamente.
Resultados: la especie prevalente fue Klebsiella pneumoniae (95,1 %), seguida por K. oxytoca (4,5 %) y K. ozaenae (0,4 %). Los aislamientos procedieron, principalmente, de los servicios de Unidades de Cuidados Intensivos (26,3 %), cirugía (22 %) y neonatología (13 %). La mayor resistencia se observó para las cefalosporinas (48-52 %), trimetoprim-sulfametoxazol (49 %), gentamicina (43 %), ácido nalidíxico (38 %) y tetraciclina (34 %). El 52 % de los aislamientos fueron productores de BLEE y prevaleció la enzima CTX-M (82 %) y la TEM (70 %).
Conclusiones: se evidencia la repercusión clínica de Klebsiella spp. en hospitales cubanos con elevada resistencia a diferentes antimicrobianos. La producción de BLEE es un mecanismo de resistencia importante en esta bacteria en las que los carbapenémicos, la piperacilina-tazobactam, la colistina, y la tigeciclina juegan un rol terapéutico importante.
Palabras clave: BLEE, resistencia antimicrobiana, Klebsiella spp.
ABSTRACT
Introduction: the Klebsiella genus gives rise to many hospital outbreaks due to multi-drug-resistant strains on different continents and leads to increased morbidity and mortality.
Objectives: to identify the Klebsiella species causing infections in Cuban hospitals, to determine the origin of isolates per service, their antimicrobial susceptibility and, to determine the production and type of extended-spectrum ß-lactamases (ESBLs) and the susceptibility of these isolations to several antimicrobials of therapeutic interest.
Methods: a descriptive study was conducted on 448 Klebsiella spp. Isolates that were received in the national reference microbiology laboratory of "Pedro Kouri" Institute of Tropical Medicine from 40 hospitals located in 12 Cuban provinces during the 2010-2012 period. Species identification was based on conventional biochemical tests and mass spectrometry technique called MS MALDI-TOF. The susceptibility to 15 antimicrobials and the extended spectrum ß-lactamase production were determined by the E-test method and by the combined disks method, respectively, according to recommendations of the Institute of Clinical and Laboratory Standards. The polymerase chain reaction made it possible the detection of BlaESBL genes as indicated in the previously described protocol.
Results: Klebsiella pneumoniae (95.4 %) was the prevalent species, followed by K. oxytoca (4.1%), and K. ozaenae (0.5 %). The isolates were mainly from the intensive care units (26.3 %), surgery (22 %), and neonatology (13%) services. The highest resistance rate was observed for cephalosporins (48-52 %), trimethoprim-sulfamethoxazole (49 %), gentamicin (43 %), nalidixic acid (38 %), and tetracycline (34 %). Fifty-two percent of the isolates were extended spectrum ß-lactamase producers, with CTX-M (82 %) and TEM (70 %) enzymes prevailing.
Conclusions: This study shows the clinical impact of Klebsiella spp in Cuban hospitals, which is highly resistant to different antimicrobials. The production of extended spectrum ß-lactamases provides a significant resistance mechanism in Klebsiella in which carbapenems, piperacillin-tazobactam, cholistin and tigecycline play an important therapeutic role.
Key words: Extended-spectrum ß-lactamases, antimicrobial resistance, Klebsiella spp.
INTRODUCCIÓN
La resistencia a los antimicrobianos en bacterias Gram negativas de importancia clínica, es un problema creciente, y en los últimos años sobrepasa la barrera nosocomial para afectar también a la comunidad.1
Existe una diseminación mundial de clones de bacterias y de genes que confieren resistencia a los antimicrobianos, entre los que el género Klebsiella, ocupa un lugar primordial.2
Klebsiella pneumoniae, constituye un desafío en las instituciones de salud al causar brotes hospitalarios en diferentes continentes con aumento en la morbimortalidad. En Latinoamérica se plantea que el 30 % de las neumonías son causadas por K. pneumoniae.3
A principios de la década del 80 comenzaron a reportarse los primeros aislamientos de Klebsiella spp. resistentes a las cefalosporinas de tercera generación, debido a la producción de ß-lactamasas de espectro extendido (BLEE).4 Esta situación constituyó el primer paso para el ingreso de esta bacteria al grupo de las multirresistentes.5
En 1996 se reporta el primer aislamiento de K. pneumoniae resistente a los carbapenémicos.5 Esto propició el incremento del uso de las polimixinas y la tigeciclina, antimicrobianos que ya son ineficaces frente a cepas emergentes pandrogorresistentes.6
En Cuba, Klebsiella spp. constituye un importante patógeno nosocomial, según notifica la Dirección Nacional de Epidemiología del MINSAP.7 Estudios puntuales desarrollados en algunas provincias como Ciego de Ávila y La Habana evidencian un porcentaje elevado de cepas productoras de BLEE;8,9 sin embargo, no se han desarrollado estudios que incluyan aislamientos de diversos hospitales del país y que permitan mostrar resultados con un valor epidemiológico mayor. Es por ello, que en el año 2010 el Laboratorio Nacional de Referencia de Microbiología del Instituto de Medicina Tropical “Pedro Kourí” (LNRM/IPK) se propone crear una colección de cultivos de Klebsiella aisladas en diferentes hospitales del país para, de forma progresiva, ir estableciendo una vigilancia de este patógeno. Este trabajo incluye la caracterización de los primeros 448 aislamientos de Klebsiella que se enviaron al LNRM-IPK en los dos primeros años de trabajo con el objetivo de identificar las especies de Klebsiella que causan infecciones en hospitales cubanos, determinar la procedencia de los aislamientos según el servicio, determinar la susceptibilidad antimicrobiana, así como conocer la prevalencia de aislamientos productores de BLEE, sus tipos y la susceptibilidad de dichos aislamientos a diferentes antimicrobianos de interés terapéutico.
MÉTODOS
Se realizó un estudio descriptivo en el que se incluyeron 448 aislamientos pertenecientes al género Klebsiella recibidos en el LNRM/IPK entre enero de 2010 y agosto 2012. Los aislamientos procedieron de 40 hospitales de 12 provincias del país (Pinar del Río, 0,4 %; La Habana, 43 %; Mayabeque,0,2 %; Matanzas,1,6 %; Villa Clara, 2,7 %; Cienfuegos,0,2 %; Ciego de Avila, 0,4 %; Camagüey,1,1 %; Holguín, 40 %; Guantánamo, 0,2 %; Granma, 0,2 %; Santiago de Cuba, 10,3 %) y se recuperaron, principalmente, de: sangre (24,3 %); orina (14 %); secreción bronquial (11,4 %); piel (11 %) y secreción de herida quirúrgica (7,4 %).
La identificación de especies se realizó mediante pruebas bioquímicas por el método convencional.10 Esta se corroboró por la técnica de Espectrometrıa de masas MS MALDI-TOF (Bruker Daltonics, Bremen, Germany) en el Laboratorio de Microbiología del “Hospital Ramón y Cajal", España y se aplicó en 100 de los aislamientos caracterizados teniendo en cuenta la inclusión de una representación de cada especie identificada las que se seleccionaron al azar.
Susceptibilidad antimicrobiana
Se determinó la concentración inhibitoria mínima (CIM) mediante la prueba de Épsilon-test (E-test, por sus siglas en Inglés) usando tiras de E-test (Casa comercial Liofilchen) a: piperacilina-tazobactan, cefuroxima, cefotaxima, ceftazidima, cefoxitin, aztreonam, imipenem, meropenem, gentamicina, amikacina, ácido nalidíxico, ciprofloxacina, tetraciclina, colistina y trimetoprim-sulfametoxazol, según las recomendaciones del Instituto de Estándares Clínicos y de Laboratorio (CLSI, por sus siglas en Inglés).11 Se utilizó E. coli ATCC 25922 como cepa control.
Detección de Betalactamasas de Espectro Extendido
La confirmación del fenotipo productor de BLEE se llevó a cabo en todas las cepas que mostraron sensibilidad disminuida o resistencia a las cefalosporinas y al aztreonam mediante el método de discos combinados: cefotaxima (30 mg) y cefotaxima/ácido clavulánico (30/10 mg) y ceftazidima (30 mg), ceftazidima- ácido clavulánico (30/10 mg) (Oxoid, Ltd.). Se utilizó K. pneumoniae ATCC 700603 como cepa control positivo productora de BLEE y E coli ATCC 25922 como cepa control negativo.
Determinación de los tipos de BLEE (genes bla)
La presencia de los genes bla: bla(TEM), bla(SHV) y bla(CTX-M)) se determinó en las primeras 94 cepas productoras de BLEE detectadas en el laboratorio por cuestiones de factibilidad y se realizó en el Laboratorio de Microbiología del Hospital "Ramón y Cajal", España. Para ello se desarrolló la técnica de la Reacción en Cadena de la Polimerasa (PCR, por sus siglas en Inglés) múltiple y se usaron cebadores específicos según protocolos reportados previamente.12 La visualización de los fragmentos amplificados se llevó a cabo mediante electroforesis en gel de agarosa al 1 %.
Determinación de la concentración inhibitoria mínima (CIM) a otros antimicrobianos de interés terapéutico en cepas de Klebsiella spp. productoras de BLEE
Mediante el sistema automatizado Vitek 2 compact (bioMèrieux, Francia) utilizando la tarjeta AST-N059 (según los procedimientos del fabricante) se determinó la CIM a otros antimicrobianos de interés terapéutico frente a cepas de Klebsiella spp. productoras de BLEE. Esta determinación se llevó a cabo en las primeras 94 cepas identificadas como productoras de BLEE por factibilidad de recursos. Los antimicrobianos evaluados fueron: amoxicilina/ácido clavulánico, piperacilina/tazobactan, tobramicina, netilmicina, levofloxacina, minociclina y tigeciclina.
Análisis estadístico
Los resultados obtenidos se procesaron mediante los programas Microsoft Excel 2007 y Microsoft Access 2007. Se utilizaron medidas de estadística descriptiva como la frecuencia y el porcentaje para el análisis de los resultados los que se expresaron en dos tablas.
RESULTADOS
Se caracterizaron 448 aislamientos de Klebsiella spp. causantes de infecciones en diferentes áreas geográficas del país. Klebsiella pneumoniae fue la especie más prevalente (95,1 %), seguida por K. oxytoca (4,5 %) y K. ozaenae (0,4 %).
Del total de aislamientos, 71 % procedieron de pacientes hospitalizados y 29 %, de la comunidad los cuales no tuvieron ingreso hospitalario durante el último año por lo que se consideraron aislamientos comunitarios.
Las unidades de cuidados intensivos (UCIs), cirugía, y neonatología aportaron el mayor número de aislamientos (26,3 %, 22 % y 13 %), respectivamente.
En relación a los estudio de susceptibilidad antimicrobiana, en la tabla 1 se muestra la susceptibilidad de los aislamientos de Klebsiella frente a los diferentes antimicrobianos evaluados y se aprecian porcentajes elevados de resistencia para las cefalosporinas (48-52 %), antibióticos de elección en las infecciones severas por este género. Además, como hallazgo alarmante se puede observar, aunque en muy bajo porcentaje, aislamientos resistentes a los carbapenémicos.
Los niveles de resistencia obtenidos para la gentamicina y la amikacina fueron de 43 y 21 %, respectivamente. También se observó resistencia elevada para la ciprofloxacina (26 %), el ácido nalidíxico (38 %), la tetraciclina (34 %) y el trimetoprim/sulfametoxazol (49 %).
El 13 % de los aislamientos (56/448) fueron resistentes a la colistina y dos de ellos mostraron resistencia simultánea a los carbapenémicos.
El 51,5 % (231/448) de los aislamientos se confirmaron fenotípicamente productores de BLEE. De ellos, el 87 % (201/231) procedía de muestras de pacientes ingresados y el 13 % (30/231) de la comunidad.
Los determinantes genéticos detectados en los 94 aislamientos productores de BLEE seleccionados fueron: gen blaCTX-M (82 %), genblaTEM (70,4 %) y el gen blaSHV (29,6 %) (figura). Para el 31 % y 21 % de los aislamientos portadores del gen blaCTX-M se observó amplificación también para los genes blaSHV y blaTEM, respectivamente.
Línea 1: marcador de peso molecular; línea 2 control negativo; línea 3: amplificado blaSHV; línea 4-5: resultados negativos; línea 6: amplificado blaSHV y blaCTX-M; línea 7,9-10: amplificado blaSHV; línea 8: control positivo; líneas 11-13: amplificado blaSHV, blaCTX-M y blaTEM; línea 14: blaCTX-M y blaTEM.
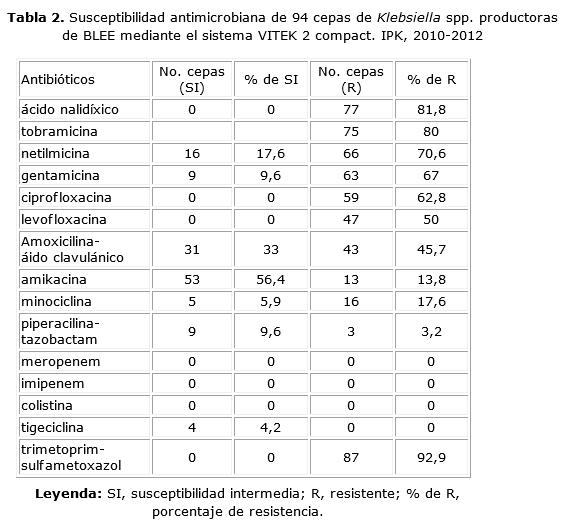
En la tabla 2 se observa la susceptibilidad de 94 aislamientos productores de BLEE a diferentes antimicrobianos.
Se observaron diferentes niveles de resistencia para la combinación de betalactámicos con inhibidores de betalactamasa, esta resultó alarmante para la amoxicilina/ácido clavulánico (45,7 %) mientras que para la piperacilina-tazobactan fue de 3,2 % (CIM ³128 mg/mL). No obstante, para este antibiótico se obtuvo una sensibilidad intermedia en el 9,6 % de las cepas, con predominio de CIM=64 mg/mL, concentración previa al punto de corte de criterio de resistencia.
Para los aminoglucósidos, la resistencia varió entre 13 % y 80,4 %. El nivel más bajo se encontró en amikacina, aunque un porcentaje alto de estas cepas (56,4 %) mostraron sensibilidad intermedia a dicho aminoglucósido.
En relación a las quinolonas, la resistencia se encontró entre 50 % y 81 % y la levofloxacina fue la de mayor actividad in vitro. Las cepas no mostraron resistencia a tigeciclina, aunque se debe señalar que el 4 % mostró sensibilidad intermedia con una CIM=4 mg/mL.
DISCUSIÓN
El género Klebsiella por su frecuencia de aislamiento y por los mecanismos patogénicos que puede presentar se considera de gran importancia en la etiología de infecciones asociadas a cuidados de salud, ya sea en instituciones hospitalarias o en la comunidad.13
Klebsiella pneumoniae representó en este estudio la especie más frecuente en correspondencia con la literatura internacional.14-16 Esto pudiera deberse a su capacidad para resistir a la desecación en el medio y sobrevivir en este debido a su cápsula hidrofílica, la presencia de adhesinas y fimbrias que le permiten adherirse a las superficies.17,18
Klebsiella oxytoca y K. ozaenae constituyeron especies de menor importancia clínica por su baja frecuencia de aislamiento en contraposición con los porcentajes elevados, por ejemplo, de K. oxytoca que se notifican en Brasil (15 %),14 Estados Unidos (19,8 %)16 y en Colombia (32,3 %).18 En relación con K. ozaenae, esta se reporta en diferentes estudios en frecuencia menor al 1 %.16,19
El género Klebsiella, por sus características especiales, está bien adaptado al medio hospitalario ya que puede sobrevivir más que otras especies en las superficies o en las manos del personal de salud, lo que facilita las infecciones cruzadas dentro de un hospital.20 Este hecho pudiera justificar la elevada prevalencia de Klebsiella spp. en pacientes hospitalizados.15
Las UCI, cirugía y neonatología aportaron el mayor número de aislamientos, lo que concuerda con el reporte de Valverde y colaboradores en el 2008, en España, quienes notifican mayor frecuencia de aislamientos de K. pneumoniae en los servicios de cirugía y UCI con 25 y 31 %, respectivamente.21 En Colombia, en un estudio multicéntrico relacionado con aislamientos obtenidos en 13 hospitales de Medellín durante los años 2007-2008, se evidenció que los pacientes hospitalizados en las UCI presentaron mayor riesgo de desarrollar infección por K. pneumoniae con una prevalencia de 14,8 %.22 Dicha bacteria presenta una mayor diseminación en UCI y en unidades de neonatos, donde los pacientes tienen mayor riesgo para adquirir microorganismos multirresistentes los que están sometidos a diversas manipulaciones y a una mayor presión antibiótica aumentando el riesgo de selección de cepas resistentes y la presión de colonización en dichas unidades.23 No obstante, se debe tener en cuenta que Klebsiella spp. también es un patógeno importante en la comunidad lo que se constató en este trabajo, en el que el 29 % de los aislamientos fueron de origen comunitario. Porcentajes similares se notifican en Irán (20,2 %)24 y España (30,5 %).21 Alves en el 2006 en Brasil reporta un porcentaje superior (51 %) de aislamientos de Klebsiella procedentes de pacientes no hospitalizados.14
La contribución del laboratorio de microbiología en el monitoreo de la susceptibilidad antimicrobiana de bacterias patógenas es crucial para la elección de terapias empíricas apropiadas y evaluar políticas de uso de los antimicrobianos especialmente en la actualidad en que las terapias de elección frente a los Gram negativos son cada vez más escasas.25
En la presente investigación se demuestran altos porcentajes de resistencia a los antimicrobianos entre aislamientos de Klebsiella spp. Una gran preocupación suscita la elevada resistencia detectada frente a las cefalosporinas concordante con estudios puntuales desarrollados en algunos hospitales cubanos8, 26 lo que evidencia que la resistencia frente a estos antibióticos es un problema en Cuba.
La producción de BLEE constituye el mecanismo más frecuente que confiere resistencia a las cefalosporinas y a otros betalactámicos, con excepción de los carbapenémicos, en el género Klebsiella27 y así lo demuestra este trabajo. Además, la prevalencia elevada de cepas productoras de BLEE en el presente estudio es concordante con lo comunicado en dos estudios realizados en hospitales de La Habana en los últimos años (48,2 %- 53 % de Klebsiella spp. productoras de BLEEs).8,26
La distribución de este tipo de cepas es mundial con una mayor prevalencia en América Latina (45 %) el Pacífico este (25 %) y Europa (20 %)28 y no es un hecho exclusivo del nosocomio, sino también se aprecia en la comunidad, como lo demuestra esta investigación y evidencia la variabilidad epidemiológica de este fenotipo de resistencia.
Se observó también una variabilidad genotípica en los tipos de BLEE al detectar los tres genes bla investigados. Aunque inicialmente las enzimas TEM y SHV eran las más prevalentes y CTX-M parecía limitada a determinadas áreas geográficas a nivel mundial en la década de 1990, hoy se describe una emergencia global de esta última enzima.29 Nuestros resultados de ratifican dicha situación ya que la enzima CTX-M fue la más prevalente entre los aislamientos cubanos y se detectó tanto en el hospital como en la comunidad.
Los genes bla que codifican para la producción de BLEE, incluyendo al más difundido entre ellos (el gen blaCTX-M-15) se encuentran en casetes genéticos, mediados por plásmidos, que portan otros determinantes de resistencia para varios antimicrobianos (aminoglucósidos, quinolonas, tetraciclina y trimetoprim-sulfametoxazol), lo que propicia el fenómeno de corresistencia y revela la necesidad de nuevas opciones terapéuticas.30 Este hecho podría ser la causa de la baja susceptibilidad de estas cepas productoras de BLEE frente a diferentes familias de antimicrobianos como que se observó en la tabla 2.
La combinación de varios mecanismos de resistencia condiciona que muchas cepas productoras de BLEE sean resistentes a las combinaciones de betalactámicos con inhibidores de betalactamasas, como amoxicilina/ácido clavulánico o piperacilina-tazobactam. Internacionalmente estos porcentajes de resistencia son variables. Se plantea que algunas de estas diferencias se deban, más allá de mecanismos adicionales, al propio tipo de BLEE. Por ejemplo, las enzimas de la familia CTX-M se suelen inhibir más fácilmente con tazobactam que con ácido clavulánico, y por ello, en este grupo concreto las tasas de resistencia a piperacilina-tazobactam suelen ser menores que las de amoxicilina-ácido clavulánico3 por lo que consideramos que la mejor actividad in vitro de la piperacilina-tazobactam frente a las cepas productoras de BLEE estudiadas pueda deberse a que la mayoría de ellas resultó del tipo CTX-M.
Los datos sobre la actividad de varios antimicrobianos contra Klebsiella productoras de BLEE muestran que, la combinación de piperacilina-tazobactam, la minociclina, los carbapenémicos, la colistina y la tigeciclina son antibióticos potencialmente activos contras estas cepas. En cambio, los aminoglucósidos y las fluoroquinolonas no tuvieron buena actividad, lo que pudiera corresponderse con el fenómeno de corresistencia que se comentó anteriormente.
La resistencia a carbapenémicos en la actualidad constituye una emergencia por la aparición y diseminación de K. pneumoniae carbapenemasa KPC y la más reciente metalobetalactamasa NDM-1.31
Aunque la circulación de cepas de K. pneumoniae resistente a los carbapenémicos constituye una emergencia en Cuba, el porcentaje bajo de resistencia, revela la importancia de esta familia de antimicrobianos como tratamiento de elección para las infecciones causadas por Klebsiella spp., principalmente, productoras de BLEE. Teniendo en cuenta la elevada prevalencia de estos aislamientos se avizora un incremento del consumo de los carbapenémicos en Cuba, lo que podría suponer un incremento de la resistencia a los mismos, además de una presión selectiva sobre bacilos Gram negativos no fermentadores como: Acinetobacter baumannii, Stenotrophomonas spp. y Pseudomonas spp.
La resistencia simultánea a múltiples antimicrobianos es una preocupación en el género Klebsiella, que es producto de la combinación de mecanismos, algunos de ellos inherentes a la especie y otros adquiridos mediante elementos genéticos móviles.32 Los resultados del presente trabajo ratifican el fenómeno de la multidrogorresistencia en el género Klebsiella. Esto unido a lo ya notificado anteriormente en La Habana hace pensar que el fenómeno de la MDR es una amenaza en los hospitales cubanos.
Nuestros resultados evidencian que las infecciones por K. pneumoniae y principalmente por cepas productoras de BLEE, es un problema en hospitales del país y que, la terapia de elección frente a las infecciones graves por este patógeno podría fracasar, si en las instituciones de salud no se detecta precozmente este fenotipo de resistencia y otros emergentes para orientar un tratamiento adecuado. Por lo tanto, se hace necesario la implementación de una vigilancia clínica, epidemiológica y microbiológica, de alcance nacional, del género Klebsiella. Esto demanda el perfeccionamiento de un trabajo multidisciplinario de autoridades de salud, el personal del LNRM/IPK, microbiólogos de la red de laboratorios del país, miembros del comité de epidemiología hospitalaria y fármacoterapéutico de los diferentes hospitales y personal médico de los mismos.
AGRADECIMIENTOS
A todo el personal de los Laboratorios de Microbiología de la red nacional del país y de los Centros provinciales de Higiene y Epidemiología (CPHE) que contribuyen con la vigilancia de Klebsiella en Cuba.
REFERENCIAS BIBLIOGRÁFICAS
1. Martínez-Martínez L, Calvo J. El problema creciente de la resistencia antibiótica en bacilos gramnegativos. Rev Enferm Infecc y Microbiol Clin. 2010;28(2):25-31.
2. Cars O, Hober LD, Murria M, Norberg O, Sivaraman S. Meeting the challenge of antibiotic resistance. Br Med J. 2008;337:726-28.
3. Paterson DL, Bonomo RB. Extended-spectrum beta-lactamases: a clinical update. Clin Microbiol Rev. 2005;18:657-86.
4. Kliebe C, Nies B, Meyer J, Tolxdorff–Neutzling RM, Wiedemann B. Evolution of plasmid–coded resistance to broad–spectrum cephalosporins. Antimicrob Agents Chemother. 1985;28:302-7.
5. Senda K, Arakawa Y, Cichiyama S, Nakashima K, Ito H, Ohsuka S. PCR detection of metallo–ß–lactamase gene (blaIMP) in gram–negative rods resistant to broad– spectrum ß–lactams. J Clin Microbiol. 1996;34:2909-13.
6. Elemam A, Rahimian J, Mandell W. Infection with panresistant Klebsiella pneumoniae: a report of 2 cases and a brief review of the literature. Clin Infect Dis. 2009;9:271-4.
7. Programa Nacional de Prevención y Control de las Infecciones Intrahospitalarias. La Habana: MINSAP;2009.
8. Hernández W, Ramos A, Nodarse R, Padrón A, De Armas E. Resistencia bacteriana en las bacterias productoras de betalactamasas extendidas (BLEE). Rev Cub Med Int Emerg. 2006;5(1):256-64.
9. Pérez F, Camejo l, Rojas E. Comportamiento de la resistencia antimicrobiana de gérmenes aislados en heridas por quemaduras. Rev Cubana Cir. 2009;48(3):35-40.
10. Abbott S. Klebsiella, Enterobacter, Citrobacter and Serratia. En: Murray PR, editor. Manual of clinical Microbiology. 9na ed. Washington, DC: ASM Press; 2007. p. 475-82.
11. Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing. CLSI document M100-S21. Table 2A. Enterobacteraceae. M02-M07. Wayne (PA): Clinical and Laboratory Standards Institute; January, 2011.
12. Valverde A, Coque T, Sánchez-Moreno M, Rollán A, Baquero F, Cantón R. Dramatic increase in prevalence of fecal carriage of extended-spectrum beta-lactamase-producing Enterobacteriaceae during non outbreak situations in Spain J. Clin. Microbiol. 2004;42:4769-75.
13. López JM, Echeverri LM. K. pneumoniae: ¿la nueva ''superbacteria''? Patogenicidad, epidemiología y mecanismos de resistencia. IATREIA. 2009 [citado el 23 de enero 2011];23(2):157-165. Disponible en: http://www.redalyc.org/src/inicio/ArtPdfRed.jsp?iCve=180519015007.
14. Alves MS. Identification of clinical isolates of indole-positive and indole-negative Klebsiella spp. J Clin Microbiol. 2006;44(10):3640-6.
15. Mantilla JR, Barreto E, Reguero MT, Veranda DA. Identificación por PCR-SSCP de genes de cefotaximasas en aislamientos hospitalarios de Enterobacteriaceae. Rev Colombiana Biotecnol. 2009;11(2):55-7.
16. Wener KM, Schechner V, Gold HS, Wright SB, Carmel Y. Treatment with fluoroquinolones or with β-Lactam–β-Lactamase inhibitor combinations is a risk factor for isolation of extended-spectrum-β-Lactamase-producing Klebsiella species in hospitalized patients. Antimicrobial Agents Chemother. 2010;54(5):2010-6.
17. Gupta A, Della-Latta P, Todd B, San Gabriel P, Haas J, Fann Wu, et al. Outbreak of extended-spectrum beta-lactamase–producing Klebsiella pneumoniae in a neonatal intensive care unit linked to artificial nails. Infect Control Hosp Epidemiol. 2004; 25(3):210-5.
18. Sahly H, Navon-Venezia S, Roesler L, Hay A, Carmeli Y, Podschun R, et al. Extended-spectrum B-Lactamase production is associated with an increase in cell invasion and expression of fimbrial adhesins in Klebsiella pneumoniae. Antimicrob Agents Chemother. 2008;52(9):3029-34.
19. Riser E, Noone P, Howard FM. Epidemiological study of Klebsiella infection in the special care baby unit of a London hospital. J Clin Pathol. 1980;33(4):400-7.
20. Pérez-Morenoa PM, Centelles-Serranoa MJ, Cortell-Ortolá M. Molecular epidemiology and resistance mechanisms involved in reduced susceptibility to amoxicillin/clavulanic acid in Klebsiella pneumoniae isolates from a chronic care centre. Int J of Antimicrob Agents. 2011;37:462-6.
21. Valverde A. Complex molecular epidemiology of extended-spectrum b-lactamases in Klebsiella pneumoniae: a long-term perspective from a single institution in Madrid. J Antimicrob Chemother. 2008;61:64-72.
22. Grupo para el Estudio de la Resistencia a Antibióticos en Medellin (GERMEN). Perfiles de sensibilidad de Klebsiella pneumoniae. Datos obtenidos en los años 2007 y 2008 de 13 instituciones hospitalarias del Área Metropolitana del valle de Aburrá. Medellín; 2009 [citado 15 de septiembre de 2009]. Disponible en: http://www.scielo.unal.edu.co/www.grupogermen.org/pdf/klebsiella.pdf.
23. Laurent C, Rodriguez-Villalobos H, Rost F, Strale H, Vincent JL. Intensive care unit outbreak of extended-spectrum beta-lactamase producing Klebsiella pneumoniae controlled by cohorting patients and reinforcing infection control measures. Infect Control Hosp Epidemiol. 2008;29:517-24.
24. Feizabadi P. Genetic characterization of ESBL producing Klebsiella pneumoniae. J Infect Dev Ctries. 2010;4(10):609-15.
25. Rodríguez-Baño J, Pascual A. Microorganismos multirresistentes, ¿adquisición nosocomial o comunitaria? Enferm Infecc Microbiol Clin. 2004;22:505-6.
26. Suarez B. Detección de fenotipos de resistencia en aislamientos clínicos de Klebsiella pneumoniae y Escherichia coli. [Tesis de Especialista de Primer Grado en Microbiología]. La Habana: IPK;2011.
27. Gaitán SL, Espinal PA. Caracterización molecular de Escherichia coli y Klebsiella pneumoniae productores de ß-lactamasas de espectro extendido en hospitales de la Región Caribe, Colombia .Rev Chil Infect. 2009;26(3):239-46.
28. Guillén R, Velazquez G, Lird G, Espinola C, Laconich M, Meyer M, et al. Estudio multicéntrico de Enterobacterias productoras de betalactamasas de espectro extendido: detección de genes blactm-2 y blaPER-2. Paraguay 2009 [citado 23 de septiembre de 2010]. Disponible en: www.labciencia.com.
29.Nematzadeh S, Shahcheraghi F, Feizabadi MM, Nikbin VS, Nasehi L. Molecular characterization of CTX-Mβ-lactamases among Klebsiella pneumoniae isolated from patients at Tehran hospitals. In dian J Med Microbiol. 2011;29(3):254-7.
30. Boyd DA, Tyler S, Christianson S, McGeer A, Muller MP, Willey BM, et al. Complete nucleotide sequence of a 92-kilobase plasmid harboring the CTX-M-15 extended-spectrum beta-lactamase involved in an outbreak in long-term-care facilities in Toronto, Canada. Antimicrob Agents Chemother. 2004;48:3758-64.
31. Livermore DM, Warner M, Mushtaq S, Doumith M, Jiancheng Z, Woodford N. What remains against carbapenem-resistant Enterobacteriaceae? Evaluation of chloramphenicol, ciprofloxacin, colistin, fosfomycin, minocycline, nitrofurantoin, temocillin and tigecycline. Int J Antimicrob Chenother. 2011;37:415-9.
32. Meletis G. Colistin heteroresistance in carbapenemase-producing Klebsiella pneumoniae. J Antimicrob Chemother. 2011;66:946-7.
Recibido: 28 de noviembre de 2013.
Aprobado: 28 de abril de 2014.
Dra. Dianelys Quiñones Pérez. Instituto de Medicina Tropical "Pedro Kourí". Departamento de Bacteriología-Micología. Autopista “Novia del Mediodía” Km 6 1/2, La Lisa, La Habana, Cuba. Tel. 537- 2553537, Fax: 537–2046051. Correo electrónico: dia@ipk.sld.cu diany.quinones@infomed.sld.cu