INTRODUCCIÓN
La enfermedad renal crónica avanzada (ERCA) se considera como una de las epidemias más importantes del siglo XXI por su aporte significativo a la morbilidad y mortalidad. La hemodiálisis (HD) es un tratamiento que se aplica para salvaguardar la vida de los pacientes con ERCA en grado 5 y en casos de fallo renal agudo. Es también una modalidad de tratamiento sustitutivo de la función renal que hoy permite vivir por muchos años a un millón de personas en todo el mundo. La necesidad de un acceso vascular (AV) es tan antigua como la propia HD pues para conducir sangre a un circuito de lavado es preciso acceder al torrente sanguíneo. Los comienzos de esta técnica fueron difíciles y hasta el diseño de la fístula arterio venosa (FAV) no se pudieron desarrollar programas de HD en pacientes crónicos.1)
La FAV, los catéteres para HD o las prótesis vasculares, aunque han evolucionado gradualmente hacia el perfeccionamiento, son proclives a las infecciones debidas fundamentalmente a bacterias de la microbiota de la piel y mucosas. Esto conduce a infecciones hematógenas o bacteriemias relacionadas con el uso de catéter (BRC) cuya frecuencia a nivel internacional oscila entre 0,74 y 9,15 eventos/1 000 días-catéter. La FAV es el tipo de AV que permite una mayor supervivencia de los pacientes y genera un menor número de infecciones.2,3
En este escenario Staphylococcus aureus se erige como el principal agente etiológico de bacteriemias y se informa hasta en el 75 % de los episodios que se producen en pacientes con catéter venoso central (CVC) y en el 25 % de los pacientes con FAV.4 El pronóstico de la infección por S. aureus en HD es grave, con un rango de mortalidad que oscila entre 8 y el 30 %.5
En Cuba, pese al aumento de los recursos que se destinan al manejo de los pacientes sometidos a HD periódica, la mortalidad entre ellos es alta y la sepsis generalizada seguida de la bronconeumonía y las encefalitis, constituyen las principales causas.6,7
En este contexto se inserta la presente investigación, que tiene el objetivo de estimar la tasa de incidencia de BRC por SARM en pacientes con ERCA en el Hospital “General Freyre de Andrad”, Cuba, y vigilar los valores de concentración mínima inhibitoria (CMI) de vancomicina frente a los aislados recuperados de bacteriemia.
MÉTODOS
Se realizó un estudio prospectivo transversal entre mayo 2017 y febrero 2018. El universo estuvo constituido por 64 pacientes con ERCA, que representaron el total de los que durante el período recibieron atención en la unidad de HD del Hospital ¨General Freyre de Andrade¨, en la Habana. De cada uno de ellos se recogió información acerca de tipo de AV implantado y tiempo de uso.
Se sospechó bacteriemia cuando apareció fiebre durante la sesión de diálisis o al finalizar la sesión precedente, sin otro foco aparente y con repercusión del estado general; es decir, cuando se presentó un cuadro febril, con escalofríos y eventual compromiso hemodinámico.8 Esta condición se certificó al inicio de cada sesión de diálisis.
De todos los pacientes que desarrollaron un episodio sugerente de bacteriemia se obtuvieron muestras de sangre para su confirmación por hemocultivo. Para los casos con retiro de catéter se propuso la realización de dos hemocultivos cualitativos de muestras de sangre venosa obtenidas de sitios diferentes y el cultivo de la punta del catéter.9,10 En los casos en los que no se retiró el catéter se indicaron hemocultivos cualitativos y cuantitativos a partir de una muestra de sangre obtenida a través del AV y de una muestra conseguida a través de punción venosa (PV). Todos los especímenes se colectaron antes de la administración del tratamiento antimicrobiano al paciente.
Procesamiento de las muestras de sangre y punta de catéter
Las muestras se procesaron en el laboratorio de Microbiología del hospital. Para los hemocultivos se utilizaron frascos para recuperación de bacterias aerobias (HemoCen, Cuba) en los que se inocularon 10 mL de sangre. Se incubaron a 35-37 ºC y a partir de ellos se realizaron resiembras a las 24, 48 h y a los 7 días, en placas de agar sangre que se incubaron en las mismas condiciones. A las 24 h estas se inspeccionaron para la detección de colonias sugerentes de S. aureus.10
Para los hemocultivos cuantitativos se colectó 1 mL de sangre por PV y 1 mL de sangre a través del AV y se transportaron al laboratorio en viales que contenían 30 µL de heparina sódica (Liorlad, 5 000 UI/mL); se sembraron en placas de agar sangre empleando espátula de Drigalski y se inspeccionaron a las 24 h para la detección y el conteo de unidades formadoras de colonias (UFC) sugerentes de S. aureus.10 Para el estudio de los catéteres se propuso su cultivo sobre placas de agar sangre con incubación a 35-37 ºC por 24 h y el conteo de UFC sugerentes de S. aureus.9
En todos los casos para la identificación de S. aureus se siguió la metodología convencional: prueba de catalasa, prueba de coagulasa en tubo y el test rápido de aglutinación de partículas látex (RapiLat- STAF de E.P.B “Carlos J. Finlay”). (11
Informe de bacteriemia y bacteriemia relacionada con el uso o no de catéter
Se siguieron los criterios de Bouza y otros. Se informó bacteriemia por S. aureus en los casos en que se obtuvo crecimiento a partir de al menos uno de los hemocultivos cualitativos. La ausencia de crecimiento a partir de los hemocultivos cualitativos excluyó la bacteriemia, aunque se obtuvieran resultados positivos para el cultivo de punta de catéter.12
Se notificó BRC por S. aureus cuando fueron positivos los cultivos cuantitativos de sangre obtenida a través del AV y PV (con una razón ≥ 4:1) y resultaron también positivos los hemocultivos cualitativos en ambos casos. Cuando los cultivos cualitativos y cuantitativos mostraron resultados discordantes, se mantuvo el informe de bacteriemia pero no se consideró BRC. Todo caso para el que no se contó con los resultados de los hemocultivos cualitativo y cuantitativo de VP se valoró como incorrectamente estudiado. Se informó colonización de AV por S. aureus cuando se obtuvo crecimiento a partir del hemocultivo cualitativo y cuantitativo (uno o los dos) de las muestras obtenidas a través del AV, pero resultaron negativos ambos hemocultivos obtenidos por VP.12
Estudio de la susceptibilidad a los antimicrobianos
En el laboratorio de Microbiología del hospital se investigó la resistencia a meticilina de todos los aislados identificados como S. aureus, a través de la técnica de difusión en discos, empleando discos de cefoxitina (30 (g/mL). La susceptibilidad a la vancomicina se estudió por el método de la determinación de la concentración mínima inhibitoria (CMI), empleando tiras de E-TEST (AB Biodisk, Suecia). Como control se incluyó en ambas pruebas la cepa de referencia de S. aureus ATCC 25923 y se siguió la metodología sugerida por el CLSI. Para la confirmación de los resultados los aislados fueron remitidos al Departamento de Bacteriología-Micología del Instituto ¨Pedro Kouri¨ (IPK), donde se determinó la CMI de vancomicina y oxacilina empleando el método de microdilución en caldo. Como control se utilizó la cepa de referencia de S. aureus ATCC 29213.13
Análisis e informe de los resultados
Se informaron bacteriemias persistentes en aquellos casos en los que para un mismo paciente se obtuvieron hemocultivos positivos para S. aureus luego de las 72 h de un episodio inicial de bacteriemia confirmada, a pesar de la instauración de un tratamiento antibiótico adecuado. Se notificó bacteriemia a repetición cuando se demostraron hemocultivos positivos para S. aureus en otro episodio diferente de manifestaciones de bacteriemia en un mismo paciente.1,14
Se calculó la tasa o densidad de incidencia de BRC por S. aureus y por SARM mediante el cociente: número de BRC/pacientes-días de exposición a AV x 1 000. Para este cálculo se consideró solo el primer episodio de bacteriemia diagnosticado para un mismo paciente. El denominador del cociente (pacientes-días de exposición a accesos vasculares) se determinó sumando los días de uso de los AV de todos los pacientes del universo de estudio. Usando la misma fracción se infirió la incidencia de bacteriemias totales entre pacientes con ERCA en la unidad de HD del hospital; en ese caso el numerador fue la suma de las bacteriemias por S. aureus y de las bacteriemias debidas a otras bacterias. Este último dato se obtuvo de los registros de la vigilancia prospectiva diaria del laboratorio de Microbiología del hospital. Para la interpretación de los resultados se utilizaron los criterios de Beathard y Urbanes.15 Se describió además la relación entre la bacteriemia por S. aureus y el tipo de dispositivo utilizado para el AV y el tiempo de uso de este.
RESULTADOS
De acuerdo con la vigilancia prospectiva de los hemocultivos del laboratorio de Microbiología del Hospital Clínico Quirúrgico ¨General Freyre de Andrade¨ se diagnosticaron 27 bacteriemias entre 41 casos con sospecha clínica (tabla 1). S. aureus fue el agente etiológico en 17 de ellas, de las cuales 16 se confirmaron debidas a SARM, atendiendo a los resultados de la determinación de la CMI (tabla 2). En una de las bacteriemias (caso 17) el agente etiológico fue S. aureus sensible a meticilina (SASM) y en una de las informadas como debidas a SARM se obtuvieron conjuntamente aislados con CMI para oxacilina ≤ 2 (g/mL y ( 4 (g/mL (caso 5) por lo que se consideró una infección mixta por SARM y SASM. El 63 y 59,2 % de las bacteriemias informadas se debieron entonces a S. aureus y SARM, respectivamente. En uno de las bacteriemias por SARM se demostró coinfección con Enteroccoccus spp.
Tabla 1 Frecuencia de bacteriemia por S. aureus en pacientes con enfermedad renal crónica avanzada

1 Informadas por el Laboratorio de Microbiología del hospital para el período de estudio.
2 Para una se demostró además infección por Enteroccoccus spp.
3 Para una se demostró coinfección por S. aureus resistente y sensible a oxacilina.
En función de los resultados de los cultivos cuantitativos simultáneos de sangre obtenida a través del AV y por PV de los hemocultivos cualitativos, nueve de las 17 bacteriemias demostradas para S. aureus se consideraron BRC; de ellas, ocho se notificaron como debidas a SARM (tabla 3). Otras cuatro bacteriemias se informaron no relacionadas con el uso de los AV y en otros cuatro casos fue imposible concluir la relación porque uno se consideró incorrectamente estudiado y para las otros tres se obtuvieron resultados discordantes. No se indicó la retirada del catéter en ninguno de los casos con sospecha de bacteriemia, en congruencia no se informó colonización del AV.
Tabla 2 Concentración mínima inhibitoria de oxacilina para los aislados recuperados en los 17 casos de bacteriemia por S. aureus en pacientes con enfermedad renal crónica avanzada
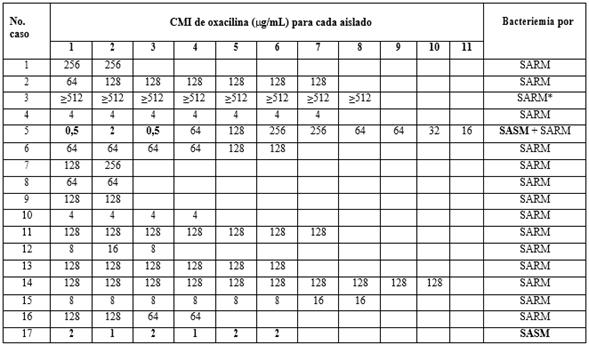
SARM: S. aureus resistente a meticillina; SASM: S. aureus sensible a meticillina.
*Coinfección con Enterococcus spp
Sensibilidad a oxacillina - CMI≤ 2 (g/mL y resistencia a oxacillina - CMI( 4 (g/mL.
Tabla 3 Bacteriemias por S. aureus y SARM relacionadas con el uso de accesos vasculares, durante el primer episodio de bacteriemia demostrado para los pacientes con enfermedad renal crónica avanzada

* Ocho se demostraron producidas por SARM y una por SASM.
Se contabilizaron un total de 13 448 pacientes-días de exposición a AV, atendiendo a que: el período de estudio se extendió por 10 meses (304 días) y a que 34 pacientes se mantuvieron recibiendo los servicios en la unidad de HD todo ese tiempo (10 336 días de catéter), 16 se incorporaron en el transcurso del estudio (1 699 días de catéter) y 14 fallecieron (1 413 días de catéter). De este modo, las tasas de incidencia de BRC por S. aureus y SARM fueron de 0,66 y 0,59 por 1 000 catéter-días, respectivamente (tabla 4).
Tabla 4 Tasa de incidencia de bacteriemia por S. aureus y por SARM asociada con el uso de acceso vascular, entre pacientes con enfermedad renal crónica avanzada

A través de los resultados del laboratorio de Microbiología del hospital se conoció que seis de las 10 bacteriemias informadas en el período como debidas a otras bacterias diferentes de S. aureus fueron también BRC. En función de este dato sumaron 15 las BRC y esto condujo a inferir una tasa de incidencia total de 1,1 por 1 000 catéter-días entre pacientes con ERCA en la unidad de HD del hospital.
En la tabla 5 se muestra el número de aislados de S. aureus por episodios de bacteriemia. En seis de los casos se demostró bacteriemias a repetición (casos 3, 5, 11, 13, 14 y 17 con dos episodios) y en solo uno de ellos se documentó un tercero (caso 5). Entre los 17 episodios primarios se informaron ocho persistencias (casos 2-6 y 13-15) y una entre los segundos episodios (caso 5). La persistencia no se produjo en el único tercer episodio de bacteriemia. Otras dos BRC se informaron en el transcurso de los segundos episodios (caso 11 y 14); una de ellas solo durante el segundo (caso 11). En resumen, sumaron 12 BRC en 10 casos.
Tres de los pacientes con diagnóstico de bacteriemia por S. aureus fallecieron durante el transcurso del estudio. Uno de ellos desarrolló una BRC pero esta no se consideró como la causa directa de la muerte, sino un padecimiento cardiovascular; en el segundo, la bacteriemia no se asoció al AV y la causa de muerte fue una neoplasia uterina. En cambio, en el tercer caso, que sí falleció por un shock séptico, no se demostró BRC aunque sí bacteriemia persistente.
Tabla 5 Bacteriemia relacionada con catéter, episodios de bacteriemia y número de aislados de S. aureus recuperados por pacientes (n= 17)

BRC: bacteriemia relacionada con catéter.
1Caso para el que la bacteriemia se debió conjuntamente a SARM y SASM.
2BRC por SASM.
Sumaron 95 los aislados de S. aureus recuperados durante los primeros episodios de bacteriemia, 22 durante los segundos y dos recuperados en un tercer episodio. El número de aislados para cada caso varió en correspondencia con el número de hemocultivos positivos (tabla 5). Asimismo, fue evidente la correspondencia entre los que se informaron como BRC y aquellos casos con cuatro aislados durante el primer y segundo episodios. El paciente del que se recuperó un mayor número de aislados se corresponde con aquel en el que se demostraron tres episodios de bacteriemia y persistencia (caso 5); sin embargo, estas no estuvieron relacionadas con el AV y fueron producidas al mismo tiempo por aislados de SARM y SASM.
En la tabla 6 se resume el tipo de AV y tiempo de uso para los 10 casos en los que se demostró BRC por S. aureus. Los tiempos de uso de los AV al momento de la confirmación de la bacteriemia oscilaron entre 11 y 97 días. Para ocho de ellas el tipo de AV al momento de la infección fue un catéter venoso central (temporal) y para las otras dos se trató de un catéter tunelizado (permanente). En solo dos de las BRC se produjo un cambio a FAV durante el período de estudio (casos 2 y 4, ambos con AV temporales implantados en ese momento). En cambio, para los dos casos con AV permanente (casos 3 y 14) esa transición no fue posible porque los pacientes mostraron desgaste del capital venoso periférico. Los pacientes de los casos 6, 10, 11, 15, 16 y 17 tenían implantado un AV temporal al momento del diagnóstico por 97, 11, 95, 19, 29 y 89 días, respectivamente; todos ellos estaban a la espera del implante de una FAV.
Tabla 6 Tipo de acceso vascular y tiempo de uso en el momento de la confirmación de bacteriemia por S. aureus relacionada con catéter (n=10)
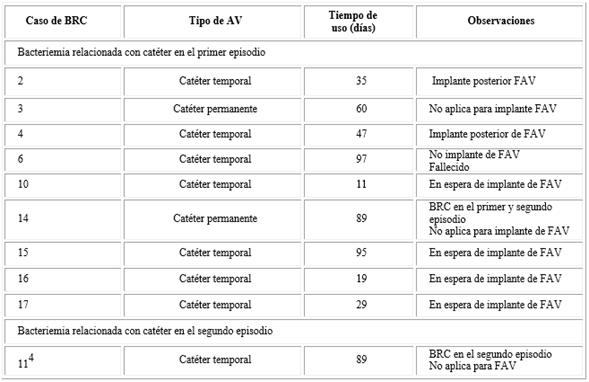
BRC: bacteriemia relacionada con catéter; AV: acceso vascular; FAV: fístula arteriovenosa.
Para los 95 aislados de S. aureus se registraron valores altos de CMI de vancomicina (36 aislados con CMI= 1 (g/mL y 59 con CMI= 2 (g/mL) aunque dentro de los límites de sensibilidad. No se hizo evidente un incremento de la CMI para los aislados obtenidos como responsables de bacteriemias en un mismo paciente en episodios repetidos o en las persistencias.
DISCUSIÓN
La comparación de la frecuencia de bacteriemias por S. aureus y SARM en la unidad de HD del hospital ¨General Freyre de Andrade¨ (63 y 59 %, respectivamente) con la de otros hospitales cubanos se dificulta porque son pocos los informes y publicaciones al respecto. Entre los escasos estudios se encuentra uno realizado en el Hospital “Lucia Iñiguez Landin”, en Holguín, en el que se demuestra el 41,1 % de bacteriemias debidas a S. aureus entre pacientes de HD con catéteres temporales y uno desarrollado en el Hospital “Camilo Cienfuegos”, provincia Sancti Spiritus, donde se notifica un porcentaje menor (34,4 %), también entre pacientes de HD con catéteres transitorios.16,17 Otro estudio, realizado entre enfermos crónicos de la unidad de HD del Hospital Pediátrico de Centro Habana, informa que el 53,8 % de ellos desarrollaron BRC por cocos grampositivos (53,7 %), mayoritariamente debidas a Staphylococcus coagulasa negativa.18 En ninguno de estos estudios se especifican las bacteriemias debidas a SARM.
Entre investigaciones análogas ejecutadas en otros países como, por ejemplo, Argentina, se notifica el 68 % de bacteriemias por cocos grampositivos en pacientes en HD y SARM como el patógeno más frecuente.19 Otra, realizada en Perú, comunica el 60 % de bacteriemias por S. aureus en pacientes sometidos a HD, prácticamente igual a la informada en la presente investigación.20 Aunque de manera general hay unanimidad en considerar a S. aureus como la causa más frecuente de bacteriemias y dentro de estas, las debidas al uso de AV, algunos estudios comunican resultados divergentes. Por ejemplo, una investigación en España indica excelentes índices de bacteriemias relacionadas a los AV (0,23 y 0,56/1 000 días-catéter) e informan como las más frecuentes las debidas a Staphylococcus coagulasa negativa.21
Para la unidad de HD del Hospital “General Freyre de Andrade”, las tasas de incidencia de BRC por S. aureus y SARM demostradas en el período de estudio se consideran excelentes pues ambas estuvieron por debajo de un evento por cada 1 000 días-catéter (0,66 y 0,59, respectivamente). Al mismo tiempo, estas fueron inferiores a la tasa de incidencia de bacteriemias totales registradas en igual período, que aunque clasificada como buena fue ligeramente superior (1,1 por 1 000 catéter-días).22 A partir de ambos resultados puede inferirse que en la unidad de HD se mantienen buenas prácticas clínicas que conducen a la prevención de las bacteriemias asociadas a los AV.
La frecuencia de BRC a nivel internacional oscila entre 0,7 y 9,1 eventos/1000 días-catéter; este rango amplio refleja importantes diferencias en las prácticas clínicas. Por consenso se indica entonces que aquellas unidades hospitalarias donde las tasas de incidencia de BRC sean superiores a 2 eventos/1000 días-catéter deben proponerse estrategias de prevención.2,15)
Nuevamente la comparación de este resultado con los de estudios semejantes en Cuba resulta prácticamente imposible pues no se encuentran trabajos publicados en los que se precisen las tasas de incidencia de BRC y menos aún que especifiquen las debidas a S. aureus y SARM. Las publicaciones disponibles se centran en describir los aspectos clínicos relacionados con el uso de los AV para HD, las vías de acceso utilizadas, las causas de su retirada, las complicaciones relacionadas con su uso y las tasas de mortalidad y letalidad por ERCA.16,17,18
La demostración en el presente estudio de ocho bacteriemias persistentes entre los 17 episodios primarios de bacteriemia y una entre los segundos episodios confirmados, alertó al personal médico sobre la elevada probabilidad de la permanencia de la infección hematógena, de su connotación en el pronóstico clínico y sugirió la necesidad de retirar los AV. Sin embargo, esto no se indicó en ninguno de los casos con sospecha de bacteriemia ni tras su confirmación. El hecho de que las 10 BRC demostradas en este estudio (nueve durante el primer episodio y una durante un segundo episodio) se presentaran predominantemente entre pacientes con AV temporales no es un resultado accidental.
En las unidades de HD el AV de elección es la FAV, a pesar de que un importante porcentaje de pacientes portan CVC y tunelizados. El uso de estos está orientado a la espera de la FAV, aunque ante dificultades en el estudio vascular pueden llegar a adquirir carácter definitivo. Debido a que la gran mayoría de pacientes en HD son de avanzada edad y con comorbilidad diabética y cardiovascular asociada, su lecho vascular resulta no apto para implantar una FAV, por lo que un buen porcentaje de ellos tienen que ser dializados mediante un CVC tunelizado (permanente). Su uso requiere medidas de esterilidad, asepsia e higiene, a pesar de las cuales no están exentos de riesgos.23
Lo comentado anteriormente se ratifica en este estudio tanto para la observación del predominio de BRC entre pacientes con AV temporales como en el hecho de que en solo dos de ellos se concretó el implante quirúrgico de una FAV tras la infección hematógena. Así mismo, la demostración de BRC entre pacientes con diferencias entre los días de uso de los AV temporales está en congruencia con los reportes internacionales, pues la vida útil de estos depende de los cuidados y buenas prácticas clínicas desde el momento de su inserción, durante las sesiones de HD y en el hogar.23)
Aunque el uso de un AV temporal es inadecuado, no hay duda que estos juegan un importante papel en el manejo de los pacientes que requieren HD. En el Hospital “General Freyre de Andrade” la mayoría de los pacientes con diagnóstico de ERCA inician las sesiones de HD de forma urgente y por consiguiente haciendo uso de CVC. Pocos pacientes se incorporan de una manera programada a través de la consulta de pre-diálisis en la que se indica el implante de una FAV si las condiciones del paciente lo admiten. La estrategia que de manera general se sigue en los casos que se dializan de forma urgente es la de colocar un catéter temporal y si el paciente clasifica para una FAV proceder después a su implante, para cuyo uso (maduración) deberán esperarse entre tres y cuatro meses. Si el paciente no es candidato al implante de una FAV se le inserta un catéter permanente. En resumen, en el Hospital “General Freyre de Andrade” la implantación de un CVC se considera siempre que no sea posible una FAV o un catéter tunelizado, o cuando sea necesario iniciar una sesión de HD sin disponer de un AV definitivo y maduro.
A pesar de que diversas guías clínicas distinguen a los CVC permanentes y temporales como “tercera opción” y “elección de necesidad”, respectivamente, un estudio multinacional europeo demuestra que no se hace un uso óptimo de estos últimos, incluso en los países industrializados.23,24,25) En la unidad de HD del Hospital “General Freyre de Andrade” las razones que condicionan la extensión en los días de uso de los AV temporales son similares a las descritas por otras instituciones. La edad, la diabetes y la mayor supervivencia de los pacientes son factores que empeoran el estado cardiovascular e inmunológico, lo que condiciona la existencia de vasos sanguíneos en peor estado para la FAV. A estas razones se añaden los fracasos en la gestión de los AV, que se concretan en la negativa del paciente a que se le implante una fístula, y a la no disponibilidad sistemática de los recursos necesarios para transitar del catéter temporal a permanente, pues el implante de este último requiere de técnicas de Imagenología y de personal entrenado. Esto conlleva a que en ocasiones se prolongue inadecuadamente el tiempo de uso de los AV temporales.
Diversos autores han comprobado que es mayor la mortalidad de los pacientes que se dializan a través de CVC respecto a los que lo hacen a través de FAV, que esta es dependiente del tiempo y que se mantiene incluso tras ajustarse a otros factores comórbidos.23,24,25 Para reducir la morbilidad y mortalidad asociadas al uso de CVC es imprescindible, siempre que sea posible, iniciar la terapia de HD de manera programada, garantizando así que se realicen con antelación los estudios pertinentes para comprobar si es factible la construcción de una FAV y que la intervención quirúrgica se efectúe con tiempo suficiente para su maduración. La derivación tardía al nefrólogo en los meses previos a la diálisis puede ser causa de la mala evolución de los pacientes con ERCA. Ese período es el momento crucial para la preparación del paciente para el tratamiento, en el que además de la implantación del AV se produce el ajuste psicosocial a un nuevo estilo de vida, el tratamiento de la anemia y del estado nutritivo.26)
Los resultados de la prueba de susceptibilidad a la vancomicina obtenidos para los aislados sucesivos de S. aureus recuperados de un mismo paciente no pusieron de manifiesto un incremento en los valores de la CMI de la droga. Esto es posible afirmarlo porque en ninguno de los casos para los que se constataron episodios de bacteriemia a repetición o persistencia se demostró variación trascendente en la CMI de la vancomicina; solo se observaron pequeñas fluctuaciones que implicaron cambios en una dilución de la droga (de 1 a 2 µg/mL).
Durante los últimos años se ha producido una emergencia de aislados de SARM con sensibilidad intermedia y heterorresistencia a la vancomicina, así como un aumento de aislados de SARM con sensibilidad reducida, es decir, sensibles pero con CMI en el límite superior del rango de sensibilidad.27,28) Asimismo se ha demostrado que la mortalidad asociada a la bacteriemia por SARM es superior cuando se utiliza vancomicina en el tratamiento de infecciones por cepas con una CMI de 2 µg/mL. El riesgo de fracaso durante el tratamiento con vancomicina hace necesaria la evaluación de la susceptibilidad a esta droga de cada uno de los aislados de un mismo paciente porque el tratamiento previo y sostenido condiciona la aparición de la resistencia.29
El parámetro farmacodinámico que correlaciona con la mayor eficacia del tratamiento con vancomicina es el valor del área bajo la curva de su concentración a lo largo del tiempo dividido por la CMI durante 24 h (ABC24 h/CMI). Un valor superior a 345 mgL/h se relaciona con una respuesta clínica favorable y un valor superior a 866 mgL/h con una respuesta microbiológica favorable. En aislados con CMI de 2 µg/mL la probabilidad de alcanzar este objetivo es prácticamente nula.30) En aislados con CMI > 1 µg/mL obliga a aumentar la dosis de vancomicina o a la administración del fármaco en perfusión continua pero esto puede comportar una mayor nefrotoxicidad, especialmente cuando el paciente recibe otros fármacos potencialmente nefrotóxicos, se le administra vancomicina por más de siete días o sufre de insuficiencia renal.31,32)
Pese a que varios autores coinciden en la observación del incremento del fracaso terapéutico con vancomicina en las infecciones por SARM con valores de CMI superiores a 1 µg/mL, se mantiene la recomendación de su empleo como primera opción para el tratamiento empírico de infecciones por bacterias grampositivas en las unidades de HD. No obstante, actualmente se sugiere utilizar daptomicina para el caso de BRC en las unidades de HD en las que para los cultivos de SARM se demuestren concentraciones de vancomicina ≥ 1,5 μg/mL y en pacientes con shock séptico o con alergia conocida a este antibiótico.23
Si en la unidad de HD del Hospital “General Freyre de Andrade” se confirma baja eficacia de la vancomicina en el tratamiento de las bacteriemias por SARM, tras lo demostrado en el presente estudio en relación con los niveles de CMI para esta droga, deberá mantenerse entonces una vigilancia sistemática con el objetivo de reorientar el tratamiento empírico inicial. Del mismo modo, la identificación de factores demográficos, antecedentes o manifestaciones clínicas asociadas a la infección por SARM o la referencia de tratamientos previos con vancomicina permitiría reconocer a los pacientes tributarios de tratamiento con dosis adaptadas de la droga para obtener un valle en torno a 15-20 mg/L. Igualmente, constituiría la forma de identificar los pacientes candidatos al tratamiento con linezolide o daptomicina cuando estas drogas se encuentren disponibles.
Hasta el día de hoy la vancomicina es el antibiótico más utilizado en el tratamiento de la bacteriemia por SARM a nivel mundial y la estrategia que se sigue en la unidad de HD del hospital ¨General Freyre de Andrade¨ se ajusta a esta recomendación. Ante la detección de BRC debidas a SARM es necesario plantearse la modificación del tratamiento, y las opciones posibles son: a) mejorar la dosificación de la vancomicina para alcanzar una concentración plasmática por encima de 15 mg/mL; b) asociar a la vancomicina un segundo antibiótico con actividad frente a SARM, o c) cambiar a un antibiótico alternativo. Sin embargo, para adoptar una de estas opciones es preciso realizar consideraciones específicas que exigen de un enfoque multidisciplinario.33 Al respecto, entre las limitaciones del presente estudio figuran: a) el no haberse planteado como objetivo la descripción de la conducta seguida ante cada caso de BRC, profundizando en las razones por las cuales no se decidió en ninguno de ellos la retirada de los AV y b) seguir la evolución de los pacientes tras el tratamiento con vancomicina a las dosis habituales, no obstante a haberse demostrado valores de CMI para la droga ≥ 1,5 μg/mL.














