Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.22 n.2 Ciudad de la Habana Mayo-ago. 2006
Instituto de Hematología e Inmunología
Transmisión de infecciones virales por la transfusión de sangre
DrC. René A. Rivero Jiménez
Resumen
Las medidas para garantizar la seguridad sanguínea incluyen la utilización de donantes voluntarios habituales, la selección cuidadosa del donante mediante el examen físico y el interrogatorio médico, la autoexclusión, la detección de marcadores serológicos de infecciones, el mantenimiento de registros digitalizados compartidos en red de donantes rechazados, y recientemente, la introducción de ensayos para la detección de ácidos nucleicos. A pesar de la realización del pesquisaje de marcadores serológicos de enfermedades de transmisión sanguínea, existen 4 razones potenciales por las cuales dicha transmisión aún puede ocurrir: el período de ventana de la infección, la existencia de donantes asintomáticos portadores crónicos de una infección transmisible con resultados serológicos negativos, infecciones dadas por mutantes o cepas raras y los errores en el laboratorio. En esta revisión se describen los principales virus que presentan peligros potenciales para la seguridad de la sangre y los resultados históricos del pesquisaje en donantes y pacientes de grupos de riesgo en Cuba.
Palabras clave: transfusión, pesquisaje, riesgo, enfermedades transmisibles, infecciones virales, VIH, VHC, VHB.
La transmisión de infecciones por vía transfusional es una de las complicaciones más importantes en receptores de sangre. En los últimos años se incrementaron las medidas para disminuir el riesgo de transmisión y en la actualidad, en los países desarrollados, es muy baja la posibilidad de desarrollar una enfermedad infecciosa como resultado de una transfusión, si se compara con otros riesgos derivados de las prácticas médicas. Pero la trascendencia epidemiológica viene dada por la existencia de donantes aparentemente sanos que pueden tener infecciones, sobre todo virales, para la cuales no existe la posible cura.
A pesar del pesquisaje de los donantes mediante pruebas que evalúan marcadores serológicos de infecciones transmitidas por transfusión (ITT), todavía existen 4 razones por las que puede ocurrir la transmisión: la primera y principal es la colecta de la donación de sangre durante el período de ventana (definido como el lapso durante el cual el donante está infectado con un virus, no tiene signos ni síntomas, y los resultados de la pesquisa serológica son negativos). Para los virus de la inmunodeficiencia humana (VIH) y de la hepatitis B (VHB), por lo menos el 90 % del riesgo es atribuible al período de ventana, mientras que para el virus de la hepatitis C (VHC) es del 73-88 %.1 La segunda es la existencia de donantes asintomáticos portadores crónicos de una infección transmisible con resultados persistentemente negativos en las pruebas de laboratorio. La tercera está dada por infecciones con mutantes o cepas no detectables por las pruebas. Y por último, los errores técnicos en el laboratorio. Según la experiencia cubana, este factor es importante por cuanto depende del ser humano, debe ser objeto de una constante preocupación debido al incremento de la automatización y se debe evitar con la aplicación consecuente de una política de aseguramiento de la calidad. Para que el error humano sea de significación clínica, tiene que ocurrir que una muestra seropositiva se informe como no reactiva (falso negativo), lo que conduciría a la transfusión de componentes contaminados.
Las medidas para aumentar la seguridad de la sangre y sus componentes incluyen la utilización de donantes voluntarios repetitivos o habituales, la selección del donante mediante cuestionarios exhaustivos, intensificación del interrogatorio médico y formularios de autoexclusión, la utilización de sistemas de alta sensibilidad para detección de marcadores serológicos de infecciones, el mantenimiento de registros computadorizados de donantes rechazados que sean compartidos por todos los centros colectores, y más recientemente, la introducción de ensayos para la detección de ácidos nucleicos (NAT: nucleic acid testing), acompañados todos por rigurosos sistemas de control de calidad y trazabilidad. Otra de las vías importantes para disminuir el riesgo, es la aplicación de criterios adecuados para la transfusión, que conducen a una reducción del número de transfusiones sanguíneas a un mínimo, lo que es compatible con el uso apropiado de sangre y sus componentes.
Para mantener la seguridad de la transfusión sanguínea en relación con la prevención de infecciones, es importante también estar alerta ante la posible introducción de nuevos agentes debido a los constantes movimientos migratorios de la población (como es el caso de algunos parásitos como los causantes de la enfermedad de Chagas, el paludismo, y otros) o de agentes patógenos emergentes, como el virus del Nilo occidental (VNO) y el agente causal del síndrome respiratorio agudo severo (SARS), entre otros.2
Además de incorporar nuevas pruebas para control de la seguridad transfusional, es necesario eliminar las que ya no son necesarias, para evitar la eliminación injustificada de unidades y donantes potenciales, ya que pueden existir ensayos con un bajo valor predictivo de positividad (VPP) para agentes biológicos que se pueden sustituir por pruebas de pesquisaje más específicas. Los valores falsos positivos causan no solo la eliminación innecesaria de sangre, sino que generan problemas emocionales y psicológicos en los donantes.
En este trabajo de revisión, se abordan los principales virus que pueden ser responsables de ITT, y los resultados históricos de su pesquisaje en donantes y pacientes de grupos de riesgo en Cuba. En próximos trabajos se desarrollarán otros temas, como los virus y enfermedades emergentes, y la transmisión de infecciones bacterianas y parasitarias a través de la transfusión.
Transmisión de virus por vía transfusional
En la mayoría de los países se estudia para cada donación la presencia de los siguientes marcadores serológicos: anticuerpos anti-VIH-1/2, anti-VHC, antígeno de superficie del VHB (HBsAg) y una prueba para sífilis. Pero hay otros países donde además se estudia anti-HTLV-I/II, antígeno p24 para VIH (Ag p24) y otras pruebas alternativas como la determinación de anti-HB core para el VHB y la alanino-aminotransferasa séricas (ALT).
En Cuba son obligatorias las siguientes pruebas para enfermedades virales transmisibles: anti-VIH-1/2, anti-VHC y HBsAg para VHB, mediante el uso de sistemas cubanos UMELISA (TecnoSuma, La Habana, Cuba). Además, se realiza la prueba de sífilis (VDRL) y según los Procederes para bancos de sangre y servicios de transfusión del Ministerio de Salud Pública, 2004, se consideran pruebas adicionales a donaciones seleccionadas, la determinación de anticuerpos contra citomegalovirus (CMV). (Ballester JM. Procederes para bancos de sangre y servicios de transfusión, Cuba, 2004. Ministerio de Salud Pública, La Habana; 2004).
Como la mayoría de los donantes cubanos son voluntarios pero no habituales, y hasta agosto del 2005 en la Ciudad de La Habana también donaron sangre los familiares o donantes de reposición, o sea, personas que están presionados a efectuar la donación, y generalmente son personas que acuden a donar por primera vez, la prevalencia de marcadores para ITT es mayor en Cuba que en algunos países desarrollados, donde la mayoría de los donantes son voluntarios y habituales. Está demostrado que la prevalencia de infecciones transmisibles es mayor en donantes por primera vez que en los repetitivos.3 Por ese motivo, el sistema de salud en Cuba promueve la donación voluntaria habitual y eliminará gradualmente las donaciones de sangre de donantes de reposición o familiares.
La transmisión potencial de infecciones virales por vía transfusional se reconoció desde hace más de 50 años. Aunque las primeras medidas adoptadas para disminuirla estuvieron dirigidas contra las hepatitis, la aparición del VIH / SIDA ejerció la mayor influencia en este sentido.
Hepatitis virales
Estas son causadas por los virus B o C, aunque se piensa que existen otros agentes virales aún no descubiertos responsables de algunos casos.3 Desde los inicios de las transfusiones sanguíneas, se realizaron esfuerzos encaminados a prevenir estas complicaciones, comenzando con el concepto de evitar la donación de personas con una historia de infección hepática previa y culminando con la utilización de NAT.
Desde los años 60 la frecuencia de transmisión de hepatitis postransfusionales (HPT) declinó de más del 30 % a niveles casi no detectables en estudios prospectivos realizados en el extranjero.4 La secuencia de eventos que llevaron a esto fue: a) la transición gradual de donantes de sangre remunerados a voluntarios, b) el desarrollo de ensayos para VHB en los 70, c) la exclusión de donantes de alto riesgo para prevenir la transmisión de VIH a mediados de la década de los 80, d) la implementación de pruebas de marcadores alternativos para hepatitis no A-no B, e) el desarrollo de inmunoensayos enzimáticos (IEE) para anti-VHC en los 90, f) la introducción de mejoras en los IEE para anti-VHC y g) la implementación de NAT como prueba habitual en algunos países desarrollados.
Con respecto al VHB, el antígeno de superficie (HBsAg) fue descubierto en 1969, 5 y en 1972 se estableció por primera vez la obligatoriedad de su estudio en donantes de sangre.6 Aunque las pruebas habituales disminuyeron significativamente la incidencia de VHB postransfusional, aún queda una incidencia residual en donantes con pruebas negativas para HBsAg. Además, se encontró ADN de VHB en suero de pacientes con enfermedad hepática crónica con resultados negativos para HBsAg, y por otra parte, el VHB pudo transmitirse a chimpancés con sangre humana sin marcadores serológicos para VHB, pero con ADN viral detectado por técnicas de biología molecular.6
En países como EE.UU., donde las donaciones de sangre se estudian para HBsAg y anti-HB core, y basándose en la sensibilidad diagnóstica de estas 2 pruebas y en las tasas de prevalencia, se estimó el riesgo residual de adquirir la hepatitis B en 1:250 000, lo que es compatible con las observaciones publicadas sobre la frecuencia de transmisión de VHB.6 Sin embargo, Schreiber y colaboradores 7 estimaron el riesgo residual en 1:63 000 por unidad, basándose en el período de ventana y la incidencia de nuevas infecciones.
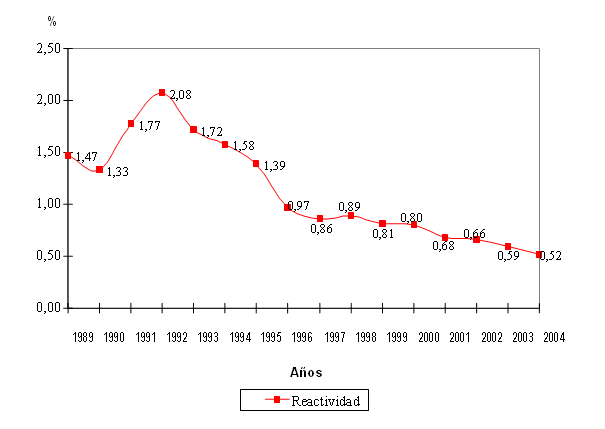
Los resultados de la pesquisa y confirmación de HBsAg en donantes cubanos en el período de 1989 al 2004 se muestran en la figura 1, y se observa una tendencia a la disminución de la reactividad en el tiempo.
Fuente: Centro de Inmunoensayo y TecnoSuma SA, La Habana, Cuba.
Fig. 1. Antígeno de superficie del virus de la hepatitis B: reactividad en donantes de sangre. Cuba, 1989-2004.
En 1989 se descubrió el VHC,8 considerado el agente responsable de la mayoría de las HPT-NANB, y se implementaron IEE de mayor sensibilidad para detección de anticuerpos. El primero que se desarrolló, llamado de 1ra. generación,9 se basó en un único antígeno recombinante, c100-3, derivado del gen no estructural NS4. Este tipo de ensayo se comenzó a utilizar antes de 1990 en Japón y en ese año en donantes de sangre en EE.UU.10
Cuando Donahue y colaboradores 11 estudiaron una población de pacientes con cirugía cardíaca, que recibieron un total de aproximadamente 120 000 unidades de sangre, pudieron estimar que el riesgo de transmisión del virus C era de alrededor del 0,45 % antes de la implantación del pesquisaje en donantes. Después de la implementación de las pruebas alternativas, ALT y anti-HB core, el riesgo disminuyó al 0,15 % por unidad transfundida, mientras que con la prueba de 1ra. generación se redujo al 0,03 %.
Los IEE de 1ra. generación para anti-VHC presentaron menor sensibilidad (entre el 70 y 80 %) y un mayor porcentaje de falsos positivos que los siguientes ensayos de 2da. y 3ra. generación que se desarrollaron en 1992 y 1996, respectivamente,10,12 ya que estas versiones incluyen un mayor número de péptidos antigénicos. Estas pruebas han reducido en forma importante el riesgo residual de transmisión por transfusión. Los ensayos de 2da. generación contienen antígenos del core y del NS3 y los de 3ra. generación han agregado antígenos del NS-5.13
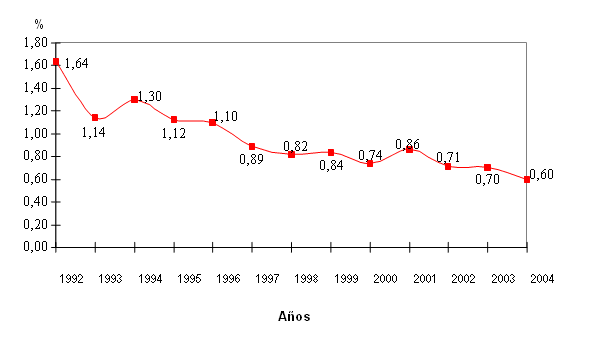
Schreiber y colaboradores, 7 estimaron que el riesgo de transmisión de VHC después de la implementación del IEE de 2da. generación fue de 1:103 000 por unidad transfundida. El período de ventana se calculó en un promedio de 82 días con esta versión y de 70 días al utilizar el IEE de 3ra. generación, con una disminución del riesgo transfusional.14 La infección por VHC se identificó como un problema de salud en Cuba desde los inicios de la década de los 90, cuando algunos investigadores detectaron anticuerpos en donantes de sangre (seroprevalencia de 0,71 %), pacientes politransfundidos, otros grupos de riesgo y se diagnosticaron los primeros pacientes receptores de sangre con distintas fases de la infección.15-21 A partir de estos resultados, se estableció un programa nacional que incluyó la vigilancia epidemiológica centinela en centros colectores de sangre en 1992, la producción nacional de juegos de diagnosticadores para el pesquisaje masivo de los donantes de sangre, las investigaciones básicas en la biología molecular del VHC para satisfacer estos propósitos, los estudios 22-24 y el tratamiento de los enfermos.25,26 En el año 1995 se logró el pesquisaje masivo de todos los donantes de sangre del país con el uso de los juegos diagnósticos UMELISA-HCV (TecnoSuma SA, La Habana, Cuba), que evolucionaron hasta alcanzar un sistema de tercera generación que está en uso en la red nacional de bancos de sangre desde 1998. Los resultados de estos esfuerzos permitieron conocer el promedio anual de la seroprevalencia de anticuerpos contra VHC en donantes de sangre en el período 1998-2004, que se redujo a 0,62 % en el año 2004 (fig. 2). A pesar del pesquisaje, un estudio del año 2003 en multitransfundidos cubanos indicó que el VHC es el virus más transmitido en Cuba,27 como se informa en las tablas 1 y 2, aunque ni el número de unidades transfundidas ni la transfusión como único factor de riesgo resultaron significativos en el grupo de pacientes, ya que las mayores tasas de seroprevalencia estuvieron asociadas con la existencia de múltiples factores de riesgo ajenos al uso de la terapia transfusional, como el empleo de jeringuillas y agujas reesterilizadas, procederes de hemodiálisis, tratamiento o investigaciones médicas invasivas, y otros.
Fuente: Centro de Inmunoensayo y TecnoSuma SA, La Habana, Cuba.
Fig. 2. Virus de la hepatitis C: porcentajes de reactividad en donantes de sangre. Cuba, 1992-2004.
*Introducción del UMELISA HIV-1/2.
Tabla 1. Pruebas serológicas en pacientes multitransfundidos. Cuba 2002-2003
| Pruebas serológicas | N | Muestras reactivas | |
| n | % | ||
| Anticuerpos contra VHC | 318 | 164 | 51,6 |
| Anticuerpos contra VIH-1/2 | 0 | 0 | |
| HBsAg | 17 | 5,3 | |
| Anticuerpos contra HBc | 143 | 45,0 | |
N: tamaño de la muestra; n: número de pacientes; %: porcentaje de seropositivos; VHC: virus de la hepatitis C; VIH-1/2: virus de la inmunodeficiencia humana tipos 1 y 2; HBsAg: antígeno de superficie del virus de la hepatitis B; HBc: antígeno core del virus de la hepatitis B.
Tabla 2. Resultados de anticuerpos contra virus de la hepatitis C según la categoría diagnóstica principal de inclusión en el estudio. Multitransfundidos, Cuba, 2002-2003
| Grupo de estudio | n | Reactividad contra VHC (*p < 0,0001) | |
| n | % | ||
| Hemodiálisis | 90 | 86 | 95,6 |
| Hemofilias | 83 | 49 | 59,0 |
| Drepanocitosis | 66 | 14 | 21,2 |
| Hemopatías malignas | 77 | 15 | 19,5 |
| Hemorragias agudas | 2 | 0 | 0 |
| Total | 318 | 164 | 51,6 |
n: número de pacientes; VHC: virus de la hepatitis C; *Chi-cuadrado con prueba de exactitud de Fisher; p: probabilidad; %: porcentaje de seropositivos.
Se estima que la detección de ácido ribonucleico (ARN) del VHC reduce en 59 días el período de ventana.28 Los niveles de VHC alcanzan títulos altos rápidamente, y es por eso que se pueden utilizar pools de sueros para detectar la mayoría de las muestras ARN positivas antes de la seroconversión.29 La aplicación del NAT para VHC reduciría en un 60-80 % el período de ventana, detectando de 1:150 000 a 1:200 000 donaciones infecciosas.1 En EE.UU., el riesgo de recibir una unidad infectada se calcula en 2,72 por millón.30
También se desarrolló por Ortho Diagnostic System un IEE para detección de antígeno del core del VHC (VHC Ag).31 La reducción del período de ventana sería equivalente a la obtenida con NAT, pero este sistema no ha sido registrado por la FDA en los EE.UU. En Francia, el grupo de Couroucé 32 trabajó con muestras de pacientes con insuficiencia renal crónica en hemodiálisis anti-VHC negativos y ARN positivos, y encontró que el ensayo de VHC Ag permitió detectar VHC alrededor de un mes y medio antes que los IEE para anticuerpos y solo 2 días más tarde que el ARN.
En Polonia, el porcentaje de donantes reactivos para anti-VHC es similar al de Argentina (0,53 %) e inferior al de Cuba. En un estudio realizado en 144 000 muestras identificaron 2 positivas por NAT y negativas para anticuerpos que también resultaron positivas para VHC Ag. Se concluyó que el método podría resultar una alternativa aceptable para ser implementada con el fin de disminuir el riesgo de la transmisión de VHC en países en los que las técnicas de NAT resultan difíciles de realizar por motivos económicos y logísticos.33
A finales de los años 70, en los bancos de sangre de EE.UU., se introdujeron como pruebas alternativas para la detección de las hepatitis postransfusionales no A-no B (HPT-NANB), las pruebas de ALT y anti-Hb core. Estudios importantes indicaron que la proporción de pacientes receptores de transfusiones que desarrollaron HPT-NANB era mayor en aquellos que recibieron unidades provenientes de donantes con niveles altos de ALT (45 %), que en las obtenidas de donantes con niveles bajos de ALT (5 %). Y los receptores de unidades de donantes positivos para anti-HB core tenían un riesgo 2 a 3 veces mayor de desarrollar HPT-NANB que los receptores de unidades negativas para este marcador. Estos trabajos indicaban que la realización de ensayos para estas pruebas alternativas en donantes de sangre eliminaría del 30-50 % de las HPT-NANB.10,34 Sin embargo, estas proyecciones optimistas no se concretaron, y si bien el rango de seroconversión de VHC (principal causa de las HPT-NANB) disminuyó del 0,52 al 0,36 % por unidad transfundida después de implementar las pruebas alternativas en 1987, la población de donantes se había modificado para reducir el riesgo de transmisión del VIH y esta se consideró la razón principal de la disminución del VHC postransfusional, 10 ya que ambos virus comparten vías de transmisión similares. En 4 países de Europa (Bélgica, Francia, Luxemburgo y Portugal) son obligatorias las 2 pruebas alternativas, mientras que en otros es obligatoria una o ninguna.35 En Cuba no se realiza ninguna de las 2 a los donantes.
En 1995, el Instituto Nacional de la Salud (NIH) de EE.UU.34 llegó a las siguientes conclusiones: a) La prueba de ALT debería ser discontinuada debido a la posible utilización de IEE específicos para VHC.
b) El uso del anti-HB core debería continuar, ya no para prevenir la transmisión de VHC, sino porque puede actuar como marcador alternativo de la infección por VIH y para prevenir algunos casos de VHB postransfusional, ya que el anti-HB core puede estar presente durante el período de ventana de la infección aguda con VHB luego de la desaparición del HBsAg, pero antes de la aparición de anticuerpos protectores anti-HBs.36
Algunos trabajos demostraron que una pequeña proporción de donantes anti-HB core positivos son virémicos, y por lo tanto, infecciosos, lo que significa que, además de la detección de HBsAg, la utilización de esta prueba es de utilidad.37 No obstante, diversos estudios en poblaciones de donantes de repetición, muestran que la inclusión del ensayo de anti-HB core tiene valor limitado para incrementar la seguridad transfusional,38,39 lo que sugiere que, en el caso de Cuba, se debería evaluar en una muestra de nuestra población de donantes la prueba para detección de anti-HB core para determinar su utilidad para prevenir las ITT debidas a VHB.
La eliminación de unidades debido a niveles elevados de ALT ha resultado siempre problemático debido a la inespecificidad de la prueba, ya que el consumo de alcohol, obesidad y otros factores no relacionados con ITT pueden dar lugar al aumento enzimático llevando a una exclusión innecesaria del donante.40 El único beneficio de la prueba sería la identificación de agentes infecciosos desconocidos causantes de un pequeño porcentaje de hepatitis postransfusionales, pero el riesgo de transmisión de estos agentes por donantes con ALT elevadas sería muy bajo.38
El valor predictivo de una prueba alternativa depende de la prevalencia del agente en una determinada población. Por ejemplo, la detección de anti-HB core tuvo un importante valor predictivo de infección para VIH en homosexuales de San Francisco, EE.UU., pero es mínimo en una población de donantes voluntarios repetitivos.41
La aplicación de la vacunación masiva contra VHB es la estrategia más sensata en un país como Cuba, donde la cobertura de salud alcanza al 100 % de la población.
No obstante, existen evidencias de que aún ocurren algunas hepatitis residuales entre receptores de sangre que no estarían asociadas con infecciones por ninguno de los virus de hepatitis conocidos, y no parece posible relacionar estas infecciones con los otros virus relacionados con hepatitis identificados recientemente, como el virus de la hepatitis G (VHG), TTV o SEN-V.6
El virus de la hepatitis A (VHA) puede ser transmitido por vía transfusional, pero la probabilidad de que esto suceda es mínima, ya que causa una infección aguda y la fase de viremia es muy corta. Hay pocos casos descriptos en la literatura 10 y se estimó que el riesgo de transmisión por vía transfusional es de 1 en un millón.4 Teóricamente, la detección de ALT podría ser útil en reducir el riesgo de VHA postransfusional, pero en la práctica, la elevación de esta enzima cubriría sólo un período de infectividad muy pequeño.10
El virus de la hepatitis D es incompleto y requiere del VHB para su replicación. Es transmitido primariamente por contacto parenteral y las medidas para prevenir la transmisión de VHB son efectivas también para este virus.10
El virus de la hepatitis E se transmite predominantemente por vía entérica, fundamentalmente en países en desarrollo. Como existe un período corto de viremia, pero no un estado de portador crónico, hay un pequeño riesgo de transmisión por transfusiones de sangre y principalmente por derivados plasmáticos.43
Retrovirus VIH-1 / 2
Las primeras informaciones acerca del SIDA sugerían que la enfermedad tenía etiología infecciosa y las medidas iniciales para reducir el riesgo de transmisión por transfusión fueron las de reducir la obtención de sangre de individuos con factores de riesgo de la enfermedad. Busch y colaboradores,44 estimaron que el riesgo de contraer una infección de VIH por vía transfusional en San Francisco a principios de la década de los 80 era del 1,2 % por unidad transfundida, pero este riesgo disminuyó notoriamente al 0,2 % al final de la década, como resultado de los esfuerzos por educar a los individuos pertenecientes a poblaciones de riesgo para evitar la donación de sangre. En 1987 se estimó que la selección de los donantes, su educación y autoexclusión llevó a que 49 de 50 personas infectadas con VIH desistieran de donar sangre.45
El reconocimiento del VIH como agente etiológico del SIDA dio lugar al desarrollo de pruebas de IEE para detección de anticuerpos para el virus,46 que se usaron en EE.UU. a partir de marzo de 1985 para pesquisaje en donantes de sangre, 44 y se demostró que la mayoría de los individuos infectados tenían conductas o factores de riesgo, razón por la cual se incrementaron las medidas referidas al cuestionario pre-donación.47 Ambos hechos provocaron una disminución importante en la transmisión de VIH por vía transfusional. Pero aún así, se continuaron presentando infecciones asociadas con transfusión, y se atribuyó en gran parte a la presencia de virus en circulación antes de la aparición de una respuesta detectable de anticuerpos, por lo que la utilización de sangre obtenida en este período de ventana resultaría en la transmisión de la infección.
Para determinar la extensión del período de ventana se desarrollaron estudios retrospectivos utilizando modelos matemáticos en donantes de repetición que establecían la relación entre la infectividad y el intervalo entre 2 donaciones. La estimación en 1990 fue de 42-45 días con los ensayos de 2da. generación que utilizaban antígenos recombinantes.14 El aumento en la sensibilidad de los ensayos de 3ra. generación, que detectan IgM además de IgG, redujo posteriormente el período de ventana a aproximadamente 22 días 14 y el riesgo residual en EE.UU. se estimó en 1:450 000 a 1:660 000.48
Existe variación genética del VIH y es importante su relación con la seguridad transfusional. El virus se puede transmitir si un donante está infectado con una variante genética atípica que no resulta detectada por los ensayos utilizados comúnmente en el pesquisaje. El VIH-1 se clasifica filogenéticamente en los grupos M y O, el grupo M es además dividido en al menos 8 subtipos designados desde la A hasta la H. Estos subtipos presentan diferente distribución geográfica. El predominante en Cuba, como en EE.UU., es el B, y es por eso los ensayos comerciales utilizaron inicialmente lisados de VIH-1 subtipo B como antígeno. Estas pruebas resultaron extremadamente sensibles para detectar infecciones causadas por VIH-1 (desde A hasta la H), pero no podían detectar algunas muestras de variantes como VIH-1 grupo O y VIH-2.14
El VIH-2 se descubrió en 1985 en África Occidental. 49 El VIH-1 y 2 presentan una homología del 50 % en sus ácidos nucleicos y más del 90 % de los sueros de personas infectadas con VIH-2 son positivos en los ensayos basados en VIH-1. A partir de 1992 se utilizaron ensayos que utilizaban antígenos para ambos virus en el pesquisaje en donantes de sangre.14
En Cuba se realizó la proeza de desarrollar sistemas de pesquisaje autóctonos e iniciar el pesquisaje masivo de los donantes por ELISA con antígenos naturales en 1986 (Sistema ELISA DAVIH, DAVIHLab, La Habana, Cuba), y luego con el sistema UMELISA HIV 1/2 (TecnoSuma, La Habana, Cuba). En la figura 3 se muestra la seroprevalencia de VIH 1/2, confirmada por Western blot (DAVIH-blot), en los donantes de sangre desde 1986 hasta el 2004.
Fuente: Laboratorio de Investigaciones del SIDA, La Habana, Cuba.
Fig. 3. Virus de la inmunodeficiencia humana 1/2: porcentaje de seropositivos confirmados en los donantes de sangre. Cuba, 1986-2004.
En 1994, investigadores franceses informaron que algunas personas infectadas con una variante endémica en países de África Central como Camerún y Gabón (VIH-1 grupo O), eran negativos en ensayos para detección de anticuerpos para VIH-1 y para VIH-1/VIH-2. 50 Entonces se desarrollaron los ensayos para detección de personas infectadas con el grupo O, y posteriormente se implementó en EE.UU. el estudio del Ag p24.
En febrero de 1995, la Asociación Americana de Bancos de Sangre (AABB) manifestó su apoyo a la autorización e implementación del pesquisaje de Ag p24 en donantes de sangre, y en 1996 se estableció la obligatoriedad de realización de la prueba.
Estudios basados en paneles de seroconversión sugirieron que el pesquisaje para Ag p24 reduciría el período de ventana a 16 días.51 Cuando se inició el estudio de Ag p24 en donantes de sangre, se esperaba encontrar una disminución del riesgo de transmisión de VIH del 27 %, 14 pero la frecuencia de detección ha sido solo de 1 caso en 9 000 000 (solo el 17 % de la predicción).1 Es posible que el hallazgo de tan pocas unidades con antígeno positivo y anticuerpo negativo se deba a que en la fase antigenémica, los síntomas clínicos de la infección induzcan al potencial donante a no realizar la donación.
En febrero de 1999, la FDA en EE.UU. instó a la comunidad relacionada con la medicina transfusional a desarrollar e implementar tecnologías para pesquisaje en donantes de sangre con ensayos de NAT para VIH, así como para VHC.
En respuesta a este requerimiento, la AABB formó un grupo de trabajo integrado por miembros de varias instituciones (Cruz Roja Americana -ARC-, Colegio de Patólogos Americanos, NIH, etc.). La primera fase se basó en implementar el requerimiento europeo para productos manufacturados a partir de plasma, y la segunda fase en aplicar esta nueva tecnología en bancos de sangre.52
En EE.UU., se estima que 1,48 unidades por millón de donaciones escapan la detección por los ensayos serológicos para anti-VIH y p24 y la implementación de NAT lo reduciría a 1,01 unidades por millón.30
La utilización de NAT en minipools acortaría la ventana del 32 a 41 % (7 a 9 días menos que con la detección de anticuerpos por IEE de 3ra. generación). El riesgo de transmisión decrecería a 1:725 000 -1: 835 000.1
Dentro del período de ventana existe un intervalo denominado período de eclipse, que comprende el tiempo desde la infección hasta que se presente infectividad. En un estudio realizado en chimpancés se sugiere que durante esta fase no habría infectividad en la sangre hasta que la presencia de virus pueda ser detectada por NAT y/o aislamiento viral.53 Estudios previos en modelos animales habían indicado que durante un período después de la exposición al virus, el mismo replica en los tejidos linfoides regionales antes de diseminarse en sangre periférica.54
HTLV-I/II
El HTLV-I fue el primer retrovirus humano reconocido en 1980.55 Posteriormente se aisló el HTLV-II. 56 El HTLV-I es endémico en el sudoeste del Japón, el Caribe y África ecuatorial. Además, existen focos en poblaciones negras de Colombia y Brasil, en indígenas en Colombia y Chile y en aborígenes de Australia Central.57 La prevalencia de la infección con HTLV-II entre drogadictos por vía endovenosa en EE.UU. y en Europa es elevada, y es endémico en poblaciones indígenas americanas de Panamá, Colombia, Venezuela, Brasil, Argentina, Florida y Nuevo Méjico.58
El pesquisaje en donantes de sangre para anticuerpos anti-HTLV-I se inició en 1986 en Japón,59 y posteriormente se hizo obligatorio en varios países, como EE.UU., Francia y Holanda, entre otros.60-62
Los IEE originales utilizaron antígenos obtenidos de células infectadas con HTLV-I, pero también detectaban HTLV-II, ya que comparte un 65 % de secuencias con el HTLV-I; posteriormente se adicionaron antígenos recombinantes específicos para HTLV-II.42
Los riesgos para infección con HTLV-II son principalmente la utilización de drogas por vía endovenosa, mientras que para HTLV-I es predominantemente la residencia en áreas endémicas.
En relación con la transmisión por vía transfusional, los rangos de seroconvesión de receptores de sangre en áreas endémicas del virus son del 44 al 82 %, 63 y es menor en áreas no endémicas.7 La probabilidad de transmisión disminuye con el tiempo de almacenamiento del componente sanguíneo, y como estos virus infectan a linfocitos, no se transmiten por productos extracelulares, como plasma fresco congelado y crioprecipitados.7
El HTLV-I está asociado al menos con 2 enfermedades: la leucemia-linfoma T del adulto, la cual presenta un período de incubación prolongado de 30-40 años, y una mielopatía asociada con HTLV-I, la paraparesia espástica tropical, cuyo período de incubación es de 3 a 5 años.59 La mayoría de las personas infectadas con el virus permanecen sanas, con un riesgo de adquirir la complicación hematológica entre el 2 y 4 %, y de desarrollar la mielopatía de menos del 1 %. También se ha asociado con uveítis.64 El HTLV-II no se ha asociado hasta el momento en forma fehaciente con ninguna enfermedad.
Schreiber y colaboradores, 7 estimaron que el riesgo residual de infección con HTLV en EE.UU. es de 1 en 641 000 unidades. Esta estimación se basó en la incidencia de nuevas infecciones en la población de donantes junto con un período de ventana calculado sobre la base de individuos con exposición conocida al HTLV-I/II.
Las pruebas de detección de anticuerpos contra ambos virus en Cuba revelaron, según las primeras encuestas seroepidemiológicas llevadas a cabo en la década de los 90, que existe una baja seroprevalencia de anticuerpos,65-66 pero ocurren infecciones en determinados grupos poblacionales con riesgo, especialmente en cubanos con ascendentes de origen caribeño anglófono (Navea L, Noa E, Lubian AL, Pérez MT, Carnot J, Rivero R. Screening of anti HTLV I antibody in sera from HIV infected persons and patients with hematological and neurological diseases in Cuba. Proceedings of the Fifth International Conference on Human Retrovirology; HTLV. Japan, 1992).67-68 Y como la infección puede persistir por toda la vida, muchos portadores sanos podrían estar transmitiendo la infección sin padecer las enfermedades asociadas.69 Los estudios revelaron la existencia no solo de portadores, sino también de enfermos con leucemia T del adulto y paraparesia espástica tropical.70 En l a situación epidemiológica en Cuba, se destaca que presumiblemente el 20 % de los seropositivos adquirieron la infección por vía de las transfusiones de sangre.68 En la tabla 3 se detalla la cantidad de muestras procesadas y los resultados en distintos grupos de estudio entre 1991 y 1996.
Tabla 3. Detección de anticuerpos contra HTLV-I en grupos de la población cubana de 1991 a 1996
| Grupos de estudio | n | Seropositivos | % |
| Donantes de sangre | 16 920 | 3 | 0,01 |
| Enfermedades hematológicas | 241 | 1 | 0,04 |
| Insuficienia renal crónica | 1 708 | 2 | 0,11 |
| Politransfundidos | 180 | 1 | 0,55 |
| Contactos sexuales de seropositivos | 7 | 2 | 28,57 |
| Hijos de madres seropositivas | 6 | 1 | 16,66 |
| Enfermedades de transmisión sexual | 6 081 | 0 | 0 |
| Enfermedades neurológicas | 187 | 0 | 0 |
| Neuropatía epidémica | 617 | 0 | 0 |
| Seropositivos al VIH-1 | 121 | 0 | 0 |
| Otros | 284 | 0 | 0 |
| Total | 26 352 | 10 | 0,037 |
n: número de pacientes; %: porcentaje de seropositividad.
Fuente: Laboratorio de Investigaciones del SIDA. 68
Importancia del pesquisaje de la sangre que se dona en Cuba:
- Causa enfermedades graves.
- Es un virus bien caracterizado.
- Se puede disponer de pruebas de pesquisaje hechas en Cuba.
- La infección se transmite por la sangre (elementos celulares).
- Existen individuos sanos infectados que actúan potencialmente como donantes de sangre.
- Detectar la infección en la sangre donada permite reducir esta fuente de infección
Infecciones por otros virus
Citomegalovirus (CMV):
Este virus en general no da lugar a enfermedad en el individuo inmunocompetente, pero puede resultar fatal en los inmunocomprometidos, incluyendo bebés prematuros de bajo peso, receptores de trasplantes, entre otros.
La primera asociación entre CMV y transfusión se describió en 1966, y a partir de ese momento fue evidente que mientras la mayoría de los pacientes expuestos a este virus desarrollaba infecciones asintomáticas o leves, una minoría, compuesta por pacientes inmunodeprimidos, sufría enfermedades severas.71
La seroprevalencia de anti-CMV en la población general es elevada, del 50 al 100 % en diferentes países, dependiendo de factores tales como nivel socioeconómico, edad, área geográfica, y otros.72 Este hecho ocasiona que la disponibilidad de unidades seronegativas sea muy limitada. En estudios llevados a cabo en Cuba con el IEE de Labsystems Oy, se encontró el 32,7 % de seropositivos para IgG anti-CMV en 300 donantes de sangre,73 57,3 % en 220 embarazadas a término,74 67,8 % en politransfundidos 75 y 77 % en 60 receptores de trasplantes renales.76
La transmisión de CMV por vía transfusional está asociada solo con componentes celulares y la eliminación de leucocitos en glóbulos rojos y concentrados plaquetarios reduce la posibilidad de transmisión de la infección.36 En la actualidad, se utilizan para pacientes susceptibles unidades filtradas, para reducir el número de linfocitos, y/o seronegativas para CMV. 6 La FDA define a una unidad como leucorreducida cuando contiene menos de 5 x 106 leucocitos/mL, lo cual se logra satisfactoriamente empleando filtros de tercera generación.71 La AABB recomienda el pesquisaje serológico o la leucorreducción como métodos equivalentes para prevenir la transmisión de CMV, pero la FDA considera que esta equivalencia aún no está demostrada.71
Parvovirus B19:
Este virus es responsable de una variedad de manifestaciones clínicas que dependen del estado hematológico e inmunológico del huésped. La infección ocurre principalmente durante la niñez y la seroprevalencia aumenta con la edad hasta alcanzar valores mayores al 90 % en la población adulta.77
El riesgo de transmisión por vía transfusional varía con la incidencia de la infección, la cual sigue un curso estacional (es mayor a finales del invierno, inicios de la primavera) y varía en diferentes años. 42 Estudios realizados con varios métodos indican que este agente está presente en sangre de 1:20 000 a 1:50 000 donantes, pero en períodos de epidemias, la incidencia se puede incrementar hasta 1:260.78
Aunque este virus puede causar enfermedad severa en fetos, individuos con anemias hemolíticas o hemoglobinopatías y en aquellos con inmunodeficiencias, solo se han publicado 3 casos de enfermedades asociadas con transmisión por vía transfusional o por trasplante.77 La incidencia de viremia del parvovirus B19 en donantes de sangre es muy baja,79 pero es suficiente para contaminar pools de plasmas utilizados para preparar concentrados terapéuticos.80 En Cuba, la transmisión sanguínea de este virus no ha sido evaluada.
Detección de ácidos nucleicos en medicina transfusional
El pesquisaje genómico de agentes infecciosos se ha hecho posible con el desarrollo de varias técnicas de amplificación e hibridización de ácidos nucleicos. Estos métodos permiten la detección directa de los organismos con una sensibilidad varias veces mayor que los ensayos tradicionales como cultivos o IEE para detección de antígeno.
Después del período de eclipse, el período de infectividad se extiende hasta el primer resultado positivo por IEE (Ag p24 para VIH, anti IgG para VHC y HBsAg para VHB). Este período de infectividad está estimado entre 6 y 10 días para VIH, de 41-57 días para VHC y entre 30 y 45 días para VHB.29 Otro parámetro importante es el período durante el cual el virus comienza a ser detectable por el ensayo de NAT. El mismo está relacionado directamente con el tiempo de duplicación de replicación viral, que es 0,3; 1 y 4 días para VHC, VIH y VHB, respectivamente. Para los 2 primeros virus, esta replicación viral rápida indica que el intervalo entre el período de eclipse y el infeccioso no cubierto por NAT es muy corto.29 Esta conclusión estaría avalada por datos experimentales obtenidos en chimpancés infectados con VIH en el cual la infectividad coincidía con ARN de VIH detectable por PCR.53 Existe una relación entre el tiempo de replicación viral y el nivel de viremia alcanzado en el período de ventana; para VHC es de 105 a 107 copias /mL, para VIH es de 102 a 107 copias/mL y para VHB de 102 a 104 copias/mL. Estos datos implican claramente la capacidad del NAT para disminuir el período de ventana, aún cuando las muestras se diluyan para la formación de pools.
El VHC es el de mayor prevalencia y mayor período de ventana, lo que explica que la detección de VHC por NAT es la prioridad en el pesquisaje de la sangre.
Hasta hace poco tiempo, la implementación de NAT se consideraba incompatible con las necesidades de un banco de sangre y no se consideraba una opción viable por las siguientes desventajas técnicas y económicas:
- Se requiere personal entrenado en técnicas de biología molecular y equipamiento que no es familiar a un servicio de medicina transfusional.
- Para prevenir la contaminación de las muestras, se requiere que la preparación de reactivos, procesamiento de las muestras y amplificación y detección se realicen en lugares separados, lo que aumenta la necesidad de espacio físico.
- La realización de las técnicas consume mucho tiempo, lo que da lugar a un esquema de trabajo incompatible con la rutina del pesquisaje del banco de sangre y la liberación de los productos. Esto se acentúa cuando se obtiene un resultado positivo y se debe discriminar cuál de los componentes del pool es el reactivo.
- El costo es alrededor de 10 veces mayor que el IEE más caro.
- No existe actualmente automatización completa.
Existen servicios de la Cruz Roja en Alemania que han implementado técnicas de NAT para VIH, VHB y VHC en donantes de sangre desde 1997.81,82 En EE.UU., casi todos los bancos de sangre realizaban NAT para detección de VIH y VHC desde 1999.83
La utilización de NAT fue propuesta por investigadores de Retroviral Epidemiology Donors Study (REDS) en 1996, 30 pero por las razones expuestas, se estimó que no era posible hasta lograr superar estos obstáculos. Un evento muy importante que aceleró la decisión de iniciar estas medidas de detección genómica fue la regulación implementada por el Committee for Proprietary Medicinal Products (CPMP).84 La misma requería que todos los derivados de plasma fueran estudiados para ARN de VHC a partir del 1º de julio de 1999. Esta medida tuvo lugar como consecuencia de infecciones por VHC que se habían producido en receptores de inmunoglobulinas por vía endovenosa.85,86 Posteriormente se requirió la obligación de detección de ARN de VIH, ADN de VHB y otras secuencias genómicas, como parte de los estándares de excelencia, aseguramiento y liderazgo que la Asociación de Productores de Proteínas Plasmáticas promueve.87
Como muchos bancos de sangre y fabricantes de derivados de plasma de EE.UU. exportan productos sanguíneos a Europa, esto presionó a utilizar el pesquisaje de NAT en ese país. La mayoría de los países de Europa y los EE.UU. están utilizando pools de sueros en rangos que varían de 16 a 128. Un resultado positivo en un pool primario implica que debe confirmarse el resultado inicial e identificar a la muestra positiva. Existen varias estrategias para hacerlo dependiendo del tamaño del pool, pero muchas veces no es posible la identificación individual y además este proceso requiere de varios días, lo que trae aparejado el problema de no poder utilizar los componentes que pueden almacenarse por poco tiempo, como son los concentrados plaquetarios.
La utilización de pools surgió como necesaria por los costos y la tecnología compleja, pero el debate acerca de las ventajas del pesquisaje individual es cada vez mayor, y se ha demostrado que el estudio de los especímenes en forma individual tiene la ventaja de una mayor sensibilidad.88 Además, se obtienen otros beneficios como una identificación rápida del donante, dando lugar a un tiempo de bloqueo muy bajo de componentes.29
La eficacia del NAT varía en forma importante en áreas con distinta prevalencia para VIH y VHC o aún en el mismo lugar entre donantes de diferente estrato social u origen geográfico. Por ejemplo, la prevalencia para VHC es homogénea en países desarrollados, pero en Alemania, la población estudiada por grandes centros de la Cruz Roja, encontró una prevalencia de 5 a 10 veces mayor que en donantes de un hospital universitario.81,82 En Gran Bretaña, la mayoría de los donantes son de repetición (>80 %) y el riesgo residual para VHC es menor a 1:200 000, siendo de 1:40 000 en los de primera vez, y en Francia se estima que en las 3 200 000 unidades anuales se prevendrían 6 para VHC, 1 para VIH y 7 para VHB; en el otro extremo, en países en desarrollo, el costo beneficio sería muy bajo.28 Se está considerando el pesquisaje de otros virus como VHA y parvovirus B19 por NAT.28
Sin lugar a dudas, los avances en la automatización permitirán el procesamiento de las muestras en forma individual, y el tiempo y la acumulación de datos proveerán una visión más realista acerca del costo-beneficio de la aplicación de NAT en la seguridad de las donaciones de sangre. Pero por el injusto orden económico mundial, en los países pobres, esta tecnología no está al alcance de los programas nacionales de sangre.
Summary
Transfusion-transmitted viral infections
The measures to guarantee blood safety include the use of habitual voluntary donors, the careful selection of the donor by physical examination and the medical interview, the self-exclusion, the detection of serological markers of infections, the maintenance of digitalized registers distributed in a rejected donor network and, more recently, the introduction of assays for the detection of nucleic acids. In spite of the screening of the serological markers of blood-borne diseases, there are 4 potential reasons for which this transmission may still occur: the window period of infection, the existance of asymptomatic donors who are chronic carriers of a transmissible infection with negative serological results, the infections given by mutants or rare strains and the laboratory errors. In this review, the main viruses with potential danger for blood safety, as well as the historical results of the screening in donors and patients from risk groups in Cuba are described.
Key words: Transfusion, screening, transmissible diseases, viral infections, HIV, HCV, HBV.
Referencias bibliográficas
1. Kleinman S, Busch M. The risks of transfusion-transmitted infection: Direct estimation and mathematical modelling. En: Contreras M, ed. New aspects of blood transfusion. London : Bailliere Tindall Publishing; 2000. p. 631-49.
2. Blejeri JL, Carreras LA, Salamone HJ. Riesgo de transmisión de infecciones por vía transfusional. Medicina 2002;62(3):259-78.
3. Glynn S, Kleinman S, Schreiber G, Busch M, Wright D, Smith J, et al. Trends in incidence and prevalence of mayor transfusion-transmissible viral infections in US blood donors, 1991 to 1996. JAMA 2000;284:229-35.
4. Alter H. Transfusion transmitted hepatitis C and non-A, non-B, non-C. Vox Sang 1994;67(Suppl 3):19-24.
5. Dodd R. Transfusion-transmitted hepatitis virus infection. Hematol Oncol Clin North Am 1995;9:137-54.
6. ------. Current viral risks of blood and blood products. Ann Med 2000;32:469-74.
7. Schreiber G, Busch M, Kleinman S, Korelitz J. The risk of transfusion-transmitted viral infections. N Engl J Med 1996;334:1685-90.
8. Choo Q, Kuo G, Weiner A, Overby L, Bradley D, Houghton M. Isolation of a cDNA clone derived from a blood-borne non-A, non-B viral hepatitis genome. Science 1989;244:359-62.
9. Kuo G, Choo Q, Alter H, Sitnick G, Redeker A, Purcell R, et al. An assay for circulating antibodies to a major etiologic virus of human non-A, non-B hepatitis. Science 1989;244:362-6.
10. Gresens C, Holland P. Current risks of viral hepatitis from blood transfusions. J Gastroenterol Hepatol 1998;13:443-9.
11. Donahue J, Muñoz A, Ness P, Brown D, Yawn D, McAllister H, et al. The declining risk of posttransfusion hepatitis C virus infection. N Engl J Med 1992;327:369-73.
12. Cheneyc C, Chopra S, Graham C. Hepatitis C. Infec Dis Clin North Am 2000;14;633-67.
13. Gretch D. Diagnostic tests for hepatitis C. Hepatology 1997;26(Suppl 1):43-7.
14. Kleinman S, Busch M, Korelitz J, Schreiber G. The incidence/window period model and its use to assess the risk of transfusion-transmitted VIH and VHC viral infections. Transfus Med Rev 1997;11:155-72.
15. Rivero RA, Hidalgo-Gato R, Martínez M, Hernández P, Ballester JM, Yamaguchi K, et al. Antibodies to hepatitis C virus in Cuban blood donors. Vox Sang 1992;63(4):285-6.
16. Padrón GJ, Arús E, Roca J, Lemus G. Hepatitis C in Cuba. Short Report. Libro de Reportes Cortos. Biotecnología Habana-92. Avances en Biotecnología Moderna 1992;1:7.
17. Galbán E, Padrón G, Arús E, González O, Rodríguez Z, Mora S, et al. Prevalencia del virus de la hepatitis C en donantes de sangre de Ciudad de La Habana. Rev Cubana Med Gen Integr 1992;8(4):324-9.
18. Rivero RA, Yamagushi K, Góngora M, Hidalgo-Gato R, Almagro D, Hernández P, et al. Prevalencia de anticuerpos contra el virus de la hepatitis C en pacientes cubanos con enfermedades hematológicas. Rev Cubana Hematol Inmunol Hemoter 1993;9(2):127-30.
19. Galbán E, Collado F, Mora S. Seroprevalencia del virus de la hepatitis C en diferentes grupos de la población y factores de riesgo asociados. Rev Cubana Med Gen Integr 1993;9(1):52-62.
20. González R, Rivero RA, Hernández P. Estudio de la transaminasa glutámico-pirúvica sérica y detección de anticuerpos anti-virus de la hepatitis C en donantes de sangre. Rev Cubana Hematol Inmunol Hemoter 1996;12(1):17-21.
21. Padrón GJ, Rodríguez Z, Rivera L, Arús E, Beltrán J, Roca J, et al. Virus de la hepatitis C en donantes de plasmaféresis. Sangre 1995;40(3):187-90.
22. Arús E, Infante M, Pérez M, Winograd R. Fiebre de origen desconocido e infección crónica por el virus de la hepatitis C. Rev Cubana Med 1995;34(3):209-11.
23. Hano OM, Jiménez G, Piñol F. Pesquisaje de AgsHB y de anti-HVC en pacientes con enfermedad intestinal crónica. Rev Cubana Hig Epidemiol 1998;36(2):127-30.
24. Infante M, Arús E, Fernández A, Gra B. Hallazgos clínicos, bioquímicos y morfológicos en 103 pacientes con anticuerpos contra el virus de la hepatitis C. Rev Cubana Med 1998;37(2):66-71.
25. Arús E, Rivera L, Fernández A, Infante M, Jorge R, Soto G, et al. Tratamiento de la hepatitis C con interferón alfa 2b recombinante: ensayo clínico controlado aleatoriado. Rev Cubana Med 2000;39(1):12-20.
26. Arús E, Rivera L, Infante M, Pérez M, Soto G, Gra B, et al. Tratamiento de la hepatitis viral aguda C con interferón alfa 2b recombinante: ensayo clínico. Rev Cub Med 2000;39(1):21-9.
27. Ballester JM, Rivero RA, Villaescusa R, Merlín JC, Arce AA, Castillo D, et al. Hepatitis C virus antibody and other blood transfusion transmitted infection markers in multitransfused Cuban patients. J Clin Virol (en prensa).
28. Busch M, Stramer S, Kleinman S. Evolving applications of nucleic acid amplification assays for prevention of virus transmission by blood components and derivatives. En: Garraty G, ed. Applications of molecular biology to blood transfusion medicine. Bethesda: American Association of Blood Banks; 1997. p. 123-77.
29. Allain J. Genomic screening for blood-borne viruses in transfusion settings. Clin Lab Haematol 2000;22:1-10.
30. Gallarda J, Dragon E. Blood screening by nucleic acid amplification technology: Current issues, future challenges. Mol Diagn 2000;5:11-22.
31. Aoyagi K, Ohue C, Iida K, Kimura T, Tanaka E, Kiyosawa K, et al. Development of a simple and highly sensitive enzyme immunoassay for hepatitis C core antigen. J Clin Microbiol 1999;37:1802-8.
32. Courouce AM, Le Marrec N, Bouchardeau F, Razer A, Maniez M, Laperche S, et al. Efficacy of VHC core antigen detection during the preseroconversion period. Transfusion 2000;40:1198-202.
33. Brojer E, Liszewski G, Niznik A, Rosiek A, Letowska M, Peterson JE, et al. Detection of VHC core antigen in VHC RNA positive, anti-VHC negative blood donations from Polish blood donors. Transfusion 2001;41:304.
34. Infectious disease testing for blood transfusions. NIH Consensus Development Panel on infectious disease testing for blood transfusions. JAMA 1995;274:1374-9.
35. Napals B, Desenclos J, Delarocque-Astagneau E, Drucker J. State of epidemiological knowledge and national management of hepatitis C virus infection in the European Community, 1996. Eur J Publ Hlth 1998;4:305-12.
36. Sloand E, Pitt E, Klein H. Safety of the blood supply. JAMA 1995;274:1368-73.
37. Seifried E, Roth W. Optimal blood donation screening. Br J Haematol 2000;109:694-8.
38. Korelitz JJ, Busch MP, Kleinman SH, Williams AE, Zuck TF, Gilcher RO, et al. Relationship between antibody to hepatitis B core antigen and retroviral infections in blood from volunteer donors. Transfusion 1996;36:232-7.
39. Busch MP, Dodd RY, Lackritz EM, AuBuchon JP, Birkmeyer JD, Petersen LR. Value and cost-effectiveness of screening blood donors for antibody to hepatitis B core antigen as a way of detecting window-phase human immunodeficiency virus type 1 infections. Transfusion 1997;37:1003-11.
40. Delle Monache M, Miceli M, Santolamazza M, Mannella E, Mercurio G, Di Lorenzo A, et al. Elevated alanine aminotransferase in blood donors: role of different factors and multiple viral infections. J Int Med Res 1999;27:134-42.
41. Barbara J. Surrogate tests. Vox Sang 2000;78(Suppl 2):63-5.
42. Goodnough L, Brecher M, Kanter M, AuBuchon J. Transfusion Medicine. Blood transfusion. N Engl J Med 1999;340:438-47.
43. Wang J, Lin J, Sheu J, Wang T, Chen D. Hepatitis E virus and posttransfusion hepatitis. J Infect Dis 1994;169:229-30.
44. Busch M, Young M, Samson S, Mosley J, Ward J, Perkins H. Risk of human immunodeficiency virus (VIH) transmission by blood transfusions before the implementation of VIH-antibody screenig. The Transfusion Safety Study Group. Transfusion 1991;31:4-11.
45. Cumming P, Wallace E, Schorr J, Dodd R. Exposure of patients to human immunodeficiency virus through the transfusion of blood components that test antibody-negative. N Engl J Med 1989;321:941-6.
46. Sarngadharan, M, Popovic M, Brusch L, Schupbach J, Gallo R. Antibodies reactive with human T-lymphotropic retroviruses (HTLV-III) in the serum of patients with AIDS. Science 1984;224:506-8.
47. Schorr J, Berkowitz A, Cumming P, Katz A, Sandler S. Prevalence of HTLV-III antibody in American blood donors. N Engl J Med 1985;313:384-5.
48. Lackritz EM, Satten GA, Aberle-Grasse J, Dodd RY, Raimondi VP, Janssen RS, et al. Estimated risk of transmission of the human immunodeficiency virus by screened blood in the United States. N Engl J Med 1995;333:1721-5.
49. Clavel F, Guetard D, Brun-Vezinet F, Chamaret S, Rey MA, Santos-Ferreira MO, et al. Isolation of a new human retrovirus from West African patients with AIDS. Science 1986;233:343-6.
50. Charneau P, Borman AM, Quillent C, Guetard D, Chamaret S, Cohen J, et al. Isolation and envelope sequence of a highly divergent VIH-1 isolate: Definition of a new VIH-1 group. Virology 1994;205:247-53.
51. Busch M, Couroucé A. Relative sensitivity of United States and European assays for screening blood for antibodies to human immunodeficiency virus. Transfusion 1997;37:352-3.
52. American Association of Blood Banks (AABB). Association Bulletin 99-3 NAT Implementation-WN. (1999 February 8) http://www.aabb.org/docs/wnab99-3.htm.
53. Murthy KK, Henrard DR, Eichberg JW, Cobb KE, Busch MP, Allain JP, et al. Redefining the HIV-infectious window period in the Chimpanzee model: Evidence suggest that viral nucleic acid testing can prevent blood-borne transmission. Transfusion 1999;39:688-93.
54. Niu M, Stein D, Schnittman S. Primary human immunodeficiency virus type 1 infection: Review of pathogenesis and early treatment intervention in humans and animal retrovirus infections. J Infec Dis 1993;168:1490-501.
55. Poiesz B, Ruscetti F, Gazdar A, Bunn P, Minna J, Gallo R. Detection and isolation of type C retrovirus particles from fresh and cultured lymphocytes of a patient with cutaneous T-cell lymnphoma. Proc Natl Acad Sci USA 1980;77:7415-9.
56. Kalyanaraman U, Sarngadharan M, Robert-Guroff M, Miyoshi I, Golde D, Gallo R. A new subtype of human T-cell leukemia virus (HTLV-II) associated with a T-cell variant of hairy cell leukemia. Science 1982;218:571-3.
57. Manns A, Hisada M, La Grenade L. Human T- lymphotropic virus type I infection. Lancet 1999;353:1951-8.
58. Newman C, Rosenblatt J. Human T-cell lymphotropic viruses. En: McCance D, ed. Human Tumor Viruses. Washington DC: ASM Press; 1998. p. 331-57.
59. Okochi, K, Sato H. Transmission of adult T-cell leukemia/lymphoma virus (HTLV-I) through blood transfusion and its prevention. AIDS Res 1986;2:157-61.
60. Lemaire J, Vosin S, Coste J. Serological diagnosis of HTLV-I/II infections in France. Nucl Med Biol 1994;21:433-9.
61. Williams A, Sullivan M. Transfusion-transmitted retrovirus infection. Hematol Oncol Clin North Am 1995;9:115-36.
62. Zaaijer H, Cuypers H, Dudok de Wit C, Lelie P. Results of one year screening of donors in the Netherlands for human T-lymphotropic virus type I: Significance of Western blot patterns for confirmation of HTLV infection. Transfusion 1994;34:877-80.
63. Okochi K, Sato H, Hinuma Y. A retrospective study on transmission of adult T cell leukemia virus by blood transfusion: Seroconversion in recipients. Vox Sang 1984;46:245-53.
64. Goto K, Saeki K, Kurita M, Ohno S. HTLV-I associated uveitis in central Japan. Br J Ophtalmol 1995;79:1018-20.
65. Navea L, Silva E, Rivero RA, Hernández P. Pesquisaje de anticuerpos contra el HTLV-I en pacientes con hemopatías malignas. Rev Cubana Hematol Inmunol Hemoter 1990;6(1):101-6.
66. Hernández P, Rivero RA, Ballester JM, Navea L, Matutes E, Catovsky D, et al. Very low seroprevalence of HTLV-I/II antibodies in Cuba: Antibodies in blood donors and in hematological and non-hematological patients. Vox Sang 1991;61:277-8.
67. Rivero RA, Hernández P, Suárez O, Hidalgo-Gato R, Navea L, Yamaguchi K, et al. Detección de anticuerpos contra el virus linfotrópico de la célula T HTLV-I/II en pacientes cubanos con insuficiencia renal crónica en hemodiálisis. Sangre 1992;37(3):05-9.
68. Lubián AL, Díaz HM, Silva E, Pérez MT, Cruz O, de la Fuente JL, et al. Seroprevalencia de la infección por HTLV-I en diferentes grupos de riesgo estudiados en Cuba. Rev Cubana Med 1998;37(4):199-204.
69. Silva E, Pérez MT, Lubián AL, de la Fuente JL, Navea L, Cruz O. Pesquisaje de anticuerpos contra el virus linfotrópico de células T humanas tipo I (HTLV-I) en donantes de sangre y grupos de riesgo. Rev Cubana Med Trop 1997;49(1):24-7.
70. Muñío JE, Díaz HM, Carnot J, de Castro R, Navea L, Rodríguez I. Leucemia / linfoma T del adulto. Primer caso en Cuba. Rev Cubana Med 2003;42(3).
71. Mooltes D. Transfusion transmitted cytomegalovirus. Pediatr Pathol Mol Med 2000;19:149-59.
72. Apperley J, Goldman J. Cytomegalovirus: Biology, clinical features and methods for diagnosis. Bone Marrow Transplant 1988;3:253-64.
73. Lorigados L, Aranda RE, Rivero R, Salas M, Rojas A, Ballester JM. Detección de anticuerpos contra el citomegalovirus en donantes de sangre. Rev Cubana Hematol Inmunol Hemoter 1987;3(1):105-12.
74. Rivero RA, Lorigados LC, Macías C, Machado H, Álvarez PL, Hernández A, Ballester JM. Anticuerpos anticitomegalovirus humano (CMV) en embarazadas a término y en recién nacidos vivos de Ciudad de La Habana. Rev Cubana Hematol Inmunol Hemoter 1988;4(1):117-24.
75. Alfonso ME, Macías C, Basanta P, Lorigados LC, Orbeal L, Fonte L, Ballester JM. Presencia de anticuerpos contra citomegalovirus en pacientes politransfundidos. Rev Cubana Hematol Inmunol Hemoter 1987;3(2):293-304.
76. Silva E, Navea L, Suárez O, Rivero RA. Seropositividad al citomegalovirus (CMV) en receptores de trasplante renal. Rev Cubana Hematol Inmunol Hemoter 1990;6(1):75-83.
77. Azzi A, Morfini M, Mannucci P. The transfusion-associated transmission of parvovirus B19. Transfus Med Rev 1999;13:194-204.
78. Brown K, Young N, Barbosa L. Parvovirus B19: Implications for transfusion medicine. Summary of a workshop. Transfusion 2001;41:130-5.
79. Yoto Y, Kudoh T, Haseyama K, Suzuki N, Oda T, Katoh T, et al. Incidence of human parvovirus B19 DNA detection in blood donors. Br J Haematol 1995;91:1017-8.
80. Azzi A, Ciappi S, Zakvrzewska K, Morfini M, Mariani G, Mannucci P. Human parvovirus B19 infection in hemophiliacs first infused with two high-purity, virally attenuated factor VIII concentrates. Am J Hematol 1992;39:228-30.
81. Cardoso M, Koerner K, Kubanek B. PCR screening in the routine of blood banking of the German Red Cross Blood Transfusion Service of Baden-Würtemberg. Infusionsther Transfusionsmed 1998;25:116-20.
82. Roth W, Weber M, Seifried E. Feasibility and efficacy of routine PCR screening of blood donations for hepatitis C virus, hepatitis B virus, and VIH- 1 in a blood-bank setting. Lancet 1999;353:359-63.
83. Stramer S, Caglioti S, Strong D. NAT of the United States and Canadian blood supply. Transfusion 2000;40:1165-8.
84. Committee for Proprietary Medicinal Products (CPMP). The application of genome amplification technologies (GAT) to plasma fractionation pools. 1997; CPMP/BWP/390/97 (rev.6)
85. Yu M, Mason B, Tankersley D. Detection and characterization of hepatitis C virus RNA in immune globulins. Transfusion 1994;34:596-602.
86. Nubling C, Wilkommen H, Lower J. Hepatitis C transmission associated with intravenous immunoglobulins. Lancet 1995;345:1174.
87. The NAT Task Force Group. Technical Considerations for the Performance of Nucleic Acid and Amplification Technology (NAT). Biologicals 2003;31:153-9.
88. Busch M, Dodd R. NAT and blood safety: What is the paradigm? Transfusion 2000;40:1157-60.Recibido: 20 de agosto de 2006. Aprobado: 13 de septiembre de 2006.
DrC. René A. Rivero Jiménez. Instituto de Hematología e Inmunología. Apartado Postal 8070, Ciudad de La Habana, CP 10800, Cuba. Tel (537) 6438268, 6438695, 6434214, Fax (537) 442334. e -mail: ihidir@hemato.sld.cu