Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.23 n.1 Ciudad de la Habana ene.-abr. 2007
Artículos originales
Instituto de Hematología e InmunologíaEfecto in vitro del Ateromixol sobre los linfocitos y neutrófilos humanos
Lic. Lázaro O. del Valle Pérez, Lic. Isabel Torres Leyva, Lic. Bertha Beatriz Socarrás Ferrer, Dra. Vianed Marsán Suárez, Lic. Yanelkys Cos Padrón, Dra. Consuelo Macías Abraham y Lic. Anissa Gramatges Ortiz
Resumen
El Ateromixol es un producto desarrollado por el Centro Nacional de Investigaciones Científicas y comercializado por los Laboratorios Delmer de Ciudad de La Habana. Tiene como principio activo al policosanol, constituido por una mezcla de alcoholes primarios alifáticos superiores obtenido de la cera de Saccharum officinarum L. Se estudió el efecto in vitro del Ateromixol, conocido como PPG, sobre los linfocitos y neutrófilos de 15 donantes voluntarios de sangre y de 15 enfermos con diagnóstico de inmunodeficiencia celular mediante la prueba de transformación linfoblástica, con el empleo de timidina tritiada, la técnica de roseta activa y la prueba de función fagocítica. No se observaron diferencias significativas en el análisis estadístico de las condiciones experimentales sin Ateromixol y con diluciones desde 500 m g/mL hasta 3,90 m g/mL.
Palabras clave : transformación blástica, roseta activa, linfocitos, función fagocítica, Ateromixol.
Las plantas han sido utilizadas por el hombre con diversos fines desde sus orígenes hasta nuestros días, entre los que se destacan su uso como remedios medicinales y la obtención de sustancias no nutritivas con actividad biológica y por su efecto sobre el sistema inmune del hombre y animales de interés humano, lo cual se ha intensificado en las últimas décadas del siglo pasado y continúa en la actualidad.1-4
El Ateromixol (A) tiene como principio activo al policosanol, constituido por una mezcla natural de alcoholes primarios alifáticos superiores aislada de la cera de la caña de azúcar (Saccharum officinarum L). Su principal componente es el 1-octacosanol, encontrándose además presentes los alcoholes siguientes: 1-tetracosanol, 1-hexacosanol, 1-heptacosanol, 1-nonacosanol, 1-triacontanol, 1-dotriacontanol y tetratriacontanol. Se trata de un medicamento que actúa inhibiendo la síntesis de colesterol antes de la formación de mevalonato.5-9
El objetivo de este trabajo fue determinar el efecto in vitro del A sobre la proliferación de los linfocitos humanos mediante la transformación blástica (TB), la formación de roseta activa (RA), así como su efecto sobre los granulocitos polimorfonucleares neutrófilos utilizando la técnica de función fagocítica en donantes supuestamente sanos y pacientes con diagnóstico de inmunodeficiencia celular.
Métodos
Se estudiaron 15 donantes voluntarios del Servicio de Medicina Transfusional del Instituto de Hematología e Inmunología y 15 enfermos con diagnóstico de inmunodeficiencia celular que no habían recibido ningún medicamento en el mes anterior a la extracción de la muestra. En cada caso se extrajeron 20mL de sangre heparinizada (15 UI/mL) con jeringuillas plásticas desechables. El aislamiento de las células mononucleares se efectuó según el método de Böyum modificado sobre un gradiente de Ficoll- Hypaque (densidad 1,077 g/mL, Sigma, EE.UU.).10
Para evaluar la respuesta al A los linfocitos se incubaron a una concentración de 2X105 /pocillo en placas de 96 pozos (NUNC, Dinamarca) en 200 ml de RPMI 1640 al 10 % de suero fetal bovino (Sigma, EE.UU.) sin exposición al A (0,5mg/mL) y con diluciones dobles de este producto desde 500 m g/mL hasta 3,90 m g/mL durante 72 h a 37 ºC, en atmósfera húmeda al 5 % de CO2 en una incubadora (ASSAB, Suecia). Para determinar la viabilidad celular de los linfocitos y granulocitos a las diferentes diluciones en el tiempo cero y 24 horas después se utilizó la técnica de exclusión del azul tripán, que en todos los casos fue superior al 98 %. Seis horas antes de culminar el cultivo se le añadió a cada pozo 1 m Ci de timidina tritiada (Amersham, Inglaterra) (actividad específica 20Ci/mmol). Las placas se procesaron en un cosechador de células (Flow Laboratories, Inglaterra). La detección de partículas b se realizó en un equipo RAK b (LKB, Suecia).11 Los resultados se expresaron en conteos por minutos (cpm).
El estudio del efecto del A sobre la formación de RA se efectuó con la incubación de los linfocitos con A (dilución 1:2 -1/128), a 4 ºC durante las 24 h previas a la formación de la roseta.12 El efecto del A (dilución 1/32) sobre los neutrófilos se determinó por la incubación durante 24 horas, a 4 ºC sin y con el medicamento, con el empleo de la técnica de la función fagocítica.13
Preparación de la solución de A: se realizó con tabletas (Ateromixol-5, policosanol 5mg, elaborado en los Laboratorios Dalmer, Ciudad de La Habana, Cuba). Se disolvieron 5mg en 10mL de RMPI 1 640 y se incubó a 4 ºC durante 60 minutos. Posteriormente, la solución se centrifugó a 2 500 rpm, durante 15 minutos a 4 ºC y finalmente se filtró por un dispositivo de 0,2 m m (Nalgene, EE.UU.) hasta su uso.
Para comparar los resultados obtenidos entre las muestras que se expusieron al A, y en aquellos en que no se usó este producto, se utilizó la prueba estadística t de Student para muestras pareadas.
Bioética: A los pacientes y a los donantes se les explicó el objetivo del estudio, los posibles beneficios derivados de los resultados y la ausencia de riesgos asociados. Se confeccionó una planilla para el consentimiento informado de los donantes y enfermos que participaron en el estudio.
Resultados
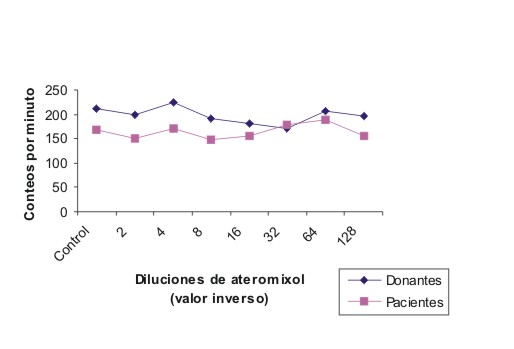
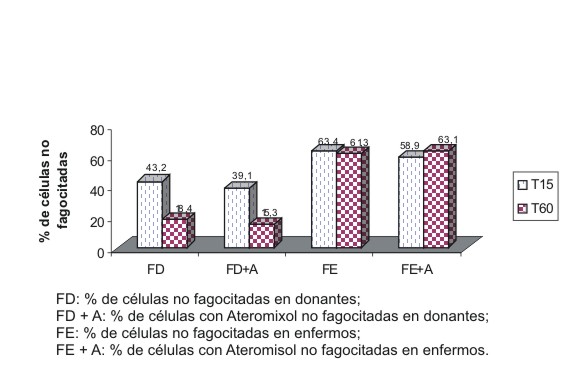
La transformación blástica in vitro de los linfocitos sin A y con diluciones desde (1:2-1:128) en donantes y enfermos con diagnóstico de inmunodeficiencia celular, no produjo cambios significativos en la estadística (fig. 1). En los linfocitos de donantes y pacientes con inmunodeficiencia celular previamente incubados sin A y con similares diluciones antes de la formación de la RA, no se observaron tampoco diferencias significativas en el análisis estadístico (fig. 3). Similares resultados se hallaron con el A (dilución 1/32) sobre los neutrófilos con el empleo de la técnica de la función fagocítica (fig. 3).
Fig. 1. Efecto in vitro del Ateromixol en la activación linfocitaria.
Fig. 2. Efecto in vitro del Ateromixol sobre la formación de roseta activa (RA).
Fig. 3. Efecto in vitro del Ateromixol sobre la función fagocítica.
Discusión
La viabilidad celular de los linfocitos y granulocitos en las diferentes diluciones a la hora de incubación y 24 h más tarde, nos permite afirmar que no es tóxica para las diluciones probadas.
El A no aumentó la proliferación de los linfocitos humanos tanto de los controles sanos como de los enfermos con diagnóstico de inmunodeficiencia celular, lo que coincide con otro reporte donde solo se estudiaron donantes sanos.14 Similares resultados se hallaron con la RA y la función fagocítica, lo que demuestra que el A no produce cambios en los linfocitos ni en los granulocitos de donantes sanos y de pacientes con trastornos del sistema inmune celular. No hemos hallado en los trabajos revisados ningún otro reporte que esté relacionado con las células involucradas en la respuesta inmune. Estos resultados son importantes por el amplio uso que tiene este medicamento en el tratamiento de las hiperlipidemias.
Consideramos de interés estudiar el efecto in vitro del A sobre los linfocitos humanos para determinar su efecto sobre la expresión de los marcadores de activación HLA-DR, CD25 y CD2, así como la realización de un estudio clínico controlado del A en enfermos con inmunodeficiencia que reciben este tratamiento para sus hiperlipidemias y en un ensayo clínico en donantes sanos.
Agradecimientos
A las técnicas de laboratorio clínico del Instituto de Hematología e Inmunología: Martha Ponce, Lourdes Palma, Mónica García, Yamila Junco y Gladys Graña, por su apoyo técnico en la ejecución de este trabajo.
Summary
Effect in vitro of Ateromixol on the human lymphocytes and neutrophiles
Ateromixol is a product developed by the National Center of Scientific Research and commercialized by Delmer Laboratories of Havana City . Its active principle is polycosanol, which is composed of a mixture of primary aliphatic higher alcohols obtained from the wax of Saccharum officinarum L. The effect in vitro of Ateromixol, known as PPG, on the lymphocytes and neutrophiles of 15 voluntary blood donors with diagnosis of cellular immunodeficiency was studied by the lymphoblastic transformation test, with the use of tritiated timidine, the active rosette technique and the phagocytic function test. No significant differences were observed in the statistical analysis of the experimental conditions without Ateromixol and with dilutions from 500 m g/mL to 3.90 m g/mL.
Key words: Blastic transformation, active rosette, lymphocytes, phagocytic function.
Referencias bibliográficas
1. Muanza DN, Euler KL, Williams L. Screening and antitumour and anti-VIH activities of nine medicinal plants from Zaire. Int J Pharmacogn 1995;33:98-106.
2. Menéndez R, Más R, Amor AM, Ledón N, Pérez J, González RM, et al. Inhibition of rat lipoprotein lipid peroxidation by the oral administration of D003, a mixture of very long-chain satured fatty acids. Can J Physiol Pharmacol 2002;80:13-21.
3. García L, García V, Rojo DM, Sánchez E. Plantas con propiedades antioxidantes. Rev Cubana Invest Biomed 2001;20:231-5.
4. Hernández M, Prieto E. Plantas que contienen polifenoles. Antioxidantes dentro del estilo de vida. Rev Cubana Invest Biomed 1999; 18:12 -4.
5. MINSAP. Plantas medicinales. Fitomed III. La Habana: Editorial Ciencias Médicas; 1994. p. 16-7.
6. Roig JT. Plantas medicinales, aromáticas o venenosas. La Habana: Científico-Técnica; 1988. p. 281-2
7. Castano G, Menéndez R, Mas R, Amor A, Fernández JL, González RL, et al. Effects of policosanol and Iovastatin on lipid profile and lipid peroxidation in patients with dislipidemia associated with type 2 Diabetes Mellitus. Int J Clin Pharmacol Res 2002;22:89-99.
8. Castano G, Más R, Fernández L, Gámez R, Illnait J. Effects of policosanol and Iovastatin in patients with intermittent claudication: a double-blind comparative pilot study. Angiology 2003;54:25-38.
9. Cabrera L, Uribari E, Laguna A, Sierra R, Mederos D, González M, et al. Study of the interaction between policosanol and excipients. Boll Chim Farm 2002;141:138-42.
10. Böyum A. Isolation of mononuclear cells and granulocytes from human blood. Scand J Clin Lab Invest 1968;10:1041-9.
11. Del Valle LO, Macías C, Torres I, Socarrás BB, Marsán V, Sánchez M. Efecto in vitro de la espirulina sobre los linfocitos humanos . Rev Cubana Hematol Inmunol Hemoter 2002;18(2) Disponible en: http://bvs.sld.cu/revistas/hih/vol18_2_02/hih06202.htm
12. Cruz C, Fernández NL, Bernal B, Hernández P, Ballester JM. Técnicas de rosetas. La aplicación en pacientes con alteraciones inmunológicas. Rev Cubana Med 1981;20:379-8.7
13. Torres I, del Valle L, Marsán V, Socarrás B, Macías C. Evaluación evolutiva de la función fagocítica de los polimorfonucleares. Rev Cubana Hematol Inmunol Hemoter 2004;20(2) Disponible en: http://bvs.sld.cu/revistas/hih/vol20_2_04/hih03204.htm
14. Del Valle L, Macías C, Esquivel I, Rodríguez J, Alpízar Y. El ateromixol y la transformación blástica. Rev Cubana Hematol Inmunol Hemoter 1999;15(2):146-7.
Recibido: 22 de diciembre del 2006. Aprobado: 15 de enero del 2007. Lic. Lázaro O. del Valle Pérez. Instituto de Hematología e Inmunología. Apartado Postal 8070, Ciudad de La Habana, CP 10800, Cuba. Tel (537) 6438268, 6438695, 6434214, Fax (537) 442334. e-mail: ihidir@hemato.sld.cu