Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.23 n.2 Ciudad de la Habana Mayo-ago. 2007
Artículos originales
Instituto de Hematología e Inmunología
Caracterización inmunofenotípica de la leucemia linfoide crónica-B
Immunophenotypical characterization of B-cell chronic lymphocytic leukemia
Dra. Miriam Sánchez Segura, Dra. Vianed Marsán Suárez, Lic. Bertha Beatriz Socarrás Ferrer, Lic. Yanelkys Cos Padrón, Lic. René Rivero Jiménez, Lic. Mercedes Martínez Machado, Lic. Isabel María Torres Leyva, Lic. Lázaro O. del Valle Pérez, Prof. Porfirio Hernández Ramírez y DraC. Consuelo Macías Abraham
Resumen
Se realizó la caracterización inmunofenotípica de 115 pacientes con leucemia linfoide crónica de fenotipo B, de células procedentes de médula ósea y sangre periférica mediante un ultramicrométodo inmunocitoquímico en el Instituto de Hematología e Inmunología durante un período de 13 años y medio. Los antígenos más frecuentemente expresados fueron: HLA-DR (98 %), CD5 (94 %), CD19 (93 %), CD20 (90 %), CD22 (84 %) e IgS (76 %). En 7 pacientes no se expresó el antígeno CD5. Se halló pobre expresión de antígenos mielomonocíticos como el CD11b (2/27) (7,4 %) y el CD11c (5/13) (38,4 %). Hubo baja expresión de IgS y de CD22 de membrana, ya que estos antígenos solo estuvieron sobreexpresados en 12,5 % y 32 % de los enfermos, respectivamente. Se encontró un predominio en la expresión de cadenas ligeras kappa. El comportamiento fenotípico de los pacientes con leucemia linfoide crónica B se correspondió con lo comunicado por otros autores para esta entidad.
Palabras clave: leucemia linfoide crónica B, inmunofenotipaje, anticuerpos monoclonales.
Summary
The immunophenotypical characterization of bone marrow cells and peripheral blood from 115 patients with B-cell chronic lymphocytic leukemia was performed by an immunocytochemical ultramicromethod at the Institute of Hematology and Immmunology during 13.5 years. The most frequently expressed antigens were: HLA-DR (98 %), CD5 (94 %), CD19 (93 %), CD20 (90 %), CD22 (84 %) and IgS (76 %). The CD-5 antigen was not present in 7 patients. It was found a poor expression of myelomonocytic antigens, such as CD11b (2/27) (7.4 %) and CD11c (5/13) (38.4 %). It was observed a low expression of IgS and of CD22 membrane, since these antigens were only overexpressed in 12.5 % and 32 % of the sick, respectively. There was a predominance in the expression of kappa light chains. The phenotypic behaviour of the patients with B-cell chronic lymphocytic leukemia corresponded with what has been reported by other authors about this entity.
Key words: B-cell chronic lymphocytic leukemia B, immunophenotyping, monoclonal antibodies.
La leucemia linfoide crónica B (LLC-B) es una enfermedad hematológica maligna caracterizada por la acumulación de linfocitos B maduros CD5 + con un defecto en la inducción de la apoptosis.1 Es el trastorno linfoproliferativo y la leucemia del adulto más común en los países occidentales, ocurre más frecuentemente en hombres que en mujeres y la edad promedio al diagnóstico es de 65 años.2
Varias anormalidades genéticas han sido encontradas en la LLC-B, pero estas son predominantemente eventos secundarios y los fenómenos iniciales en la etiología de la enfermedad aún no están establecidos.3
Estudios recientes han mostrado que la LLC-B se compone de 2 entidades distintas, ya sea con genes de región variable de cadena pesada de inmunoglobulina (Ig) no mutados, la cual tiene un curso clínico agresivo, o somáticamente hipermutados (más del 50 % de los pacientes) con un pronóstico más favorable, una evolución lenta y probabilidades de mayor supervivencia.4,5
La disfunción inmune profunda es una característica constante de los pacientes con LLC-B. Las anormalidades inmunológicas incluyen hipogammaglobulinemia, deterioro en el cambio de clase de Ig y disminución en la formación de centros germinales. El estado de depresión inmune hace a los pacientes con LLC-B altamente susceptibles a padecer de infecciones, las cuales contribuyen grandemente a la morbimortalidad en esta enfermedad.
También son frecuentes los defectos en la función de la célula T, y se ha sugerido que son el resultado de los efectos inhibitorios ejercidos por los linfocitos B malignos. 6 Los trastornos de la regulación inmune se asocian con fenómenos de autoinmunidad. Las enfermedades autoinmunes que usualmente se presentan son la anemia hemolítica autoinmune (AHAI) y la púrpura trombocitopénica (PTI) de naturaleza inmune.7
La morfología y el inmunofenotipo son las principales herramientas diagnósticas para distinguir a la LLC-B de otros trastornos linfoproliferativos crónicos de la célula B. El inmunofenotipaje es esencial y contribuye a evaluar la expresión de ciertos antígenos, por lo que es de importantancia no solo diagnóstica, sino también pronóstica, y puede ser de gran utilidad al considerar la patogénesis de la enfermedad.8,9
En este trabajo se realizó la caracterización inmunofenotípica de los pacientes con LLC-B diagnosticados en el Instituto de Hematología e Inmunología durante un período de 13 años y medio, con el objetivo de conocer la expresión antigénica más frecuente, los antígenos (Ags) menos expresados y la expresión de Ags mielomonocíticos, lo que contribuirá a mejorar el diagnóstico, el pronóstico y el tratamiento de los pacientes con esta hemopatía maligna.
Métodos
En el Departamento de Inmunología del Instituto de Hematología e Inmunología se clasificaron 115 pacientes con LLC-B, 64 del sexo femenino y 51 del masculino, con una edad promedio de 61,48 años y un rango de edad de 25 a 96 años.
Para la caracterización inmunofenotípica de las células leucémicas, se aplicó un método de inmunofenotipaje celular y una batería mínima de anticuerpos monoclonales (AcMo) dirigidos tanto contra Ags linfoides T y B como mieloides (tabla). Para el inmunofenotipaje de las células leucémicas, se aplicó el ultramicrométodo inmunocitoquímico (UMICIQ).10,11
Tabla. Batería de anticuerpos monoclonales (AcMo) utilizados para el inmunofenotipaje celular
| Ac Mo | Linaje de la célula que identifica | Procedencia |
| Anti- CD2 (OKT11) | Células T | Filatov Institute of Immunology |
| Anti- CD3 (OKT3) | Células T | Hospital Clinic de Barcelona |
| Anti- CD4 (OKT4) | Células T | Filatov Institute of Immunology |
| Anti- CD5 (Cris 1) | Células T | Hospital Clinic de Barcelona |
| Anti-CD8 (OKT8) | Células T | Filatov Institute of Immunology |
| Anti- CD19 (B4) | Células B | Institute of Cancer Research |
| Anti- CD20 (B1) | Células B | Institute of Cancer Research |
| Anti- CD21 (OKB7) | Células B | Institute of Cancer Research |
| Anti- CD22 (Leu 14) | Células B | Hospital Clinic de Barcelona |
| Anti- IgS | Células B | Hospital Clinic de Barcelona |
| Anti- cadenas k | Células B | Hospital Clinic de Barcelona |
| Anti- cadenas l | Células B | Hospital Clinic de Barcelona |
| Anti- HLA-DR | Otros | Hospital Clinic de Barcelona |
| Anti- CD11b (OKM1) | Células mieloides | Filatov Institute of Immunology |
| Anti- CD11c | Células mieloides | Filatov Institute of Immunology |
Las células mononucleares procedentes de sangre periférica o del aspirado de la médula ósea fueron obtenidas mediante el método de Böyum modificado12 y se realizó el ajuste celular a 4 x 10 cel /mL. Se determinó la viabilidadcelular (mayor del 95 %) mediante el método de exclusión del tripán azul.
En el método UMICIQ se utilizan células no deshidratadas que se unen por una atracción electrostática de cargas a láminas portaobjeto de cristal que contienen 21 pocillos recubiertos con poli-L lisina. Este procedimiento técnico tiene la ventaja de hacer posible la detección de Ags de membrana y citoplasmáticos por la utilización del detergente Brij 56, lo que permite la identificación de estadios de diferenciación celular muy tempranos, donde los Ags aún no están expresados en la membrana plasmática. Para el revelado de la reacción, se emplea un segundo Ac que se conjuga con la enzima peroxidasa, la cual reacciona luego con un sustrato para, en presencia de un cromógeno, originar un producto insoluble que puede observarse a través del microscopio óptico.
En la tinción se utiliza el cloronaftol, que posibilita la distinción entre células linfoides y mieloides y en la contratinción se utilizan el aminoetilcarbazol, que tiñe a las células positivas de color amarillo-naranja y el hemalón que favorece la visualización de la morfología de las células.10,11
Se contaron al menos 200 células en cada lámina y se consideró positivo el marcador cuando su valor era ³ 20 %.
Resultados
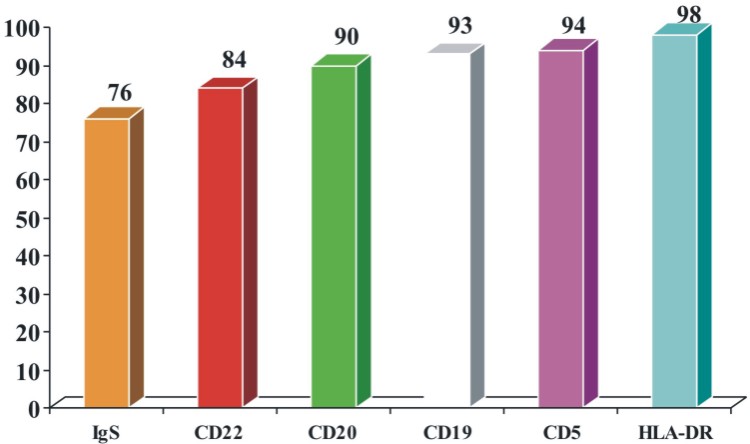
En los pacientes con LLC-B, los Ags más frecuentemente expresados fueron: HLA-DR (98 %), CD5 (94 %), CD19 (93 %), CD20 (90 %), CD22 (84 %) e Ig S (76 %). En 7 pacientes (6 %) no se encontró expresión del Ag CD5 (fig. 1).
Fig. 1. Expresión antigénica más frecuente en pacientes con LLC-B.
La Ig de superficie solo tuvo una alta expresión en 5 pacientes (12,5 %), el CD22 de membrana solo estuvo sobre expresado en el 32 % de los pacientes estudiados.
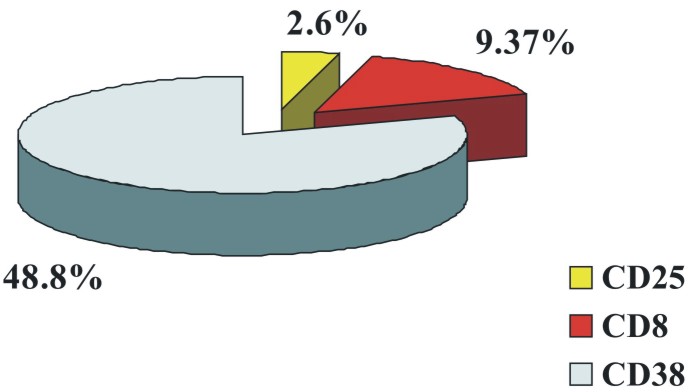
Con menor expresión antigénica se encontró el CD38 (48,8 %), el CD8 (9,37 %) y el CD25 (2,6 %) (fig 2).
Fig. 2. Expresión antigénica menos frecuente en pacientes con LLC-B.
Los Ags mielomonocíticos expresados fueron el CD11b y el CD11c. El CD11b se determinó en 27 pacientes y lo expresaron 2 (7,4 %), mientras que el CD11c se realizó en 13 y lo expresaron 5 (38,4 %) (fig. 3).
Fig. 3. Expresión de antígenos mielomonocíticos en la LLC-B.
Hubo expresión de cadenas ligeras de Ig en 100 pacientes (93,45 %), con sobreexpresión solo en el 12,14 % de los casos. Hubo predominio de cadenas ligeras k (53 %) y una relación k: l de 1,13:1 (fig. 4).
Fig. 4. Expresión de cadenas ligeras (L) de Ig en la LLC-B. Se expresaron cadenas L de Ig en el 93,45 % de los pacientes.
Se determinó la roseta de ratón en 39 pacientes y resultó positiva (≥30 %) en 31 de ellos (79,48 %) (fig. 5).
Fig. 5. La determinación de roseta de ratón se realizó en 39 pacientes y fue positiva en 31 (79,48 %).
Discusión
Los últimos años han aportado importantes y nuevos conocimientos sobre las características biológicas e inmunofenotípicas de las células de la LLC-B, lo que ha contribuido a modificar los criterios de diagnóstico y pronóstico en esta enfermedad.13,14 La LLC-B es una enfermedad heterogénea, lo que se refleja en la variedad clínica y los hallazgos de laboratorio que experimentan los pacientes.15
Esta enfermedad es la hemopatía linfoide más común en la ancianidad, sin embargo, aproximadamente el 10 % de los enfermos tiene menos de 50 años en el momento del diagnóstico.7,16,17 En este trabajo se diagnosticó LLC-B en 18 pacientes menores de 50 años (15,6 %), lo que difiere ligeramente de lo encontrado por otros autores.
En cuanto a la edad promedio y al sexo, Cmunt y colaboradores, en un estudio de inmunofenotipaje de 100 pacientes con LLC-B, encontraron que la edad promedio fue de 58,2 años, similar a los datos de este trabajo (61,48 años), con 62 pacientes del sexo masculino y 38 del femenino. 18 Esto último difiere de lo encontrado en este estudio, donde hubo un mayor número de mujeres afectadas por la enfermedad, lo que podría atribuirse a características demográficas típicas de nuestro país.
La frecuencia antigénica hallada en los pacientes con LLC-B se asemeja a la reportada por otros autores. En un estudio inmunofenotípico de 54 casos con LLC-B realizado en Suiza, se encontró que el 100 % de los enfermos expresaron el Ag CD5, 97 % el CD19, 82 % el HLA-DR, 79 % la IgS y 67 % el CD22.19
El CD5 es un marcador de células T expresado de forma aberrante por las células de la LLC-B, 20 el cual puede participar en la patogénesis de los fenómenos autoinmunes. Sin embargo, del 7-20 % de los pacientes con esta entidad son CD5-, 21 lo que concuerda con los resultados obtenidos en este trabajo, en el que no hubo expresión de este Ag en 7 pacientes, lo que corresponde con el 6 % de los casos estudiados.
La baja expresión de la IgS en esta hemopatía maligna ha sido descrita por diferentes investigadores, y este hecho puede depender principalmente de una pobre expresión de la molécula de CD79b.22-24 En nuestro trabajo se encontró pobre expresión de IgS, pues aunque este marcador estuvo expresado en el 76 % de los enfermos, solo estuvo sobreexpresado en 5 de ellos (12,5 %).
La LLC-B también está fenotípicamente caracterizada por una débil expresión del CD22 de membrana.25,26 En la caracterización inmunológica este marcador solo tuvo una sobreexpresión en el 32 % de los enfermos, lo que está de acuerdo con lo reportado por otros autores.
En nuestros pacientes se encontró una baja expresión del Ag CD38 (48,8 %).
Otros autores como Domenech, lo han encontrado expresado en el 19 % de los casos estudiados,27 y otros en 13/29, para el 44,8 %. 24 Los estudios clínicos indican que la LLC-B CD38+ está caracterizada por un curso clínico más agresivo y con alteraciones citogenéticas más complejas que las LLC-B CD38-, datos que refuerzan el valor del CD38 como factor pronóstico en esta enfermedad.28-30
Una característica inmunofenotípica de la LLC-B es la expresión en la superficie del linfocito de Ags propios de la célula B. Sin embargo, la presencia concomitante de otros Ags distintivos de una subpoblación particular de leucocitos, por ejemplo, de células T, como el CD8, es un hallazgo inusual en esta enfermedad. La expresión aberrante de este Ag la han descrito algunos investigadores en un solo paciente, 31,32 y otros lo han encontrado expresado en 10, 33 lo que guarda relación con nuestros resultados, donde se encontró expresión de este marcador en 3/39 pacientes (9,37 %).
Se observó pobre expresión de Ags mielomonocíticos como el CD11b (7,4 %) y el CD11c (38,4 %) en los pacientes con LLC-B, resultados que se asemejan al de otros estudios, como el realizado en 106 pacientes con esta enfermedad, donde se encontró expresión del CD11c en el 49 % de los casos analizados, lo que correspondió fundamentalmente con pacientes en etapa temprana de la enfermedad y resultó de utilidad para un diagnóstico diferencial más preciso dentro del espectro de los síndromes linfoproliferativos crónicos de la célula B.34
El comportamiento en la expresión de cadenas ligeras de Ig es similar a la comunicada por otros autores para esta entidad. Lewis y colaboradores, en su análisis inmunofenotípico sobre LLC-B, encontraron que de 23 pacientes estudiados, 15 mostraron restricción de cadenas ligeras k y 8 de cadenas ligeras l.24 De igual modo, en investigación realizada en Brasil sobre inmunofenotipaje en LLC-B, se encontró que de 29 casos analizados, 16 tuvieron restricción de cadenas ligeras k y 13 de cadenas l. Estos datos guardan similitud con los encontrados en este trabajo, donde se observó predominio en la expresión de cadenas ligeras k (53 %) entre los pacientes estudiados.
La alta positividad en la formación de roseta espontána con eritrocitos de ratón por los pacientes con LLC-B (79,48 %) ya ha sido comunicado con anterioridad; este es un marcador que resulta útil y ha sido propuesto por el grupo FAB dentro de los criterios de diagnóstico inmunológico de la LLC-B, con una cifra propuesta de al menos el 30 % para el diagnóstico.7
Las células de la LLC-B tienen un repertorio inmunológico diferente del de otros síndromes linfoproliferativos crónicos de la célula B. Tanto el estudio morfológico como el inmunofenotípico, constituyen 2 investigaciones esenciales que deben realizarse en aquellos pacientes donde se sospeche esta enfermedad.
Los avances logrados en los métodos de inmunofenotipaje de células y en las técnicas de biología molecular, permitirán en un futuro no muy lejano, un conocimiento más preciso y un mejor manejo de los pacientes afectados por LLC-B.
Referencias bibliográficas
1. Martínez-Lostao L, Briones J, Martínez-Gallo M, Forne I, Sierra J, Rodríguez Sánchez JL, et al. Fludarabine- induced apoptosis in CD19+/CD5+ B-CLL cells is a direct and nurse-like-cell independent effect. Leuk Lymphoma 2004;45(11):2307-14.
2. Korte W, Cogliatti S. Chronic lymphocytic leukemia the old and the new. Ther Umsch 2004;51(2): 151-6.
3. Rawstron A, Hillmen P, Houlston R. Clonal lymphocytes in persons without known chronic lymphocytic leukemia (CLL): Implications of recent findings in family members of CLL patients. Semin Hematol 2004;41(3):192-200.
4. Vilpo J, Tobin G, Hulkkonen J, Hurme M, Thunberg U, Sundstrom C, et al. Surface antigen expression and correlation with variable heavy-chain gene mutation status in chronic lymphocytic leukemia. Eur J Haematol 2003; 70(1):53-9.
5. Klain U, Tu Y, Stolovitzky GA, Mattioli M, Cattoretti G, Husson H, et al. Gene expressionprofiling of B cell chronic lymphocytic leukemia reveals a homogeneus phenotype related to memory B cells. J Exp Med 2001;194(11):1625-38.
6. Romano C, De Fanis U, Sellitto A, Dalla Mora L, Chiurazzi F, Giunta R, et al.Effects of preactivated autologous T lymphocytes on CD80, CD86 and CD95 expression by chronic lymphocytic leukemia B cells. Leuk Lymphoma 2003;44(11):1953-71.
7. Hernández P. Leucemia linfoide crónica. Aspectos clínicos y biológicos. Rev Cubana Hematol Inmunol Hemoter 1999;15(1):7-20.
8. Matutes E, Polliack A. Morphological and immunophenotypic features of chronic lymphocytic leukemia. Rev Clin Exp Hematol 2000;4(1): 22-47.
9. Deneys V, Mazzom AM, Marques JL, Benoit H, De Bruyere M. Reference values for peripheral blood B-lymphocyte subpopulations: A basis for multiparametric immunophenotyping of abnormal lymphocytes. J Immunol Methods 2001;253(1-2):23-36.
10. Suárez LE, Cruz C, Rivero RA. Ultramicrométodo inmunocitoquímico. Titulación de anticuerpos utilizados para el inmunofenotipaje celular. Rev Cubana Hematol Inmunol Hemoter 1995;111:5762.
11. Rivero RA, Bello M, Suárez LE, Cruz C, Martínez M, Palma L. Introducción de un ultramicrométodo inmunocitoquímico para la cuantificación de subpoblaciones linfocitarias identificadas con anticuerpos monoclonales. Rev Cubana Hematol Inmunol Hemoter 1995;11:46-56.
12. Böyum A. Isolation of mononuclear cells and granulocytes from human blood. Scand J Clin Lab Invest 1968;21:77-89.
13. Leporrier M. Chronic lymphocytic leukemia. Rev Prst 2004;54(4):359-67.
14. Keating MJ. Chronic lymphocytic leukemia. Semin Oncol 1999;26(5 Suppl 14):107-14.
15. Chiorazzi N, Allen SL, Ferrarini M. Clinical and laboratory parameters that define clinically relevant B-CLL subgroups. Curr Top Microbiol Immunol 2005;20(4):109-33.
16. Evrard s, Gaussem P, Helley d, Darnige L. Prognostic factors in chronic lymphocytic leukaemia: Contribution of recent biological markers. Ann Biol Clin 2005;63(6):589-97.
17. De Lima M, O’ Brien S, Lerner S, Keating MJ. Chronic lymphocytic leukemia in young patient. Semin Oncol 1998;25:107-16.
18. Cmunt E, Michalova K, Karban J, Zemanova Z, Sindelarova L, Bosakova Z, et al. Lymphocyte immunophenotyping and cytogenetics for more precise prognosis in patients with type B chronic lymphatic leukemia. Cas Lek Cesk 2003;142(2):105-11.
19. Dwilewicz- Trajaczek. Chronic lymphocytic leukemia from B CD5+ cell: Characteristics, clinical and laboratory features, and immunophenotyping. Pol Tyg Lek 1995;50:12-4.
20. Cavalcanti Junior GB, Sale VS, Cavalcanti E, Silva DG, Lopes MC, Paiva AD, et al. Detection of CD5 in B-cell chronic lympohoproliferative diseases by flow cytometry: A strong expression in B-chron ic lymphocytic leukemia. Acta Cir Bras 2005;20(1):56-62.
21. Efstathion S, Tsioulous D, Zacharos I, Tsiakov A, Mastorantonakis S, Salgami E, et al. The prognostic role of CD5 negativity in B- cell chronic lymphocytic leukaemia a case control study. Haematologia (Budap)2002;32(3):209-18.
22. Minuzzo S, Indraccolo S, Tosello V, Piovan E, Cabrelle A, Trentin L, et al. Heterogeneous intracellular expression of B- cell receptor components in B- cell chronic lymphocytic leukaemia (B- CCL) cells and effects of CD79b gene transfer on surface immunoglobulin levels in a B-CLL- derived cell line. Br J Haematol 2005;130(6):878-89.
23. Guillaume N, Alimardani G, Capiod JC, Claisse JF. Relevance of cytological and immunophenotypical analysis for he diagnosis of B- cell chronic lymphocytic leukaemia. Ann Biol Clin 2002; 60(6):673-81.
24. Lewis RE, Cruse JM, Pierce S, Lam J, Tadros Y. Surface and cytoplasmic Immunoglobulin expression in B -cell chronic lymphocytic leukemia CLL. Exp Mol Pathol 2005;79(2):146-50.
25. Di Giuseppe JA, Borowtz MI. Clinical utility of flor cytometry in the chronic lymphoid leukemias. Semin Oncol 1998;25: 6-10.
26. Degan M, Bomben R, Bo MD, Zucchetto A, Nanni P, Rupolo M, et al. Analysis of IgV gene mutations in B cell chronic lymphocytic leukaemia according to antigen driven selection identifies subgroups with different prognosis and usage of the canonical somatic hypermutation machinery.Br J Haematol 2004;126(1):29-42.
27. Domingo Domenech E, Domingo Claros A, González Barca E, Beneitez D, Alonso F, et al. CD38 expression in B- chronic lymphocytic leukaemia: Association with clinical presentation and outcome in 155 patients. Haematologica 2002;87(10):1021-7.
28. Ottagio L, Viaggi S, Zunino A, Zupo S, Rossi E, Sprian OM, et al. Chromosome aberrations evaluated by comparative genomic hybridization in B- cell chronic lymphocytic leukemia: Correlation with CD38 expression. Haematologica 2003;88(7):769-77.
29. Chang CC, Liu CZ, Cleveland RP. Relative importance of CD38 expression over myeloid associated markers expression in predicting the clinical course of B-CLL patients. Leu Lymphoma 2002;44(6):977-82.
30. Durig J, Naschar M, Schmucker U, Renzing Kohler K, Holter T, Huttmann A, Duhrsen U. CD38 expression is an important prognostic marker in chronic lymphocytic leukaemia. Leukemia 2002;16(1):30-5.
31. Schroers R, Pukrop T, Durig J, Haase D, Duhrsen U, Trumper L, et al. B-cell chronic lymphocytic leukemia with aberrant CD8 expression: Genetic and immunophenotypic analysis of prognostic factors. Leuk Lymphoma 2004;45(8):1677-81.
32. Espinosa A, Bjork P, Magnussen K, Moen T, Sorum Y. Aberrant expression of the CD8 antigen in B-cell chronic lymphocytic leukaemia. Leuk Lymphoma 2003;44(1):193-6.
33. Mulligan SP, Dao LP, Francis SE, Thomas ME, Gibson J, Cole-Sinclair MF, et al. B-cell chronic lymphocytic leukaemia with CD38 expression: Report of 10 cases and immunochemical analysis of the CD8 antigen. Br J Haematol1998;103:157-82.
Recibido: 10 de mayo del 2007. Aprobado: 4 de junio del 2007.
Dra. Miriam Sánchez Segura. Instituto de Hematología e Inmunología. Apartado Postal 8070, Ciudad de La Habana, CP 10800, Cuba. Tel (537) 6438268, 6438695, 6434214, Fax (537) 442334. e-mail: ihidir@hemato.sld.cu
 Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons
Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons