Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.26 n.1 Ciudad de la Habana ene.-mar. 2010
PRESENTACIÓN DE CASOS
Leucoplasia oral en un paciente pediátrico con deficiencia primaria de linfocitos T
Oral leukoplasia in a pediatric patient with primary deficiency of T lymphocytes
Dra. Vianed Marsán SuárezI; Dr. Julio Valcárcel LlerandiII; DraC. Consuelo Macías AbrahamI; Dra. Miriam Sánchez SeguraI; Dra. Concepción Insua ArreguiII; Lic. Lázaro del Valle PérezI; Lic. Beatriz Socarrás FerrerI; Lic. Lourdes Palma SalgadoI; Lic. Ada Arce HernándezI; Lic. Mónica García CuéllarI
IInstituto de Hematología e Inmunología. Ciudad de La Habana, Cuba.
IIHospital Pediátrico Docente "William Soler". Ciudad de La Habana, Cuba.
RESUMEN
La presencia de infecciones recurrentes causadas por gérmenes no habituales con la aparición de complicaciones frecuentes y asociadas con manifestaciones alérgicas y autoinmunes o tumorales o ambas, son características de las inmunodeficiencias primarias. Se presenta el caso de un niño varón de 12 años de edad, de color de la piel blanca, con antecedentes de infecciones virales, bacterianas y parasitarias, recurrentes y severas desde los primeros meses de nacido, con el diagnóstico actual de leucoplasia oral no homogénea de la lengua, corroborada por histopatología. Los estudios virológicos mostraron la presencia de anticuerpos específicos contra la cápside viral y del antígeno nuclear del virus de Epstein-Barr. Los estudios inmunológicos demostraron la presencia de una inmunodeficiencia primaria de los linfocitos T. No se encontraron alteraciones en las concentraciones séricas de las inmunoglobulinas, el complemento y la función fagocítica. La extirpación quirúrgica de la lesión y el uso de inmunomoduladores, contribuyeron a la evolución favorable del enfermo.
Palabras clave: deficiencia primaria de linfocitos T, leucoplasia oral, virus de Epstein-Barr.
ABSTRACT
Presence off recurrent infections caused by uncommon germs related to appearance of frequent complications and associated with allergic and autoimmune and/or tumor manifestations, are characteristic of primary immunodeficiencies. Authors present the case of a white male child aged 12, with backgrounds of viral, bacterial and parasitic, recurrent and severe infections, from the first months of life, with a diagnosis of non-homogenous oral leukoplasia of tongue, supported by histopathology. Viral study showed the presence of antibodies specific to viral capsid and of nuclear antigen of Epstein-Barr virus. Immunologic studies showed the presence of a primary immunodeficiency of T lymphocytes. There were not alterations in serum concentrations of immunoglobulins, the complement and the phagocytic function. Surgical removal of lesion and the use of immunomodulation contributed to a favorable course of patient.
Key words: T lymphocytes primary deficiency, oral leukoplasia, Epstein-Barr virus.
INTRODUCCIÓN
Desde el punto de vista etimológico, el término leucoplasia significa crecimiento o proliferación blanca. Fue propuesto por primera vez por Ernst Schwimmer en 1877 y se utilizó con un sentido anatomoclínico para distinguir a una lesión blanca de las mucosas, principalmente de la bucal, con un destacado pleomorfismo clínico, histológico y etiológico, y que en una pequeña proporción de pacientes podía experimentar una trasformación maligna.1-3
La leucoplasia oral (LO) tiene una incidencia anual estimada de 14 casos por 100 000 habitantes y una prevalencia que oscila entre 0,2 y 11,7 %, con cifras medias comprendidas entre 2 y 4,5 %. Esta prevalencia es mayor en pacientes diabéticos (6,2 %), psiquiátricos (7,6 %) y trasplantados renales (10,7 %).1
En general, los factores etiológicos relacionados con la aparición de la LO coinciden con los implicados en la génesis del precáncer y cáncer oral, aunque en algunos pacientes se considera idiopática.2,3
Entre los factores involucrados como desencadenantes de esta lesión se encuentran: tabaquismo, carencias nutricionales, deficiencia de hierro asociada con disfagia sideropénica o síndrome de Plummer-Vinson, deficiencia de vitamina B12 y de ácido fólico, alcoholismo, traumatismos, queratosis friccionales, diferentes infecciones causadas por Candida albicans, micoplasmas, subtipos 16 y 18 del virus papiloma humano, virus de inmunodeficiencia humana (VIH), virus herpes simple (VHS), virus de las hepatitis C y G (VHC/G), virus de Epstein-Barr (VEB) y determinados productos farmacológicos como el colutorio bucal, cuyo principio activo se derivó de la Sanguinaria canadensis L.3,4
La LO suele diagnosticarse a partir de la segunda década de la vida, con una mayor afectación en mayores de 50 años;1 de ahí, la importancia de su aparición en un paciente pediátrico con historia de infecciones a repetición.
PRESENTACIÓN DEL CASO
Paciente de 12 años de edad, masculino, de piel blanca, nacido a término de parto eutócico, con buen peso y talla al nacer y retardo en la caída del cordón umbilical. Recibió lactancia materna exclusiva hasta los 4 meses. Hasta el momento no ha presentado reacciones adversas a las inmunizaciones, alimentos o medicamentos. A partir del tercer mes de nacido, comenzó a presentar infecciones recurrentes respiratorias altas: otitis media, amigdalitis; respiratorias bajas: neumonías; digestivas: salmonelosis, giardiasis; y cutáneas: piodermitis, molusco contagioso; todas con pobre respuesta a los tratamientos habituales, evolución tórpida hacia la cronicidad y con aparición frecuente de complicaciones no esperadas. Presentó además, manifestaciones alérgicas respiratorias: rinitis, laringitis; y cutáneas: dermatitis atópica.
Tiene antecedentes familiares por la línea materna, de asma bronquial.
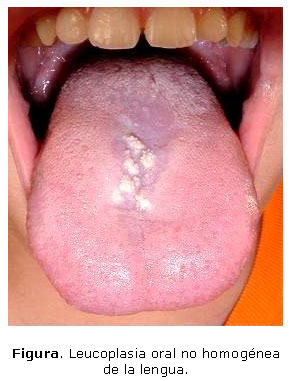
En el examen físico del enfermo se encontraron múltiples lesiones no homogéneas caracterizadas por áreas blanquecinas que alternaban con zonas rojas (eritroleucoplasia) localizadas en la línea media de la cara dorsal de la lengua, de aproximadamente 1,5 milímetros de diámetro, de superficie irregular, ásperas, ligeramente elevadas y firmes (Fig.), con más de 4 semanas de evolución. Presentó además múltiples adenopatías cervicales, pequeñas, no dolorosas y no adheridas a los planos profundos.
Los estudios complementarios indicados en el enfermo mostraron:
Hemograma completo:
Hemoglobina: 134 g/L (120-60 g/L).
Leucocitos totales: 6,7 × 109/L (4,5-11 × 109/L).
Segmentados: 055 (0,55-0,65 × 109/L).
Linfocitos: 025 (0,25-0,40 × 109/L).
Monocitos: 012 (0-0,1 × 109/L).
Eosinófilos: 008 (0-0,03 × 109/L).
Velocidad de sedimentación: 45 mm/h (0-10 mm/h).
Serología: no reactiva.
Estudios virológicos:
Anticuerpos anti-VIH: negativos.
Anticuerpos anti-citomegalovirus: negativos.
Anticuerpos anti-VHS: negativos.
Anticuerpos anti-VHB y C: negativos.
Anticuerpos IgG dirigidos contra la cápside (VCA) y el antígeno nuclear del VEB (EBNA): positivos.
El estudio histopatológico de la lesión mostró la presencia de una leucoplasia sin displasia, con hiperqueratosis e infiltración ligera del corion.
Los estudios inmunológicos mostraron una marcada disminución en el número de linfocitos T CD3 positivos: 47 % (57-74 %), fundamentalmente a expensas de la subpoblación T CD4 positiva: 30 % (40-65 %). Los linfocitos T CD8 positivos mostraron una ligera disminución: 14 % (17-32 %).
También la roseta espontánea: 55 % (64-85 %) y la roseta activa: 27 % (35-47 %) se encontraron por debajo de los valores normales.
La proliferación linfocitaria a la estimulación con diferentes mitógenos se comportó de la siguiente forma: normal con el uso de la concanavalina A (Con A), con un índice de estimulación (IE) de 13 (³ 11) y disminuidas con fitohemaglutinina (PHA), IE de 15 (³ 20) y con Fitolaca americana (PWM) IE de 18 (³ 22).
Se obtuvieron concentraciones normales de las inmunoglobulinas: IgM, 0,84 g/L (0,69-2,69g/L); IgG, 9,18 g/L (7,81-15,30g/L); e IgA, 2,03 g/L (1,58-3,94 g/L).
No se encontraron alteraciones en la actividad hemolítica total de la vía clásica del complemento: 25 CH50 (27,5 ± 6, 5) y los valores normales de inmunocomplejos circulantes fueron normales: 0,03 (= 0,13). La función opsonofagocítica en diferentes intervalos de tiempo: 15 minutos, 48,22 % (22,99-53,95 %); y 60 minutos, 12,23 % (6,63-28,43 %), mostró valores normales.
El diagnóstico definitivo del paciente fue de LO no homogénea secundaria a infección con el VEB e inmunodeficiencia primaria (IDP) de los linfocitos T.
El diagnóstico diferencial de la LO se realizó con otras enfermedades que afectan la cavidad oral, entre las que se encuentran: lesiones traumáticas, quemaduras químicas, candidiasis oral, liquen plano, lupus eritematoso sistémico, nevo blanco esponjoso, lengua geográfica, verrugas vulgares y carcinoma epidermoide.5 El diagnóstico diferencial de la deficiencia de células T se llevó a cabo con el resto de las IDP combinadas.
Tratamiento
El tratamiento estuvo encaminado a 5 pilares fundamentales: 1) actuar sobre los factores desencadenantes o asociados; 2) medidas generales; 3) tratamiento quirúrgico de la lesión: 4) tratamiento antiviral; y 5) tratamiento inmunomodulador.
En primer lugar, lograr el mantenimiento sistemático de una higiene bucal adecuada y evitar la ingestión de alimentos excesivamente calientes, muy condimentados o ácidos. Se le recomendó mantener una alimentación balanceada, alta en consumo de frutas y vegetales, con un aporte adicional de vitaminas (complejo B, A, C, E) y oligoelementos (ácido fólico y hierro).
Para la extirpación quirúrgica de la lesión se emplearon técnicas convencionales.
Fueron indicados antivirales como el aciclovir (tab de 200 mg), en dosis de 200 mg 5 veces al día durante 5 días; e Interferón alfa recombinante, 1 bulbo de 3 × 106 de unidades, 3 veces por semana durante 2 semanas; luego, 2 veces por semana durante 2 semanas y finalmente, 1 vez por semana durante 2 semanas.
El tratamiento inmunomodulador consistió en la administración de levamisol (tab de 150 mg) 3 mg/kg 1 vez por semana durante 8 semanas y en varios ciclos; factor de transferencia (Hebertrans), que consiste en un extracto dialisable de leucocitos humanos en una concentración de 108, en dosis de 1 unidad por semana durante 8 semanas, por vía subcutánea y en varios ciclos; y gammaglobulina humana al 10 %, por vía intramuscular, en dosis de 200 mg/Kg de peso, cada 15 días durante 3 meses.
En el primer año de tratamiento el paciente fue evaluado cada 3 meses en consultas de Inmunología y Maxilofacial. Debido a su evolución clínica favorable, actualmente su seguimiento se realiza anualmente.
DISCUSIÓN
Las IDP son consecuencia de los defectos en la maduración y en la diferenciación de los linfocitos T en el timo, de la activación de estos en los órganos linfoides periféricos por alteraciones en la expresión o en la función de una o más moléculas correceptoras, así como de la producción de mediadores solubles o sus receptores específicos.6,7
El paciente estudiado presentó un retardo en la caída del cordón umbilical que se observa frecuentemente en niños con IDP, en especial de células T o fagocíticas.6
A este caso, con una deficiencia cuantitativa de linfocitos T CD4 positivos auxiliadores, se sumó un trastorno funcional de estas células cuando se utilizó la PHA.
Estos linfocitos liberan linfocinas con un patrón T auxiliador de tipo 1 que favorece el desarrollo de la respuesta inflamatoria, entre las que se encuentran las interleucinas 2, 15 y el interferón gamma, que interactúan con las células presentadoras de antígenos profesionales y con las células B, y permiten la activación, proliferación y diferenciación de estas últimas a células plasmáticas secretoras de anticuerpos.8
La eliminación de los virus que se replican en el interior de las células está mediada fundamentalmente por los linfocitos T citotóxicos (LTC) CD8 positivos, los cuales reconocen antígenos virales citosólicos. La diferenciación completa de estos linfocitos requiere de la presencia de citocinas producidas por las células T colaboradoras CD4 positivas. El mecanismo principal de la citotoxicidad mediada por LTC es la liberación de proteínas granulares citotóxicas como granzima B y perforinas, directamente sobre las células diana infectadas. Los LTC utilizan un segundo mecanismo de citólisis, mediado por interacciones que se establecen entre moléculas constitutivamente presentes en su membrana y en las células diana, y una vez activados, inducen la expresión de otra proteína de membrana llamada ligando de Fas (FasL), que se une con su molécula correceptora (Fas) y de esta forma, programa la muerte celular o apoptótica.9
La activación de los linfocitos T CD8 positivos estimulados con el uso de Con A fue normal en este paciente; sin embargo, esta subpoblación linfocitaria se encontró ligeramente disminuida, lo que pudiera explicar la presencia temprana de infecciones recurrentes causadas por diversos microorganismos.
La presencia de anticuerpos IgG dirigidos contra el VCA y contra el EBNA del VEB, sugirió la reactivación de la enfermedad de una forma persistente y activa10 y evidenció la posible causa de la aparición de la LO. La IDP de células T favoreció la evolución tórpida de la infección por este virus.
Los pacientes con IDP pueden presentar, además de las infecciones, manifestaciones alérgicas, autoinmunes y tumorales.11-14 El enfermo presentó manifestaciones alérgicas: respiratorias y cutáneas.
La extirpación quirúrgica de la lesión y el tratamiento antiviral e inmunomodulador indicados oportunamente en este enfermo, permitieron disminuir la frecuencia y severidad de las infecciones y evitar la transformación maligna de la lesión.
REFERENCIAS BIBLIOGRÁFICAS
1. García Pola M, García J. Leucoplasia oral. Aten Primaria 2002;29:39-49.
2. Bascones A, Seoane J, Aguado A, Quintanilla J. Cáncer y precáncer oral. Bases clínico-quirúrgicas y moleculares. Madrid: Ediciones Avances Médico-Dentales; 2003. p. 113-24.
3. Martínez-Sahuquillo A, Gallardo I, Cobos MJ, Caballero J, Bullón P. La leucoplasia oral. Su implicación como lesión precancerosa. Av Odontoestomatol 2008;24:33-44.
4. Reibel J. Prognosis of oral premalignant lesions: Significance of clinical, histopatological and molecular biological characteristics. Crit Rev Oral Biol Med 2003;14:47-62.
5. Lozada Nur F. Oral lichen planus and oral cancer: Is there enough epidemiologic evidence? Oral Surg Oral Med Pathol Oral Radiol Endod 2000;89:265-6.
6. Fischer A. Human primary immunodeficiency disease: A perspective. Nature Rev Immunol 2004;5:23-30.
7. Candotti F, Nottarangelo L, Visconti R, Shea JJ. Molecular aspects of primary immunodeficiencies: Lessons from cytokine and other signaling pathways. J Clin Invest 2002;109:1261-9.
8. Mills DM, Cambie JC. B lymphocyte interactions during cognate interactions with CD4+ T lymphocyte: Molecular dynamics and immunological consecuences. Sem Immunol 2003;15:325-9.
9. Rusell JH, Ley TJ. Lymphocyte-mediated cytotoxicity. Ann Rev Immunol 2002;20:323-70.
10. Cohen J. Epstein-Barr virus infection. N Engl J Med 2000;343:481-92.
11. Elorz J, García JM, Bilbao A. Inmunodeficiencias primarias. An Pediatr 2004;60:19-23.
12. Notarangelo L, Casanova JL, Conley ME, Chapel H, Fisher A, Puck J. Primary immunodeficiency diseases: An update from the International Union of Immunological Societies Primary Immunodeficiency Diseases. Classification Comittee Meeting in Budapest, 2005. J Allergy Clin Immunol 2006;117:883-95.
13. Abbas A, Lichtman A. Congenital and acquired inmunodeficiencias. Cellular and Molecular Immunology. 5 ed. Madrid: Elsevier SaundersM 2005. p. 453-76.
14. Atkinson JC, O Connell A, Aframian D. Oral manifestations of primary immunological diseases. J Am Dent Assoc 2000;131:345-56.
Recibido: 27 de octubre del 2009.
Aprobado: 18 de noviembre del 2009.
Dra. Vianed Marsán Suárez. Instituto de Hematología e Inmunología. Apartado 8070. Ciudad de La Habana, CP 10800, Cuba. Tel (537) 643 8268, 643 8695, Fax (537) 644 2334. E-mail: ihidir@hemato.sld.cu