Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.22 n.1 Ciudad de la Habana ene.-mar. 2003
Facultad de Medicina, Universidad Nacional Autónoma de México (UNAM)
Universidad Autónoma Metropolitana-Xochimilco. MÉXICO
Acción de algunos antiinflamatorios no esteroideos sobre la lipoperoxidación hepática inducida por etanol
Dra. Yolanda Saldaña-Balmori , Dr. Ramírez-González y Dr. Héctor Delgadillo-Gutiérrez
Resumen
Se realizó un estudio sobre la base de que la ingestión elevada de etanol tiene una acción hepatotóxica por causa del excesivo depósito de triacilgliceroles y por su disminución en la degradación y exportación a la circulación, coincidiendo con el desarrollo de esteatosis. Simultáneamente, hay elevación de la lipoperoxidación iniciada por radicales libres, la cual afecta a los fosfolípidos de la membrana y ocasiona pérdida de sus funciones. La capacidad antioxidante celular es insuficiente, lo que produce el estrés oxidativo. Se propuso que los antiinflamatorios no esteroideos secuestran radicales libres generados por la intoxicación alcohólica y disminuyen el estrés oxidativo. Cuando se permite la acción simultánea de etanol y de los antiinflamatorios no esteroideos, la disminución de las sustancias reactivas al ácido tiobarbitúrico, es significativa a las 8 h: (p < 0,05) con ácido acetilsalicílico, y (p < 0,001) con dipirona, naproxen, nimesulide y piroxicam. Los resultados obtenidos, mediante este indicador de la lipoperoxidación en tejido hepático, sugieren que estos antiinflamatorios no esteroideos contribuyen para atenuar el estrés oxidativo que se produce por la ingestión aguda de etanol.
DeCS: AGENTES ANTIINFLAMATORIOS NO ESTEROIDES/uso terapéutico; ETANOL/toxicidad; ESTRES OXIDATIVO; RADICALES LIBRES; INTOXICACION ALCOHOLICA; ANTIOXIDANTES/uso terapéutico.
El uso del alcohol está legalmente aceptado por la mayoría de los gobiernos y religiones del mundo; su consumo se extiende desde los países más industrializados hasta los de recursos más reducidos. En México, los problemas relacionados con el abuso en el consumo de etanol, representan un asunto grave de salud pública. El Programa contra el alcoholismo y el abuso de bebidas alcohólicas reporta que en México, la cirrosis alcohólica se encuentra dentro de las 10 primeras causas de muerte en la población general, y en primer lugar en la población masculina de 25 a 44 años. Se ha descrito ampliamente, que la ingestión elevada de etanol tiene una acción que puede lesionar a diferentes órganos blanco; ya sea al sistema nervioso central, al hígado y en ocasiones al páncreas y con todo esto, presentar diversas patologías.
Por otro lado, se sabe que aquellas sustancias que tengan una función oxidante o que debiliten la capacidad antioxidante de la célula, están identificadas como agentes que producen estrés oxidativo.1 Con el consumo de grandes cantidades de etanol, el aumento de triacilgliceroles en suero interviene en el establecimiento del hígado graso, el cual se debe a la acumulación de triacilgliceroles que recibe el hígado y a la inhibición de la oxidación de estos, porque es conocido que en alcohólicos, la participación de agentes antioxidantes como el glutatión hepático y el alfa tocoferol presente en el suero, se encuentran disminuidos. Por tal situación la participación de los mecanismos antioxidantes de la célula, resultan insuficientes en presencia de la producción elevada de radicales libres, y ocasiona de esta manera el estrés oxidativo. Se ha identificado que el estrés oxidativo es responsable de la lipoperoxidación y que esta se inicia cuando una especie reactiva, generalmente el radical hidroxilo (.OH), abstrae un hidrógeno de un ácido graso poliinsaturado, de los fosfolípidos de las membranas, o de las lipoproteínas, lo que ocasiona una reacción en cadena. Se sabe desde 1966, que las ratas después de la intoxicación alcohólica aguda y estudiado en homogenado de hígado, tienen un mayor depósito de triacilgliceroles acompañado de un aumento de la lipoperoxidación.2
Con la información de que el empleo del piroxicam, un antiinflamatorio no esteroideo (AINE), administrado al mismo tiempo que CCl4, mantiene el contenido de triacilgliceroles y la lipoperoxidación en valores normales en hígado de rata,3 se procedió a realizar una serie de investigaciones en las que entre otros indicadores, se midió la lipoperoxidación en hígado de ratas que son sujetas a intoxicación alcohólica aguda y reciben simultáneamente, la administración de alguno de los siguientes AINES: ácido acetilsalicílico, dipirona, naproxen, nimesulide o piroxicam.4,5 El propósito de este trabajo es conocer cuál es la participación de estos AINES en el proceso de la lipoperoxidación inducida por etanol.
MÉTODOS
Los experimentos se realizaron con ratas macho cepa Wistar de 200-220 g, alimentadas ad libitum con dieta comercial (Nutricubos de Purina, México). En algunos experimentos se mantuvo a los animales con ayuno de 16 a 24 h antes del tratamiento, pero tenían libre acceso al agua, otros experimentos se llevaron a cabo, con ratas alimentadas y con libre acceso al agua.
Las ratas fueron divididas en 4 grupos y recibieron por vía orogástrica el tratamiento siguiente:
- Glucosa, 37,5 kcal/kg de peso (de una solución a 40 %), más la cantidad correspondiente al vehículo del AINE.
- Etanol, 37,7 kcal/kg de peso (de una solución a 30 %), más la cantidad correspondiente al vehículo del AINE.
- Glucosa a la cantidad arriba señalada, más 1 de los 5 AINES: ácido acetilsalicílico (56 mg/kg de peso), dipirona (43 mg/kg de peso), naproxen (7 mg/kg de peso), nimesulide (30 mg/kg de peso) o piroxicam (10 mg/kg de peso).
- Etanol más 1 de los 5 AINES en las cantidades señaladas arriba.
En el caso de las que recibieron piroxicam se realizaron experimentos tanto en rata alimentada como con ayuno y se permitió la acción del tratamiento, por 2, 4, 8, 12 o 16 h y con el resto de los AINES los experimentos se realizaron solo en rata con ayuno y los tiempos de tratamiento fueron de 4, 8 y 12 h.
Las ratas se sacrificaron por decapitación, se extrajo el hígado, el cual se homogenizó en agua bidestilada para realizar, entre otras, las determinaciones de las sustancias reactivas al ácido tiobarbitúrico (TBARS), las que se midieron conforme el método descrito por Ottolenghi6 y con las modificaciones reportadas por Zentella y otros;5 el homogenado de hígado se pasó a través de una gasa, se tomó una alícuota de 0,2 mL y se incubó con 1,0 mL de buffer fosfato 0,15 M a pH 7,0 por 30 min a 37 oC. Se añadió ácido acético 20 % a pH 2,0 y ácido tiobarbitúrico 0,8 %, la mezcla se llevó a baño de ebullición durante 45 min, se enfrió y se le añadió KCl 2 % y 5 mL de butanol-piridina (15:1), se agitó fuertemente para realizar la extracción y se leyó la absorbancia de la capa orgánica a 532 nm. La concentración de TBARS en las muestras se calculó7 usando el coeficiente de extinción de 1,56 x 105 M-1 cm-1.
Las proteínas se midieron por el método de Bradford,8 utilizando albúmina bovina como patrón. Los datos se expresaron como nmolas de TBARS por miligramo de proteína. El análisis estadístico se realizó por medio de la prueba de t de Student.
RESULTADOS
De los resultados obtenidos al hacer una gráfica de nmolas de TBARS por mg de proteína contra el número de horas que se permite el tratamiento, en ratas con ayuno, se observó que en las ratas del primer grupo, que recibieron glucosa, y las del tercero que recibieron glucosa más uno de los 5 AINES estudiados, no presentaron diferencias significativas, independientemente de la cantidad de horas que se haya permitido la acción.
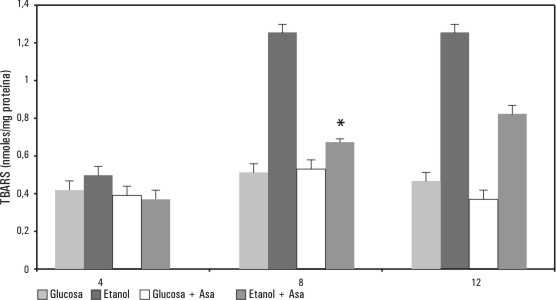
La concentración de TBARS, como un indicativo de la lipoperoxidación propiciado por el etanol, se incrementó en la medida en que aumentó el tiempo de tratamiento, se hizo óptima a las 8 h y se mantuvo a las 12; cuando se administró simultáneamente etanol y ácido acetilsalicílico (ASA), a las 4 y 8 h, se abatió la cantidad de TBARS producidas (p < 0,05), no así a las 12 h; situación en la que por los datos observados, la lipoperoxidación fue de la misma magnitud que la presente en las ratas que no recibieron el AINE. Una segunda dosis de ASA a las 8 h, permitió que las TBARS a las 12 h fueran producidas en menor cantidad que la observada en las ratas que recibieron solo etanol; esta diferencia no resultó significativa (fig. 1).
Fig. 1. Efecto del ácido acetilsalicílico (ASA) en ratas con ayuno, sobre la lipoperoxidación promovida por etanol. Las ratas recibieron 37,5 kcal/g de peso de glucosa o etanol; la cantidad de ASA fue de 56 mg/kg de peso. Al comparar el grupo de etanol vs. el de etanol más ASA a las 8 h de tratamiento, tienen diferencias estadísticamente significativas (p < 0,05). Tomada de Zentella de Piña M, Saldaña-Balmori Y, Hernández-Tobías A, Piña E. Nonsteroidal antiinflammatory drugs lower ethanol-mediated liver increase in lipids and thiobarbituric acid reactive substances. Alcoholism Clin Exp Res 1993;17:1228-32.
En relación con la dipirona, un antiinflamatorio que se encuentra borrado de los cuadros básicos de medicamentos de países del primer mundo, porque el consumo sostenido por 3 semanas, puede contribuir a que se presente degranulación hepática; en México, su venta no tiene restricción, su empleo es frecuente y de los datos obtenidos en estos experimentos, resulta ser muy eficaz en el abatimiento de la lipoperoxidación ocasionada por el etanol, además de disminuir el contenido de triacilgliceroles.5 Las ratas con ayuno de 16 a 24 h que recibieron la administración de etanol y dipirona simultáneamente, mantuvieron de una manera semejante la cantidad de nmolas de TBARS producida por miligramo de proteína, tanto a tiempo 0 como a las 4, 8 o 12 h; contrariamente a las que recibieron solo etanol, en las que la producción de TBARS fue aproximadamente del doble para 8 y 12 h. La acción de la dipirona adicionada al etanol tuvo un efecto muy marcado en la disminución de TBARS, a las 8 y a las 12 h de tratamiento (p < 0,001) (fig. 2).
Fig. 2. Efecto de la dipirona en ratas con ayuno, sobre la lipoperoxidación promovida por etanol. Las ratas recibieron 37,5 kcal/g de peso de glucosa o etanol; la cantidad de dipirona fue de 43 mg/kg de peso mg/kg de peso. Al comparar el grupo de etanol vs. el de etanol más dipirona a las 8 y a las 12 h de tratamiento, tuvieron diferencias estadísticamente significativas (p < 0,001). Tomada de Zentella de Piña M, Saldaña-Balmori Y, Hernández-Tobías A, Piña E. Nonsteroidal antiinflammatory drugs lower ethanol-mediated liver increase in lipids and thiobarbituric acid reactive substances. Alcoholism Clin Exp Res 1993;17:1228-32.
El naproxen, a la concentración de 7 mg/kg de peso, es efectivo propiciando una protección del tejido hepático tanto en la disminución de la lipoperoxidación al bajar los valores de TBARS como en el contenido de triacilgliceroles5 en el hígado de las ratas tratados con etanol (p < 0,001) (fig. 3).
Fig. 3. Efecto del naproxen en ratas con ayuno, sobre la lipoperoxidación promovida por etanol. Las ratas recibieron 37,5 kcal/g de peso de glucosa o etanol; la cantidad de naproxen fue de 7 mg/kg de peso. Al comparar el grupo de etanol vs. el de etanol más naproxen a las 8 y a las 12 h de tratamiento, tuvieron diferencias estadísticamente significativas (p < 0,001). Tomada de Zentella de Piña M, Saldaña-Balmori Y, Hernández-Tobías A, Piña E. Nonsteroidal antiinflammatory drugs lower ethanol-mediated liver increase in lipids and thiobarbituric acid reactive substances. Alcoholism Clin Exp Res 1993;17:1228-32.
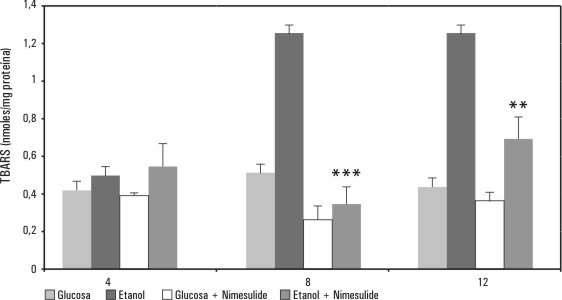
El nimesulide manifiesta una acción semejante a la presentada por estos últimos AINES, aunque es más marcado su efecto como antilipoperoxidativo a las 8 h (p < 0,001) que a las 12 (p < 0,01) (fig. 4).
Fig. 4. Efecto del nimesulide en ratas con ayuno, sobre la lipoperoxidación promovida por etanol. Las ratas recibieron 37,5 kcal/g de peso de glucosa o etanol; la cantidad de nimesulide fue de 30 mg/kg de peso. Al comparar el grupo de etanol vs. el de etanol más nimesulide a las a las 8 h de tratamiento, tuvieron diferencias estadísticamente significativas (p < 0,001) y a las 12 h (p < 0,01). Tomada de Zentella de Piña M, Saldaña-Balmori Y, Hernández-Tobías A, Piña E. Nonsteroidal antiinflammatory drugs lower ethanol-mediated liver increase in lipids and thiobarbituric acid reactive substances. Alcoholism Clin Exp Res 1993;17:1228-32.
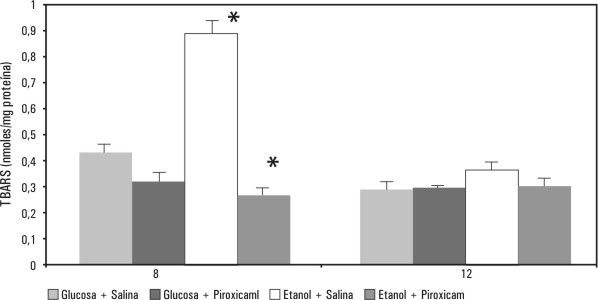
Siguiendo el mismo protocolo que el realizado con los AINES anteriores, el piroxicam se usó para realizar una curva temporal a las 2, 4, 8, 12 y 16 h, se encontró que cuando se sacrificaron las ratas a las 2 y 4 h de tratamiento, no hubo cambio en el indicativo de la lipoperoxidación, porque la cantidad de TBARS en las 4 condiciones experimentales: glucosa, etanol, glucosa más piroxicam y etanol más piroxicam eran iguales. Por otro lado a las 8 h de tratamiento la cantidad de TBARS producido por la presencia del etanol resultó muy elevada con respecto a las otras condiciones experimentales y la diferencia fue altamente significativa, al compararlo con el dato obtenido de las ratas que recibieron etanol y piroxicam (p< 0,001) (fig. 5).
Fig. 5. Efecto del piroxicam en ratas con ayuno, sobre la lipoperoxidación promovida por etanol. Las ratas recibieron 37,5 kcal/g de peso de glucosa o etanol; la cantidad de piroxicam fue de 10 mg/kg de peso. Al comparar el grupo de etanol vs. el de etanol más piroxicam a las 8 y a las 12 h de tratamiento, tuvieron diferencias estadísticamente significativas (p< 0,001). Tomada de Zentella de Piña M, Hernández-Tobías A, Saldaña-Balmori Y, Díaz-Belmont A, Piña E. Biochemical ethanol effects affected by a non-steroidal anti-inflammatory drug. FEBS Letters 1992;298:123-5.
A las 12 h de tratamiento, continuó el efecto lipoperoxidativo del etanol, y conservó su significancia al compararlo con lo obtenido por la adición del piroxicam al etanol. A las 16 h ya no se percibió el efecto del AINE. Mientras que la acción protectora del piroxicam mediante la determinación de TBARS, en ratas tratadas con etanol y sin ayuno, solo se observó a las 8 h de tratamiento ( p < 0,001) (fig. 6).9
Fig. 6. Efecto del piroxicam en ratas alimentadas sobre la lipoperoxidación, promovida por etanol. Las ratas recibieron 37,5 kcal/g de peso de glucosa o etanol; la cantidad de piroxicam fue de 10 mg/kg de peso. Al comparar el grupo de etanol vs. el de etanol más piroxicam a las 8 h de tratamiento, tuvieron diferencias estadísticamente significativas (p < 0,001). Tomada de Zentella de Piña M, Corona S, Rocha-Hernández AE, Saldaña.Balmori Y, Cabrera G, Piña E. Restoration by piroxicam of liver glutathione levels decreased by acute ethanol intoxication. Life Sci 1995;54:1433-9.
DISCUSIÓN
La posibilidad de que los AINES y otras drogas antiinflamatorias, tengan múltiples mecanismos de acción, establece la pregunta de si estos compuestos pueden ejercer efectos antioxidantes in vivo. Está estudiado que estas drogas pueden incidir sobre el daño oxidativo en el sitio de la inflamación, pues permiten una disminución en la producción de sustancias reactivas de oxígeno, porque una buena cantidad de ellas pueden secuestrar al .OH, debido a su estructura aromática y a la presencia de grupos tiol en su composición.10 Por otro lado las drogas antiinflamatorias más comunes, donde el prototipo es el ácido acetilsalicílico,11 son inhibidoras de la ciclooxigenasa y bloquean la producción de prostaglandinas, que limitan la cascada lipoperoxidativa.
La participación de los 5 AINES estudiados en la disminución de la lipoperoxidación, puede ser el agente que contribuya a disminuir el incremento en el contenido de triacilgliceroles promovido por el etanol.12 Al medir triacilglicerol y glutatión, además de TBARS en las mismas muestras, se apoya lo propuesto de que los AINES pueden revertir el daño oxidativo ocasionado por el etanol, porque disminuye tanto el contenido de triacilgliceroles como la lipoperoxidación y aumenta el nivel de glutatión, que problablemente es el metabolito más abundante con un papel fundamental como agente de defensa contra el estrés oxidativo. Por otro lado, hay una atenuación de la etanolemia en presencia de algunos AINES,4,5 la que puede deberse entre otras causas, a un aumento en la oxidación del etanol o bien a que el AINE fije el etanol a los fosfolípidos de la membrana. También se ha reportado que si bien algunos AINES pueden participar como agentes antioxidantes in vivo, otras drogas de este mismo grupo, pueden convertirse en radicales libres y hacer mayor el daño oxidativo; tal es el caso de la penicilamina y la fenilbutazona entre otras, que pueden inactivar a la oxidasa del ácido ascórbico y acelerar la lipoperoxidación in vitro. Con todo esto, es necesario estudiar el metabolismo particular de cada uno de los AINES empleados en esta investigación para identificar su función en el proceso.
Summary
A study was conducted based on the fact that the elevated ingestion of ethanol has an hepatotoxic action due to the excesive deposit of triacylglycerols and to their reduction in the degradation and export to circulation, coinciding with the development of steatosis .Simultaneously, there is an elevation of lipoperoxidation initiated by free radicals, which affects the phospholipids of the membrane and causes loss of their functions . The cellular antioxidant capacity is insufficient, which produces oxidative stress. It was proposed that the NSAIDs sequestrate free radicals generated by alcoholic poisoning and reduce the oxidative stress. When it is allowed the simultaneous action of ethanol and NSAIDs, the reduction of the thiobarbituric acid reactive susbtances (TBARS) is significant at 8 hours (p < 0.05) with acetyl salysilic acid, and (p < 0.001) with dipirone, naproxen, nimesulide and piroxicam. The results obtained by this indicator of lipoperoxidation in liver tissue suggest that these NSAIDs contribute to attenuate the oxidative stress produced by the acute ingestion of ethanol.
Subject headings: ANTI-INFLAMATORY AGENTS, NON-STEROIDAL/therapeutic use; ETHANOL/toxicity; OXIDATIVE STRESS; FREE RADICALS; ALCOHOLIC POISONING; ANTIOXIDANTS/therapeutic use.
Referencias bibliográficas
- Pacifici RE, Davis KJA. Protein degradation as an index of oxidative stress, in Packer L, Glazer AN. eds.: Oxygen radicals in biological systems. Oxygen radicals and antioxidants. Methods in Enzymology, vol 186. San Diego:Academic Press,1990:186-485.
- Kalish GH, Di Luzio NR. Peroxidation of liver lipids in the pathogenesis of the ethanol-induced fatty liver. Science 1966;152:1390-2.
- Díaz-Belmont PA, Zentella de Piña M, Rodríguez L, Piña E. Role of nonsteroidal anti-inflammatory drug in the acute liver injury. Clin Res 1990;38(2):533-A.
- Zentella de Piña M, Hernández Tobías A, Saldaña Balmori Y, Díaz Belmont A, Piña E. Biochemical ethanol effects affected by a non-steroidal anti-inflammatory drug. FEBS Lett 1992;298:123-5.
- Zentella de Piña M, Saldaña Balmori Y, Hernández Tobías A, Piña E. Nonsteroidal antiinflammatory drugs lower ethanol-mediated liver increase in lipids and thiobarbituric acid reactive substances. Alcohol Clin Exp Res 1993;17:1228-32.
- Ottolenghi A. Interaction of ascorbic acid and mitochondrial lipids. Arch Biochem Biophys 1959;79:355-63.
- Wills ED. Lipid peroxide formation in microsomes. The role of non haem iron. Biochem J 1969;113:325.
- Bradford MM. A rapid sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem 1976;72:248-54.
- Zentella de Piña M, Corona S, Rocha-Hernández AE, Saldaña Balmori Y, Cabrera G, Piña E. Restoration by piroxicam of liver glutathione levels decreased by acute ethanol intoxication. Life Sci 1995;54:1433-9.
- Halliwell B. Oxygen radicals, NO. and human antiinflammatory joint disease. Ann Rheum Dis 1995;54:505.
- Jack DB. 100 years of aspirin. Lancet 1997;350:437.
- Di Luzio NR. Prevention of the acute ethanol-induced fatty liver by the simultaneous administration of antioxidants. Life Sci 1964;3:113-8.
Recibido: 11 de octubre de 2001. Aprobado:26 de diciembre de 2002.
Dra. Yolanda Saldaña. Departamento de Bioquímica, Facultad de Medicina, Universidad Nacional Autónoma de México (UNAM), Apartado Postal 70-159, Coyoacán, C. P. 04510. México, D. F.