Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd vol.35 no.1 Ciudad de la Habana ene.-mar. 2016
Rev Cubana de Investigaciones Biomédicas. 2016;35(1)
ARTÍCULO ORIGINAL
Comportamiento clínico, epidemiológico, endoscópico e histológico del cáncer gástrico de tipo epitelial
Clinical, epidemiological, endoscopic and histological behavior of epithelial gastric cancer
Alfredo Hierro González, Eugenia Paulo de Uime Ferreira, Licet González Fabián
Instituto de Gastroenterología. La Habana, Cuba.
RESUMEN
Introducción: el cáncer gástrico constituye un grave problema de salud mundial por ser una de las enfermedades de más difícil control.
Objetivo: describir las principales características clínicas, epidemiológicas, endoscópicas e histológicas del cáncer gástrico de tipo epitelial.
Métodos: estudio observacional de casos y controles, en el Instituto de Gastroenterología, entre septiembre de 2012 y agosto de 2014. Se incluyeron 27 casos y 54 controles.
Resultados: predominaron las mujeres (59,3 %, n= 27), fue más frecuente entre 70 a 79 años, edad media de 63,9 años. La epigastralgia fue el síntoma más frecuente en ambos grupos [85,2 % (casos) vs 81,5 % (controles)], su asociación con náuseas, vómitos, astenia, anorexia y pérdida de peso fue más frecuente en los casos, se mostró diferencias estadísticamente significativas (P= 0,008, IC= 1,39-25,31). El signo físico más frecuente fue la palidez cutáneo-mucosa. Fueron más frecuentes las lesiones mayores de 2 cm, en los dos tercios distales del estómago, así como el tipo III (clasificación de Paris). El carcinoma de células en anillo de sello predominó (48,1 %).
Conclusiones: la epigastralgia asociada a la astenia, la pérdida de peso y la anorexia constituyen la sintomatología clínica más frecuente en los pacientes con cáncer gástrico de tipo epitelial. El tipo histológico más frecuente fue el carcinoma de células en anillo de sello.
Palabras clave: cáncer gástrico; adenocarcinoma gástrico; neoplasia maligna de estómago.
ABSTRACT
Introduction: Gastric cancer is a serious health problem due to the complexity of its control.
Objective: Describe the main clinical, epidemiological, endoscopic and histological characteristics of epithelial gastric cancer.
Methods: An observational case-control study was conducted at the Institute of Gastroenterology from September 2012 to August 2014. The study sample consisted of 27 cases and 54 controls.
Results: There was a predominance of the female gender (59.3 %, n= 27) and the 70-79 age group, with a mean age of 63.9 years. Epigastralgia was the most common symptom in both groups [85.2 % (cases) vs. 81.5 % (controls)]. Its association with nausea, vomiting, asthenia, anorexia and weight loss was more frequent in cases, with statistically significant differences (P= 0.008, CI= 1.39-25.31). The most common physical sign was skin and mucous pallor. The most frequent lesions were those larger than 2 cm, located in the two distal thirds of the stomach, and type III of the Paris classification. Signet ring cell carcinoma predominated (48.1 %).
Conclusions: Epigastralgia associated to asthenia, weight loss and anorexia are the most common clinical symptoms in patients with epithelial gastric cancer. The most frequent histological type is signet ring cell carcinoma.
Key words: Gastric cancer; gastric adenocarcinoma; malignant neoplasm of the stomach.
INTRODUCCIÓN
A pesar del descenso continúo de las tasas de incidencia y mortalidad por cáncer gástrico (CG), este continúa como el cuarto más frecuente y la segunda causa de muerte a nivel mundial.1-6
En el año 2008, el 8 % del total de casos nuevos de cáncer y el 10 % de las muertes por cáncer en el mundo correspondió a CG, más del 70 % ocurrieron en países en vías de desarrollo.1,4,5
En las últimas décadas ha habido importantes variaciones en su epidemiología con una disminución significativa en su incidencia global, pero con aumento relativo de incidencia en grupos etarios definidos y en determinadas localizaciones.6
En Cuba, las neoplasias malignas (NM) ocupan el primer lugar entre las causas de muerte durante los últimos años.7,8 El país registra la menor incidencia de CG en el área del Caribe,9 con una mortalidad baja (4-10 casos × 100,000).
El CG es una neoplasia muy heterogénea y agresiva,10,11 tiene origen multifactorial y su desarrollo depende de la interacción de los genes del organismo involucrados en procesos de proliferación, apoptosis, diferenciación y ciclo celular,13 con el medio ambiente.4,13,14
Las manifestaciones clínicas dependen del estadio en que sea diagnosticada la enfermedad.5 En el Cáncer gástrico precoz (CGP) hasta el 80 % pueden estar asintomáticos; en el resto, los síntomas son inespecíficos.5,6 Por lo general se diagnostica por estudios de grupos poblacionales.9
El 90 % de los casos de CG son diagnosticados tarde, que llevan a un pésimo pronóstico.15,16
En el Cáncer gástrico avanzado (CGA) no hay sintomatología específica,5,9 el 25 % de los casos se presenta dispepsia ulcerosa con dolor postprandial recurrente que no responde a las medidas terapéuticas simples, habituales, no farmacológicas,5,18 el 50 % de los pacientes puede presentar pérdida de peso, astenia, vómitos, saciedad precoz, entre otros. El 90 % de los pacientes presentan síntomas de alarma o secundarios a complicaciones.5
Al examen físico se puede constatar una masa abdominal palpable en epigastrio (se relaciona con enfermedad avanzada), hepatomegalia y/o ascitis, caquexia, adenopatías, edemas en miembros inferiores, entre otros.18
El hígado y los pulmones están comprometidos cerca del 40 % de los casos, y el peritoneo y los huesos en alrededor del 10 %. Las metástasis en otros sitios son menos comunes.5
Los estudios de laboratorio pueden mostrar anemia crónica en un 40 % de los casos y alteración de las proteínas por la desnutrición crónica.18
La panendoscopia oral constituye la técnica de elección para el diagnóstico (sensibilidad y especificidad del 99 %).18
Para los CGA se han utilizado varias clasificaciones entre las que se encuentran la de Borrmann5 y más reciente la de Paris.19
El adenocarcinoma (ADC) gástrico, constituye el 95 % de las NM del estómago,5,13 mientras que los linfomas, sarcomas, carcinoide y carcinomas escamosos dan cuenta del 5 %.
En 1965 Lauren estableció dos tipos histológicos diferentes de ADC gástrico, el tipo intestinal o expansivo y el tipo difuso o infiltrante.20 Según la clasificación de la Organización Mundial de Salud (OMS) del año 2010,21 el CG se clasifica en cuatro grupos:
- Epiteliales.
- No epiteliales.
- Linfomas malignos.
- Tumores secundarios.
Reconoce cuatro tipos histológicos mayores en el grupo de los epiteliales:
- El tubular.
- El papilar.
- El mucinoso.
- El pobremente cohesivo (incluye el carcinoma de células en anillo del sello), más las variantes histológicas raras.
El rol principal de las imágenes en la actualidad, se encuentra en el estadiaje del CG.22
La Tomografía Computarizada (TC) es el examen de elección.24 La ecografía endoscópica (ecoendoscopia) constituye la técnica más precisa en la estadificación en los estadios precoces, donde es importante distinguir entre afectación mucosa y submucosa.5,23,24
En los últimos años se ha dedicado un gran esfuerzo al estudio de las bases biomoleculares del ADC gástrico.25
Los marcadores tumorales pueden sugerir y apoyar su existencia, pero ninguno de ellos puede por sí mismo; en ausencia de una prueba histológica, utilizarse como diagnóstico definitivo,25 su papel fundamental es la monitorización de la evolución de la enfermedad y la evaluación de la eficacia del tratamiento.26
La cirugía es el tratamiento de elección en el CG resecable, los tratamientos neoadyuvantes no han demostrado un incremento significativo en la supervivencia de los pacientes con CG.27,28
El tratamiento del CGP ha experimentado revolucionarios cambios en las últimas décadas con el advenimiento de su manejo endoscópico.29
Con excepción de algunos países, el pronóstico de la enfermedad es malo; la sobreviva a los 5 años es solo de 5-15 %.La proporción caso-fatalidad por CG es superior que en el cáncer de colon, de pulmón y de próstata.17,26,30
El diagnóstico basado en parámetros clínico-epidemiológicos es el mejor método para la detección precoz.
¿El comportamiento clínico, epidemiológico, endoscópico e histológico será similar que en el resto de mundo?
El objetivo del estudio es describir el perfil clínico, epidemiológico y endoscópico, así como determinar la frecuencia de los subtipos histológicos de las neoplasias malignas gástricas de tipo epitelial, en los pacientes diagnosticados en el Instituto de Gastroenterología de la Habana en el período de septiembre de 2012 y agosto de 2014.
MÉTODOS
Se realizó un estudio observacional de casos y controles en el Instituto de Gastroenterología (IGE) de la Habana, entre septiembre de 2012 y agosto de 2014. Se incluyeron todos los pacientes de 19 años y más, de ambos sexos diagnosticados de forma consecutiva de CG de tipo epitelial por endoscopia digestiva superior, con confirmación histológica (casos), así como todos aquellos en que la endoscopia no se encontró lesión sugestiva de este tipo de lesión (controles), en el período previsto para la investigación. Se seleccionaron 2 controles por cada caso que cumplían con los requisitos de igual sexo y grupo de edad, identificados más próximos a su “caso”.
La muestra quedó constituida por 27 casos y 54 controles que cumplieron con los criterios de inclusión establecidos. Se excluyeron los pacientes con diagnóstico anterior de CG.
Desde el punto de vista endoscópico se empleó la Clasificación de París20 para las lesiones neoplásicas del tracto gastrointestinal. Se utilizó la Clasificación Histológica de la Organización Mundial de la Salud de 2010 para clasificar los tumores gástricos de tipo epitelial.21
Se tuvieron en cuenta variables como la edad, sexo, síntomas y signos, tiempo de evolución, tipo endoscópico del tumor, localización y tamaño de la lesión, tipo histológico y variables de laboratorio.
La información referente a las características investigadas fue resumida con la utilización de frecuencias absolutas y porcentajes. Se realizó análisis univariado para explorar la posible asociación entre cada una de las variables independientes antes citadas y la variable dependiente (presencia de CG). La significación de la asociación se indagó mediante la prueba Ji2 para comparación de proporciones independientes, con un nivel de significación del 5 % y se consideró un valor de Odds Ratio (OR) igual o mayor de 3,5; significativo desde el punto de vista estadístico.
Todas las variables del modelo se llevaron a escala dicotómica. Se prestó atención al análisis de la temporalidad, monotonía y colinealidad.
Las características endoscópicas e histológicas presentes en los pacientes con CG se resumieron con el uso de medidas descriptivas: números absolutos y porcentajes.
RESULTADOS
En la tabla 1 se puede observar que el CG de tipo epitelial predominó en el sexo femenino con un 59,3 %. De igual manera; en todos los grupos de edades existió un ligero predominio en este sexo. Ocurrió con mayor frecuencia en el grupo de pacientes, masculinos y femeninos, comprendidos entre 70 y 79 años. La media de la edad entre los casos fue de 63,9 años (rango 40-88), mientras que entre los controles fue de 64,57 años (rango 41-86).
En la tabla 2 se advierte que el síntoma más frecuente -tanto para los casos como para los controles- fue el dolor abdominal epigástrico (85,2 % para los casos y 81,5 % para los controles). La pérdida de peso, la astenia y la anorexia se presentaron en ese orden de frecuencia entre los casos. El síntoma que ocupó el segundo lugar en frecuencia entre los pacientes del grupo control fue la dispepsia. Se puede apreciar también que existieron diferencias en la frecuencia de presentación entre casos y controles de algunos de los síntomas [(pérdida de peso 77,8 % en los casos vs 38,9 % en los controles), (la astenia 70,4 % en los casos vs 27,8 % en los controles) y (anorexia 66,7 % en los casos vs 20,4 % en los controles)]. Diferencias que fueron significativas desde el punto de vista estadístico.
Al hacer un análisis univariado de los síntomas, se observó como la asociación de epigastralgia con la anorexia (OR= 8,5000; índice de confianza (IC)= 2,946-24,519; nivel de probabilidad (p)= 0,0000), con los vómitos (OR= 7,84; IC= 2,378-25,844; p= 0,0002), con la pérdida de peso (OR= 4,0000; IC= 1,501-10,657; p= 0,0044), así como con la astenia y las náuseas, fueron más frecuentes en los casos que en los controles, con diferencias estadísticas significativas en orden descendente (tabla 3).
En la tabla 4 se aprecia que la mayoría de los pacientes con CG presentaba síntomas y signos desde hacía más de tres meses (77,7 %), de igual manera, pero en un porcentaje mayor, sucedió entre los pacientes del grupo control.
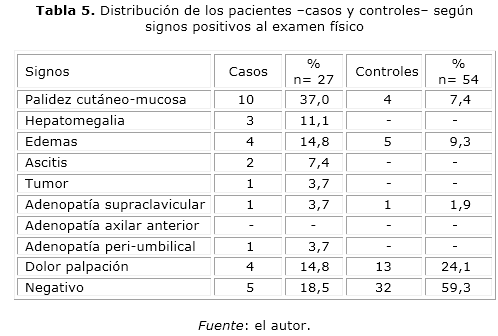
La palidez cutáneo-mucosa fue el signo más frecuente entre los pacientes del grupo de “casos”, en el 37 % de los mismos se observó aislada o en combinación con otros signos. Entre los controles el examen físico negativo o normal fue el hallazgo más frecuente con el 59,3 %, en contraste con el 18,5 % de los pacientes del grupo de “casos” en el que no se constató alteración (tabla 5).
En la tabla 6 se muestra que en los pacientes con CG existen alteraciones de las pruebas de laboratorio, fue la Velocidad de Sedimentación Globular la que con mayor frecuencia se alteró (resultó acelerada en el 77,8 %), existió anemia en más del 50 % de los casos, mientras que la albumina (en el 28,5 % de los pacientes) y las proteínas totales (en el 5,7 % de los pacientes) resultaron bajas en el grupo pacientes con CG. En el grupo de pacientes “controles” no hubo alteración de las proteínas totales ni de la albúmina, mientras que presentaron anemia el 35,2 % y la velocidad de sedimentación globular estuvo acelerada en el 13 % del referido grupo.
El mayor número de lesiones se observó en el extremo distal del estómago, así lo muestra la tabla 7; tanto en antro como en cuerpo se observaron más de la mitad de los casos.
En la tabla 8 se muestra la distribución de los casos según el tipo de lesión (clasificación de París). Se observaron lesiones de todos los tipos incluidos en la mencionada clasificación, predominando el tipo III que fue observado en el 29,6 % de los casos.
La mayoría de las lesiones tenían más de 2 cm (96,1 %). Así se observa en la tabla 9.
Al observar la tabla 10 se puede percibir un ligero predomino del carcinoma de células en anillo de sello (48,1 %) con núcleo excéntrico (40,7 %), seguido del carcinoma tubular (40,7 %) a predominio de los pocos diferenciados con patrón sólido, que se observó en el 22,2 % de los casos.
DISCUSIÓN
La mortalidad por cáncer digestivo en Cuba muestra diferencias que dependen del sexo, edad, tipo de tumor y región geográfica. Las razones para estos cambios son complejas, y por desgracia no muchos datos están disponibles para el análisis. A pesar de que el sistema de salud cubano ha buscado mejorar la calidad del cuidado en el nivel primario de atención y ha enfocado sus mayores esfuerzos en la promoción de salud y prevención de la enfermedad, la carga de enfermedad por cáncer y sobre todo la mortalidad, aumentó entre 1990 y el 2002.31
En el periodo en que se reclutaron los casos el número de endoscopias del tracto digestivo superior realizadas en el IGE fue inferior al de los años precedentes, por ello; el descenso en las cifras de pacientes con CG se debió a la declinación en el número de pacientes estudiados. Las razones son múltiples. El predominio del CG en las mujeres constituyó un hallazgo que difiere de lo reportado en la literatura nacional e internacional. Durante esos años el número de mujeres que se realizaron endoscopia del tracto digestivo superior fue mayor que el de los hombres, se tuvo en cuenta esto, las proporciones difieren (mujeres 16/3347= 0,47 % y hombres 11/1760= 0,62 %), lo que permite concluir que en realidad el porcentaje de hombres con CG entre los estudiados por endoscopia es mayor que el de las mujeres, pero esta diferencia no fue significativa desde el punto de vista estadístico (p= 0,49).
Seoane-Mato D.,2 de igual manera que Martínez Marín,33 Zhao YP,3 Hur y colaboradores,16 reportaron predominio del sexo masculino. Castaño-Molina y colaboradores4 hallaron un predominio de la población masculina, con una proporción de 1,8:1; tendencia también reportada en el estudio realizado por Adrada,32 ambos autores intentan explicar esta tendencia; en parte, por el hecho de que los hombres están más expuestos a factores ambientales nocivos.4,34 Gómez Zulueta M,14 aunque reporta predominio de CG en los hombres, no obtuvo diferencia significativa entre sexos, señala además, que entre los menores de 40 años, el CG predominó en las mujeres. Zhao YP,3 al igual que Hur y colaboradores,16 reportan predominio de CG en los hombres. En el ámbito nacional, Reina Alfonso BE y colaboradores9 reportaron predominio del sexo masculino.
Es común que el cáncer se encuentre con mayor frecuencia en la edad adulta, porque con el envejecimiento los procesos fisiológicos no son tan eficientes, disminuyen los mecanismos de protección y reparación de la mucosa gástrica, se hacen más notables los efectos nocivos de factores de riesgo ambientales o por estilos de vida desfavorables que inducen los procesos celulares hacia el desarrollo y progresión de un cáncer.4
Por ello, era de esperar que el CG predominara en los mayores de 60 años, especialmente los que se encontraban comprendido entre 70 y 79 años. La edad media fue de 63,9 años, aspecto que no difiere de lo reportado en otras investigaciones realizadas en diferentes poblaciones colombianas7 o las reportadas por Hur H y colaboradores.16 Martínez Marín y colaboradores33 señalaron la edad promedio de 66 años, Gómez M,15 por su parte; informa que el promedio de edad de los pacientes con CG fue de 60,5 ± 15 años.
Un reciente trabajo realizado en China,34 país con alta incidencia de CG, el 64 % de los pacientes menores de 40 años, el CG era difuso, el 19 % de ellos tenía antecedente de CG en familiares de primer grado, cifra que es similar a la reportada por Gómez M y colaboradores.15 Por su parte, Rodriguez-Vargas B. y colaboradores35 señalan que la edad promedio de los pacientes con CG de tipo intestinal fue de 69,1 ± 10,3 años; mientras que la de los pacientes con el tipo difuso fue 59,3 ± 15,3 años y para los que presentaban el tipo mixto fue de 69,1 ± 17,1 años. Ambos estudios parecen indicar relación existente entre la edad de aparición del CG, el tipo histológico y los antecedentes patológicos familiares de padecer de CG. En el contexto nacional Reina Alfonso BE y colaboradores9 reportan que el mayor número de pacientes tenían entre 60 a 69 años. De igual manera, para Prieto Grave de Peralta A.36 existió predominio del CG en el grupo de 60 a 69 años; tanto en hombres como en mujeres, sin embargo, incluye todos los tipos de CG, aspecto que puede haber determinado la diferencia con los resultados del estudio.
El dolor abdominal epigástrico constituyó el síntoma más frecuentes para ambos grupos, sin diferencias entre unos y otros, hecho que lo ubica en el síntoma más frecuente de cualquier patología del sistema digestivo alto, este hecho no permite sospechar la presencia de una patología maligna cuando se presenta de forma aislada, habría que profundizar en sus características semiológicas para poder perfilar su patrón de comportamiento en pacientes con CG. El predominio de síntomas como la pérdida de peso, la astenia, la anorexia, los vómitos y las náuseas en los pacientes con CG, no difiere de lo reportado por otros investigadores, como Reina Alfonso BE y colaboradores.9 Para Gómez y colaboradores,15 el principal síntoma fue el ardor epigástrico, señalan como síntoma de alarma más frecuente, la pérdida de peso, sin embargo, a diferencia de los resultados que se exponen en este informe, la hematemesis y la melena constituyeron; en conjunto con la palidez cutáneo-mucosa, síntomas y signos de alarma frecuentes.
Los principales síntomas referidos por los pacientes con CG; según Prieto Grave de Paralta,36 fueron la epigastralgia y el decaimiento. Obtuvieron asociación estadísticamente significativa entre la presencia de CG y las variables epigastralgia, vómitos, hemorragia digestiva alta, decaimiento, pérdida de peso y mucosas hipocoloreadas. Al profundizar en el análisis de los síntomas, podemos observar como las asociaciones de epigastralgia con alguno de los siguientes síntomas: anorexia, vómitos, pérdida de peso, astenia o nauseas, fueron más frecuente en los casos que en los controles, se mostró diferencias significativas desde el punto de vista estadístico. La intensidad de estas asociaciones -en los casos- desciende en el orden antes referido. En opinión de los autores, la presencia de dolor epigástrico asociado a alguno de ellos, constituye; en conjunto, elementos a tener en cuenta en la valoración clínica de cada paciente y su presencia elevaría de forma ostensible el índice de sospecha de CG.
La elevada frecuencia de palidez cutáneo-mucosa -aislada o en combinación con otros signos-, en opinión de los autores; puede deberse, a la anorexia, las náuseas y los vómitos frecuentes en los pacientes con CG. El dolor a la palpación y las adenopatías a cualquier nivel fueron poco frecuente en ambos grupos de pacientes.
Llama la atención; entre los pacientes del grupo control, la ausencia de signos físicos patológicos en alrededor del 60 % de ellos, en comparación con los pacientes con CG, esta diferencia resultó significativa (OR= 0,1562; IC= 0,0513-0,4752; p= 0,0005), resultados que reflejan poca probabilidad de padecer CG en pacientes con aparente examen físico normal. Estos resultados no difieren con lo reportado por Reina Alfonso BE y colaboradores,9 quienes en conjunto con la pérdida de peso; señalan la palidez cutáneo-mucosa entre los signos más frecuentes.
En opinión de los autores, la intensidad y naturaleza de los síntomas influyeron en la decisión de buscar ayuda médica; de forma más precoz; en los casos, que en los pacientes del grupo control, se determinó de esta manera que el periodo de aparición de los síntomas y el momento de la endoscopia fuera superior en estos últimos. El promedio de duración de los síntomas entre los pacientes con CG incluidos en el estudio realizado por Gómez y colaboradores15 fue superior a los 6 meses, hecho que se corresponde con nuestros resultados.
El predominio de la velocidad de sedimentación globular acelerada y de anemia, así como su asociación en los pacientes con CG, sugiere que la presencia de ambas alteraciones en un paciente, es muy sugestiva de CG y puede ser un elemento de incalculable valor en la sospecha de CG en pacientes con síntomas digestivos. Los resultados reafirman el planteamiento que los estudios de laboratorio pueden mostrar datos compatibles con anemia crónica compensada.18 La determinación de proteínas puede estar alterada por la desnutrición crónica del paciente portador de esta patología.18
En un gran número de pacientes la lesión abarcó varias regiones del estómago, son más frecuentes aquellas que comprometían el antro y el cuerpo, ambas localizaciones fueron afectadas en más de la mitad de los pacientes. Estos resultados se corresponden con los obtenidos por otros investigadores como Gómez M,16 Pérez Torres E.19 y Hur H y colaboradores.17 Reina Alfonso BE9 reporta que las lesiones por ellos detectadas, en su mayoría se encontraban localizadas en el antro, seguida del cuerpo. Martínez Marín JD,33 por su parte, manifiesta que la localización proximal de los tumores fue la predominante, en especial entre los hombres.
Investigadores,9 refieren que el tipo endoscópico más frecuente lo constituyen las formas ulceradas, que en un porcentaje de los casos asientan sobre una lesión vegetante o infiltrante y optan una forma mixta, plantean además que las formas ulceradas predominan en la región antral, mientras que las vegetantes e infiltrantes lo hacen con mayor frecuencia hacia el cuerpo y el fundus gástrico.En concordancia con ello predominó el tipo III o ulcerado infiltrante sin bordes bien definidos (clasificación de Paris, 2010), seguido por el tipo II o carcinoma ulcerado, bien delimitado, con márgenes elevados, mientras que el avanzado inclasificable ocupo el tercer lugar. Para Martínez Marín JD33 el 97 % de casos correspondió a tumores avanzados, la morfología Borrmann III y IV fueron las más comunes. En lo referente a las características endoscópicas, para Rodriguez-Vargas B y colaboradores,35 los más hallados fueron los tipos III y V de la clasificación de Borrmann, con similares frecuencias para ambos.
En el presente estudio, todos los casos fueron CGA, aspecto que refleja la incapacidad de realizar el diagnóstico en fases tempranas de la enfermedad. La frecuencia en el diagnóstico de CGP reportada por Gómez y colaboradores,15 fue superior a la de este estudio, solo en un caso (5 %) de los pacientes menores de 40 años el tumor era temprano, mientras que en el 20,4 % de los pacientes mayores de esa edad (p< 0,05) tenían CGP. Reportan además, que el 26,3 % de los casos avanzados del grupo < 40 años tenían una linitis plástica, este tipo endoscópico estuvo presente en un porcentaje menor entre los pacientes > 40 años (14,5 %), se muestran en estos resultados diferencias significativas desde el punto de vista estadístico.
Para Prieto Grave de Peralta A.36 la mayoría de los pacientes con CG clasificaron como Tipo IV (carcinoma no ulcerado, infiltrante de forma difusa) según la clasificación de Paris. Al igual que en nuestra casuística, el CG se detectó en estadios avanzados de la enfermedad. El 96 % de las lesiones fue mayor de 2 cm. por lo que creemos pudieron haber sido diagnosticadas con anterioridad, los autores deducen que la poca especificidad de los síntomas en el curso del CG pudo influir en el retardo del diagnóstico. Hur H y colaboradores17 reportaron CGA en el 55,6 %, las localizaciones fueron similares a las nuestras, pero el punto de corte establecido para las dimensiones de la lesiones difieren de las nuestras (5 cm). Lauren21,37 en 1965 estableció dos tipos histológicos diferentes de adenocarcinoma -el intestinal y el difuso-, con marcadas diferencias de comportamiento clínico y epidemiológico.
En un amplio artículo publicado por Hu y colaboradores,38 se establecen similitudes entre los adenocarcinoma tubular, papilar y mucinoso (clasificación de la OMS, 2010) con el Tipo intestinal (clasificación de Lauren, 1965) y el carcinoma de células en anillo del sello y otros pobremente cohesivos (OMS, 2010), con el tipo difuso (Lauren 1965), el tipo indeterminado de Lauren se relaciona con el carcinoma mixto de la clasificación de la OMS.
De acuerdo con la clasificación de la OMS de 2010, existió predominio de los carcinomas de células en anillo de sello, seguido del tubular. Si se tiene en cuenta que no existe en la literatura consultada ningún trabajo que utilice la clasificación de la OMS de 2010 y se asueme a los carcinomas papilar, tubular y mucinosos como subtipos del tipo intestinal de Lauren, así como el de células en anillo de sello como el difuso de la clasificación de 1965, se podría decir que existió un predominio del tipo difuso (48,1 %) sobre el intestinal (40,7 %).
Estos resultados difieren con los obtenidos por Adrada JC32 y Castaño-Molina E.4 quienes reportan predominio del tipo intestinal en la población colombiana, señalan que este tipo es propio de zonas de alto riesgo en las cuales hay un marcado efecto ambiental, de igual manera, el ADC de tipo intestinal fue más frecuente para Reina Alfonso BE.9
Según Llorens y colaboradores,39 a pesar de la mayor incidencia del ADC de tipo intestinal con respecto al difuso, este último ha experimentado un ascenso a nivel mundial.
Para Reina Alfonso BE y colaboradores9 existió predominio del tipo intestinal. Gómez y colaboradores14 constataron que el ADC difuso fue más frecuente en pacientes menores de 40 años, mientras que este tipo histológico fue poco frecuente en los pacientes mayores de esa edad.
Rodriguez-Vargas B,35 por su parte, reporta frecuencias de CG de tipo intestinal del 56 %; en el tipo difuso del 38 %, y tipo mixto del 6 %.
Martínez Marín33 encontró predominio del tipo intestinal con respecto al difuso. De igual manera, Hur H16 y Martínez Marín33 reportaron que el tipo histológico más frecuente fue el intestinal.
CONSIDERACIONES FINALES
La epigastralgia asociada a la astenia, la pérdida de peso y anorexia constituyen la sintomatología clínica más frecuente en los pacientes con cáncer gástrico de tipo epitelial. El cáncer gástrico de tipo epitelial prevaleció en los dos tercios distales de estómago, siendo el tipo III de la clasificación de Paris y las lesiones mayores de 2 cm las más frecuentes. El tipo histológico más frecuente de cáncer gástrico de tipo epitelial fue el carcinoma de células en anillo de sello.
REFERENCIAS BIBLIOGRAFICAS
1. Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM, et al. Globocan 2008. V2.0, Cancer incidence and Mortality Worldwide: IARC Cancer Base No 10 [Internet]. Lyon: International Agency for Research on Cancer. 2010. [citado 15 de Ago del 2012]. Disponible en: http://globocan.iarc.fr/
2. Seoane-Mato D, Aragonés N, Ferreras E, García-Pérez J, Cervantes-Amat M, Fernández-Navarro P, et al. Trends in oral cavity, pharyngeal, oesophageal and gastric cancer mortality rates in Spain, 1952-2006: an age-period-cohort analysis. BMC Cancer. 2014;14:254. doi:10.1186/1471-2407-14-254.
3. Zhao Y-P, Xu X-Y, Fang M, Wang H, You Q. Decreased Core-Fucosylation Contributes to Malignancy in Gastric Cancer. PLoS ONE. 2014;9(4):e94536. doi:10.1371/journal.pone.0094536
4. Castaño-Molina E, Santacoloma M, Arango L, Camargo M. Cáncer gástrico y genes detoxificadores en una población colombiana. Rev Col Gastroenterol. 2010;25(3):252-60.
5. Subirat Esquivel L, Guillén Isern D. Algunas consideraciones actuales sobre el Cáncer Gástrico. AMC. 2011 [citado 15 Abr 2014];15(2). Disponible en: http://scielo.sld.cu/scielo.php?pid=S1025-02552011000200019&script=sci_arttext
6. Park DJ, Thomas NJ, Yoon Ch, Yoon SS. Vascular Endothelial Growth Factor A Inhibition in Gastric Cancer. Gastric Cancer; 2014. DOI 10.1007/s10120-014-0397-4.
7. Cuba. Ministerio de Salud Pública. Dirección Nacional de Estadística. Anuario estadístico de salud. La Habana: MINSAP. 2012. [citado 25 Abril 2014] disponible en: http//www.infomed.sld.cu
8. Fernández Fernández ML. Mortalidad por algunos canceres digestivos en Cuba. 1989-2008. [Tesis para optar por el título de especialista en gastroenterología]. La Habana: MINSAP; 2012.
9. Reina Alfonso BE, Lebroc Pérez D, Massip Ramírez M. Comportamiento clínico-epidemiológico del cáncer gástrico en el Departamento de Gastroenterología del Hospital Provincial de Ciego de Ávila. MEDICIEGO. 2011 [citado 15 de Abr del 2014];17(2). Disponible en: http://web.ebscohost.com/ehost/pdfviewer/pdfviewer?vid=11&sid=1b0f1328-9f24-466b-9b53-0dd3cf5ec992%40sessionmgr10&hid=12
10. Charles F, Jae Yong Ch, Dumitru F, Passalacqua R, Goswami Ch. Ramucirumab monotherapy for previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (REGARD): an international, randomised, multicentre, placebo-controlled, phase 3 trial. The Lancet; Oct 03, 2013.
11. Kodera Y, Fujitani K, Fukushima N, Ito S, Muro K, Ohashi N, et al. Surgical resection of hepatic metastasis from gastric cancer: a review and new recommendation in the Japanese gastric cancer treatment guidelines. Gastric Cancer. 2014;17:206-12. DOI 10.1007/s10120-013-0299-x
12. Garda Robles R, Ayala Ramírez P, Acosta Vega N. Alteración de la regulación de la apoptosis vía Fas/FasL en cáncer gástrico. Bogotá, Colombia: Rev Cienc Salud. 2009;7(1):83-94.
13. Otero Regino W, Gómez MA, Castro D. Carcinogénesis gástrica. Rev Col Gastroenterol. 2009;24(3):314-29.
14. Gómez Zuleta M, Otero Regino W, Ruiz Lobo X. Factores de riesgo para cáncer gástrico en pacientes colombianos. Rev Col Gastroenterol 2009;24(2):134-43.
15. Gómez M, Otero W, Caminos JE. Cáncer gástrico en pacientes jóvenes en Colombia. Rev Col Gastroenterol. 2012;27(3):166-72.
16. Hur H, Paik MJ, Xuan Y, Nguyen D-T, Ham I-H, Yun J, et al. Quantitative Measurement of Organic Acids in Tissues from Gastric Cancer Patients Indicates Increased Glucose Metabolism in Gastric Cancer. PLoS ONE. 2014;9(6):e98581. doi:10.1371/journal.pone.0098581
17. Siddavaram Nagini. Carcinoma of the stomach: A review of epidemiology, pathogenesis, molecular genetics and chemoprevention. World J Gastrointest Oncol. 2012 July 15;4(7):156-169.
18. Pérez Torres E, Abdo Francis JM, Zavala Solares MR, Badillo Vázquez GY, Casillas Guzmán GB. Tratamiento quirúrgico del cáncer gástrico en el Servicio de Gastroenterología del Hospital General de México. Rev Med Hosp Gen Mex. 2010;73(1):9-15.
19. The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach, and colon: November 30 to December 1, 2002. Gastrointest Endosc. 2003;58(6 Suppl):S3-43.
20. Vassallo JA, Barrios E. Actualización Ponderada de los Factores de Riesgo del Cáncer. Montevideo: Comisión Honoraria de Lucha contra el Cáncer; 2003 [citado 23 de Jun del 2012]. Disponible en: http://www.urucan.org.uy/uilayer/ve/factores_riesgo/factores_riesgo_3.pdf
21. WHO histological classification of gastric tumours. 2011. [citado 15 de Abr del 2014]. Disponible en: http://www.saap.es/pdfsvarios/WHO%20HISTOLOGICAL%20CLASSIFICATION%20OF%20GASTRIC%20TUMOURS1.pdf
22. Paula Csendes G, Álvaro Sanhueza S. Evaluación del cáncer por tomografía computada. Revista Chilena de Radiología. 2006;12(2):57-63.
23. Japanese Gastric Cancer Association. Japanese classification of gastric carcinoma. Gastric Cancer. 2011;14:101-12. DOI10.1007/s10120-011-0041-5.
24. Habermann C, Weiss F, Riecken R. Preoperative staging of gastric adenocarcinoma: Comparison of Helical CT and Endoscopic US. Radiology. 2004;1:230-465.
25. Shimada H, Tamaki Noie T, Ohashi M, Oba K, Takahashi Y. Clinical significance of serum tumor markers for gastric cancer: a systematic review of literature by the Task Force of the Japanese Gastric Cancer Association. Gastric Cancer. 2014;17:26-33. DOI 10.1007/s10120-013-0259-5.
26. Díez Alonso M, Mugüerza Huguet JM, Martín Duce A. Marcadores biológicos en adenocarcinomas gástricos. Gastroenterología Integrada. 2002;3(4):229-41.
27. Tomohiro M, Mitsuru S, Junki M, Seiichi H, Atsushi O, Ryoji K, et al. HER2 expression in locally advanced gastric cancer with extensive lymph node (bulky N2 or paraaortic) metastasis (JCOG1005-A trial). Gastric Cancer; 2014.
28. Barone C, Cassano A, Pozzo C, D'Ugo D, Schinzari G, Persiani R, et al. Long-term follow-up of a pilot phase II study with neoadjuvant epidoxorubicin, etoposide and cisplatin in gastric cancer. Oncology. 2004,67:48-53.
29. Forero Piñeros EA, Arantes V, Toyonaga T. Disección endoscópica de la submucosa (DES) en cáncer gástrico temprano: Estado del arte. Rev Col Gastroenterol. 2012;27(3):200-221.
30. Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D, et al. Global cancer statistics. CA Cancer J Clin. 2011;61(2):69-90.
31. Abreu MR, Vilar E, Arús ER, Mejia JM, Martínez Y, Yasells A, et al. Trends in digestive cancer mortality, Cuba 1987-2008. European Journal of Public Health. 2012;1-7. [citado 15 de Abr del 2014]. Disponible en: http://eurpub.oxfordjournals.org/
32. Adrada JC, Calambas FH, Diaz JE. Características sociodemográficas y clínicas en una población con cáncer gástrico en el Cauca, Colombia. Rev Col Gastroenterol. 2008;23:309-14.
33. Martínez Marín JD, Garzón Olarte MA, Lizarazo Rodríguez JI, Marulanda Gómez JC, Molano Villa JC, Rey Tovar MH, et al. Características de los pacientes con cáncer gástrico del departamento de Cundinamarca, remitidos al Hospital Universitario de la Samaritana entre los años 2004 y 2009. Rev Col Gastroenterol. 2010;25(4):344-48.
34. Bai Y, Li ZS. Endoscopic, clinicopathological features and prognosis of very Young patients with gastric cancer. J Gastroenterol Hepatol; 2011.
35. Rodriguez Vargas B, Arevalo Suarez F, Monge Salgado E, Montes Teves P. Características histológicas y endoscópicas del cáncer gástrico diagnosticado en un hospital nacional del Callao, Perú. Rev Perú MedExp Salud Pública. 2013;30(1):12-7.
36. Prieto Grave de Peralta AC. Factores de riesgo asociados al cáncer gástrico. [Tesis para optar por el título de Especialista en Gastroenterología]. La Habana: MINSAP; 2012.
37. Qiu M, Cai M, Zhang D, Wang Z, Wang D, Li Y, et al. Clinicopathological characteristics and prognostic analysis of Lauren classification in gastric adenocarcinoma in China. Journal of Translational Medicine. 2013;11:58.
38. Hu B, El Hajj N, Sittler S, Lammert N, Barnes R, Meloni-Ehrig A. Gastric cancer: Classification, histology and application of molecular pathology. J GastrointestOncol. 2012;3(3):251-61. doi: 10.3978/j.issn.2078-6891.2012.021
39. Llorens S, Contreras M, Luis P. Diagnóstico de la metaplasia intestinal gástrica antral y angular por cromoendoscopia en sus etapas iniciales. GastroenteolLatinoam. 2007;18(1):13-20.
Recibido: 3 de noviembre de 2015.
Aprobado: 5 de diciembre de 2015.
Alfredo Hierro González. Instituto de Gastroenterología. La Habana, Cuba.
Correo electrónico: ahierroglez@infomed.sld.cu