Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Ortopedia y Traumatología
versión On-line ISSN 1561-3100
Rev Cubana Ortop Traumatol vol.30 no.2 Ciudad de la Habana jul.-dic. 2016
ARTÍCULO DE REVISIÓN
Actualidades en infecciones vertebrales
News on Vertebral Infections
Actualités sur les infections vertébrales
Horacio Tabares Neyra,I Juan Miguel Díaz Quesada, II Horacio Tabares Sáez,I Laura Tabares SáezI
ICentro de Investigaciones en Longevidad, Envejecimiento y Salud. La Habana, Cuba.
IIHospital General Docente "Calixto García". La Habana, Cuba.
RESUMEN
Introducción: las infecciones vertebrales constituyen una afección de baja incidencia, pero con incremento importante en años recientes, el cual está en relación con una población más susceptible por diversas razones. A pesar de nuevos métodos para el diagnóstico, la demora constituye un importante problema.
Propósito: revisar y discutir algunos temas actuales acerca de las infecciones vertebrales, la epidemiologia, etiología, fisiopatología, diagnóstico y tipos de tratamientos.
Método: se seleccionó la literatura apropiada usando las bases de datos Pubmed, Hinari y Clinical Key.
Resultados: la literatura muestra la importancia del correcto y rápido diagnóstico; determinar el agente causal es de primordial importancia para aplicar una adecuada terapia antimicrobiana. El tratamiento conservador produce, generalmente, buenos resultados y el quirúrgico está indicado en déficit o sepsis neurológicos, inestabilidad espinal y/o deformidad y fallo del tratamiento conservador. Se muestra algoritmo para diagnóstico y tratamiento.
Conclusiones: aplicar una metodología correcta para el diagnóstico y tratamiento de las infecciones vertebrales, logra resultados satisfactorios.
Palabras clave: infección vertebral; espondilodiscitis; espondilitis; biopsia; terapia antimicrobiana.
ABSTRACT
Introduction: vertebral infections are a disease of low incidence, but with significant increase in recent years. This increase is related to a more susceptible population due to various reasons. Despite the new methods for diagnosis, its delay is a major problem.
Objective: review and discuss some current issues about the spine infections, epidemiology, etiology, pathophysiology, diagnosis and types of treatment.
Method: select the appropriate literature using PubMed database, Hinari and Clinical Key.
Results: the literature shows the importance of correct and rapid diagnosis, which determine the causal agent, is primordial to implement appropriate antimicrobial therapy. Conservative treatment generally produces good results and surgery is indicated in neurological deficit or sepsis, spinal instability and / or deformity and failure of conservative treatment. Diagnostic and treatment algorithm is shown.
Conclusions: applying correct methodology for the diagnosis and treatment of spinal infection, satisfactory results are achieved.
Keywords: spinal infection, spondylodiscitis, spondylitis, biopsy, antimicrobial therapy.
RÉSUMÉ
Introduction: les infections vertébrales sont des affections à faible incidence, mais d'un récent accroissement important. Cette augmentation est associée à une population plus sensible pour des raisons diverses. Malgré les nouvelles méthodes diagnostiques, le retard constitue un problème important.
Objectif: le but de cette étude est d'examiner et discuter des questions actuelles sur les infections vertébrales, leur épidémiologie, leur étiologie, leur physiopathologie, leur diagnostic, et les types de traitement.
Méthode: on a sélectionné une littérature appropriée au moyen des bases de données de PubMed, Hinari et Clinical Key.
Résultats: la littérature montre l'importance d'un diagnostic correct et précoce; la définition de l'agent causal est d'une importance essentielle pour appliquer une adéquate thérapie antimicrobienne. En général, le traitement conservateur a de bons résultats, mais le traitement chirurgical est indiqué en cas de déficit ou sepsis neurologiques, d'instabilité et/ou déformation rachidienne, et d'échec du traitement conservateur. Un algorithme est présenté pour le diagnostic et le traitement.
Conclusions: l'application d'une correcte méthodologie pour le diagnostic et le traitement des infections vertébrales assure des résultats satisfaisants.
Mots-clés: infection vertébrale; spondylodiscite; spondylite; biopsie; thérapie antimicrobienne.
INTRODUCCIÓN
Es conocido que a lo largo de la historia de la medicina, las infecciones espinales se han considerado afecciones devastadoras, con elevados índices de morbilidad y mortalidad asociados. El advenimiento de nuevas pruebas diagnósticas, de la quimioterapia antimicrobiana multidrogas y el empleo de novedosas técnicas quirúrgicas han variado este pronóstico de manera importante en años recientes.1
Las primeras descripciones de infecciones espinales se encuentran en los textos Hipocráticos escritos entre el siglo IV antes de nuestra era y el I de nuestra era, donde se menciona la "espondilitis tuberculosa".1 Existen otras descripciones que datan de la "Edad de hierro".2
En 1779, Sir Percival Pott hizo la primera descripción detallada de infección por tuberculosis en la columna vertebral asociándola a parálisis, lo que se conoció como "paraplejia de Pott"1,2-4 y un siglo después, en 1897, Lanneloungue mencionó por primera vez, en la literatura médica, el término osteomielitis piógena vertebral.5
La laminectomía se estableció como la técnica quirúrgica de elección en infecciones vertebrales desde fines del siglo XIX, y fue condenada por Seddon y otros debido a que no resolvía la afectación anterior y creaba inestabilidad.3 En 1894 Menard publicó su serie de casos con paraplejia de Pott tratados mediante descompresión por costotransversectomia,6 pero esta técnica fue desechada por el elevado índice de infecciones secundarias.7 Hibb y Albee en 1911, independientemente, describen la fusión posterior como medio para lograr buena recuperación.8,9 Posteriormente, Girdlestone reintroduce la descompresión por costotransversectomía en 1931 con técnica aséptica, la que logró establecerse.10
El abordaje anterior de la columna lumbar fue descrito por Ito en 1934, quien demostró que este provee adecuada exposición y permite el desbridamiento radical y una mejor fusión.11 Hodgson popularizó el abordaje anterior en el manejo de la tuberculosis vertebral y valoró la importancia de la fusión para evitar cifosis y paraplejia tardia.12,13
La quimioterapia antituberculosa estuvo disponible en 1945 y mostró ser capaz de curar la enfermedad incluso sin necesidad de cirugía.14-17 En Inglaterra, ante los divergentes criterios que existían para tratar las infecciones tuberculosas, un grupo de investigadores crearon el "British Medical Research Council Working Party on Tuberculosis of the Spine", el cual realizó un gran número de estudios prospectivos controlados, a larga escala, acerca de los diferentes métodos de tratamiento que junto a otros desarrollados posteriormente, ayudaron a determinar las recomendaciones actuales de tratamiento de esa enfermedad.1
Aunque las infecciones piógenas difieren de la espondilitis tuberculosa, el tratamiento quirúrgico de estas ha estado influenciado por el desarrollo en el manejo de la tuberculosis.18-21 La introducción de la penicilina y la estreptomicina revolucionaron el tratamiento de todas las infecciones vertebrales. En la medida que se han desarrollado agentes antimicrobianos más potentes y se han definido las combinaciones de sus dosis, la relativa efectividad de los tratamientos quirúrgicos ha disminuido.20-25
La introducción de la biopsia por aguja disminuyó la necesidad de biopsias abiertas.1,26-30 Las nuevas modalidades para realizar el diagnóstico han disminuido la demora en aplicar tratamiento y con ello, el papel de la cirugía en la prevención y tratamiento de las deformidades residuales.26-30
Sin embargo, los pacientes con déficit neurológico y deformidad progresiva continúan teniendo indicación de desbridamiento radical por cirugía y reconstrucción. Los significativos avances en las técnicas quirúrgicas, el desarrollo de implantes especializados y la aplicación de otras terapias biológicas han mejorado significativamente los resultados en pacientes con severas infecciones espinales.26-30
Es propósito de este artículo revisar y discutir algunos de estos temas actuales acerca de las infecciones vertebrales, la epidemiologia, etiología, fisiopatología, el diagnóstico y los tipos de tratamientos para dicho proceso patológico.
Estrategia de búsqueda y criterio de selección
Las referencias se identificaron mediante la búsqueda en PubMed de las publicaciones de los últimos 5 años en inglés con los términos: "Infecciones vertebrales", "Tratamiento de infecciones vertebrales", "Manejo de infecciones vertebrales". Igualmente se revisaron artículos accesibles de forma libre o a través del servicio Hinari y Clinical Key. Se añadieron algunos artículos que sobrepasan los 5 años de antigüedad, pero que son claves para el tema tratado.
DESARROLLO
Epidemiología
Antes del empleo de los antibióticos, la mortalidad en pacientes con infecciones vertebrales era entre el 40 % y el 70 %. Los avances en la quimioterapia a partir de 1960 alteraron drásticamente la historia natural de estas enfermedades, hasta el punto de que en la actualidad las infecciones vertebrales son relativamente raras, constituyendo solo entre 2 % y 4 % de todas las osteomielitis, con una incidencia de 1:1000 000 y 1:250 000 en países desarrollados, con mortalidad estimada entre 1 % a 20 % en dependencia del grupo a que pertenece el paciente y al agente infeccioso causal.1,19-21
Aunque la incidencia de espondilitis tuberculosa ha decrecido considerablemente en los años recientes, la incidencia de osteomielitis vertebral piógena se ha incrementado.31 El problema actualmente es la demora en hacer el diagnóstico, alrededor de 3 meses, el largo periodo de recuperación, 12 meses promedio, y los elevados costos del tratamiento.1 La infección vertebral ocurre a cualquier edad, desde la infancia hasta el adulto mayor, teniendo predilección por este último grupo, donde la disminución de los niveles inmunológicos y las comorbilidades favorecen su incidencia.1,2,25
Algunos trabajos ubican la mitad de los pacientes con infecciones vertebrales en pacientes mayores de 50 años de edad, donde dos terceras partes de ellos son hombres.1 Muchos autores refieren una distribución bimodal con un pico de incidencia alrededor de los 20 años y otro entre los 50 a 70 años de edad, representando este último grupo aproximadamente del 3 %-5 % de todos los casos de osteomielitis.20,23,24
Constituyen factores de riesgo predisponentes, las cirugías sobre la columna, los focos sépticos a distancia, la diabetes mellitus, la edad avanzada, el abuso de drogas intravenosas, la infección por HIV, la inmunosupresión, historia oncológica, fallo renal, enfermedades reumatológicas y la cirrosis hepática.25,26,32
En años recientes se ha observado un incremento de la incidencia lo que se atribuye al aumento de la población susceptible y la demora en el diagnóstico. La discitis posquirúrgica representa actualmente el 30 % de todos los casos de espondilodiscitis piógena.33,34
Etiología
Las infecciones vertebrales ocurren básicamente por tres tipos de agentes: bacterias que causan infecciones piógenas; tuberculosis u hongos, que causan infecciones granulomatosas; o parásitos, que constituye la etiología menos común.4 En el pasado la infección por el germen de la tuberculosis era la mayor causa de infección vertebral, pero los avances en el diagnóstico y tratamiento de la tuberculosis pulmonar han disminuido su incidencia en los últimos 50 años. En la actualidad la mayoría de las infecciones son bacteriales monomicrobiales causadas por estafilococos áureos con incidencia entre 30 %-80 %.20,27 Gérmenes gramnegativos como Escherichia coli son responsables en algunas series de alrededor del 25 % de las infecciones vertebrales.20
El Mycobacterium tuberculosis es el agente común en infecciones vertebrales de pacientes HIV positivo, representando más del 60 % de los casos. Los gérmenes anaeróbicos aparecen ocasionalmente como causa de estas infecciones, fundamentalmente en lesiones penetrantes de columna.35
Está establecido, que a pesar de los esfuerzos para diagnosticar el agente infeccioso, en la tercera parte de los casos no se llega a identificar.36 La mayoría de los autores recomiendan prestar atención a infecciones vertebrales en áreas aún endémicas de brucelosis y tuberculosis, por la posibilidad de estas etiologías.37
De manera esquemática se presentan en el cuadro 1 los principales organismos reportados como causantes de osteomielitis vertebral.
Fisiopatología
El platillo terminal de los cuerpos vertebrales es el foco comúnmente reportado de infección vertebral, seguido por el disco intervertebral y la formación de abscesos epidurales y paraespinales. Otros elementos vertebrales que pueden afectarse incluyen las apófisis articulares, facetas articulares y la odontoide, aunque estos aparecen en reportes aislados primarios como áreas de infección. Las vértebras de la columna torácica y lumbar constituyen las áreas más comunes de infecciones piógenas, mientras que la unión toracolumbar lo es de las infecciones tuberculosas.3
Se plantean 3 rutas de diseminación de los patógenos: vía hematógena, inoculación externa directa y por contigüidad a partir de tejidos vecinos.4
En niños, las arterias intraóseas tienen extensas anastomosis con vasos que penetran el disco intervertebral. Por esa razón, el émbolo séptico hematógeno no provoca afectación ósea y la infección se limita al disco intervertebral. El disco intervertebral del adulto es avascular pero relativamente muy activo en su metabolismo y recibe su nutrición a partir de la difusión de nutrientes por los platillos terminales y de los vasos sanguíneos en la periferia del anillo fibroso; alrededor de la tercera década de vida las anastomosis intraóseas sufren involución.1,38 Por esa razón, en adultos, el émbolo séptico provoca infartos vasculares óseos y ocasiona infección en las estructuras adyacentes que llevan a la imagen clásica de espondilodiscitis: erosión de los platillos terminales vertebrales, lesiones osteolíticas y fracturas por compresión que ocasionan inestabilidad, deformidad y riesgo de compresión neurológica.39-41
Una infección no controlada puede diseminarse alrededor de las estructuras óseas y acceder a tejidos vecinos causando abscesos vertebrales y del psoas. La diseminación de la infección hacia el canal vertebral puede originar abscesos epidurales, subdurales y meningitis. La diseminación hacia estructuras posteriores es rara debido al deficiente aporte vascular y ocurre en infecciones por hongos o en espondilodiscitis tuberculosa.39 La espondilodiscitis piógena hematógena afecta principalmente la columna lumbar (58 %), seguida por la torácica (30 %) y la cervical (11 %), lo que es reflejo de la extensión en el aporte vascular que reciben dichas estructuras.39
Las infecciones tuberculosas, de preferencia, involucran más de 2 niveles en la región torácica, lo que las diferencia de la espondilodiscitis piógena.38 La inoculación directa frecuentemente es iatrogénica, por procederes quirúrgicos lumbares o por punciones epidurales lumbares.33 Las infecciones vertebrales por contigüidad son raras y ocurren en el contexto de infecciones adyacentes por rupturas esofágicas, abscesos retrofaríngeos o infecciones consecutivas a implantes aórticos.42
Diagnóstico
Hallazgos clínicos
El diagnóstico generalmente es difícil y requiere de un elevado nivel de suspicacia. Por esa razón es común que exista un significativo retraso entre la aparición de los primeros síntomas y el diagnóstico, el cual debe incluir tanto hallazgos clínicos, como de laboratorio e imágenes.19,21 Generalmente, lo primero que suele referir el paciente es dolor en la espalda o el cuello, aunque más del 15 % no tienen dolor.32
El dolor puede ser constante, y empeora de noche y con los cambios de posición, la deambulación u otras actividades y puede irradiarse al tórax o el abdomen. La intensidad varía de moderada a extrema.3 La fiebre es poco frecuente, presentándose en el 48 % de los pacientes con infección piógena y alrededor del 17 % en casos con tuberculosis. Disfagia y tortícolis son síntomas que indican localización cervical.29,43
Otros síntomas relacionados con déficit neurológico como hipoestesia, adormecimiento, calambres e incontinencia, están presentes en un tercio de los pacientes y guardan relación con diagnóstico tardío, infección cervical, presencia de absceso epidural e infección tuberculosa. Es importante determinar si existen deformidades como cifosis y tumefacción, lo que suele asociarse a espondilitis tuberculosa.24,43 Se ha encontrado asociación entre osteomielitis piogénica vertebral y endocarditis infecciosa, lo que no debe desestimarse durante la evaluación clínica y puede ser necesario realizar ecocardiograma.44,45
En edades pediátricas la presentación clínica es muy inespecífica. Los síntomas pueden incluir irritabilidad, negarse a gatear, sentarse o caminar, dolor abdominal o incontinencia. La fiebre es muy rara en niños y el signo más frecuente al examen físico es la pérdida de la lordosis lumbar; los déficit neurológicos son extremadamente raros.46-48
Puig-Guri describió 4 presentaciones sindrómicas clínicas que puede causar la infección:
1. Síndrome de la articulación de la cadera, con dolor agudo en cadera, contractura en flexión y limitación de movimientos.
2. Síndrome abdominal, con síntomas y signos que sugieren una apendicitis aguda.
3. Síndrome meníngeo, con síntomas y signos que sugieren meningitis supurativa o tuberculosa.
4. Síndrome doloroso lumbar, donde el dolor en la espalda baja puede ser agudo o insidioso, moderado o severo, y la estancia en cama, agonizante.49
El signo de Kernig (rigidez severa en fosa poplítea) y debilidad generalizada son otros posibles hallazgos. En adultos mayores y pacientes inmunosuprimidos la sintomatología suele ser mínima. La formación de abscesos es difícil de identificar debido a la profundidad de la columna; los abscesos paraespinales, cuando se presentan, drenan debajo del músculo psoas hasta el ligamento de Poupart.3,45-49
Los signos neurológicos rara vez son radiculares y por lo general asocian múltiples grupos de nervios. El síndrome de cordón central se reporta en dos tercios de los pacientes con parálisis por compresión, mientras que el síndrome de cordón anterior se presenta en un tercio de ellos. Los síntomas neurológicos son más frecuentes cuando la infección ocurre en niveles espinales altos; área cervical y torácica.3 Cuando se desarrollan signos neurológicos, siempre existe la posibilidad de compresión neural por formación de abscesos, colapso óseo o infección directa neural, por lo que se debe actuar rápidamente realizando descompresión y drenaje.3
Pruebas de laboratorio
Algunas pruebas de laboratorio, empleadas rutinariamente en la práctica diaria, son imprescindibles para hacer el diagnóstico en infecciones vertebrales y muy útiles para evaluar la efectividad del tratamiento.48
La velocidad de sedimentación de eritrocitos (VSE) ayuda para identificar infección del espacio discal, posee baja especificidad e indica la existencia de un proceso inflamatorio, esto le confiere un gran valor para determinar la respuesta al tratamiento.1,3,4 La VSE normalmente está elevada después de una cirugía (alrededor de 25 mm/h) y usualmente decrece hasta la normalidad alrededor de transcurridas 4 semanas. La elevación de VSE posterior a las 4 semanas de la cirugía con hallazgos clínicos asociados indican una infección persistente.3,4
Los valores de VSE se incrementan algunos días después de la infección con un pico entre el 7mo. y 8vo. días y su recuperación a valores normales es lenta.1 Está elevada en 71 %-97 % de los niños con osteomielitis vertebral; en 37 % de adultos con osteomielitis el valor de VSE es superior a 100 mm/h y en el 67 % mayor de 50 mm/h.3 Carrage encontró que la reducción del 25 % del valor inicial de VSE después de 1 mes de tratamiento es un marcador de buen pronóstico, sin embargo, en el 50 % de sus casos que no tuvieron cambios en la VSE los resultados fueron igualmente buenos.50
La mayoría de los autores consideran a la proteína C reactiva (PCR) el mejor indicador de infección y de evaluación de la respuesta al tratamiento pues regresa a sus valores normales en un corto periodo después de un adecuado tratamiento, mucho más rápido que la VSE. La PCR está elevada en más del 90 % de los casos de espondilodiscitis.51-53 La PCR ha demostrado ser un marcador más sensitivo que la VSE para la detección precoz de infecciones vertebrales posoperatorias. Alcanza un nivel pico a los 2 días posteriores a la intervención, y declina rápidamente hasta negativizarse, por ello la elevación continua de PCR en el periodo posoperatorio inmediato (4-7 días) constituye un indicador de infección.3,4
Al igual que la VSE, la PCR, desafortunadamente, posee poca especificidad ya que cualquier proceso infeccioso o inflamatorio eleva sus valores.54
El conteo total de leucocitos es el menos útil de los marcadores de inflamación; debido a su baja sensibilidad no es de gran ayuda en infecciones vertebrales, decrece en infantes y pacientes debilitados, y su incremento puede indicar sepsis en otras localizaciones.24,51
Cuando se sospecha infección vertebral, está recomendado realizar hemocultivos y urocultivos antes de iniciar el tratamiento antibiótico. Debido a que la espondilodiscitis piógena suele ser monomicrobial, en alrededor del 59 % de las ocasiones el hemocultivo positivo identifica el microorganismo causante.20,55,56
Los cultivos para gérmenes anaeróbicos decrecieron en los años 80 debido a lo raro de infección por estos gérmenes, pero la bacteriemia anaeróbica ha resurgido como problema clínico significativo, por lo que se recomienda su empleo.1,3,4
Diagnóstico por biopsia
El diagnóstico definitivo solo puede realizarse a través de microscopia o examen bacteriológico de los tejidos infectados. Son muchos los trabajos que enfatizan sobre la importancia de realizar biopsia en pacientes donde los hemocultivos son negativos o no concluyentes.27,37,57 En muchos casos la identificación del organismo causal solo se logra a través de biopsia y se describen experiencias de correlación del 100 % entre resultados de hemocultivos seriados y biopsias de tejidos infectados.1,58
La biopsia por aguja es el mejor método para determinar la infección e identificar el agente causal, lo que permite administrar el antibiótico apropiado. El diagnóstico a través de biopsia por aguja guiada por TAC muestra resultados variables lo que depende de la experiencia del radiólogo que la realiza, del número de muestras que se tomen y de la ausencia de tratamiento antibiótico previo, por ello algunos autores reservan la biopsia abierta para los casos donde la biopsia por aguja resulta negativa.3,4,41 Esta biopsia por aguja se lleva a cabo con el paciente bajo anestesia local (general en niños) y control de radiografías o TAC. Se reportan éxitos con la biopsia por aguja entre 71 % y 96 %; los índices de biopsias inadecuadas oscilan entre 0 % y 20 % y los resultados falsos negativos, de 4 %-20 %.1,3,4
Se reporta 25 % de biopsias negativas en infecciones donde se administró antibiótico previo a la biopsia.1,3,4 El tiempo transcurrido, la resistencia del huésped, la virulencia bacteriana, antibióticos previos y el medio donde se cultive son factores mencionados que actúan sobre el éxito de aislar el agente causal.3
Imágenes
Radiografías. Los estudios radiográficos son realizados inicialmente ante la sospecha de enfermedad vertebral. Todos los autores coinciden en señalar que los cambios que se observan en estos estudios aparecen entre 2 semanas y 3 meses después de la infección y que, básicamente, incluyen estrechamiento del espacio intervertebral, irregularidad de los platillos vertebrales terminales o pérdida de sus contornos normales, defectos en la porción subcondral del platillo y formaciones óseas hipertróficas (esclerosis).3,4
Es importante identificar alguna pérdida de la alineación coronal o sagital como consecuencia de la afección. Ocasionalmente se observan masas paravertebrales que envuelven áreas de la columna. El tomograma simple puede mostrar anormalidades antes que las radiografías, como osteopenia de los platillos terminales a los 10-14 días, pero en la actualidad ha sido remplazada por el empleo de la TAC.1
Tomografía axial computarizada. La TAC confiere otra dimensión a los estudios imaginológicos, es el mejor test para evaluar los cambios óseos que ocurren en el proceso séptico, incluyendo los cambios tempranos en los platillos vertebrales, como defectos líticos subcondrales, irregularidad, hipointensidad del disco, ruptura de hueso en la periferia discal, cambios de intensidad en regiones epidural y paraespinal, presencia de osteonecrosis y calcificaciones patológicas sugestivas de tuberculosis.59 La TAC se emplea de rutina para realizar biopsia por aguja.60-62 El mieloTAC define claramente la compresión de elementos neurales por abscesos y permite determinar si la infección se extiende a estructuras nerviosas.1,3,4
Resonancia magnética. Las imágenes por resonancia (IRM) se consideran la modalidad "gold" estándar para el diagnóstico de espondilodiscitis debido a su elevada sensibilidad (96 %), especificidad (94 %) y gran capacidad para brindar información anatómica detallada acerca del estado de los tejidos blandos adyacentes y el espacio epidural.63,64
La IRM brinda imágenes de calidad y es un método rápido para identificar las infecciones vertebrales. Con IRM se identifican los tejidos normales y los infectados, y tal vez sea el mejor test para determinar la extensión del proceso séptico. Con este estudio no puede diferenciarse entre infecciones piógenas y no piógenas, por lo que no excluye la necesidad de diagnóstico por biopsia.3
Para detectar infecciones deben realizarse imágenes cargadas en T1 y T2 en vistas sagitales, donde los cambios característicos consisten en: señal hipointensa del disco y cuerpo vertebral en T1 con pérdida del margen entre el disco y la vértebra adyacente; y señal hiperintensa en el disco intervertebral en T2 que se corresponden con edema por infección con marcada disminución de intensidad en el cuerpo vertebral. Los abscesos paravertebrales alrededor del saco tecal son fácilmente identificables como áreas de intensidad aumentada y la delineación de la infección elimina la necesidad de mielografía adicional.3,4 La IRM es útil incluso para identificar infecciones del cordón (mielitis) donde no está involucrado tejido óseo o la zona epidural.3
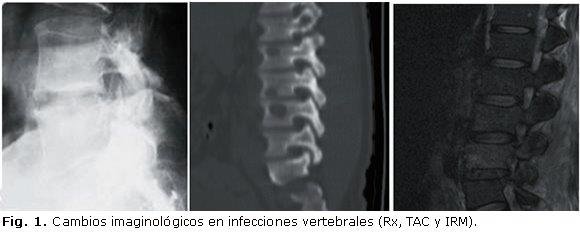
Al adicionar gadolinium se mejora la delimitación de la infección, permitiendo diferenciar las lesiones infecciosas de las degenerativas (hipointensidad en T2 acorde con cambios Modic de platillos terminales) y de lesiones tumorales (el tejido óseo hipointenso a normal en T1).65,66 La figura 1 muestra imágenes de infecciones óseas por radiografía, TAC e IRM.
Actualmente se plantea que la IRM puede tener importancia para diferenciar la espondilitis tuberculosa de la espondilodiscitis piógena. La infección tuberculosa produce gran destrucción ósea, conservando relativamente los discos intervertebrales y desarrollando grandes abscesos paravertebrales.4 El cuadro 2 hace referencia a los cambios por imágenes que ayudan en el diagnóstico diferencial de las infecciones vertebrales.37,65,67-69
Aunque se ha incrementado el empleo de IRM para monitorear la respuesta al tratamiento en las infecciones vertebrales, los estudios de Kowalski no apoyan el uso rutinario de IRM con ese fin, dándole lógica preponderancia a la respuesta clínica ante la terapia microbiana.70,71
Escaneo con radionúclidos. Los estudios con radionúclidos son relativamente efectivos para identificar infecciones vertebrales. A pesar del incremento en su importancia, deben reservarse para aquellos casos donde el diagnóstico es dudoso, o la IRM es inconclusa.3,4
Estas técnicas incluyen escaneo con 99tecnecio, escaneo con 67galio y leucocitos marcados con 111iridium. El escaneo óseo con 99tecnecio tiene tres fases: angiograma, "pool" de imágenes sanguíneas e imágenes estáticas tardías. En las infecciones se observa actividad difusa en el "pool" de imágenes, esta actividad difusa es focal en las imágenes tardías. Aunque el escaneo óseo casi siempre es positivo en pacientes con infección, debe tenerse presente que ello indica incremento de la circulación, lo cual no necesariamente diagnostica infección.3
El escaneo con 67galio se considera una herramienta muy útil para detectar osteomielitis, con sensibilidad de 90 % y especificidad de 100 %; se plantea que su efectividad se incrementa al 94 % cuando se combina el escaneo con 67galio con el de 99tecnecio. Algunos autores sugieren el uso de escaneo con 67galio cuando existe fiebre de origen desconocido.72
Los leucocitos marcados son útiles para diagnosticar y detectar abscesos, pero no diferencia entre infecciones agudas o crónicas. Se han descrito resultados falsos negativos en infecciones crónicas porque el radionúclido se acumula en lesiones inflamatorias no infecciosas. Las lesiones inflamatorias originadas por neoplasias pueden igualmente mostrar resultados falsos positivos con todas las técnicas de escaneo. Se plantea que la mayor ventaja del escaneo de leucocitos marcados es que puede diferenciar entre lesiones no infecciosas, tales como seromas o hematomas, que aparecen como masas o cavidades en TAC y IRM y abscesos cavitarios. Esa diferenciación es muy importante cuando se evalúan infecciones posquirúrgicas potenciales.3
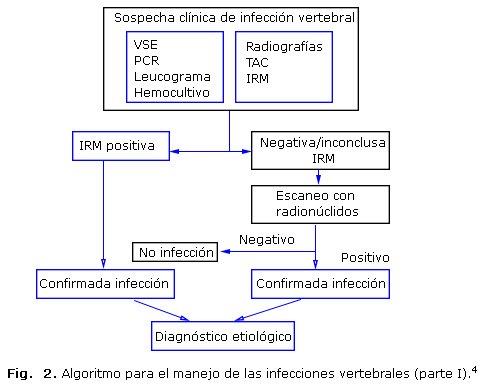
De manera simplificada, se muestra en la figura 2, la primera parte del algoritmo propuesto por Duarte y Vaccaro para el diagnóstico y tratamiento de las infecciones vertebrales, con el empleo de los criterios clínicos, de laboratorio y por imágenes antes expuesto.4
Los principios básicos en el tratamiento de las infecciones vertebrales son: antibióticos para erradicar la infección; fijación del segmento afectado para preservar o restaurar la estructura de la columna y su estabilidad; y desbridamiento y descompresión del canal espinal en presencia de déficit neurológico o abscesos peridurales.20,73
El tratamiento antibiótico es la primera terapia para las infecciones vertebrales. Los antibióticos deben seleccionarse acorde con los datos positivos que se tengan, los resultados de los cultivos y la sensibilidad del organismo causal. Lo ideal es iniciar su aplicación después de lograr el diagnóstico etiológico, pero en los casos en que es difícil o imposible lograrlo dicho se debe considerarse el empleo empírico de la terapia antibiótica.3,4 En la situación mencionada los medicamentos de elección deben tener espectro amplio, cubriendo la mayor cantidad de gérmenes, incluidos S. aureus y E. coli, gérmenes más comunes en espondilodiscitis piógenas; además deben tomarse en cuenta criterios epidemiológicos locales y la posible colonización por organismos resistentes.4
En ocasiones los antibióticos específicos pueden no ser adecuados, Eismont notó que 1 hora después de la inyección de cefalotin, este no era detectable en el disco y penetraba menos del 4 % en los valores séricos. Clindamicina y tobramicina tenían valores séricos mayores de 50 % 1 hora después de la inyección.74 Gibson confirmó esa conclusión y estudio los niveles de flucloxacillin y cefradine en discos intervertebrales de niños durante cirugía espinal anterior, encontró que ninguno de ellos era detectable en los discos, a pesar de elevados niveles presentes en otros tejidos.75
En casos de bacteriemia causada por S. aureus meticillin-resistente, la droga de elección es la vancomicina, aunque su eficacia es dudosa. Para lograr niveles de concentración terapéutica en hueso, la Sociedad Americana de Enfermedades Infecciosas (ASID) recomienda mantener concentraciones de vancomicina entre 15-20 mg/L.4
En casos de tuberculosis confirmada se debe iniciar terapia específica tuberculostática. Las guías de la Sociedad Británica para Infecciones (BIS), recomiendan que el tratamiento para todas las formas de tuberculosis del sistema nervioso central consiste en 4 drogas (isoniazida, rifampicina, pirazinamida y etambutol) por 2 meses, seguido por 2 drogas (isoniazida y rifampicin) por otros 10 meses.76 Otras infecciones atípicas no poseen un consenso establecido, en las espondilodiscitis fúngicas es difícil identificar el agente causal, y la terapia antimicótica es también complicada, por lo que muchos autores recomiendan como primer abordaje el quirúrgico.20,73,77
El tiempo para mantener los antibióticos varía, generalmente la administración parenteral se realiza durante 3-8 semanas.3,4 Autores como Collert sugieren que los antibióticos deben continuarse hasta que la VSE retorne a normal. Pero la VSE se mantiene elevada por un periodo prolongado, lo que lleva a otros a guiarse por la normalización de la PCR para descontinuar los antibióticos.3,78
Se ha demostrado que la duración de la terapia no se relaciona directamente con mejores resultados. Se coincide en que después de esos periodos iniciales de administración parenteral de antibióticos, debe mantenerse la terapia con administración oral basada en la respuesta individual y el patógeno involucrado.3,44 En espondilodiscitis piógenas no específicas se recomienda terapia oral adicional por un periodo variable entre 6 semanas y 3 meses.20,21
Debido a la buena difusión de las fluoroquinolonas, la clindamicina y la rifampicina, algunos reportes las mencionan como las de elección para la terapia oral antimicrobiana.44,79 Antes de cambiar a la vía oral, debe descartarse la posibilidad de endocarditis.3
En espondilitis tuberculosa el tratamiento debe continuarse por un periodo de 10-24 meses, para lograr la adecuada curación y evitar la recurrencia.20 Se ha propuesto que la reducción semanal de un 50 % de la PCR sugiere una evolución favorable, y constituye un criterio aceptado que para descontinuar el tratamiento antimicrobiano es necesario además de la resolución de los síntomas, la normalización de la VSE y la PCR.80
En los casos donde se ha determinado el germen causal, y el paciente responde rápido al tratamiento con antibióticos, la hospitalización y el reposo en cama solo se requieren por breve tiempo por los síntomas iniciales. Pueden administrarse los antibióticos intravenosos en la casa, lo que permite que el paciente complete su tratamiento fuera del hospital. Pueden indicarse aparatos de inmovilización para aliviar el dolor y evitar fracturas y deformidades, pero esto requiere educar al paciente y monitorizarlo adecuadamente.3,20,37
La controversia aparece cuando están presentes déficit neurológicos menores; en la serie de Pigrau, donde el 29,7 % presento síntomas neurológicos, solo 13 % de los pacientes requirieron cirugía. La opinión es que si no existe inestabilidad espinal, debe aplicarse tratamiento conservador y los síntomas neurológicos menores deben remitir con terapia específica antibiótica.3,81
La inmovilización es una de las formas de tratamiento conservador, inmovilizar el segmento afectado es necesario cuando existe dolor importante sin riesgo de inestabilidad, lo que elimina la necesidad de reposo prolongado en cama. La columna cervical se inmoviliza usando collar cervical o halo-tractor. Para la columna torácica o lumbar se emplean corsés para distribuir las cargas y reducir la presión en la vértebra afectada.20 Si el paciente demuestra incremento del dolor y posible deformidad, sin mejoría de los test de laboratorio, debe considerarse el manejo quirúrgico.4
Los cuidados médicos generales son fundamentales, cualquier condición asociada que comprometa la curación o la respuesta inmune debe ser manejada agresivamente. La atención a la nutrición, los déficit metabólicos y la hipoxia son esenciales. Debe controlarse la diabetes y otras enfermedades sistémicas. Cualquier foco de infección en tracto urinario, pulmones, piel u otra localización debe tratarse al mismo tiempo que la infección vertebral.1
El tratamiento quirúrgico se emplea en presencia de déficit o sepsis neurológica; una indicación absoluta es la inestabilidad espinal debido a la destrucción ósea masiva, la cifosis severa, las lesiones intracanal con efecto de masa, la etiología desconocida asociada con tumor activo y fallo del tratamiento conservador.20,82
Algunos autores recomiendan tratamiento quirúrgico cuando existe un absceso epidural, incluso sin déficit neurológico, especialmente en las regiones cervical y torácica.83 Las indicaciones relativas consisten en dolor incontrolable y condiciones inexistentes para tratamiento conservador.21
La decisión quirúrgica ante déficit neurológico puede estar afectada por la edad del paciente, así como por condiciones médicas concurrentes.36 Yoshimoto en una revisión de 45 casos de espondilitis piógena en adultos mayores, encontró que el 42 % con parálisis al momento de admisión, no pudieron someterse a cirugía por las malas condiciones generales que presentaban.84
Las claves del tratamiento quirúrgico incluyen: (1) rápida descompresión del canal espinal y estabilización del segmento vertebral, en presencia de déficit neurológico. (2) Desbridamiento agresivo de los tejidos incluido el drenaje de los abscesos paravertebrales. (3) toma de muestras para análisis microbiológico e histológico.85,86 Cualquier abordaje puede ser empleado (anterior, posterior, combinado o mínimo invasivo) en dependencia de la presencia de déficit neurológico, la localización de la infección y el grado de destrucción ósea asociada.
En infecciones de columna cervical se recomienda el abordaje anterior con apropiado desbridamiento, descompresión (eventual corpectomía) y fusión con injerto óseo asociado a estabilización con placa anterior. En casos multinivel, se puede complementar con instrumentación posterior. Eventualmente, si la afectación mayormente es epidural, sin destrucción severa del cuerpo vertebral, es aceptable realizar descompresión y fusión posterior. 73,85
En columna torácica, generalmente la estabilidad está conservada por la restricción de la movilidad que producen las costillas por lo que no constituye una prioridad restaurarla. En presencia de afectación epidural sin lesión anterior del disco ni destrucción ósea, el abordaje posterior con descompresión e instrumentación es la primera opción. El abordaje anterior para descompresión y fusión (transtorácico, posterolateral o con toracoscopía) se reserva para lesiones monosegmentarias que no involucran elementos posteriores.87 En los casos con destrucción anterior severa y colapso, se recomienda el abordaje anterior para desbridamiento, descompresión y fusión con injerto óseo, complementado con instrumentación posterior.73,85,86
En la unión toracolumbar se recomienda la descompresión y estabilización cuando existe déficit neurológico o invasión epidural extensa. Si existe espondilodiscitis monosegmentaria con afectación anterior moderada que involucra hueso y mínima deformidad cifótica, muchos cirujanos prefieren no invadir los tejidos posteriores para exponer el área purulenta, y realizan un desbridamiento anterior inicial, seguido por el proceder de estabilización posterior en otro tiempo quirúrgico. En presencia de destrucción ósea anterior extensa y colapso con cifosis segmentaria, la recomendación es realizar doble abordaje (en uno o dos tiempos) con desbridamiento anterior y fusión entre los cuerpos vertebrales, asociándola con instrumentación posterior; todo esto debe resultar en la rápida fusión vertebral, con corrección de la cifosis y movilización precoz del paciente.88-90
Existen opiniones divergentes con relación a la mejor opción de fusión anterior entre los cuerpos vertebrales. Se reconoce como un procedimiento seguro y de buenos resultados el empleo de injerto tricortical ilíaco autólogo.90-92 Publicaciones recientes plantean que se obtiene mejores índices de fusión cuando se combina proteína morfogenética ósea humana con el injerto óseo estructural. Aunque no es frecuente, debe tenerse presente al usar injertos, el riesgo de reacción inmune que empeore y complique el cuadro infeccioso existente.90,93-95
Gran cantidad de publicaciones recientes muestran que los implantes metálicos son seguros en infecciones vertebrales. Debido a la importancia de distinguir entre los diferentes riesgos que se asume con el empleo de implantes metálicos en las infecciones piógenas o tuberculosas, las publicaciones actuales son entusiastas con los resultados obtenidos en ambas situaciones.90,96,97
Con el desarrollo de la cirugía mínima invasiva de la columna (MISS), algunas técnicas se han empleado para el tratamiento de las infecciones vertebrales; en el segmento torácico, el abordaje por toracoscopía se ha empleado en muchos centros con buenos resultados. Tiene las ventajas, además de disminuir el dolor y lograr una mejor función respiratoria posoperatoria, de crear menos daño de los tejidos blandos, mejores resultados estéticos y menor estadía hospitalaria.87
En infecciones del segmento lumbar se recomiendan los procedimientos mencionados para la unión toracolumbar, la instrumentación percutánea posterior se emplea regularmente en pacientes sometidos a doble abordaje.4
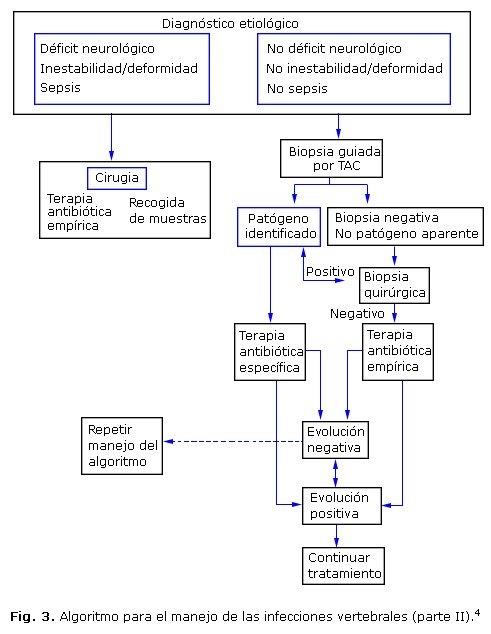
Como hicimos anteriormente para el diagnóstico, en relación con la clínica, exámenes de laboratorio e imágenes, en la figura 3 se muestra la parte II del algoritmo propuesto por Duarte y Vaccaro para el manejo de las infecciones vertebrales; la terapia antibiótica es ajustada en dependencia de los resultados de cultivos subsecuentes, ya sea por hemocultivo, por biopsia por aguja guiada por TAC o por toma directa de muestras en el transcurso del tratamiento quirúrgico.
Pronóstico
Desde el advenimiento de los antibióticos, con las nuevas técnicas de manejo y el diagnóstico temprano, la mortalidad asociada a las infecciones vertebrales ha decrecido significativamente hasta situarse actualmente en países desarrollados en alrededor del 5 %.32,36 Incluso, en los casos donde el diagnóstico absoluto no puede hacerse, muchas infecciones vertebrales resuelven la sintomatología y los cambios radiográficos en un periodo entre 9 y 24 meses.3
La mayor preocupación en la actualidad es la posibilidad del déficit neurológico permanente; algunos estudios retrospectivos muestran los distintos factores pronósticos que pueden ocasionar malos resultados.4 Junto con la edad del paciente y el segmento vertebral afectado, el mayor factor que pronostica resultados malos es la presencia de déficit motor antes de iniciarse el tratamiento, principalmente si dicho déficit ha estado presente por más de 36 horas.21,98
Algunos trabajos refieren que si se realiza descompresión inmediata al diagnóstico la recuperación puede ser completa.98 Otros, sin embargo, opinan que la presencia de déficit neurológico al momento de la admisión provoca síntomas residuales a mediano y largo plazo independientemente de la agresividad del tratamiento que se emplee, por lo que los resultados están directamente relacionados con la demora en el diagnóstico.99 Estas secuelas son esencialmente, el resultado de los cambios degenerativos secundarios a la destrucción tisular ocasionada por el proceso infeccioso.
Siempre existe la posibilidad de recurrencia de la infección en periodos donde la respuesta inmune disminuya por otras causas. McHenry reportó en su serie de 253 pacientes, 14 % de recurrencia, donde el 75 % de ellas ocurrieron en el primer año después de la cirugía.80 Este riesgo es grande durante el periodo en que la infección está controlada, pero el hueso es aún blando; cuando en el proceso de curación se forma hueso sólido alrededor del tejido infectado, eso no ocurre.3 En niños, el pronóstico suele ser excelente.46,100
En el cuadro 3 se muestran los factores que pronostican un mal resultado, según la mayoría de los autores.4
CONCLUSIONES
Las infecciones vertebrales muestran un incremento en su incidencia debido a la existencia de una población más susceptible. Factores como el envejecimiento poblacional, el HIV, la reaparición de la tuberculosis causada por las fluctuaciones socioeconómicas, la inmunosupresión y, básicamente, el aumento y complejidad de las cirugías espinales han motivado ese incremento.
Debido al carácter insidioso de su presentación, se requiere de una elevada suspicacia clínica para realizar un pronto diagnóstico; se necesita correlacionar la historia del paciente con los hallazgos clínicos, los resultados de las pruebas de laboratorio y de los estudios por imágenes. Los cultivos de sangre y de tejidos obtenidos mediante biopsia por aguja (con ayuda de TAC), o a través de la cirugía, permiten llegar a un correcto diagnóstico microbiológico e histológico, lo que constituye la piedra angular para definir el manejo terapéutico específico.
El tratamiento de las infecciones vertebrales es fundamentalmente no quirúrgico, y comprende la terapia antibiótica específica asociada con inmovilización, lo que reduce el dolor, y ayuda a prevenir la inestabilidad segmentaria y las deformidades. No debe obviarse el manejo del paciente en su conjunto, valorando el estado respiratorio, el cardiovascular, la nutrición, posibles comorbilidades y/o otras infecciones asociadas.
La cirugía está indicada en pacientes con déficit o sepsis neurológica, inestabilidad espinal y/o deformidad, abscesos epidurales y fallo de la terapia conservadora. Cuando la afectación principal incluye el cuerpo vertebral y el disco intervertebral la estrategia debe ser el desbridamiento anterior y la reconstrucción; para la descompresión de elementos neurales el abordaje posterior y la estabilización instrumentada pueden ser lo indicado. En pacientes seleccionados se puede emplear la cirugía mínima invasiva.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses en la realización de este trabajo.
REFERENCIAS BIBLIOGRÁFICAS
1. Kim CW, Currier BL, Eismont FJ. Infecciones de la columna vertebral. En: Herkowitz HN, Garfin SR, Balderston RA, Eismont FJ, Bell GR, Wiesel SW (eds.). Rothman-Simeone. The Spine. 6th ed. Philadelphia: Elsevier-Saunders; 2011.
2. Tayles N, Buckley HR. Leprosy and tuberculosis in iron age Southeast Asia? Am J Phys Anthropol. 2004;125(3):239-56.
3. Camillo FX. Infections of the spine. In: Canale ST, Beaty JH (eds.). Campbell's operative orthopaedics. Philadelphia: Mosby Elsevier; 2008.
4. Duarte RM, Vaccaro AR. Spinal infection: state of the art and management algorithm. Eur Spine J. 2014. doi 10.1007/s00586-013-2850-1.
5. Lannelongue O. On Acute Osteomyelitis, Miscellaneous, Pathological, and Practical Medicine Tracts. Paris: 1897.
6. Menard V. Causes de paraplégie dans le mal de Pott. Son traitement chirurgical par l'ouverture directe du foyer tuberculeux des vertébres. Revue d'Orthopedie. 1894;5:47-64.
7. Adams ZB. Tuberculosis of the spine in children. A review of sixty-three cases from the Lakeville State Sanatorium. J Bone Joint Surg Am. 1940;22:860-1.
8. Hibbs RA. An operation for progressive spinal deformities. N Y State Med J. 1911;93:1013-6.
9. Albee FH. Transplantation of a portion of the tibia into the spine for Pott's disease: a preliminary report 1911. Clin Orthop Relat Res. 2007;460:14-6.
10. Girdlestone GR. The operative treatment of Pott's paraplegia. Br J Surg. 1931; 9:121-41.
11. Ito H, Tsuchiya J, Asami G. A new radical operation for Pott's disease: A report of ten cases. J Bone Joint Surg. 1934;16:499-515.
12. Hodgson AR, Stock FE. Anterior spinal fusion a preliminary communication on the radical treatment of Pott's disease and Pott's paraplegia. Br J Surg. 1956;44:266-75.
13. Hodgson AR, Stock FE, Fang HS, Ong GB. Anterior spinal fusion. The operative approach and pathological findings in 412 patients with Pott's disease of the spine. Br J Surg. 1960;48:172-8.
14. Dickson JA. Spinal tuberculosis in Nigerian children. A review of ambulant treatment. J Bone Joint Surg Br. 1967;49:682-94.
15. Konstam PG, Blesovsky A. The ambulant treatment of spinal tuberculosis. Br J Surg. 1962;50:26-38.
16. Tuli SM. Results of treatment of spinal tuberculosis by "middle-path" regime. J Bone Joint Surg Br. 1975;57:13-23.
17. Friedman B, Kapur VN. Newer knowledge of chemotherapy in the treatment of tuberculosis of bones and joints. Clin Orthop. 1973;97:5-15.
18. McHenry MC, Easley KA, Locker GA. Vertebral osteomyelitis: long-term outcome for 253 patients from 7 Cleveland-area hospitals. Clin Infect Dis. 2002;34:1342-50.
19. Frangen TM. Surgical management of spondylodiscitis. An analysis of 78 cases. Unfallchirurg. 2006;109(9):743-53.
20. Sobottke R. Current diagnosis and treatment of spondylodiscitis. Dtsch Arztebl Int. 2008;105(10):181-7.
21. Butler JS. Nontuberculous pyogenic spinal infection in adults: a 12-year experience from a tertiary referral center. Spine. 2006;31(23):2695-700.
22. Tsiodras S, Falagas ME. Clinical assessment and medical treatment of spine infections. Clin Orthop Relat Res. 2006;444:38-50.
23. Mylona E. Pyogenic vertebral osteomyelitis: a systematic review of clinical characteristics. Semin Arthritis Rheum. 2009;39(1):10-7.
24. Grammatico L. Epidemiology of vertebral osteomyelitis (VO) in France: analysis of hospital-discharge data 2002-2003. Epidemiol Infect. 2008;136(5):653-60.
25. Carragee EJ. Pyogenic vertebral osteomyelitis. JBJ Surg Am. 1997;79(6):874-80.
26. Afshar M, Reilly RF. Spondylodiscitis in a patient on chronic hemodialysis. Nat Rev Nephrol. 2011;7(10):599-604.
27. Euba G. Long-term clinical and radiological magnetic resonance imaging outcome of abscess-associated spontaneous pyogenic vertebral osteomyelitis under conservative management. Semin Arthritis Rheum. 2008;38(1):28-40.
28. Gouliouris T, Aliyu SH, Brown NM. Spondylodiscitis: update on diagnosis and management. J Antimicrob Chemother. 2010;65 Suppl 3:iii11-iii24.
29. Kim CJ. A comparative study of pyogenic and tuberculous spondylodiscitis. Spine. 2010;35(21):E1096-1100.
30. Zimmerli W. Clinical practice. Vertebral osteomyelitis. N Engl J Med. 2010;362(11):1022-9.
31. Collert S. Osteomyelitis of the spine. Acta Orthop Scand. 1977;48:283-90.
32. Fantoni M. Epidemiological and clinical features of pyogenic spondylodiscitis. Eur Rev Med Pharmacol Sci. 2012;16(Suppl 2):2-7.
33. Silber JS. Management of postprocedural discitis. Spine J. 2002;2(4):279-87.
34. Jimenez-Mejias ME. Postoperative spondylodiskitis: etiology, clinical findings, prognosis, and comparison with nonoperative pyogenic spondylodiskitis. Clin Infect Dis. 1999;29(2):339-45.
35. Lim MR, Lee JY, Vaccaro AR. Surgical infections in the traumatized spine. Clin Orthop Relat Res. 2006;444:114-9.
36. Govender S. Spinal infection. JBJ Surg. 2005;87(B):1454-8.
37. Turunc T. A comparative analysis of tuberculous, brucellar and pyogenic spontaneous spondylodiscitis patients. J Infect. 2007;55(2):158-63.
38. Ratcliffe JF. An evaluation of the intra-osseous arterial anastomoses in the human vertebral body at different ages. Microarteriographic study. J Anat. 1982;134(Pt 2):373-82.
39. Ratcliffe JF. Anatomic basis for the pathogenesis and radiologic features of vertebral osteomyelitis and its differentiation from childhood discitis. A microarteriographic investigation. Acta Radiol Diagn (Stockh). 1985;26(2):137-43.
40. Wiley AM, Trueta J. The vascular anatomy of the spine and its relationship to pyogenic vertebral osteomyelitis. JBJ Surg Br. 1959;41-B:796-809.
41. Spyropoulou V, Valaikaite R, Dhouib A, Dayer R, Ceroni D. Progression of Infection after Surgical CT Navigation-Assisted Aspiration Biopsy of a Vertebral Abscess. Case Reports in Orthopedics. 2016; Article ID 8675761: http://dx.doi.org/10.1155/2016/8675761
42. Babinchak TJ, Riley DK, Rotheram EB. Pyogenic vertebral osteomyelitis of the posterior elements. Clin Infect Dis. 1997;25(2):221-4.
43. Schimmer RC. Osteomyelitis of the cervical spine: a potentially dramatic disease. J Spinal Disord Tech. 2002;15(2):110-7.
44. Roblot F. Optimal duration of antibiotic therapy in vertebral osteomyelitis. Semin Arthritis Rheum. 2007;36(5):269-77.
45. Zimmerli W. Clinical practice. Vertebral osteomyelitis. N Engl J Med. 2010;362(11):1022-9.
46. Garron E. Nontuberculous spondylodiscitis in children. J Pediatr Orthop. 2002;22(3):321-8.
47. Fernandez M, Carrol CL, Baker CJ. Discitis and vertebral osteomyelitis in children: an 18-year review. Pediatrics. 2000;105(6):1299-304.
48. Brown R. Discitis in young children. JBJ Surg Br. 2001;83(1):106-11.
49. Puig-Guri J. Pyogenic osteomyelitis of the spine: differential diagnosis through clinical and roentgenographic observations, JBJ Surg Am. 1946 Jan;28:29-39.
50. Carragee EJ. The clinical use of erythrocyte sedimentation rate in pyogenic vertebral osteomyelitis. Spine. 1997;22(18):2089-93.
51. Beronius M, Bergman B, Andersson R. Vertebral osteomyelitis in Goteborg, Sweden: a retrospective study of patients during 1990-95. Scand J Infect Dis. 2001;33(7):527-32.
52. Hsieh PC. Surgical strategies for vertebral osteomyelitis and epidural abscess. Neurosurg Focus. 2004;17(6):E4.
53. Kang BU. Surgical site infection in spinal surgery: detection and management based on serial C-reactive protein measurements. J Neurosurg Spine. 2010 13(2):158-64.
54. Lin ZY, Chuang WL, Dai CY. Clinical application of serum C-reactive protein measurement in the detection of bacterial infection in patients with liver cirrhosis. Kaohsiung J Med Sci. 2002;18:121-6.
55. Lillie P. Healthcare associated discitis in the era of antimicrobial resistance. J Clin Rheumatol. 2008;14(4):234-7.
56. Lassmann B. Reemergence of anaerobic bacteremia. Clin Infect Dis. 2007: 44(7):895-900.
57. Karadimas EJ. Spondylodiscitis. A retrospective study of 163 patients. Acta Orthop. 2008;79(5):650-9.
58. O'Daly BJ, Morris SF, O'Rourke SK. Long-term functional outcome in pyogenic spinal infection. Spine. 2008;33:E246-53.
59. Jevtic V. Vertebral infection. Eur Radiol. 2004;14(Suppl 3):E43-52.
60. de Lucas EM. CT-guided fine-needle aspiration in vertebral osteomyelitis: true usefulness of a common practice. Clin Rheumatol. 2009;28(3):315-20.
61. Rankine JJ. Therapeutic impact of percutaneous spinal biopsy in spinal infection. Postgrad Med J. 2004;80(948):607-9.
62. Michel SC. CT-guided core biopsy of subchondral bone and intervertebral space in suspected spondylodiskitis. Am J Roentgenol. 2006;186(4):977-80.
63. Ledermann HP. MR imaging findings in spinal infections: rules or myths? Radiology. 2003;228(2):506-14.
64. Leone A. Imaging of spondylodiscitis. Eur Rev Med Pharmacol Sci. 2012; 16(Suppl 2):8-19.
65. Diehn FE. Imaging of spine infection. Rad Clin North Am. 2012;50(4):777-98.
66. Shah LM, Salzman KL. Imaging of spinal metastatic disease. Int J Surg Oncol. 2011, Article ID 769753, 12 pages, 2011. doi:10.1155/2011/769753
67. Kwon JW. MRI findings of Aspergillus spondylitis. AJR Am J Roentgenol. 2011;197(5):W919-23.
68. Currie S. MRI characteristics of tuberculous spondylitis. Clin Radiol. 2011;66(8):778-87.
69. James SL, Davies AM. Imaging of infectious spinal disorders in children and adults. Eur J Radiol. 2006;58(1):27-40.
70. Kowalski TJ. Follow-up MR imaging in patients with pyogenic spine infections: lack of correlation with clinical features. AJNR Am J Neuroradiol. 2007;28(4):693-9.
71. Carragee EJ. The clinical use of magnetic resonance imaging in pyogenic vertebral osteomyelitis. Spine. 1997;22(7):780-5.
72. Tzen KY, Yen TC, Yang RS. The role of 67Ga in the early detection of spinal epidural abscesses. Nucl Med Commun. 2000;21:165.
73. Zarghooni K. Treatment of spondylodiscitis. Int Orthop. 2012;36(2):405-11.
74. Eismont FJ, Wiesel SW, Brighton CT. Antibiotic penetration into rabbit nucleus pulposus. Spine. 1987;12:254.
75. Gibson MJ, Karpinski MRK, Slack RCB. The penetration of antibiotics into the normal intervertebral disc. JBJ Surg. 1987;69B:784-6.
76. Thwaites G. British infection society guidelines for the diagnosis and treatment of tuberculosis of the central nervous system in adults and children. J Infect. 2009;59(3):167-87.
77. van Ooij A. Surgical treatment of aspergillus spondylodiscitis. Eur Spine J. 2000;9(1):75-9.
78. Friedman JA. Spontaneous disc space infections in adults. Surg Neurol. 2002;57(2):81-6.
79. Darley ES, MacGowan AP. Antibiotic treatment of grampositive bone and joint infections. J Antimicrob Chemother. 2004;53(6):928-35.
80. McHenry MC, Easley KA, Locker GA. Vertebral osteomyelitis: long-term outcome for 253 patients from 7 Cleveland area hospitals. Clin Infect Dis. 2002;34(10):1342-50.
81. Nolla JM. Spontaneous pyogenic vertebral osteomyelitis in nondrug users. Semin Arthritis Rheum. 2002;31(4):271-8.
82. Chen WH, Jiang LS, Dai LY. Surgical treatment of pyogenic vertebral osteomyelitis with spinal instrumentation. Eur Spine J. 2007;16(9):1307-16.
83. Darouiche RO. Spinal epidural abscess. N Engl J Med. 2006;355(19):2012-20.
84. Yoshimoto M. Pyogenic spondylitis in the elderly: a report from Japan with the most aging society. Eur Spine J. 2011;20(4):649-54.
85. Pola E. Surgical treatment of tuberculous spondylodiscitis. Eur Rev Med Pharmacol Sci. 2012;16(Suppl 2):79-85.
86. Linhardt O. Long-term results of ventro-dorsal versus ventral instrumentation fusion in the treatment of spondylitis. Int Orthop. 2007;31(1):113-9.
87. Muckley T. The role of thoracoscopic spinal surgery in the management of pyogenic vertebral osteomyelitis. Spine. 2004;29(11):E227-33.
88. Hee HT. Better treatment of vertebral osteomyelitis using posterior stabilization and titanium mesh cages. J Spinal Disord Tech. 2002;15(2):149-56. Discussion 156.
89. Liljenqvist U. Titanium cages in the surgical treatment of severe vertebral osteomyelitis. Eur Spine J. 2003;12(6):606-12.
90. Korovessis P, Repantis T, Hadjipavlou AG. Hematogenous pyogenic spinal infection: current perceptions. Orthopedics. 2012;35(10):885-92.
91. Schuster JM. Use of structural allografts in spinal osteomyelitis: a review of 47 cases. J Neurosurg. 2000;93(1 Suppl):8-14.
92. Dimar JR. Treatment of pyogenic vertebral osteomyelitis with anterior debridement and fusion followed by delayed posterior spinal fusion. Spine. 2004;29(3):326-32. Discussion 332.
93. Rihn JA. The use of RhBMP-2 in single-level transforaminal lumbar interbody fusion: a clinical and radiographic analysis. Eur Spine J. 2009;18(11):1629-36.
94. O'Shaughnessy BA, Kuklo TR, Ondra SL. Surgical treatment of vertebral osteomyelitis with recombinant human bone morphogenetic protein-2. Spine (Phila Pa 1976). 2008;33(5):E132-9.
95. Allen RT. Bone morphogenetic protein-2 (BMP-2) in the treatment of pyogenic vertebral osteomyelitis. Spine. 2007;32(26):2996-3006.
96. Jin D. One-stage anterior interbody autografting and instrumentation in primary surgical management of thoracolumbar spinal tuberculosis. Eur Spine J. 2004;13(2):114-21.
97. Benli IT. Anterior radical debridement and anterior instrumentation in tuberculosis spondylitis. Eur Spine J. 2003;12(2):224-34.
98. Hadjipavlou AG. Hematogenous pyogenic spinal infections and their surgical management. Spine. 2000;25(13):1668-79.
99. Lu CH. Adult spinal epidural abscess: clinical features and prognostic factors. Clin Neurol Neurosurg. 2002;104(4):306-10.
100. Fucs PM, Meves R, Yamada HH. Spinal infections in children: a review. Int Orthop. 2012;36(2):387-95.
Recibido: 18 de noviembre de 2015.
Aprobado: 6 de marzo de 2016.
Horacio Tabares Neyra. Correo electrónico: milahola@infomed.sld.cu