Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Oftalmología
versión On-line ISSN 1561-3070
Rev Cubana Oftalmol v.20 n.2 Ciudad de la Habana jul.-dic. 2007
Instituto Cubano de Oftalmología “Ramón Pando Ferrer”
Estudio comparativo de los resultados anatómicos y funcionales en el manejo quirúrgico de la catarata utilizando dos modalidades diferentes: extracción extracapsular del cristalino y facoemulsificación
Gilberto Fernández Vásquez,1 Juan Raúl Hernández Silva,2 Marcelino Río Torres,3 Meisy Ramos López,2 Luis Curbelo Cunill,1 Belkys Rodríguez Suárez4 y Eneida de la Caridad Pérez Candelaria5
Resumen
El cambio de una técnica quirúrgica a otra mucho más compleja, no deja de constituir un verdadero reto, más cuando esta técnica requiere de un difícil mecanismo de adaptación a nuevos criterios clínicos y tecnológicos, así como una curva de aprendizaje extensa y difícil, así se comporta el caso de la transición de la extracción extracapsular del cristalino (EECC) a la facoemulsificación en el manejo quirúrgico de la catarata. Nuestro estudio tuvo como objetivo comparar resultados anatómicos y funcionales del manejo quirúrgico de la catarata utilizando esas dos diferentes modalidades (extracción extracapsular del cristalino y facoemulsificación), además de valorar la agudeza visual posoperatoria con cristales y sin ellos, el cilindro refractivo y/o queratométrico posquirúrgico; comparar las modificaciones morfológicas y morfométricas después de implementar estos tipos de cirugía en la población celular del endotelio corneal y enumerar las complicaciones más frecuentes. Realizamos un estudio prospectivo, comparativo y descriptivo a 100 ojos portadores de catarata que fueron intervenidos (desde enero de 2005 a enero de 2006), mediante extracción extracapsular del cristalino (50 ojos), y facoemulsificación (50 ojos) como técnicas quirúrgicas, los cuales conformaron los grupos de estudio, atendiendo a los criterios de inclusión adoptados. A todos se les realizó seguimiento posoperatorio durante tres meses en el Centro de Microcirugía Ocular de nuestro Instituto Cubano de Oftalmología “Ramón Pando Ferrer”. Las variables analizadas fueron: edad, agudeza visual con cristales, astigmatismo inducido, conteo celular endotelial y complicaciones transoperatoria. La agudeza visual corregida o sin corrección fue superior en los ojos intervenidos mediante facoemulsificación. La recuperación visual fue mucho más precoz en los pacientes sometidos a facoemulsificación, se indujo menos astigmatismo en los pacientes del grupo de facoemulsificación, con un menor cilindro refractivo y queratométrico final. Los pacientes operados con la técnica de facoemulsificación presentaron menor deterioro del endotelio corneal, el grupo de facoemulsificación presentó un mayor número de complicaciones transoperatorias y posoperatorias, aunque escasas.
Palabras clave: Facoemulsificación, extracción extracapsular del cristalino, cilindro refractivo, cilindro queratométrico, microscopia endotelial.
Para un cirujano, el cambio de una técnica quirúrgica a otra mucho más compleja, puede constituir un verdadero dilema, mucho más cuando esta técnica requiere de un difícil mecanismo de adaptación a nuevos criterios clínicos y tecnológicos, y a una curva de aprendizaje extensa y difícil también. Este es el caso de la transición de la extracción extracapsular del cristalino (EECC) a la facoemulsificación en el manejo quirúrgico de la catarata.
Hace menos de una década, aproximadamente 50 % de las cirugías de cataratas en EE.UU. eran EECC, cifras que ahora constituyen menos de 3 %; así se manifiesta la aceptación cada vez más creciente de la facoemulsificación.
Esta situación no es nueva en el contexto de la cirugía de cataratas. La transición de la EECC por expresión e irrigación a partir de la técnica de extracción intracapsular del cristalino (EICC), ocurrió gradualmente porque los cirujanos tenían dificultad a la hora de evaluar la cantidad de material cortical remanente detrás del iris al compararla con la cirugía de EICC, que terminaba limpia y en 10 minutos. Muchos oftalmólogos experimentados salieron insatisfechos en su primer día postoperatorio, cuando el material cortical floculento ocluía significativamente porciones de la pupila.1,2
La facoemulsificación no es una técnica nueva, sin embargo, han tenido que transcurrir más de treinta años para que tome la importancia que ahora se le concede.
Esta técnica fue desarrollada en un inicio por el doctor Charles Kelman. El pensaba que la catarata senil podía ser eliminada a través de una incisión de 2 a 3 mm. En febrero de 1963, estando sentado en un sillón de estomatología, donde se le prestaba atención como paciente, observó lo ingenioso del instrumental con que se le realizaban las obturaciones dentales; percibió entonces que un instrumento delgado podía ser introducido dentro del ojo para capturar la catarata y en cierto modo suavizar, fragmentar, o pulverizar el material nuclear en su preparación para su retirada a través de una pequeña incisión. Experimentó con varios instrumentos tales como barrenos, vibradores, molinillos, así como métodos como maceración, agitación, oscilación, y desmenuzado. Incluso, trató de hallar un compuesto químico que pudiera disolver el lente sin destruir el endotelio corneal. Todos estos métodos eran incontrolables, poco confiables y tremendamente traumáticos para los contenidos intraoculares. Así continuó buscando durante 3 años, hasta que encontró que la fuerza ultrasónica podía ser aplicada para su objetivo. Después de múltiples experimentos en vivo con vibradores dentales ultrasónicos, estos resultaron insatisfactorios. Entonces, Kelman comenzó a trabajar con ingenieros de la Cavitron ® para desarrollar una aguja roma que pudiera vibrar a lo largo de su eje axil longitudinal y así fragmentar los cristalinos cataratosos.
Desde enero de 1966 hasta septiembre de 1969, se realizaron varias modificaciones y refinamientos que proveyeron el eslabón primario de una unidad de facoemulsificación clínicamente útil. El primer reporte donde se describe la técnica, aparece publicado en 1967. Este estuvo basado en cirugías realizadas en ojos de cadáveres y a animales in vivo, pero no fue hasta seis años después (1973) cuando aparecieron experiencias de facoemulsificación en pacientes portadores de cataratas.1
Los primeros instrumentos generadores de energía ultrasónica eran espirales de cables enrollados en una columna metálica delgada, unidos como el eje de un automóvil (principio magneto-restrictivo). La energía ultrasónica era transferida a la punta hueca por contacto físico directo. Una vez que la energía ultrasónica se iniciaba, esta punta describía no solo rápidos movimientos hacia delante y atrás, sino también otro movimiento restrictivo en forma de número 8, lo cual provocaba la repulsión de partículas finas del núcleo lejos del puerto de aspiración.2
Las actuales generaciones de piezas de mano generan la energía con el uso de los principios piezoeléctricos. Con este método, se crean vibraciones ultrasónicas mediante la producción de resonancia en cristal comprimido de cerámica con una carga eléctrica. Las vibraciones se transfieren directamente a la punta como en los métodos anteriores, pero con mucho menos movimientos laterales y una menor tendencia a expeler partículas del cristalino a lo lejos. Dado que la generación magnetorestrictiva era ineficiente, los equipos iniciales de mano requerían enfriamiento por agua, lo que hacía que estos fueran más gruesos, pesados y menos manipulables. Los actuales equipos con sistemas p2 Vol 6 / Chap 7 CLINICAL OPHTHALMOLOGYiezoeléctricos de mano son mucho más delgados y ligeros ya que no requieren enfriamiento por agua y tan solo con una protección externa, la generación de calor ha dejado de ser un problema mayor.3-5
Pero en la década de los años setenta no existían otros elementos indispensables para la facoemulsificación, como los viscoelásticos, los inhibidores de la miosis transoperatoria, los lentes intraoculares plegables (LIO), etc.; estaba entonces opacada por la técnica de EECC, la cual toma gran auge cuando los oftalmólogos adquieren conciencia de la importancia de conservar la cápsula posterior y por supuesto, ocurrir el suceso que para muchos constituye el descubrimiento más importante en el desarrollo de cirugía de catarata: la aparición de los LIO, que en aquella época eran rígidos en su totalidad. Esto hizo que se despreciaran las desventajas de una incisión de 8 -10 mm o más que debían ser suturados. Esta fue la causa por la cual, ya casi mayor de edad, la facoemulsificación se mantuvo en hibernación por casi 10 años más, hasta que en Houston, Texas, el facofragmentador ve la luz.6
Posteriormente, ciertos avances como las incisiones autosellables tunelizadas o en válvulas, el desarrollo de los materiales viscoelásticos, la aparición de la capsulorrhexis, y las lentes plegables, así como modificaciones en los sistemas de automatización de los equipos de facoemulsificación, terminaron por elevar a un rango mayor y definitivo esta técnica. Hoy día, con la aparición del facoláser y otros dispositivos para la destrucción del cristalino, aquellos tiempos pueden parecer lejanos; pero ocurre sencillamente que junto a la cirugía refractiva, quizás en los últimos quince años ningún otro renglón de la Oftalmología se ha desarrollado a pasos tan agigantados como la cirugía de cataratas. Parte de la gran lucha entre facoemulsificación y EECC estaba dada porque los resultados de esta última eran excelentes. Sin embargo, la posibilidad de un proceder con muy poca o mínima hiperemia y con una rehabilitación visual en extremo precoz en un muy elevado porcentaje de los pacientes, sin diplopía o parcheo posoperatorio, atraen al más conservador de los cirujanos.7
Son numerosas e indiscutibles las ventajas de la facoemulsificación. Las más importantes son las relacionadas o derivadas del mínimo acceso por la muy pequeña incisión (3-5 mm), lo cual disminuye el astigmatismo posoperatorio y minimiza la inflamación, permitiendo una recuperación visual más rápida, incluso el uso de anestesia tópica de rutina para la cirugía, y evitando el uso de suturas.8
Sin embargo, este proceder posee desventajas relacionadas fundamentalmente con la tecnología, la cual limita su uso casi masivo solo a países desarrollados. Las principales limitaciones de la facoemulsificación se derivan de su alto costo, no solo por el equipo de faco en sí mismo, sino por el múltiple y variado arsenal de elementos accesorios e instrumental especializado que es usado para realizar esta técnica (ejemplo: viscoelásticos, LIOs plegables, etc.). También, el dominio de esta técnica requiere de un entrenamiento específico de mucha dedicación, y favorece de cierto modo un grado muy elevado de especialización. La facoemulsificación requiere de una larga y difícil curva de aprendizaje, la cual debe comenzarse y mantenerse durante mucho tiempo basada en el uso de laboratorios ad hoc, tipo wetlab. Por su dificultad, la presencia de complicaciones en los cirujanos inexpertos (aunque sean avezados cirujanos en la EECC convencional) aumenta considerablemente, además de que en ocasiones son de mayor severidad y de más difícil manejo.9- 10
Cuba, con nuestro Centro de Microcirugía Ocular vanguardista en todos los sentidos, se encuentra en la etapa de transición de la EECC a la facoemulsificación.
El probado bienestar que el uso de este proceder le concede a nuestros pacientes nos conduce a generalizar en lo posible su uso, por eso decidimos realizar un estudio para evaluar nuestros resultados con el empleo de esta técnica quirúrgica y a la vez realizar un estudio comparativo por implementarse por vez primera esta cirugía en nuestro país.
Nuestro estudio tuvo como objetivos comparar resultados anatómicos y funcionales obtenidos en el manejo quirúrgico de la catarata utilizando dos modalidades diferentes: EECC y facoemulsificación; valorar la agudeza visual posoperatoria con cristales y sin ellos, el cilindro refractivo y/o queratométrico posquirúrgico; comparar las modificaciones morfológicas y morfométricas después de implementar estos tipos de cirugía en la población celular del endotelio corneal y enumerar las complicaciones más frecuentes.
Métodos
Se realizó un estudio prospectivo, comparativo y descriptivo a 100 ojos portadores de catarata que fueron intervenidos (desde enero de 2005 hasta enero de 2006), mediante extracción extracapsular del cristalino (50 ojos), y facoemulsificación (50 ojos) como técnicas quirúrgicas, los cuales conformaron los grupos de estudio, atendiendo a los criterios de inclusión adoptados. A todos se les realizó seguimiento posoperatorio durante tres meses en el Centro de Microcirugía Ocular de nuestro Instituto Cubano de Oftalmología “Ramón Pando Ferrer”..
Adoptamos como criterios de inclusión para ambos grupos los siguientes parámetros:
1. Dureza del núcleo lenticular (atendiendo al color del núcleo en el examen biomicroscópico).
a. Núcleo blanco o gris amarillento --- Grado I
b. Núcleo amarillo -----------------------Grado II
c. Núcleo ámbar o negro -----------------Grado III
2. Estado corneal
a. Endotelio morfológicamente sano: Hexagonalidad entre 60-75 % (pleomorfismo ++).
b. Conteo celular entre 2 000 y 3 000 células/mm2.
3. Agudeza visual (AV) preoperatoria (en correspondencia con la dureza del núcleo).
- Grado I de dureza del núcleo-----------0,4 AV
- Grado II de dureza del núcleo ----------0,3 AV
- Grado III de dureza del núcleo----------0,2 AV
Todos los pacientes fueron estudiados en la línea de diagnóstico preoperatorio del Servicio de Cataratas de Microcirugía; se les realizaron los siguientes exámenes: queratometría, refracción, biometría, tonometría, microscopia endotelial, biomicroscopia, fondoscopia directa e indirecta.
La técnica quirúrgica de facoemulsficación se realizó mediante incisión en cuatro pasos, con tunelización escleral a 1,5-2 mm del limbo corneal de una longitud aproximada de 6-6,5 mm autosellante. Se realizó capsulorrhexis, hidrodisección, e hidrodelaminación en todos los casos. En dependencia de la dureza del núcleo se realizó la emulsificación mediante las variantes chip and flip o divide y vencerás. Se implantó LIO rígido de cámara posterior, de polimetilmetacrilato (PMMA). Durante toda la cirugía nos beneficiamos con la utilización de viscoelástico.
La extracción extracapsular del cristalino se ejecutó mediante una incisión por córnea clara de 8-11 mm de longitud, en dependencia del tamaño del núcleo. La extracción del núcleo se realizó mediante maniobras de presión contra presión, se implantó LIO de cámara posterior rígido de PMMA y se suturó la herida con la utilización de nylon monofilamento 10-0, y se realizó un estilo surget.
En la totalidad de los casos se aplicó antiinflamatorio esteroideo y antibióticos por vía subconjuntival al terminar la cirugía.
El seguimiento posoperatorio se realizó mediante consultas planificadas después de transcurridas 24 h de efectuada la cirugía, una semana; uno, dos y tres meses posteriores a la operación. La terapéutica médica incluyó el uso de midíatricos ciclopléjicos del tipo homatropina 2 % en colirio, que se instiló solo una vez al día en la primera semana. Se indicó de rutina en los pacientes no complicados diclofenaco (Voltarén®) tópico cada 8 h, y oral con la misma frecuencia durante 30 días. Los pacientes que presentaron complicaciones fueron tratados particularmente según la naturaleza de esta.
En las consultas de chequeo posoperatorio se realizó examen ocular que incluyó siempre biomicroscopia anterior con lámpara de hendidura. En el chequeo semanal, mensual, bimensual y trimestral, se incluyó además estudio refractivo, mientras que en el trimestral se realizó también la microscopia endotelial.
Para evaluar las complicaciones que aparecieron en ambas técnicas, se consideraron aquellas que ocurrieron en el período transoperatorio, postoperatorio inmediato (< 1 semana), y posoperatorio mediato (> 1 semana; < 3 meses).
La recolección de datos, incluyendo las complicaciones transquirúrgicas, se realizó mediante sistema automatizado de información.
Todas estas variables fueron sometidas a un procesamiento estadístico a través de cálculos porcentuales, promedios, desviación standard y varios análisis de inferencia estadística, tales como el la prueba de t Student y chi cuadrado. Los resultados se reflejan en tablas y gráficos que expresan el comportamineto de los objetivos propuestos.
Resultados y discusión
La tabla 1 refleja las características generales de la muestra. Dentro de los detalles significativos observamos la diferencia de la edad promedio entre ambos grupos. En el grupo EECC la edad promedio fue mayor que en el grupo de facoemulsificación (67, 23 vs. 58,34 años; p = 0,04) En cuanto a las patologías oculares asociadas, existió una mayor frecuencia de estas en el grupo de facoemulsificación (17 pacientes; 34 %), principalmente dada por pacientes miopes (11 de 17; 64,70 %) con miopía axil previa y cataratas, que aunque incipientes o moderadas, inducían una miopía de índice sobreañadida y tenían repercusión óptica significativa dada su defecto refractivo de base.
También la AV con corrección fue significativamente mayor en el grupo de facoemulsificación (0,357) que en el grupo EECC (0,281) (p = 0,05), lo cual pudría asociarse a lo anteriormente expresado en relación con los pacientes miopes. En cuanto a la dureza del núcleo, se presentaron diferencias entre ambos grupos, con una dureza promedio mayor en el grupo EECC que en el de facoemulsificación.
Tabla 1. Características generales de la muestra
| Características | Grupo extracción extracapsular del cristalino | Grupo facoemulsificación | P |
| Edad (media) (Años) | 67,23 | 58,34 | 0,04* |
| Sexo masculino/ femenino (%) | 56,22 / 43,78 | 48 / 52 | 0,41 |
| Patología ocular asocidada (Sí/No) (%) | 16 / 84 | 34 / 66 | 0,06 |
| Agudeza visual (sin corrección) (Promedio) | 0,152 | 0,233 | 0,08 |
| Agudeza visual (con corrección) (Promedio) | 0,281 | 0,357 | 0,05* |
| Dureza del n úcleo (promedio) | III | II | ¾ |
*Estadísticamente significativo.
Fuente: Historias clínicas de los pacientes.
Estos hallazgos poseen explicaciones que están causalmente concatenadas. Es recomendable la ejecución de una facoemulsificación en pacientes cataratosos con núcleos de una dureza leve o moderada.10 Este tipo de núcleo habitualmente se correlaciona con una AV mejor, y no es frecuente la asociación del mismo a cataratas seniles con pérdida visual significativa.9,11 Justamente, cuando existen determinadas patologías asociadas a cataratas, como la miopía, la retinosis pigmentaria, uveítis, etc. Las opacidades núcleo-corticales incluso incipientes son capaces de tener importante implicación en el déficit visual dependiente de los medios, y estas cataratas se acompañan muy frecuentemente de núcleos blandos o semiduros, por lo que se justifica la cirugía de la catarata por facoemulsificación en estos casos.12 Si además, tomamos en cuenta que en muchos de estos casos con patología ocular asociada, la catarata aparece en edades más tempranas, así como que con la edad, fisiológicamente, existe un endurecimiento gradual del núcleo, es por esto que en nuestra serie, en el grupo de facoemulsificación los pacientes presentaron una menor edad promedio, mayor frecuencia de patologías oculares asociadas, mejor AV con corrección y núcleos más blandos como promedio. Este hallazgo se relaciona además con el hecho de que, a pesar de que muchos de los pacientes del grupo de facoemulsificación tenían una AV no muy marcadamente disminuida, al ser estos como promedio más jóvenes, se encontraban en pleno ejercicio de sus capacidades físico-intelectuales, y requerían cirugía con más necesidad que los del grupo EECC, a pesar de su agudeza visual.
Como hemos podido observar, en nuestra serie se prefirió la facoemulsificación en el paciente como modelo joven y con núcleo lo menos duro posible. Esto se corresponde con lo referido en la literatura revisada en los inicios de la evolución de esta técnica,11-13 cuando la dureza del núcleo era un parámetro a tener en cuenta, e incluso excluyente, si este era moderadamente duro o duro. En la actualidad, con el desarrollo de la ingeniería y la confección de equipos más eficientes que complacen las exigencias del oftalmólogo más caprichosos, y el desarrollo de nuevas variantes de ejecución de la técnica (ejemplo: pre-chop) es factible la realización de la faco aún cuando la dureza del núcleo sea grado III.7
En relación con las características refractivas preoperatorias, expuestas en la tabla 2, encontramos que hubo una diferencia significativamente marcada en la esfera promedio entre ambos grupos (p = 0,04), con valores positivos en el grupo EECC, y negativos en el grupo de facoemulsificación. Este hallazgo en algún sentido nos sorprendió, pues al comparar con la literatura consultada, se aprecia que habitualmente en las grandes series de pacientes con cataratas predominaba las refracciones con esferas negativas.14-15 En el presente estudio, creemos que esto se deba a que 14 pacientes (28 %) de este grupo no mejoraron AV con cristales, por lo cual no es cuantificable el defecto esférico, y predominó aleatoriamente en el resto del grupo los defectos esféricos positivos. En los demás aspectos, no existieron diferencias intergrupales significativas.
Tabla 2. Características refractivas preoperatorios
| Características preoperatorias | Grupo extracción extracapsular del cristalino | Grupo extracción extracapsular del cristalino | P | |
| Esfera (media ± DS) | + 1,50 (± 1,75) | + 1,50 (± 1,75) | 0,04* | |
| Cilindro (media ± DS) | - 1,25 (± 0,75) | - 1,25 (± 0,75) | 0,2 | |
| Eje (promedio) (°) | 75 | 75 | ¾ | |
| Meridiano fuerte (promedio) | Poder | 43,25 | 43,75 | 0,8 |
| Eje (°) | 85 | 95 | ¾ | |
| Meridiano débil (promedio) | Poder | 42,00 | 42,00 | 0,9 |
| Eje (°) | 175 | 185 | ¾ | |
*Estadísticamente significativo.
Fuente: Historias clínicas de los pacientes.
Al analizar las características preoperatorias en cuanto a los parámetros ennrelación con el endotelio corneal encontramos, como promedio, que los pacientes del grupo de facoemulsificación tuvieron parámetros de salud endotelial mejores que los del grupo EECC, aunque sin diferencias estadísticamente significativas16 (tabla 3).
Creemos que esto se trate fundamentalmente de un bias inducido por la diferencia de edades entre los dos grupos; predominaron pacientes más jóvenes en el grupo de facoemulsificación (tabla 1). Sin embargo, atendiendo a los criterios de inclusión del estudio, los pacientes en estos grupos presentaban valores de microscopia endotelial dentro de límites normales.
Tabla 3. Microscopia endotelial: resultados preoperatorios
| Características | Grupo extracción extracapsular del cristalino | Grupo facoemulsificación | P |
| Hexagonalidad (%) | 61,3 | 66,9 | 0,09 |
| Coeficiente de variabilidad | 0,30 | 0,28 | 0,08 |
| Densidad celular (media ± DS) | 2 387 ± 187 | 2 480 ± 103 | 0,10 |
*Estadísticamente significativo.
Fuente: Historias clínicas de los pacientes.
Analizando los resultados posoperatorios en el corte final (3 meses de evolución); en cuanto a las características refractivas (tabla 4), observamos algo significativo en los dos grupos, y es que en ambos quedaron con una corrección esférica promedio negativa, aun en el grupo de la EECC, que en el preoperatorio obtuvo valor positivo. Por supuesto, en la mayoría de los casos, esto respondió a una planificación en el cálculo del LIO -previo consentimiento de los pacientes.
Esto corresponde con la literatura consultada17 en la que se prefiere dejar a los pacientes ligeramente miopes (esfera -1,00 D), defecto refractivo mediante el cual se logra una visión útil tanto desde cerca como desde lejos, y solamente necesitan utilizar cristales para determinadas labores.18 Nuestra planificación para la corrección óptica de los pacientes operados se cumplió en los dos grupos. En los pacientes del grupo de facoemulsificación específicamente, se prefirió dejar con una ligera tendencia al defecto refractivo previo (± 1,00 D), lo cual crea menos problemas al paciente en su adaptación a la pseudofaquia.5
Tabla 4. Características refractivas posperatorias: corte final (3 meses)
| Características posperatorias | Grupo extracción extracapsular del cristalino | Grupo de facoemulsificación | P | |
| Esfera (media ± DS) | - 0,50 (± 1,75) | - 0,50 (± 1,75) | 0,09 | |
| Cilindro (media ± DS) | - 2,50 (± 1,25) | - 1,00 (± 0,50) | 0,02 (*) | |
| Eje (promedio) | 85 | 95 | ¾ | |
| Meridiano fuerte (promedio) | Poder | 45,00 | 43,75 | 0,04 |
| Eje (°) | 95 | 100 | ¾ | |
| Meridiano débil (promedio) | Poder | 43,00 | 42,50 | 0,06 |
| Eje (°) | 185 | 10 | ¾ | |
*Estadísticamente significativo.
Fuente: Historias clínicas de los pacientes.
Otro parámetro muy importante es el cilindro refractivo, donde observamos que en el grupo EECC el astigmatismo posoperatorio fue de -2,50 dioptrías, significativamente diferente al del grupo de facoemulsificación, que fue de -1,00 dioptría (p= 0,02). También la varianza promedio de los cilindros preoperatorios y posoperatorios en el grupo EECC fue mayor que en el grupo de facoemulsificación (grupo EECC: l, 657; grupo de facoemulsificación: 0,631; p= 0,008). De hecho, en el grupo de facoemulsificación se redujo el astigmatismo promedio preoperatorio. (astigmatismo preoperatorio: -1,50 dioptrías; astigmatismo posoperatorio: -1,00 dioptría).
Al analizar el astigmatismo posoperatorio desde el punto de vista queratométrico (dioptrías queratométricas), se mantuvieron las diferencias significativas entre los valores de los meridianos fuertes entre ambos grupos ( p= 0,04); incluso, en el grupo EECC hubo diferencias preoperatorios y posoperatorias de significación (ANOVA: 1,855; p= 0,03)(no tabulado), así como un cambio en el eje de este de 10 grados promedio, no así en el grupo de facoemulsificación, en el que no hubo diferencias en este sentido preoperatorios ni posoperatorias, lo cual expresa una mayor mantención de la estabilidad morfológica externa del globo ocular en la facoemulsificación.
Sin embargo, como desde el punto de vista práctico muchas correcciones que se realizan mediante queratometría no son toleradas visualmente por el paciente, no las tomamos en cuenta de modo fundamental. Además, no debemos olvidar que nuestros esfuerzos quirúrgicos van en mayor medida encaminados mejorar la visión del paciente.
¿Qué elementos pueden influir en estos resultados? El tamaño de la incisión, la vía de abordaje, y el empleo de suturas, fundamentalmente, son elementos muy importantes en este sentido.
En la EECC, habitualmente se realizaron incisiones entre 8 y 11 mm (según el tamaño del núcleo), por córnea clara, que requirieron cierre de la herida quirúrgica mediante sutura, comúnmente surget con nylon 10-0. Estos factores invariablemente inducen determinado grado de astigmatismo posoperatorio, que dado ciertas circunstancias (sutura más apretada, inflamación posoperatoria más marcada, etc.) puede ser más notorio.
Así, en el grupo EECC, la mayoría de los astigmatismos preoperatorios estaban a favor de la regla, por lo que al practicar una incisión del tamaño previamente descrito, en el sector superior de la córnea, suturando con nylon, habitualmente con un ajuste impermeable y fuerte, no debe sorprender que estos pacientes hayan desarrollado astigmatismos inducidos del orden de -1,25 dioptrías. Esto concuerda con lo referido en la literatura consultada, donde se refiere que estos factores pueden inducir astigmatismos de hasta 2 dioptrías.19
Por otra parte, la facoemulsificación no presenta estas limitaciones, ya que como regla general, en ella realizamos incisiones de pequeño o mediano tamaño (± 6 mm), por vía escleral, a 1,5 o 2 mm del limbo y autosellantes (tunelizadas, no suturadas). Este tipo de incisión influye mucho en el astigmatismo inducido, pues crea cierta relajación a nivel de ese meridiano, lo cual disminuye su curvatura y por ende su poder. Justamente, la menor magnitud del astigmatismo posoperatorio inducido es una de las mayores ventajas de la facemulsificación sobre la EECC.20 En este caso, el grupo de facoemulsificación desarrolló una variación leve (-0,50 D) en su astigmatismo, reduciéndose por el efecto relajante antes citado, su magnitud preoperatoria. Así esta técnica en nuestro estudio, de forma no planificada, actuó con característica de un proceder de cirugía refractiva.
Para concluir con el tema del astigmatismo inducido, consideramos que la queratometría no es el mejor método para medir este defecto, pues en el examen solo se miden los valores centrales (± 3 mm), y únicamente en dos meridianos, por lo que no proporciona la asfericidad total de la córnea. Consideramos que una topografía corneal sería de mayor utilidad para analizar este parámetro -no hacemos referencia a esto en nuestro estudio por no estar entre nuestros objetivos.
Los resultados posoperatorios en cuanto a la microscopia endotelial mostraron importantes variaciones intragrupales e intergrupales (tabla 5). Existió una variación en cuanto a la hexagonalidad de hasta un 12,8 % (promedio) en el grupo EECC, lo cual conllevó a que este parámetro se modificara hasta colocarse fuera de los valores considerados como normales. En el grupo de facoemulsificación, la variación en este parámetro fue solo de un 10,4 %, y permaneció finalmente dentro de valores normales. Al final, existieron diferencias estadísticas significativas entre los dos grupos (p= 0,05)
El coeficiente de variabilidad, presentó variaciones de mayor rango en el grupo EECC, también se excedió de los parámetros normales, resultando en valores posoperatorios mayores y estadísticamente muy diferentes que los del grupo de facoemulsificación (0,39 vs. 0,31; p= 0,03) La densidad celular fue también objeto de importante variación en el grupo EECC, con una pérdida de aproximadamente 32 %, mientras que en el grupo de facoemulsificación esta variación fue solamente de 18 %. En el corte evaluativo final, existieron diferencias de significación estadística entre ambos grupos (p= 0,007) en este parámetro.
Podemos ver que en el posoperatorio todos estos parámetros variaron, esto fue más significativo en el grupo EECC que en el de facoemulsificación. En este sentido, consideramos que influyen elementos resultantes del muestreo en nuestro estudio, así como determinadas características inherentes al proceder quirúrgico. Es de observar que el grupo EECC estuvo integrado como ya vimos por sujetos de mayor edad y por ende más propensos al daño endotelial relativo al trauma quirúrgico. Justamente, por características propias de la EECC, este daño es mucho más severo y de mayor magnitud en este tipo de proceder, dado por factores tales como el tamaño de la incisión, que duplica en ocasiones el tamaño de la realizada durante una facoemulsificación. A su vez, otros factores como son el traumatismo por la manipulación con pinzas de los labios de la herida quirúrgica corneal, las fluctuaciones en la profundidad de la cámara anterior, el plegamiento corneal inducido por la tensión provocada por el ajuste de la sutura, así como el proceso inflamatorio de mayor cuantía en la EECC, tanto en intensidad como en tiempo, influyen negativamente en la salud endotelial de los pacientes sometidos a este proceder. Lo revisado en la literatura al respecto justifica nuestros hallazgos, así como expone esta, otra más de las ventajas de la facoemulsificación.21
Tabla 5. Microscopia endotelial: resultados posoperatorios
| Características | Grupo extracción extracapsular del cristalino | Grupo facoemulsificación | P |
| Hexagonalidad (%) | 48,5 | 56,4 | 0,05* |
| Coeficiente de variabilidad | 0,39 | 0,31 | 0,03* |
| Densidad celular (media ± DS) | 1623 ± 438 | 2033 ± 547 | 0,007* |
*Estadísticamente significativo.
Fuente: Historias clínicas de los pacientes.
La complicación transoperatoria (tabla 6) más frecuente en ambos grupos fue la rotura de la cápsula posterior, más frecuente en el grupo de facoemulsificación que en el EECC (faco: 8 %; EECC: 4 %) En el grupo de facoemulsificación además, la presencia de hipema también se reportó en el orden del 8 % (4 casos) En ambos grupo la frecuencia de complicaciones transoperatorias puede considerarse como baja, no siendo significativa la diferencia en la frecuencia de aparición de complicaciones entre ambos grupos (p= 0,08; no tabulado).
Como tal, las complicaciones transoperatorias están en dependencia en cada grupo por las maniobras y forma de realizar cada una de las técnicas. En el caso del hipema, en el grupo de facoemulsificación como vimos, su frecuencia cuadruplicó el valor del grupo EECC, siendo significativa esta diferencia. Esto se produce por la entrada de sangre a través del túnel proveniente de vasos episclerales. Esto no acarrea mayores dificultades y es resuelto cuando se forma la cámara anterior definitivamente y se comprueba lo estanco de la incisión. La rotura de cápsula posterior en el grupo de facoemulsificación es muy significativo si lo comparamos con los datos reportados por cirujanos avezados,22 los cuales reportan incidencias del orden del 1 por cada 400 - 500 cirugías realizadas.
Es notorio señalar que hubo un caso de hemorragia expulsiva en el grupo EECC. La realización de esta técnica implica la presencia de ese riesgo, sobre todo por el hecho de que existe en ella una más notable fluctuación e inestabilidad de la cámara anterior, y en donde existe una forma de incisión incapaz de yugular precozmente un evento tan agresivo para la anatomía del globo como lo es esta complicación. Por el reservadísimo pronóstico de este cuadro, la naturaleza hermética de la técnica de faco es una garantía en este sentido.
Tabla 6. Complicaciones transoperatorias
| Complicaciones | Grupo extracción extracapsular del cristalino n (%) | Grupo facoemulsificación n (%) |
| Hipema | 1 (2) | 4 (8) |
| Rotura cápsula posoperatoria. | 2 (4) | 4 (8) |
| Hemorragia expulsiva | 1 (2) | 0 |
| Ninguna | 46 (92) | 41 (84) |
| Total | 4 (8) | 8 (16) |
*Estadísticamente significativo.
Fuente: Historias clínicas de los pacientes.
Entre las complicaciones posoperatorias (tabla 7) encontramos que su mayor frecuencia se encuentra en el grupo de la faco (13 pacientes; 26 %). De este grupo 11 casos presentaron queratitis producida por la instrumentación a través del túnel y por la liberación de energía ultrasónica, la cual en exceso favorece y produce este tipo de afección.23 Con respecto a la energía ultrasónica, consideramos que utilizando técnicas de pre-chop y realizando cambios exactos en los parámetros del facoemulsificador durante el proceder, esta se puede disminuir.24 También el uso de la tecnología de punta determina un menor daño del endotelio. Así actualmente existen equipos de faco a cuya punta se le adiciona un protector endotelial que impide que la energía se expanda de forma descontrolada, haciendo que esta sea dirigida solamente hacia el interior donde es inocua.25
El descentramiento del LIO se encontró solamente en el grupo EECC (4 %), en este caso muy propiciado por el frecuente uso de LIO pequeños, sobre todo en ojos miopes (ambos casos) Además es de destacar que en la EECC no se puede hacer una capsulorrexis óptima, al menos cuando se necesitan incisiones relajantes para la extracción del núcleo,26 lo cual no garantiza la estabilidad del LIO dentro del saco capsular.27
En general, la frecuencia de complicaciones entre ambos grupo no difirió de modo significativo (faco: 13 casos; 26 %; EECC: 9 casos; 18 %; p= 0,07).
Tabla 7. Complicaciones posoperatorias
| Complicaciones | Grupo extracción extracapsular del cristalino n (%) | Grupo facoemulsificación n (%) |
| Queratitis | 6 (12) | 11 (22) |
| Hipotalamia | 0 | 1 (2) |
| Descentramiento del LIO | 2 (4) | 0 |
| Uveítis | 0 | 1 (2) |
| Endoftalmitis | 1 (2) | 0 |
| Sin complicaciones | 41 (82) | 37 (74) |
| Total | 9 (18) | 13 (26) |
*Estadísticamente significativo.
Fuente: Historias clínicas de los pacientes.
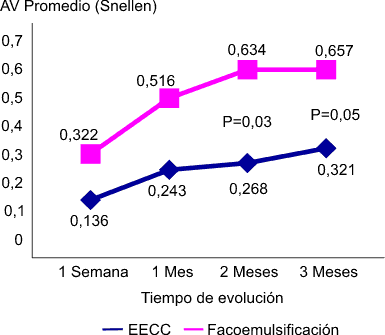
En la fugura 1 se muestra cómo se comportó la AV sin corrección posoperatoria, y es aquí donde encontramos una de las diferencias más notorias cuando comparamos ambos grupos. En el grupo EECC la AV sin corrección promedio a los tres meses (0,321) fue menor que en el grupo de facoemulsificación (0,657), con significación estadística (p= 0,05); hubo una mayor estabilidad en el tiempo en esta a partir del segundo mes en el grupo de facoemulsificación, no así en el grupo EECC. A partir del segundo mes, las diferencias entre ambos grupos en este sentido fue marcadamente significativas.
Fig. 1. Evolución de la agudeza visual pooperatoria sin corrección promedio.
El valor máximo se obtuvo en el grupo EECC en etapas más tardías del seguimiento (aproximadamente 3 meses), justificando una recuperación más lenta desde el punto de vista anátomo-funcional en estos casos. Esto indudablemente se encuentra relacionado con elementos anteriormente discutidos, como son el tamaño y tipo de la incisión, la vía de abordaje, etc. En el grupo de facoemulsificación, el valor máximo de la AV sin corrección se alcanzó más precozmente (aproximadamente 2 meses) y de forma evolutivamente más estable, lo que permite el alta en estos pacientes en un menor tiempo tras la cirugía, dada la recuperación visual más rápida, así como la mejoría en su calidad de vida.
En correspondencia con lo analizado en la tabla 4 y atendiendo a lo revisado en la literatura,28 la menor AV sin corrección, en nuestro estudio en el grupo EECC se debió fundamentalmente a la presencia de un astigmatismo inducido posoperatorio, que es la más causa frecuente de mala AV SC en pacientes operados de cataratas mediante EECC. Así un astigmatismo comprendido entre 0,50 y 1,00 D precisa por lo general de alguna corrección óptica. Un error astigmático comprendido entre 1,00 y 2,00 D puede reducir la AV SC hasta niveles de AV de 0,6 a 0,4 (Snellen), mientras que entre 2,00 y 3,00 se corresponde con AV SC de entre 20/70 y 20/100.29
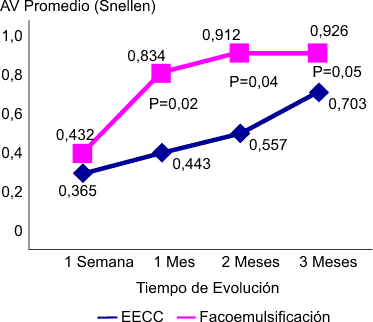
La AV con corrección a los tres meses fue mucho mayor en el grupo de facoemulsificación (0,926) que en el EECC (0,703). En el primer grupo, a los dos meses aproximadamente, la AV CC se hizo casi definitiva, con una variación promedio de la AV CC entre los meses segundo y tercero de seguimiento de solo 0,0121 líneas de Snellen (p= 0,22). En el grupo EECC, sin embargo, la AV CC definitiva tuvo una estabilización mucho más tardía, la mayoría solo a la altura de los tres meses, con una mejoría y estabilización de esta lenta y progresiva, lo cual sugiere una inestabilidad anátomo-funcional que no permite el alta de los pacientes hasta pasado este tiempo, por tanto es más lenta la reintegración del paciente a su medio habitual, lo cual influye negativamente en su calidad de vida (fig. 2).
Fig. 2. Evolución de la agudeza visual pooperatoria con corrección promedio.
No obstante, en la práctica, estos pacientes que se someten a EECC a menudo necesitan algún tipo de reintervención sobre los astigmatismos residuales postoperatorios que presentan.30,31 Así, a los tres meses y no antes, es necesario evaluar su estado refractivo, y retirar la sutura con vistas a reducir el astigmatismo inducido por esta, y una vez realizado este proceder, es obligatorio esperar otro mes adicional para que se estabilice la fórmula refractiva del paciente.32-34 Esto entorpece aún más la reincorporación del paciente a su entorno social habitual, más aún si requiere de una recuperación visual óptima y precoz. Esto hace de la facoemulsificación una opción quirúrgica no solo mejor por lo rápido y segura de la intervención quirúrgica, sino porque permite una incorporación precoz y total del paciente a su medio.35-41
Estos hallazgos son constantes en la literatura, donde se reportan astigmatismos mayores de 2 dioptrías en el 30 % de los sujetos que se someten a EECC, con una menor predictibilidad a corto e incluso largo plazo por la hidrólisis de la sutura, lo cual hace que el astigmatismo continúe cambiando hasta incluso durante años.36-42
Conclusiones
- La agudeza visual corregida o sin corrección fue superior en los ojos intervenidos mediante facoemulsificación, durante todo el período de seguimiento.
- La recuperación visual fue mucho más precoz en los pacientes sometidos a facoemulsificación comparándolos con aquellos a los que se les practicó EECC.
- Se indujo menos astigmatismo en los pacientes del grupo de facoemulsificación, con un menor cilindro refractivo y queratométrico final.
- Los pacientes operados con la técnica de facoemulsificación presentaron menor deterioro del endotelio corneal (microscopia endotelial) que los sometidos a extracción extracapsular del cristalino.
- Aunque el grupo de facoemulsificaciónemulsificación presentó un mayor número de complicaciones transoperatorias y posoperatorias, estas en realidad fueron escasas y sin repercusión visual, no existió diferencias de significación en la frecuencia de estas entre ambos grupos.
Summary
Comparative study of the anatomical and functional results of two cataract surgical management techniques: extracapsular extraction of the crystalline and phacoemulsification
The shift of a simpler surgical technique to a more complex procedure is a real challenge, even more if this technique requires a difficult mechanism of adapting to new clinical and technological criteria and the learning curve is also extensive and difficult. This is the case of the transition of extracapsular extraction of the crystalline to phacoemulsification in the surgical management of the cataract. Our study was intended to compare anatomic and functional results of two cataract surgical management modalities, that is, extracapsular extraction of the crystalline ECEC and phacoemulsification, in addition to assess postoperative visual acuity with/without spectacles and the refractive and /or keratometric cylinder after surgery; also to compare the morphological and morphometric changes after implementing these types of surgery in the cell population of the corneal endothelium, and to list the commonest complications. A prospective, comparative and descriptive study was performed in 100 eyes affected by cataract and operated on by ECEC (50 eyes) and by phacoemulsification (50 eyes) from January 2005 to January 2006, which were included in two study groups according to the approved inclusion criteria and followed up postoperatively for three months at the Center of Eye Microsurgery of “Ramon Pando Ferrer” Cuban Ophthalmologic Institute. The analyzed variables were age, visual acuity with the spectacles, induced astigmatism, endothelial cell count and transoperative complications. Corrected and non-corrected visual acuity was higher in phacoemulsification-treated eyes. Visual recovery occurred much earlier, induced astigmatism was lower and final refractive and keratometric cylinder was also lower in phacoemulsification-operated eyes. The patients who underwent phacoemulsification surgical technique exhibited less corneal endothelium deterioration although the number of transoperative and postoperative complications was higher.
Key words: Phacoemulsification, extracapsular extraction of the crystalline, refractive cylinder, keratometric cylinder, endothelial microscopy.
Referencias bibliográficas
1. Tasman WS. Duane’s Clinical Ophthalmology. 1996. [CD ROM]. USA. Edition. Vol 1, Cap 73
2. Pereira G. Detalles técnicos de la facoemulsificación. Avances en Oftalmología. España. 1997;1(3):22- 7.
3. Fine I. Phacoemulsification. New Technology and Clinical Application. USA: Slack Inc.; 1996.
4. Padilha L: Facoemulsificación, de lo básico a lo avanzado. Brazil: Rio Med Livros; 1996.
5. Koch S. Simplifying phacoemulsificación. 5th. ed. USA: Slack Inc; 1997.
6. Pereira G. Estado actual de la facoemulsificación. Avances en Oftalmología. España. 1998;1(2):19-23.
7. Steinert RF. Cataract surgery. technique, complications and management. USA: WB Saunders Inc;1995.
8. Boyd BF. Atlas de cirugía ocular. Fascículo 5. Facoemulsificación. Panamá; 1995
9. Boyd BF. Cómo hacer la transición de la cirugía extracapsular planificada a la facoemulsificación. Highlights of Ophthalmology. Ed. Panamericano. 1996; 24(3):
10. Chylack LT, Leske MC, McCarthy D. Lens opacities classification system II (LOCS II). Arch Ophthalmol. USA. 1989;107:991.
11. Zaczek A. Cataract surgery in patients with diabetes mellitus. Acta Ophthalmol Scand. USA. 1999;77:726-27.
12. Mahatme V. Woodcutter technique is effective. Ocular Surgery News. USA. 2001;19(17):1-26
13. Birinci H, Oge I, Oge F: Effect of intraocular lens and anterior capsule opening type on posterior capsule opacification. J Cataract Refract Surg USA 1999, 25: 180-87.
14. Chao-Yu H, Lin-Chung W, Meng-Chi W: Intraocular lens calculation for lens exchange. J Cataract Refract Surg USA 2001, 27: 543-49.
15. Tan JHY, Newman DK, Klunker C, and Watts SE. Phacoemulsification cataract surgery: Is routine review necessary on first postoperative day? Eye .USA. 2000; 14:53-5.
16. Walkow T, Anders N, Klebe S. Endothelial cell loss after phacoemulsification: Relation to preoperative and intraoperative parameters. J Cataract Refract Surg. 2000;26:727-32.
17. Chang-Godinich A, Ou Rj, Koch DD. Functional improvement after phacoemulsification cataract surgery. J Cataract Refract Surg. 1999;25:1226-31.
18. Hamptom R: Presbyopia treatment modalities. non-surgical and surgical. Ocular Surgery News ,USA. 2001;19(17):10.
19. Dowler JGF, Hyking PG, Hamilton AMP. Phacoemulsification versus extracapsular extraction in patients with diabetes. Ophthalmology, USA. 2000; 107:457-62.
20. Elliot DB, Patla AE, Furniss M. Improvement in clinical and functional vision and quality of life after second eye cataract surgery. Optom Vis Sci, USA. 2000;77:13-24.
21. Edelhauser HF. The resiliency of the corneal endothelium to refractive and intraocular surgery. Cornea. USA. 2000;19:263-73.
22. Jampel RS. The effect of technology on the indications for cataract surgery. Doc Ophthalmol. USA. 1999;98:95-103.
23. Sparrow JM, Vazquez G, Frost NA. Cataract surgery: Who and How much? Eye USA. 1999;13:107-8.
24. Jackobiec FA, Shiuey Y. Postoperative complications in ophthalmic surgery. Int Ophthalmol Clin .USA. 2000;40:19-20.
25. Mackool RM. New technology improves performance for Alcon Legacy. Ocular surgery News USA. 2001;19(17):1-28.
26. Arne JL. Complications of cataract surgery. J Fr Ophthalmol. 2000;23:62.
27. Mamalis N, Talsma J. IOL-related complications on the rise, survey finds. Ophthalmology Times. 2001;26(15):42.
28. Desai P, Minassian DC, Reidy A. National cataract survey 1997-8. A report of the results of the clinical outcomes. Br J Ophthalmol .England. 1999;83:1336-40.
29. Desai P, Reidy A, Minassian DC. Profile of patients presenting for cataract surgery in the UK: national data collection. Br J Ophthalmol. 1999;83:893-6.
30. Monestam E, Wachtmeister L. Impact of cataract surgery on visual acuity and subjective functional outcomes: a population-based study in Sweden. Eye Sweden. 1999,13:711-9.
31. Kanelloulos AJ, Dodick JM, Brauweiler P, Alzner E. Dodick photolysis for cataract surgery with the Q-switched Nd-YAG laser in 100 consecutive patients. Ophthalmology. 1999,106:2197-202.
32. Monestam E. Impact of cataract surgery. A population-based approach. Acta Ophthalmol Scand. 1999;77:729.
33. Taylor HR. Cataract: How much surgery do we have to do? Br J Ophthalmol. 2000; 84:1-2.
34. Badoza DA, Jure T, Zunino LA. State-of-the-art phacoemulsification performed by residents in Buenos Aires, Argentina. J Cataract Refract Surg ,USA. 1999;25:1651-55.
35. Castells X, Alonso J, Ribo C, and Nara D. Factors associated with second eye cataract surgery. Br J Ophthalmol. 2000;84:9-12.
36. Chaine G. Cataract surgery and hospital practice. J Fr Ophthalmol. 1999;22:709-10.
37. Johnson GJ. Improving outcome of cataract surgery in developing countries. Lancet. 2000; 355:158-59.
38. Johns K, Feder RS, Rosenfeld SI (Ed.). Basic and Clinical Science Course 1999-2000. Section 11. Lens and Cataract. American Academy of Ophthalmology. 1999, pp: 140-157.
39. Jonhson SH. Phacoemulsifications. Focal Points: Clinical Modules for Ophthalmologists. Module 6, pp: 12-18. American Academy of Ophthalmology, USA 1994.
40. American Academy of Ophthalmology. Quality of care committee: Anterior segment panel: Cataract in the Adult Eye. American Academy of Ophthalmology Preferred Practice Patterns; 1996. p.22-31
41. Lichtenstein S, Tipperman R. Cataract. LEO Clinical Topic Updates. American Academy of Ophthalmology, USA; 1996.
42. Charlton JF. Cataract surgery and lens implantation. Current Opin Ophthalmology. 2001;12(1):7-47.
Recibido: 25 de marzo de 2007. Aprobado: 15 de abril de 2007.
Dr. Gilberto Fernández Vásquez. Instituto Cubano de Oftalmología “Ramón Pando Ferrer”. Ave. 76 No. 3104 entre 31 y 41 Marianao, Ciudad de La Habana, Cuba.
1Especialista de I Grado en Oftalmología. Profesor Instructor.
2Especialista de II Grado en Oftalmología. Profesor Asistente.
3Especialista de II Grado en Oftalmología. Profesor Titular.
4Especialista de I Grado en Oftalmología.
5Especialista de I Grado en Oftalmología. Profesor Asistente.