Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Salud Pública
versión impresa ISSN 0864-3466
Rev Cubana Salud Pública vol.42 no.1 Ciudad de La Habana ene.-mar. 2016
REVISIÓN
Declaración de Helsinki: cambios y exégesis
Helsinki Declaration: changes and interpretation
DrC. Irene Barrios Osuna, DrC. Vivianne Anido Escobar, Dr. Maricela Morera Pérez
Centro Nacional de Cirugía de Mínimo Acceso. La Habana, Cuba.
RESUMEN
La Declaración de Helsinki es muy citada de en el ámbito de las ciencias médicas y de la salud. En Cuba se utiliza para valorar los aspectos éticos de las investigaciones, sin embargo, es escasa la literatura dedicada a la valoración crítica de la misma. Referir sus versiones presupone conocer su devenir histórico para interpretar sus aciertos y limitaciones. La intención del estudio es contribuir a actualizar los conocimientos de los profesionales de la salud sobre la Declaración de Helsinki. Se realizó revisión de la literatura publicada entre 2008 y 2014 (agosto) en las bases de datos bibliográficos Cumed, Lilacs, SciELO PubMed, MedLine, Clinical Key, Cochrane y el motor de búsqueda Google utilizando vocabulario controlado con los siguientes descriptores: Declaración de Helsinki, placebo, ensayo clínico, ética y bioética. Los temas más polémicos fueron: uso del placebo, doble estándar en las investigaciones clínicas y garantía de continuidad de tratamiento a los pacientes participantes. Se destacaron méritos en la versión de 2013 tales como la insistencia para aumentar la transparencia en la investigación, su nuevo diseño estructural y la consideración de la competencia ética como un requisito para los investigadores. Los comentarios sobre la Declaración de Helsinki oscilan desde el elogio hasta la sugerencia de su desaparición o sustitución. La polémica sobre la misma es considerada necesaria por algunos autores pero también estéril por otros. Los problemas más álgidos tratados en las últimas versiones emanan del enfrentamiento entre los intereses de la industria farmacéutica y los derechos de los participantes en las investigaciones.
Palabras clave: Declaración de Helsinki, placebo, ensayo clínico, ética y bioética.ABSTRACT
In the fields of medical and health sciences, the Helsinki Declaration is quoted very often. The Helsinki Declaration is used to evaluate the ethical aspects of research studies; however, literature devoted to critical assessment of those studies is scanty. Making reference to the declaration versions presupposes the knowledge about its historical development in order to construe its good things and limitations. The intention of this study is to help to update the health professionals' knowledge about the Helsinki Declaration. A literature review published between 2008 and August 2014 was made and collected on the following databases: Cumed, Lilacs, SciELO PubMed, MedLine, Clinical Key, Cochrane and Google, using controlled vocabulary with the f subject headings Helsinki Declaration, placebo, clinical trial, ethics and bioethics. The most controversial topics were the use of placebo, application of the double standard possition in clinical research, and guaranteed continuous treatment for the participating patients. The following 2013 version's merits were highlighted: insistence on the research transparency its new structural design, and the concern for ethical competence as a requirement for researchers. Comments about the Helsinki Declaration range from praise to disappearance or replacement suggestions. Some authors deem the controversy necessary but others think it is a wasteful argument. The hottest problems in the most recent versions come from the confrontation between the pharmaceutical industry interests and the rights of participants in research studies.
Keywords: Helsinki Declaration, placebo, clinical trial, ethics and bioethics.
INTRODUCCIÓN
Toda actividad humana posee una dimensión ética, en el caso de la actividad científica investigativa esta cualidad se acentúa por el grado de afectación potencial que puede implicar para la vida humana, otros seres vivos o la naturaleza inanimada.
Desde los sucesos que provocaron la aparición del Código de Nüremberg en 1947 el interés de la comunidad médica por los aspectos éticos de su proceder ha ido en ascenso. Múltiples declaraciones, códigos, normas y resoluciones se han creado durante los siglos xx y XXI para guiar, orientar o regular los aspectos éticos de la investigación con seres humanos. En el ámbito de las ciencias médicas y de la salud ocupa un lugar destacado la Declaración de Helsinki (DdH), proclamada por la Asociación Médica Mundial (AMM), su citación es muy generalizada en las investigaciones biomédicas y en algunos países tiene valor legal.1
En Cuba es utilizada como documento de referencia para valorar los aspectos éticos de investigaciones. Una revisión realizada en el Repositorio de Tesis Doctorales en Ciencias Biomédicas, de la Salud y de otras ramas afines relacionadas con el Sistema Nacional de Salud de Cuba (Biblioteca Virtual en Salud de Cuba) evidenció que de las 28 tesis doctorales publicadas en el 2014 (referidas hasta el mes de agosto del 2014),13 utilizan la DdH como referente (46 %). También documentos oficiales del Centro Nacional Coordinador de Ensayos Clínicos (CENCEC) y revistas nacionales (Revista Habanera de Ciencias Médicas y Revista Cubana de Enfermería) recomiendan el uso de los principios de la DdH para el examen del cumplimiento de los requisitos éticos de sus investigaciones y artículos. Sin embargo, es escasa la literatura cubana que se dedica a la valoración crítica de esta Declaración.2-4
Desde su aparición en 1964 esta Declaración ha estado sujeta a precisiones y variaciones que ya abarcan cinco décadas, lo cual responde, entre otros aspectos, a los continuos cambios en los dilemas que surgen con la intensificación de las relaciones entre ciencia y tecnología médica, su impacto en la solución de problemas de salud y los peligros que pueden implicar para los seres humanos que participan en los experimentos clínicos. Referir la DdH es aludir a una de sus versiones, lo cual presupone un conocimiento del devenir histórico de su contenido para poder interpretar sus aciertos y limitaciones. Siguiendo esta lógica es objetivo de este trabajo contribuir a actualizar los conocimientos de los profesionales de la salud sobre la DdH.
La estrategia de búsqueda se realizó con vocabulario controlado que incluyó los siguientes descriptores: Declaración de Helsinki, placebo, ensayo clínico, ética y bioética. Se revisó el Repositorio de Tesis Doctorales en Ciencias Biomédicas, de la Salud y de otras ramas afines relacionadas con el Sistema Nacional de Salud de Cuba dadas a conocer durante el año 2014 (hasta el mes de agosto) y la literatura del tema publicada entre el 2008 hasta agosto de 2014. La indagación de esta literatura se efectuó en las bases de datos bibliográficos Cumed, Lilacs, SciELO PubMed, MedLine, Clinical Key, Cochrane y el motor de búsqueda Google por ser esta selección del ámbito nacional e internacional la de mayor alcance en las ciencias biomédicas.
RESULTADOS
EL USO DEL PLACEBO, EL DOBLE ESTÁNDAR EN LAS INVESTIGACIONES Y LA CONTINUIDAD DE TRATAMIENTO
Estos temas son los más controvertidos en los análisis de las versiones de 2008 y 2013 de la DdH.
Una síntesis de la historia de esta problemática refiere los tres últimos años del siglo XXI y los tres primeros años del siglo xXI (1997-2002) como la franja temporal donde se manifestó el asedio a la DdH para flexibilizar sus principios en cuanto al uso del placebo.5
La epidemia de VIH/sida que comenzó a principios de los años ochenta llevó a diversos grupos en Estados Unidos de América a solicitar a la Food and Drug Administration (FDA) la autorización de procedimientos más rápidos y menos restrictivos para la creación de fármacos de posible beneficio cuando la afección tenía alta mortalidad. La FDA, al defender los intereses de la industria farmacéutica, se enfrentó a los valores éticos universales proclamados por la DdH, renunciando en el 2004 a tomar a la misma como documento de referencia para adscribirse a las Guías de Buena Práctica Clínica, originadas en la industria farmacéutica (Guidelines for Good Clinical Practice, GCP) de la Conferencia Internacional de Armonización, que nucleaba a los principales países productores de medicamentos. De esta forma culminó el enfrentamiento al universalismo ético iniciado con la postulación del doble estándar para las investigaciones: un tipo de terapia para países desarrollados y otro para países en desarrollo; diferentes cuidados a los participantes en la investigación en dependencia de su nivel socioeconómico y el país al que pertenezcan.5-7
Kottow considera que la DdH "fue seguida con gran atención y en general criticada por robustecer posiciones éticamente condenables que terminaron por delinear y ratificar la ética del doble estándar: uno aspiracional o de máximos aplicado en los países de mayor desarrollo económico, y uno pragmático o de contexto que relativiza el rigor ético para países pobres, corruptibles, menos educados, de población vulnerable en el sentido de ser incapaz de defender sus propios intereses".8
La crítica a esta versión se patentizó con la Declaración de Córdoba de noviembre de 2008. Este documento rechazó el doble standard de las investigaciones clínicas, la flexibilización ética del uso del placebo y la inexistencia de compromiso de los patrocinadores de las investigaciones para con los sujetos del estudio cuando este concluye.9
En la reunión de Roatán (Honduras) la Confederación Médica Latinoamericana y del Caribe (CONFEMEL) expresó su rechazo a las modificaciones propuestas en los artículos 29.º y 30.º de la DdH de 2008 alegando que afectarían la salud de las personas y de los pueblos y manifestó su alarma ante la posibilidad de que puedan existir investigaciones médicas que discriminen personas, exponiéndolas a riesgos deletéreos.10
La persistencia del uso del placebo y el doble estándar en las investigaciones clínicas evidencian interpretaciones opuestas sobre el tratamiento de esta temática en la DdH. Millum, Wendler y Emanuel al analizar los problemas con los placebos exponen que: “La revisión de la Declaración no habla de probar intervenciones que podrían ser beneficiosas para algunos grupos pero que se espera que sean menos efectivas que las intervenciones que están disponibles en otras partes –las intervenciones mejor probadas”.
Según estos autores aunque la DdH afirma que los placebos solo pueden utilizarse cuando los pacientes que los reciben no “serán expuestos a riesgos adicionales serios o a daños irreversibles como consecuencia de no recibir la mejor intervención probada” (párrafo 33), para ellos no está claro cómo hay que interpretar esta cláusula, pues existe el peligro de que se impida la investigación vital que pudiera mejorar las condiciones de los más desfavorecidos.11
No obstante, los pronunciamientos de Garrafa al analizar la propia versión 2013 son: "defender la exclusión –de una vez por todas– del placebo y del double standard en las investigaciones clínicas y enseñar a los países ricos, empresas e investigadores, aunque se nieguen a comprender, el significado real de vulnerabilidad para quienes vivimos en el hemisferio sur del mundo donde, más que en otros lugares, siguen existiendo inaceptables índices de exclusión económica y social".12
En la Declaración de 2008 se perdió la protección hacia los pacientes que ingresan a la investigación al no garantizar la continuidad de los tratamientos. Esta situación afectó a los países de África y Asia, así como a Brasil y todos los países latinoamericanos que al participar en programas de investigación luego no tienen posibilidades de continuar los tratamientos o contar con los mejores métodos.13-15
Sobre la Declaración de 2013 Paul Ndebele considera que: "La nueva versión de la Declaración de Helsinki es más relevante para los países de recursos limitados porque establece requisitos claros para resolver temas importantes en esos entornos, tales como el acceso a las intervenciones tras la conclusión de los ensayos clínicos y el cuidado a los participantes de lugares de bajos recursos".16 3
Otros afirman que esto solo sería posible en algunos casos concretos como en ensayos clínicos de fase 3 en que se determine que la intervención experimental es la más efectiva: "Cuando la investigación no confirme que la intervención es efectiva –estudios fase 1 y 2 y estudios de fase 3 con resultados negativos– los participantes de países pobres con acceso limitado a servicios médicos tendrán pocas probabilidades de beneficiarse de todos estos requisitos".11
Varias reflexiones sobre el rol de la DdH 2013 se produjeron en la Organización Médica Colegial de España. En un video-debate, promovido por su diario online, "Médicos y Pacientes" el Dr. Baos recordó que países como India y China (emergentes en ensayos clínicos por su bajo coste) pueden tener garantías diferentes a Occidente en la seguridad de los pacientes que intervienen en dichos ensayos:
Lo que no puede ser -añadió- es que la seguridad de un paciente de la India o China sea inferior a la de otro en EE. UU. o de Europa. Tenemos ejemplos recientes, sin ir más lejos de la India, donde al transformar las leyes relativas a las indemnizaciones a las que tiene derecho un paciente si sufre algún daño en algún ensayo clínico, compañías americanas o europeas han optado por bloquear el ensayo clínico correspondiente, al dispararse el coste de sus investigaciones a partir de estas condiciones. Considera de gran valor la existencia de una Declaración Mundial, como la de Helsinki, que comprometa a todos los actores, tanto a los que operan en los países subdesarrollados como también en los desarrollados, dado que estos últimos son los que fomentan la investigación en los países menos desarrollados.17
Un aspecto no contemplado en las Declaraciones en estudio ha sido la posibilidad de aceptar el uso de un medicamento que no ha terminado sus fases de investigación, lo cual ha surgido con la actual epidemia del ébola. Las problemáticas que se derivan de esta situación necesitaron una reunión de especialistas en ética médica convocados por la Organización Mundial de Salud (OMS) a principios de agosto de 2014 para determinar sobre estas cuestiones.18
Los expertos consideraron justificado el uso de fármacos experimentales en la lucha contra la enfermedad. En ausencia de un tratamiento aprobado contra el virus, aun cuando la eficacia y los efectos secundarios del tratamiento experimental no son totalmente conocidos, acordaron por consenso que en las circunstancias particulares de este brote es ético ofrecer intervenciones no probadas como terapia potencial o para la prevenir la enfermedad. En cualquier caso, se indicó la necesidad de tener en cuenta los factores éticos, como la transparencia en todos los aspectos del tratamiento de los afectados, el consentimiento informado, la confidencialidad médica y el respeto a la dignidad de los pacientes.19
Sobre el alcance de las afectaciones que pueden tener los participantes de una investigación para lograr una atención de la salud apropiada, Mastroleo precisa que ello es un problema global y no solo un problema en países de ingresos bajos y medios. Al destacar que una parte significativa de la población de los países más desarrollados también está perjudicada por este problema, pone como ejemplo que en Estados Unidos afecta principalmente a las personas sin seguro o con seguros de salud insuficientes que participan en una investigación y en Reino Unido, a los participantes en estudios con drogas no disponibles en el National Health System (NHS). Al revisar las obligaciones pos investigación, en la DdH 2013, el citado autor considera que habría estado justificado incluir a los “gobiernos de los países financiadores” como agentes responsables de las obligaciones pos investigación ya que identificar a los gobiernos de los países financiadores como agentes primarios responsables de las investigaciones permite superar la objeción de que ciertas agencias no tienen permitido financiar acceso a la atención de la salud para los participantes, ya que esta prohibición no se aplica al gobierno o estado en su conjunto (p. e. los EE. UU.).20
Sin embargo una adición importante en la DdH 2013 está en el párrafo 15, donde se establece que debe ser asegurada una adecuada compensación para los sujetos que resulten con daños como resultado de participar en una investigación. Aunque es un aspecto que resulta bienvenido, algunos expertos aseguran que el desafío puede ser asegurar que el daño es una consecuencia directa de la investigación y lograr la adopción de una política de compensación por parte de los gobiernos.21
TRANSPARENCIA EN LA INVESTIGACIÓN CLÍNICA
Uno de los temas que se refuerzan en la Declaración del 2013 está dado en el sentido de obligatoriedad, ya no de “deber”, cuando plantea que los investigadores tienen que considerar los aspectos éticos, legales, normas regulatorias y reglamentaciones para la investigación que incluye sujetos humanos en sus propios países, tanto como las normas y regulaciones internacionales.22
Bachelet y Rada al señalar la vinculación de la DdH 2013 con los esfuerzos mundiales para aumentar la transparencia en la investigación clínica destacan de los párrafos 35 y 36 los siguientes aspectos:
Párrafo 35:
- los ensayos clínicos deben estar registrados en una base de datos públicamente accesible, antes del reclutamiento del primer participante,
- no es aceptable que el registro sea retrospectivo.
El propósito de esta disposición es que la investigación se realice en concordancia con el método científico: corroboración o refutación de hipótesis.
Párrafo 36:
- los investigadores tienen el deber de dar a conocer los resultados de todas las investigaciones realizadas en seres humanos, independiente del resultado,
- la comunicación debe ser completa y transparente, y debe incluir las fuentes de financiamiento y los conflictos de intereses,
- las revistas no deben aceptar manuscritos que no se encuentren en conformidad con estas recomendaciones.
El propósito de esta disposición es que el reporte científico sea completo y transparente, lo que permite que otros grupos repliquen la investigación para corroborar o refutar los resultados previamente comunicados.23
Aunque los autores desarrollan estos análisis en el epígrafe "¿Qué es lo nuevo en la Declaración de Helsinki?" de su artículo, ya en la versión del 2008 de la Declaración, aparecían muchas de estas precisiones (principios 19 y 30). En su trabajo Bachelet y Rada destacan las situaciones adversas que existen en torno a las investigaciones clínicas (distorsión entre lo publicado y lo realizado, entre lo planificado y lo realizado) a partir de lo cual enfatizan el carácter positivo de la Declaración para enfrentar estos hechos.
EDUCACIÓN, FORMACIÓN Y CALIFICACIÓN ÉTICA
La indisoluble unión de la ciencia y la ética es reconocida por las autoras Ceschi y Marré quienes distinguen en la DdH de 2008 la consideración de que la aceptabilidad ética de las investigaciones clínicas requiere de profesionales altamente calificados, pues el investigador comenzará a ser moral cuando haya alcanzado una máxima capacidad técnica (párrafo 16).24
Sin embargo, la última DdH (2013) expresa explícitamente que los investigadores deben poseer no solo la educación, formación y calificación científica apropiada sino también la educación, formación y calificación ética correspondiente para poder conducir las investigaciones médicas en sujetos humanos.5,25
En el ámbito de las variadas propuestas epistemológicas que asumen los científicos que ejecutan los proyectos o los miembros de los Comités de Ética de la Investigación, Ferrer Salvans le adjudica a la DdH la cualidad de representar un equilibrio entre la bioética principalista derivada del Informe Belmont y la utilitarista impulsada por motores económicos que pueden bloquear los mecanismos de defensa de la sociedad, debido a su proyección mundial y estar referenciada en muchos libros de bioética.26
La competencia exigida ahora por la DdH 2013 para los investigadores se caracteriza por la diversidad y en ocasiones enfrentamiento de posiciones al analizar el comportamiento ético, lo cual no debe ser óbice para desarrollar la necesaria educación, formación y calificación ética de los mismos, aunque seguirá siendo fuente de debate los criterios para evaluar su calificación de "apropiada" tal como lo exige su Principio General 12: "La investigación médica en seres humanos debe ser llevada a cabo solo por personas con la educación, formación y calificaciones científicas y éticas apropiadas".25
ESTRUCTURA DE LA DECLARACIÓN
Los cambios apreciados en el diseño estructural de la DdH, al comparar la versión de 2008 con la de 2013, han provocado que algunos autores consideren esta última como más coherente, organizada y precisa (tabla 1).11,16,26,27
P. Ndebele opina que:
Tras cincuenta años y siete revisiones, la versión de la DdH de 2013 incluye varios cambios importantes. Al cambiar el formato e incluir varias subsecciones, la nueva revisión aumenta y mejora la claridad de algunos temas específicos. Al tratar asuntos concretos bajo estas subsecciones, la Declaración aborda temas específicos de forma más audaz. Los lectores apreciarán el nuevo formato porque las subsecciones mejoran la lectura del documento. Al hacerlo, la DdH gana en importancia y autoridad para cumplir con su objetivo servir de guía para la investigación que involucra a seres humanos.16
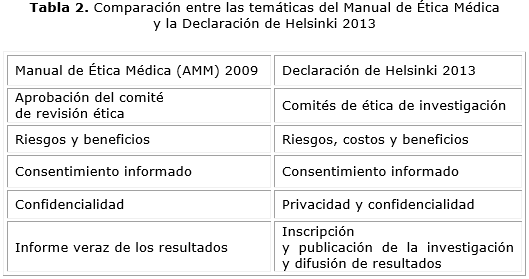
Un intento anterior de abordar temáticas específicas a partir de la DdH aparece en el Manual de Ética Médica de la AMM,28 donde se presenta una breve descripción de los principios tomados principalmente de esta Declaración. De ellos son coincidentes con las subsecciones de la versión del 2013 los siguientes:
La DdH 2013 incluye otra serie de subsecciones: Grupos y personas vulnerables, Requisitos científicos y protocolos de investigación, Uso del placebo, Estipulaciones post-ensayo e Intervenciones no probadas en la práctica clínica. Este conjunto de aspectos sintetiza los problemas éticos que afronta en la actualidad la investigación médica favoreciendo el análisis de estas problemáticas para los investigadores y miembros de los comités de ética de la investigación (tabla 2).
Por todo lo expuesto se puede concluir que los comentarios sobre las más recientes versiones de la DdH oscilan desde el elogio hasta la sugerencia de su desaparición o sustitución. La polémica sobre la misma es considerada necesaria por algunos autores pero también estéril por otros e incluso bioeticistas latinoamericanos abogan por construir una guía propia para la investigación clínica que responda a las realidades sociales de Latinoamérica. Los problemas más álgidos tratados en las últimas versiones de la Declaración de Helsinki emanan del enfrentamiento entre los intereses de la industria farmacéutica y los derechos de los participantes en las investigaciones.
REFERENCIAS BIBLIOGRÁFICAS
1. OMC. Debate sobre Declaración de Helsinki. Última modificación de la Declaración de Helsinki, ¿qué beneficios aporta? Rev OMC. 2009 [citado 16 Jun 2014];(9):29-34. Disponible en: http://www.cgcom.es/files/cgcom/files/RevistaOMC.9.pdf
2. Nuevas instrucciones a los autores. Normas para autores/as. Rev haban cienc méd. 2014 [citado 1 Sep 2014];13(4). Disponible en: http://www.revhabanera.sld.cu/index.php/rhab/about/submissions#authorGuidelines
3. Nuevas instrucciones a los autores. Directrices para autores/as. Rev Cubana Enfermer. 2013 [citado 1 sep 2014];29(4). Disponible en: http://www.revenfermeria.sld.cu/index.php/enf/about/submissions#authorGuidelines
4. CENCEC. Guía para la elaboración del informe final de ensayo clínico. [citado 6 Jul 2014]. Disponible en: http://files.sld.cu/coloproctologia/files/2010/08/guia-para-la-elaboracion-del-informe-final-de-ensayo-clinico-cencec.pdf
5. Tealdi JC. Universalismo y cambios en la Declaración de Helsinki. Bol Fármacos. 2014 [citado 6 Jul 2014]. Disponible en: http://www.saludyfarmacos.org/lang/es/boletin-farmacos/boletines/feb2014/p2014065/
6. Tealdi JC. Universalismo y cambios en la Declaración de Helsinki. Boletín Fármacos. 2014 [citado 6 Jul 2014]. Disponible en: http://www.saludyfarmacos.org/lang/es/boletin-farmacos/boletines/feb2014/p2014065/
7. Tealdi JC. Historia y significado de las normas éticas internacionales sobre investigaciones biomédicas. Bogotá: UNESCO. Red Latinoamericana y del Caribe. Universidad Nacional de Colombia, Instituto de Genética; 2006 [citado 6 Jul 2014]. Disponible en: http://unesdoc.unesco.org/images/0015/001512/151255s.pdf Diccionario latinoamericano de bioética. Bogotá: UNESCO; 2008. p. 369-71.
8. Kottow M. De Helsinki a Fortaleza: una Declaración desangrada. Rev Bioét. 2014 [citado 1 Sep 2014];22(1). Disponible en: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1983-80422014000100004&nrm=iso
9. Garrafa V. REDBIOÉTICA. Una iniciativa de UNESCO para América Latina y el Caribe. Rev Redbioética/UNESCO. 2010 [citado 6 Jul 2014];1(1). Disponible en: http://unesdoc.unesco.org/images/0019/001930/193027m.pdf
10. CONFEMEL. Resolución de CONFEMEL: “Ante los cambios propuestos a la Declaración de Helsinki”. Bol Fármacos. 2008 [citado 20 Agos 2014]. Disponible en: http://www.saludyfarmacos.org/boletin-farmacos/boletines/nov2008/p19825#R
11. Millum J, Wendlel D, Emanuel EJ. The 50th Anniversary of the Declaration of Helsinki Progress but Many Remaining Challenges. JAMA. 2013 [cited 2014 Aug 20];310(20):2143-4. Available from: http://www.jama.jamanetwork.com/article.aspx?articleid=17603209
12. Garrafa V. Declaración de Helsinki y sus repetidos “ajustes” - un tema fatigoso… Bol Fármacos. 2014 feb [citado 20 Agos 2014]. Disponible en: http://www.saludyfarmacos.org/lang/es/boletin-farmacos/boletines/feb2014/p2014065/
13. WMA. Declaración de Helsinki de la Asociación Médica Mundial. Principios éticos para las investigaciones médicas en seres humanos. 59ª Asamblea General; 2008 octubre; Seúl, Corea. [citado 20 Agos 2014]:5. Disponible en: http://www.wma.net/es/30publications/10policies/b3/17c_es.pdf
14. Mazzanti Di Ruggiero MA. Declaración de Helsinki, principios y valores bioéticos en juego en la investigación médica con seres humanos. Rev Col Bioét. 2011 Ene-Jun [citado 20 Agos 2014];6(1). Disponible en: http://www.redalyc.org/articulo.oa?id=189219032009
15. Garrafa Volnei LC. Helsinque 2008: redução de proteção e maximização de interesses privados Rev Assoc Med Bras. 2009 [citado 20 Ago 2014];55(5). Dispónivel em: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0104-42302009000500010&lng=en http://dx.doi.org/10.1590/S0104-42302009000500010
16. Ndebele P. The Declaration of Helsinki, 50 Years Later. JAMA. 2013 [cited 2014 Ago 20];310(20). Available from: http://www.jama.jamanetwork.com/article.aspx?articleID=1760319
17. OMC. Video-Debate Revisión Declaración de Helsinki. En investigación con seres humanos, las garantías han de ser iguales para todos. Médicos y Pacientes. 2013 [citado 4 Agos 2014](1718). Disponible en: http://www.medicosypacientes.com/articulos/helsinki211113.html
18. ONU; Centro de noticias. Expertos en ética médica evalúan un tratamiento experimental contra el Ébola [Internet]. Servicio de Noticias de las Naciones Unidas. 11 de Ago de 2014. [citado 3 Sep 2014]. Disponible en: http://www.un.org/spanish/News/story.asp?NewsID=30188#.U_dLEaP9Jkg
19. Organización Mundial de la Salud (OMS). Consideraciones éticas sobre el uso de intervenciones no registradas en la enfermedad por el virus del Ebola (EVE). Resumen de la mesa redonda. Declaración de la OMS. Ginebra: OMS; 12 agosto 2014 [citado 3 Sep 2014]. Disponible en: http://www.who.int/mediacentre/news/statements/2014/ebola-ethical-review-summary/es/
20. Mastroleo I. Consideraciones sobre las obligaciones pos investigación en la Declaración de Helsinki 2013. Rev Bioética Derecho. 2014 [citado 28 Agos 2014];(31):51-65. Disponible en: http://revistes.ub.edu/index.php/RBD/article/view/10438
21. Morris K. Revising the Declaration of Helsinki. The Lancet. 2013 [cited 2014 Aug 28];381(9881): Available from: http://www.download.thelancet.com/pdfs/journals/lancet/PIIS0140673613609514.pdf
22. Kompanje EJO. Strong words, but still a step back for researchers in emergency and critical care research? The proposed revision of the Declaration of Helsinki. Intensive Care Med. 2013 [cited 2014 Aug 28];39:1469-70. Available from: http://download.springer.com/static/pdf/74/art%253A10.1007%252Fs00134-013-2988-7.pdf?auth66=1409928327_5d0cd9ce063901a13854aa415bf16687&ext=.pdf
23. Bachelet VC, Rada G. Por qué la Declaración de Helsinki ahora recomienda registrar los ensayos clínicos, y publicar y difundir los resultados de la investigación. Medwave. 2013 [citado 28 Agos 2014];13(10):e5846-e5846. Disponible en: http://www.mednet.cl/link.cgi/Medwave/Perspectivas/Editorial/5846.
24. Ceschi RI, Marré AG. Monitoreo de Consentimientos Informados en investigaciones clínicas con seres humanos en el Hospital Privado de Comunidad de la ciudad de Mar del Plata, Argentina. Revista Redbioética/UNESCO. 2012 [citado 28 Jul 2014];2(6):23-34. Disponible en: http://www.unesco.org.uy/shs/red-bioetica/fileadmin/shs/redbioetica/Revista_6/RevistaBioetica6b-23a34.pdf
25. Asociación Mëdica MNdial (AMM). Declaración de Helsinki de la AMM - Principios éticos para las investigaciones médicas en seres humanos. 64ª Asamblea General; 2013 octubre. Fortaleza, Brasil: AMM; 2013 [citado 20 Agos 2014]:8. Disponible en: http://www.wma.net/es/30publications/10policies/b3/
26. Ferrer Salvans P. Comentarios a la última Declaración de Helsinki, emitida en octubre de 2013. 2013 [citado 20 Agos 2014]:9. Disponible en: http://www.ancei.es/noticias/2014/2014-02-01%20Comentarios%20a%20la%20%FAltima%20Declaraci%F3n%20de%20Helsinki/Comentarios%20a%20la%20%FAltima%20Declaraci%F3n%20de%20Helsinki%20%20P%20Ferrer.pdf
27. Gamboa-Bernal GA. La investigación biomédica tiene otra versión de la Declaración de Helsinki. Persona y Bioética. 2013 [citado 20 Agos 2014];17(2). Disponible en: http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S0123-31222013000200001&lng=en
28. Williams J. Manual de Ética Médica. La Ética y la Investigación Médica. 2009 [citado 20 Agos 2014]. Disponible en: www.wma.net/es/30publications/30ethicsmanual/.../ethics_manual_es.pdf
Recibido: 30 de septiembre de 2015.
Aprobado: 30 de octubre de 2015.
Irene Barrios Osuna. Centro Nacional de Cirugía de Mínimo Acceso. La Habana, Cuba.
Dirección electrónica: irene.barrios@infomed.sld.cu