Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Archivo Médico de Camagüey
versión On-line ISSN 1025-0255
AMC vol.16 no.4 Camagüey jul.-ago. 2012
ARTÍCULO ORIGINAL
Plasmaféresis por método de filtración de membrana para el Síndrome de Guillain-Barre
Plasmapheresis by membrane filtration method for Guillain-Barré syndrome
Dr. Leonardo Curbelo Rodríguez; Dr. Rafael Pila Pérez
Hospital Universitario Manuel Ascunce Domenech. Camaguey, Cuba.
RESUMEN
Fundamento: la plasmaféresis por método de filtración de membrana es un tratamiento eficaz para pacientes con síndrome de Guillain-Barre grave.
Objetivo: demostrar las ventajas de la plasmaféresis por filtración de membrana en el tratamiento de las formas graves del síndrome de Guillain-Barre.
Método: se realizó un estudio prospectivo descriptivo en la unidad de terapia intensiva del Hospital Universitario Manuel Ascunce Domenech de Camagüey, desde enero de 2007 a enero de 2011. La muestra fue de 23 pacientes con diagnóstico de síndrome de Guillain-Barre con parálisis respiratoria. Se utilizó para la plasmaféresis una máquina de hemodiálisis convencional Fresenius 4008-D, filtros de plasma y líneas sanguíneas para hemodiálisis. Los volúmenes de plasma extraídos fueron de 3000 ml, se utilizaron como soluciones de reemplazo albúmina humana y plasma fresco, la información fue recogida en planillas a partir de las historias clínicas, se procesaron las frecuencias relativas y porcentajes de las variables.
Resultados: la recuperación de la fuerza muscular fue significativa y la rápida salida de la ventilación de los pacientes después de las primeras cinco sesiones. Se presentaron pocas complicaciones. El tratamiento fue efectivo para el 95,6 % de los pacientes.
Conclusiones: el tratamiento fue efectivo, la mejoría se obtuvo después de los cinco recambios, el tiempo necesario para obtener el volumen plasmático deseado fue de una hora y media a dos horas y media, más rápido que por el método de centrifugación, redujo el tiempo de recuperación de la fuerza muscular y de la ventilación mecánica, resultó ser, además, una técnica segura y rápida para el paciente que padece de esta enfermedad.
DeCS: SÍNDROME DE GUILLAIN-BARRE/diagnóstico; FILTRACIÓN POR MEMBRANAS; CENTRIFUGACIÓN; PLASMAFÉRESIS; EPIDEMIOLOGÍA DESCRIPTIVA.
ABSTRACT
Background: plasmapheresis by membrane filtration method is an effective treatment for patients with serious Guillain-Barré syndrome.
Objective: to demonstrate the advantages of plasmapheresis by membrane filtration in the treatment of severe Guillain-Barré syndrome.
Methods: a prospective and descriptive study was conducted in the intensive care unit at the Provincial Hospital Manuel Ascunce Domenech, Camaguey; from January 2007 to January 2011. The sample was composed of 23 patients with diagnosis of Guillain-Barré syndrome with respiratory paralysis. For plasmapheresis was used a conventional haemodialysis machine Fressenius 4008-D, and plasma filters and blood lines for haemodialysis. Extracted plasma volumes were about 3000 ml, as replacement solutions albumin human and fresh plasma were used. The information was collected in forms from clinical histories, relative frequencies and percentages of variables were processed.
Results: the recovery of muscle strength was significant and the quick exit of the ventilation of patients after the first five sessions. Few complications were presented. The treatment was effective for 95, 65 % of patients.
Conclusions: the treatment was effective; improvement was obtained after five exchange transfusions; the needed time to obtain the desired plasma volume was on an hour and a half to two hours and a half, quicker than the centrifugation method. It reduced the time of recovery of muscle strength and mechanical ventilation, turned out to be, in addition, a safe and quick technique for patients who suffer from this disease.
DeCS: DeCS: GUILLAIN-BARRE SYNDROME/diagnosis; MEMBRANE FILTRATION; CENTRIFUGATION; PLASMAPHERESIS; EPIDEMIOLOGY, DESCRIPTIVE.
INTRODUCCIÓN
El síndrome de Guillain Barre (SGB) o polineuroradiculitis aguda es una enfermedad paralizante aguda y simétrica, generalmente ascendente, debida a una inflamación de los nervios periféricos. Se cree que es causada por factores autoinmunes,1,2 como los anticuerpos y desencadenada por una infección viral o bacteriana. Se caracteriza por una debilidad simétrica, rápidamente progresiva, de comienzo distal y avance proximal, a veces afecta la musculatura bulbar respiratoria, y cursa con pérdida de reflejos osteotendinosos, y con signos sensitivos leves o ausentes.3 El líquido cefalorraquídeo (LCR) muestra una disociación albúmino-citológico, con aumento de proteínas y normalidad celular. Es laausa más frecuente de parálisis neuromuscular aguda, con incidencia anual de uno a tres por 100 000abitantes. Suele afectar a personas de cualquier edad y sexo con dos picos de presentación: uno en la etapa adulta joven y otra en ancianos,4 es rara en niños menores de un año de edad.5,6 El trastorno suele aparecer unos días o semanas después de que la persona haya tenido síntomas de infección viral respiratoria o intestinal, en algunas ocasiones, el embarazo, cirugías o las vacunas pueden desencadenar el síndrome.7 Su mortalidad alcanza el 5-15 %.8
Se recoge el antecedente de infecciones precedentes, 2/3 de los pacietnes han padecido una infección del tracto respiratorio o gastrointestinal uno a tres semanas antes.9,10
El antecedente patológico más frecuentemente encontrado es la gastroenteritis bacteriana producida por el Campylobacter jejuni.11 El uso de la plasmaféresis y las inmunoglobulinas intravenosas (IgG IV), han demostrado similar eficacia.12
La plasmaféresis es un procedimiento extracorpóreo, en el cual a partir de la sangre extraída del paciente, se procede a separarla en sus componentes plasma y elementos celulares. Constituye una variedad de aféresis, y su objetivo principal es remover elementos específicos del plasma, los cuales se consideran que son los mediadores de procesos patológicos.13
Existen dos métodos de plasmaféresis:
-Plasmaféresis por centrifugación, el cual requiere de equipos complicados y de uso común en bancos de sangre.
-Plasmaféresis por filtración, la que se puede aplicar también por equipos exclusivamente diseñados para ese propósito y que son de difícil obtención.
La plasmaféresis por filtración que utiliza plasmafiltros adaptados a las máquinas de hemodiálisis, es una alternativa terapéutica de fácil utilización, bajo costo y tiene la posibilidad de ser practicada por personal médico y paramédico que laboran en las unidades renales. Como las máquinas de hemodiálisis se encuentran comúnmente en hospitales de tercer nivel, y son de fácil transporte, se entiende que es el procedimiento más práctico para llevar a cabo en estos centros hospitalarios.
El objetivo de este trabajo fue demostrar las ventajas de la plasmaféresis por el método de filtración de membrana en el tratamiento del síndrome de Guillain-Barre grave.
MÉTODOS
Se realizó un estudio prospectivo, descriptivo, en la unidad de terapia intensiva del Hospital Universitario Manuel Ascunce Domenech de la ciudad de Camagüey desde enero del 2007 a enero del 2011. El universo estuvo formado por 26 pacientes, la muestra estuvo constituida por pacientes de ambos sexos que ingresaron en la terapia intensiva de este hospital con un síndrome de Guillain-Barre (SGB) con requerimiento de ventilación asistida. La misma se conformó con 23 pacientes que cumplieron los criterios diagnósticos, de inclusión y exclusión preestablecidos en la investigación. Los criterios de inclusión fueron: paciente con SGB con requerimiento de ventilación mecánica, la no existencia de contraindicaciones para la plasmaféresis y que dieran su consentimiento para recibir el tratamiento. Se excluyeron los que no cumplían los criterios antes mencionados.
Técnicas y procedimientos:
Para iniciar el tratamiento se realizó la estimación del volumen plasmático a remover para llegar a una prescripción apropiada de la plasmaféresis. Para ello empleamos la fórmula propuesta por Kaplan:14,15
VEP (litros)= (0.07x peso en Kg.) x (1-Hto)
VEP: volumen estimado de plasma.
Hto: hematocrito.
El método de plasmaféresis utilizado fue el de filtración transmembrana, al utilizar un plasmafiltro con membranas de alta permeabilidad con gran tamaño de sus poros (0,3-0,6 micrones), se emplearon máquinas convencionales de hemodiálisis (Fresenius 4008-D) y las líneas arteriovenosas utilizadas en la hemodiálisis que se adaptan perfectamente al plasmafiltro.16 Los volúmenes de plasma obtenidos estuvieron entre los 2700 y 3000ml y el tiempo promedio en obtener el volumen plasmático deseado fue de una y media a dos y media horas. Las variables utilizadas se seleccionaron en correspondencia al problema científico y el sistema de objetivos trazados.
- Edad.
- Sexo.
- Color de la piel.
- Número de sesiones.
- Tiempo de duración del recambio.
- Número de sesiones al momento de salir de la ventilación.
- Complicaciones durante el tratamiento.
Las fuentes utilizadas para obtener las variables fueron las historias clínicas de los pacientes y una planilla de recolección de datos creadas para las particularidades del proceder. El método de muestreo empleado fue no probabilístico.
En el procesamiento estadístico se calcularon las frecuencias relativas y el porcentaje por año de las variables: número de sesiones por pacientes, tiempo de duración de los recambios, número de sesiones al momento de salir de la ventilación mecánica, complicaciones del proceder, causas de muerte.
La evaluación del resultado se realizó cuando se obtuvo la recuperación de la fuerza muscular, la salida de la ventilación mecánica y la incorporación del paciente de la cama de hospitalización.
RESULTADOS
El número de sesiones de plasmaféresis a que se sometieron los pacientes fueron cuantificadas, las cuales eran suspendidas al presentarse una respuesta clínica evidente y favorable, el principal indicador clínico que se tuvo presente para discontinuar el tratamiento fue la salida del respirador.
Se observó que 16 pacientes (69,6 %) recibieron cinco recambios solamente porque luego de estos lograron ser extubados, fueron el grupo predominante seguidos de cinco pacientes más que resolvieron con seis o siete recambios (21,7 %), solo a dos pacientes hubo que extenderle la terapéutica a 9 recambios (8,7 %). (Tabla 1)
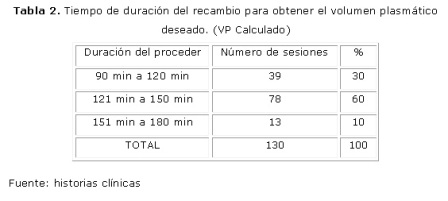
El tiempo de duración de las sesiones de plasmaféresis, estuvo determinado por el número de minutos que tardó en obtenerse el volumen de plasma a extraer en cada sesión, el cual fue calculado previamente, se observó que el volumen de plasma deseado se obtuvo en un período de 121 a 150 minutos (dos horas a dos horas y media), lo que constituyó un 60 %, seguido de los que duraron de una a una hora y media (30 %). (Tabla 2)
Se registró el número de recambios que fueron realizados para lograr la separación del paciente del ventilador, se observó que el número de recambios donde una mayor cantidad de pacientes lograron desacoplarse del ventilador fue de cuatro a cinco para un 69,6 %, seguido de los que requirieron de seis a siete recambios (21,7 %). Solo el 8,7 % de los enfermos necesitaron más de ocho recambios para respirar espontáneamente. (Tabla 3)
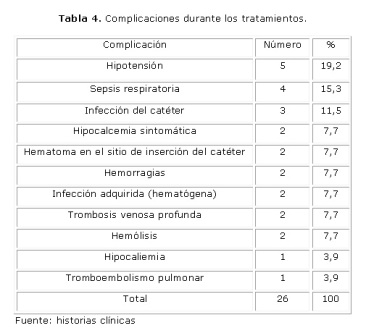
El número total de sesiones fue de 130, aplicadas a los 23 pacientes que entraron en el estudio, como se observó la complicación que con mayor frecuencia se presentó durante el tratamiento fue la hipotensión arterial (19,2 %), seguidas por la sépsis respiratoria (15,3 %) y de la infección del catéter intravascular (11,5 %). (Tabla 4)
DISCUSIÓN
El tiempo promedio de asistencia respiratoria mecánica en pacientes con SGB y fallo respiratorio es de tres a seis semanas y el período de hospitalización en la unidad de cuidados intensivos, alcanza como promedio las seis semanas, la duración de la estancia hospitalaria es mucho más larga e impredecible. Ambos períodos pueden reducirse significativamente con el uso temprano de la plasmaféresis, en esta investigación se inició siempre el tratamiento antes de los siete días de iniciada la enfermedad.17 Al comparar el resultado obtenido en este estudio con otros estudios que relacionan la salida del ventilador con el número de recambios plasmáticos efectuados, se observa que la mayoría de los autores reconocen que la mayor respuesta se obtiene en los primeros recambios plasmáticos, al tener en cuenta los conocimientos actuales de las propiedades farmacocinéticas de cada inmunoglobulina.
Se observó que 16 pacientes (69,6%) recibieron cinco recambios solamente porque luego de estos lograron ser extubados, fueron el grupo predominante seguidos de cinco pacientes más que resolvieron con seis o siete recambios (21,7%), solo a dos pacientes hubo que extenderle la terapéutica a 9 recambios (8,7%). Esta respuesta fue más evidente y rápida si se compara con la obtenida mediante el método de centrifugación, empleada con mayor frecuencia en la unidad de cuidados intensivos, por no disponer de máquinas de hemodiálisis en la misma.
Algunos autores opinan que los mejores resultados se obtienen con recambios de 200 mL de plasma/Kg. de peso corporal en un período de 7 a 14 días (alternos), equivalente a 4 - 5 recambios de 3,5 a 4 litros cada uno, otros estiman que bastan dos recambios para lograr un tratamiento eficaz.18
Las inmunoglobulinas tienen una vida media de 5 (IgM) a 21 (IgG) días, y tienen una distribución intravascular entre 45-75 % de su masa total (75 % IgM y 45 % IgG). Este contenido determina qué tan eficientemente son removidas del cuerpo cuando se practica una sesión de plasmaféresis.18 La mayor cantidad de inmunoglobulinas removidas ocurre con la remoción del volumen plasmático, alcanzando cifras de 45-75 % del total; posteriores remociones de iguales volúmenes plasmáticos sólo logran grados menores de eliminación de estas macromoléculas, por lo tanto, se recomienda que cada sesión de plasmaféresis no practique remociones superiores a dos volúmenes plasmáticos.
Los resultados confirman el planteamiento de algunos autores que refieren que cuatro recambios en los pacientes graves (estadio V) de síndrome de Guillain-Barre son tan eficaces como seis y los beneficios obtenidos a partir de los cinco son pobres.19
Los tiempos obtenidos para la obtención del volumen plasmático deseado (90 a 150 minutos) en el 90% de los pacientes coinciden con lo reportado por los autores revisados y demuestran que este método por filtración de membrana es mucho más rápido y más sencillo que cuando se emplea el de centrifugación.19 En la centrifugación, las células sanguíneas son separadas con base en su densidad, en tal forma que al centrifugar la sangre los elementos celulares se van hacia la periferia, y el plasma ocupa la parte central de la centrífuga o campana de donde puede ser evacuado, retornando luego el componente celular al paciente previa redilución y calentamiento. Este método es el utilizado en los bancos de sangre, y tiene la enorme ventaja que permite la citoféresis, con lo cual el grupo celular de interés puede ser retirado del paciente con fines terapéuticos o para donaciones posteriores. Requiere la anticoagulación con citrato, la cual puede generar hipocalcemia, se asocia en ocasiones a trombocitopenia postratamiento, tiene la ventaja de que utiliza venas periféricas, bajo flujo sanguíneo (50ml/minuto), pero requiere de cinco a seis horas por procedimiento y máquinas sofisticadas de difícil transporte, lo cual limita su utilización en aféresis terapéutica. Pero si se tiene en cuenta que las máquinas de plasmaféresis por centrifugación empleadas en los bancos de sangre, están ubicadas lejos del hospital y se requieren muchos recursos para garantizar el tratamiento, aquí con el empleo de las máquinas de hemodiálisis se puede garantizar un tratamiento más rápido y seguro.
La plasmaféresis cuando se emplean máquinas de hemodiálisis utiliza filtros que permiten la desplasmatización continua que repone simultáneamente el volumen extraído sin provocar desestabilización del paciente en su hemodinamia y evita manipulación de la sangre con el riesgo de contaminación, sin embargo no se comporta así cuando se emplea el método intermitente de centrifugación en el cual se utiliza la máquina de plasmaféresis en el banco de sangre. Este método transmembrana tiene las ventajas de un volumen de circulación muy bajo (100 a 150ml de sangre por minuto), remoción de plasma (2 litros) en mucho menor tiempo (1 a 11/2 hora), y además porta bajo riesgo de generar trombocitopenia. Las máquinas de plasmaféresis de flujo continuo son superiores a las de flujo intermitente. 20
La hipotensión por la disautonomía neurovascular ocurre en el 10 % de los pacientes y las infecciones respiratorias se presentan en un 25 % de los enfermos según los diferentes autores. 21 En la investigación la hipotensión se presentó en un 19,2% y la sepsis respiratoria en un 15,3% por lo cual las complicaciones fueron más frecuentes.
Al revisar diversos estudios sobre la evolución de los pacientes con SGB sometidos a tratamiento se reporta que el 80 % de los pacientes se recuperan completamente o con déficit pequeños; como evolución desfavorable solo se tuvieron aquellos que murieron producto de complicaciones asociadas a la enfermedad (dos pacientes) para un 8,7 %; cifra esta que se corresponde con lo reportado por la literatura revisada la cual hace referencia a una mortalidad de un 5 a un 15 %, 21 ninguno de los fallecidos tuvo relación directa con el proceder. Es importante señalar que no hubo en este estudio ningún paciente que no respondiera al tratamiento de forma favorable.
Las causas de muerte se corresponden con los reportes de los diferentes autores donde mencionan el tromboembolismo pulmonar y las infecciones respiratorias como causas frecuentes de fallecimiento de estos enfermos. 22
CONCLUSIONES
La mejoría clínica se obtuvo después del cinco o seis recambio en la mayoría de los pacientes.
El tiempo necesario para obtener el volumen de plasma deseado fue de una y media a dos y media horas, mucho mas rápido que con el método de centrifugación.
La intervención terapéutica que utiliza la plasmaféresis por filtración continua redujo de forma significativa el tiempo de recuperación de la fuerza muscular y de ventilación mecánica en los pacientes con SGB.
El 91,3 % de los pacientes evolucionó de forma favorable. Las complicaciones presentadas en el estudio fueron escasas, las más frecuentes fueron la hipotensión y la sepsis respiratoria.
REFERENCIAS BIBLIOGRÁFICAS
1. Hartung HP, Pollard JD, Harvey GK, Toika KV. Inmunopathogenesis and treatment of the Guillain Barré syndrome. Part I. Muscle and Nerve. 1995; 18:137-153.
2. Van der Meché FG, Van Doom PA. Guillain Barré and chronic inflammatory demyelinating polyneuropathy. Inmune mechanism and update on current therapies. Ann Neurol. 2005; 37(Suppl 1):S14-31.
3. Hahn AF. Guillain-Barré syndrome. Lancet. 2008; 352:635-41.
4. Pascual-Pascual SI. Aspectos actuales de las Neuropatías inflamatorias agudas y crónicas. Síndrome de Guillain-Barré y polineuritis crónica inflamatoria desmielinizante. Rev Neurol. 2002; 35:269-76.
5. Bernhard Singsen H. Plasma pheresis: a pediatric perspective. J Pediatr. 2007; 98(2):232-5.
6. Delanoe C, Sebire G, Landrieu P. Acute Inflammatory demyelinating polyradiculopathy in children: Clinical and electrodiagnostic studies. Ann Neurol. 1998; 44:350-6.
7. Newswanger DL. Guillain-Barré Syndrome. Am Fam Physician [Internet]. 2004 [citado 15 Feb 2007]; 69(10):[aprox. 10 p.]. Disponible en: http:/www.aafp.org/afp/20040515/2405.html.
8. Govoni V, Granieri E. Epidemiology of the Guillain-Barré syndrome. Current Opin Neurol. 2001;14:605-13.
9. Jacobs BC, Rothbart PH, Van der Meche FG. The spectrum of Antecedent infections in Guillain-Barré syndrome: A Case-control study. Neurology. 1998; 51:1110.
10. Avila Funes JA, Mariona Montero VA, Melano Carranza E. Síndrome de Guillain-Barré: Etiología y Patogénesis. Rev Invest Clin [Internet]. 2002 [citado 24 Feb 2007]; 54(4):[aprox. 9 p.]. Disponible en: http://scielomx.bvs.br/scielo.php?script=sci_arttext & pid=S0034- 83762002000400011 & lng=es & nrm=iso
11. McCarthy N, Giesecke J. Incidence of Guillain-Barré syndrome following Infection with Campylobacter jejuni. Am J Epidemiol. 2001; 153:610.
12. Hughes RAC, Raphael J-C, Swan AV. Randomised trial of plasma exchange, intravenous immunoglobulin, and combined treatments in Guillain-Barré syndrome. Plasma Exchange/Sandoglobulin Guillain-Barré Syndrome Trial Group. Lancet. 2007; 349:225.
13. Corbin F, Qullis HM, Freireich EJ, Ito Y, Kellogg RM, Latham A, et al. Development of Apheresis Instrumentation. En: McLeod BC, Prince TH, Weinstein R, editors. Apheresis: Principles and Practice. 2th ed. Bethesda: AAB B press; 2003. p.1-27.
14. Kaplan AA. Plasma exchange in renal disease. Semin Dial. 2006; 9:61-70.
15. Hakim RM. Plasmapheresis. In: Jacobson HR, editor. The principles and practice of nephrology. 2da ed. St. Louis: Mosby-Year Book; 2005.p.713-21.
16. Gerhardt RE, Ntoso KA, Koethe JD, Lodge S, Wolf CJ. Acute plasma separation with hemodialysis equipment. J Am Soc Nephrol. 2006; 2:1455-8.
17. Kiprov DD, Hofmann J. Plasmapheresis in immunologically mediated polyneuropathies. Ther Apheresis Dial. 2008; 7(2):189-96.
18. Schroeder C, Vernino S, Birkenfield AL. Plasma exchange for primary autoimmune autonomic failure. N Engl J Med. 2005; 353(15):585-90.
19. Madore F. Plasmapheresis. Technical aspects and indications. Crit Care Clin. 2002; 18(2):375-92.
20. de-Zoysa NS, Jayaweera KK, Vaithianathan T. Manual plasmapheresis in the treatment of Guillain Barré) syndrome. J Clin Apher. 2004; 9:147-50.
21. Sabath E, Denker Bradley M. Plasmapheresis. In: Brenner Barry M, editor. The Kidney. 8va ed. Boston: Editorial Saunders; 2007.p.2071-9.
22. French Cooperative Group. Efficiency of plasma exchange in Guillain Barré Syndrome. Ann Neurol. 2007; 22:753.
Recibido: 11 de noviembre de 2011
Aprobado: 18 de junio de 2012
Dr. Leonardo Curbelo Rodríguez. Especialista de I Grado en Nefrología. Máster en Urgencias Médicas. Profesor instructor. Hospital Universitario Manuel Ascunce Domenech. Camaguey, Cuba. Email: curbelo62@mad.cmw.sld.cu