Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Vaccimonitor
versión impresa ISSN 1025-028X
Vaccimonitor vol.23 no.3 Ciudad de la Habana sep.-dic. 2014
ARTICULO ORIGINAL
Avances en la caracterización de un proteoliposoma derivado de Mycobacterium bovis BCG como candidato vacunal contra la tuberculosis
Advances in the characterization of a proteoliposome derived from Mycobacterium bovis BCG as vaccine candidate against tuberculosis
Nadine Alvarez-Cabrera,*1 Sonsire Fernández-Castillo,1 Daymí Serpa-Almaguer,2 Daily Serrano-Hernández,1 Caridad Zayas-Vignier,1 Rubén Adonis Cabrera-Arias,1 Reinaldo Acevedo-Grogues,1 Vladimir Peña-Sánchez,3 Norazmi Mohd-Nor,4María Elena Sarmiento-García-San Miguel,1 Armando Acosta-Domínguez,1 José Luis Pérez-Quiñoy1
1Instituto Finlay. Centro de Investigación-Producción de Vacunas. Ave. 27 No. 19805, La Lisa. La Habana, Cuba. AP. 16017, CP11600.
2Departamento de Laboratorio Clínico, Hospital Pediátrico de Centro Habana. La Habana, Cuba.
3 Centro de Inmunología Molecular. Calle 15 esq. 216, Reparto Siboney, Municipio Playa. La Habana, Cuba.
4Escuela de Ciencias Médicas, Universidad Sains Malaysia, 16150 Kubang Kerian, Malaysia.
email: nalvarez@finlay.edu.cu
* Licenciada en Biología, Dra. en Ciencias de La Salud, Investigador Agregado, Biotecnólogo de Tercer Nivel.
RESUMEN
A pesar de los esfuerzos por erradicar la tuberculosis (TB) a nivel mundial, esta enfermedad aún es un grave problema de salud. El Bacilo de Calmette-Guérin (BCG), única vacuna disponible contra la TB, tiene una eficacia variable y aunque protege contra las formas graves de la enfermedad en la infancia, su papel es cuestionable en la protección contra la forma pulmonar en adultos. En los últimos años, se desarrollan nuevos candidatos vacunales contra la TB al emplear múltiples variantes tecnológicas. Teniendo en cuenta la similitud antigénica que existe entre M. bovis BCG y M. tuberculosis y los antecedentes del uso de los proteoliposomas en formulaciones vacunales, se propuso estudiar las potencialidades del proteoliposoma de M. bovis BCG (PLBCG) como posible candidato vacunal contra la TB. Los resultados demuestran que se obtuvo un PLBCG compuesto por vesículas nanoparticuladas. Adicionalmente, el análisis en electroforesis (SDS-PAGE seguido de tinción con Coomassie) mostró la presencia de numerosas bandas de proteínas que por su tamaño molecular corresponden a proteínas reportadas para M. bovis BCG que poseen homología con M. tuberculosis.
Palabras clave: tuberculosis, vacuna, proteoliposomas, Mycobacterium bovis BCG.
ABSTRACT
Despite efforts to eradicate tuberculosis (TB) worldwide, this remains a serious health problem. The Bacillus Calmette-Guerin (BCG), the only available vaccine against TB, has variable efficacy and though protects against severe forms of the disease in childhood, has a questionable role in the protection against pulmonary tuberculosis in adults. In recent years, new TB vaccine candidates are being developed using multiple vaccine strategies. Taking into account the antigenic similarity of M. bovis BCG and M. tuberculosis, and the history of the use of proteoliposomes in vaccine formulations, we aimed to study the potentialities of a proteoliposome derived from M. bovis BCG (PLBCG) as a potential vaccine candidate against TB. The results demonstrate that a PLBCG was obtained, which was observed by different techniques and that is composed of nanoparticulate vesicles. Additionally, analysis by SDS-PAGE followed by Coomassie stained showed the presence of several protein bands on PLBCG whose molecular size may correspond with that reported for M. bovis BCG protein having homology to M. tuberculosis.
Key words: tuberculosis, vaccine, proteoliposome, Mycobacterium bovis BCG.
INTRODUCCIÓN
A casi cien años de la aplicación de la primera vacuna contra la tuberculosis (TB) y a pesar de la introducción desde 1943 de la terapia antimicrobiana, la tuberculosis continúa siendo la segunda causa de muerte por enfermedades infecciosas (1,3 millones de muertes en el 2012) (1). Sólo en ese año se reportaron 8,6 millones de casos, de los cuales, probablemente la causa de más de un 15% fueron cepas resistentes a múltiples fármacos de sus siglas en inglés MDR o extremadamente resistentes a fármacos de sus siglas en inglés XDR, aunque las cifras fueron inferiores a las que se declararon en el año 2011 (1).
La búsqueda de una nueva vacuna contra la TB es un campo relativamente joven. Los enfoques que se dirigen a la obtención de nuevas vacunas contra la TB se basan en tres estrategias fundamentales, los cuales incluyen el reemplazo del BCG, vacunas de refuerzo y vacunas inmunoterapéuticas (2). Los avances en la identificación de genes y antígenos, la disponibilidad de las secuencias genómicas del hombre y del microorganismo causante de la TB, así como un mayor conocimiento de los mecanismos inmunológicos involucrados en la defensa del hospedero contra M. tuberculosis permiten la valoración de nuevas estrategias vacunales.
Se evalúan un número considerable de candidatos vacunales en diferentes fases de ensayo clínico, sin embargo, todos fallaron al no demostrar superioridad en protección al compararse con BCG (2). Una estrategia para la obtención de nuevas vacunas contra la TB se basa en el uso de proteoliposomas (PL), estos son extractos de membrana celular que están compuestos por proteínas y lípidos del microorganismo que les dio origen (3).
A pesar de existir varios estudios que indican sus propiedades inmunogénicas (4), en la actualidad existen muy pocas vacunas basadas en PL.
Estudios previos demostraron el potencial inmunogénico de los PLs derivados de micobacterias no patogénicas (Mycobacterium smegmatis y Mycobacterium bovis BCG) en modelos animales de experimentación (5, 6).
Teniendo en cuenta las potencialidades de los PLs como candidatos vacunales así como la elevada similitud antigénica existente entre Mycobacterium bovis BCG y Mycobacterium tuberculosis (7), el objetivo del presente trabajo fue profundizar en la caracterización del PL de M. bovis BCG (PLBCG) como candidato vacunal contra la TB.
MATERIALES Y MÉTODOS
Obtención del PLBCG
Cepa bacteriana
Se empleó la cepa M. bovis BCG Moreau, procedente de la Empresa de Productos Biológicos Carlos J. Finlay (La Habana, Cuba).
Obtención de la biomasa bacteriana
La cepa se subcultivó en medio Sauton-papa bajo condiciones de cultivo estático durante 21 días a 37°C, para lo cual se utilizaron erlenmeyers con 500 mL de medio, que se inocularon con la micobacteria a partir de un ámpula liofilizada reconstituida en medio Sauton sintético. El cultivo que se obtuvo se subcultivó dos veces en medio Sauton sintético durante 15 días, bajo las condiciones descritas previamente. Al recolectar las células crecidas en la superficie del medio, se filtraron asépticamente a través de un filtro Birkhaug para obtener la biomasa semi-seca.
Preparación del PLBCG
La biomasa obtenida se resuspendió en una solución tampón (30 mM Tris – 2 mM EDTA, pH=8,5) y se ajustó la concentración celular. Una vez homogeneizada la suspensión celular, se añadió desoxicolato de sodio (DOC) 0,2 mL/min, preparado al 5-15% a razón de 0,25-1 mL/g de biomasa (4) y se incubó durante un intervalo de 30 min a 2 h en baño de agua con hielo. La suspensión que se obtuvo se centrifugó a 17700 G durante 20 min a 4°C. Luego se desechó el sedimento celular y el sobrenadante se sometió a un sistema secuencial de ultrafiltración tangencial (Sartocon slice 200, Sartorius) hasta obtener el PL. Finalmente, la muestra se filtró bajo condiciones estériles al emplear filtros Sartorius Minisart plus de 0,45 y 0,2 µm y se almacenó a 4°C hasta su formulación y caracterización.
Caracterización del PLBCG
Cuantificación de proteínas
La concentración de proteínas se determinó mediante el método de Lowry (8), se utilizó un estándar de albúmina sérica bovina fracción V cristalizada (Sigma, EUA).
Análisis del perfil electroforético
Para conocer el perfil electroforético del PLBCG, una fracción del mismo se aplicó en un gel de poliacrilamida con sodio-duodecil sulfato (SDS-PAGE, tinción con Coomassie) al 12,5%, según Laemmli (9). La muestra de PLBCG (30 µL) se mezcló con 15 µL de solución tampón (muestra 4X) y se calentó a 100°C durante 5 min, se aplicó en el gel 15 µL a una concentración de 4 µg/µL. Se utilizó un patrón de peso molecular (PPM) con un rango entre 14,4 y 94 kDa (Amersham Pharmacia Biotech AB, Suecia). Posteriormente, el gel se sometió a tinción con Azul Coomassie R250 (Sigma, EUA) y se analizó en un procesador de imágenes (Quantity One, Biorad GS800, USA), para determinar el peso molecular de las proteínas, así como identificar las de mayor representación en la muestra.
Estimación del tamaño del PLBCG mediante cromatografía de exclusión molecular
Con el objetivo de estimar el tamaño del PLBCG, se aplicó 1 mL que contenía 2 mg de proteínas en una columna cromatográfica XK 16/40, empaquetada con Sephacryl S-1000 (Pharmacia, Suecia), previamente equilibrada con Tris 30mM, EDTA 2mM y DOC 0,5%. La elución se realizó a 0,4 mL/min y el perfil cromatográfico se registró al emplear un rango máximo de absorbancia de 0,2. El tamaño del PLBCG se estimó mediante la relación entre el volumen de su elución (Ve) y el volumen total de la columna (Vt), tomando como referencia los estudios de caracterización de otros PLs (Neisseria meningitidis, Vibrio cholerae, Bordetella pertusis) que incluyen la microscopia electrónica y el tamaño de partículas (4, 10).
Determinación del tamaño y la morfología del PLBCG mediante microscopía electrónica de transmisión
La confirmación del tamaño del PLBCG y su morfología se realizó mediante microscopía electrónica de transmisión mediante la técnica de tinción negativa (11). Se empleó una rejilla de cobre de 400 mesh recubierta con membrana de formvar. Una gota de la muestra en estudio se expuso en la rejilla durante 3 min, luego se secó con papel de filtro y se dejó reposar por 1 min. Posteriormente, se adicionó una gota del colorante (tungstato de metilamina al 2%) en la superficie de la rejilla y después de 1 min se secó nuevamente con papel de filtro. Finalmente, la muestra se observó en un microscopio electrónico Phillips CM12, (Holanda).
Confirmación del tamaño del PLBCG e índice de polidispersión mediante espectroscopía de correlación fotónica
El diámetro promedio y la distribución de las partículas (índice de polidispersión) se analizaron mediante espectroscopia de correlación fotónica en un equipo Delsa Nano C (ángulo fijo de dispersión de 165°, Beckman Coulter, USA), al seguir las instrucciones del fabricante. Los valores de talla e índice de polidispersión se obtuvieron por los algoritmos de CONTIN y Cumulant, respectivamente.
Para determinar la homogeneidad en cuanto al tamaño de las vesículas, se utilizó una fuente de láser fija y un ángulo de luz desviada a 90°. Se tomaron 2 mL de PLBCG y se diluyeron en 10 mL de solución salina tampón sulfato, para una concentración final de 0,4 mg/mL. Se realizaron 10 mediciones del lote experimental que se evaluó, se determinó la media aritmética de la talla con su desviación estándar y el índice de polidispersión de las partículas, mediante el empleo de un Delsa Nano C (Beckman Coulter, Alemania).
RESULTADOS Y DISCUSIÓN
El proceso de purificación que se utilizó en este trabajo, permitió obtener una preparación de PLs derivados de M. bovis BCG. El procedimiento es sencillo, rápido y escalable a nivel industrial, compatible con la tecnología que utiliza el Instituto Finlay para la producción y desarrollo de la vacuna VA-MENGOC-BC® compuesta por PLs, el cual muestra excelentes resultados en modelos animales (4). Estas características, hacen más factible la idea del desarrollo de un candidato vacunal contra la TB basado en PLs.
La determinación de proteínas totales se comportó de manera similar en cada uno de los procesos de purificación que se realizaron. Los resultados del promedio de los procesos indicaron un rendimiento de entre 0,038 y 0,043%. Estos valores coinciden con estudios anteriores que utilizan micobacterias como fuente de obtención de PLs (5) y difieren esencialmente de los altos rendimientos de proteínas con el uso de otros microorganismos (4,5). En este estudio el bajo rendimiento proteico de los procesos se relaciona con el alto contenido de lípidos presentes en la superficie de las micobacterias (más del 60% de su peso seco) (12).
Análisis del perfil electroforético
El perfil electroforético del PLBCG mostró bandas de proteínas en la zona correspondiente a los 16-90 kDa según PPM (Fig. 1), donde se encuentran representadas tanto las proteínas de estrés térmico (hsp 65 kDa y hsp 70 kDa), como las lipoproteínas (19, 26, 27 y 38 kDa) (7). Estas proteínas secretorias quedaron incluidas en la estructura esférica del PL mediante el proceso de obtención que se utilizó.
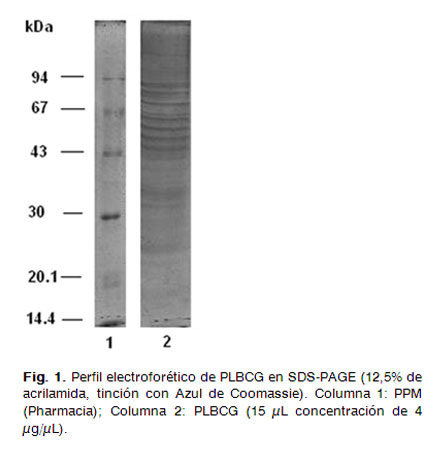
Algunas investigaciones sugieren que sin la presencia del complejo antigénico del que forma parte el Ag85B es imposible la supervivencia de la micobacteria dentro del fagosoma (14). La inmunogenicidad de este antígeno se estudió mediante diferentes estrategias que abarcan desde las vacunas de ácido desoxirribonucleico (ADN) (15) y BCG recombinante (16), hasta su combinación con otros antígenos secretorios (17). Un estudio anterior muestra la generación de anticuerpos contra esta proteína en ratones BALB/c inmunizados con PLBCG (18), además se evidenció que la inmunización con el Ag85B es capaz de inducir protección parcial en modelos murinos (13).
En la zona cercana a los 70 kDa se observa una banda intensa que pudiera corresponder a la proteína de hsp70 (Rv0350). Esta proteína se localiza en la membrana celular y en el citosol de M. bovis BCG y M. tuberculosis(19) por lo que quedó incluida en la estructura proteoliposómica. Se conoce que hsp70 actúa como chaperona y su síntesis se induce bajo condiciones de estrés lo cual le atribuye un papel importante en la persistencia de la micobacteria en el organismo (19).
A pesar de su carácter inmunogénico, su uso como candidato vacunal se limita por la posible asociación con enfermedades autoinmunes (20).
La electroforesis de proteínas permitió inferir, en base al peso molecular, las proteínas ensambladas en el PLque se estudió; no obstante resulta necesario la confirmación mediante métodos más precisos como los estudios de Western blot, al emplear anticuerpos monoclonales contra las proteínas a identificar y/o estudios de secuenciación y proteómica.
Estimación del tamaño del PLBCG mediante cromatografía de exclusión molecular por filtración en gel
El cromatograma muestra el comportamiento del PLBCG en cromatografía de exclusión molecular mediante Sephacryl S-1000. Se obtuvo un pico simétrico y mayoritario (Fig. 2).
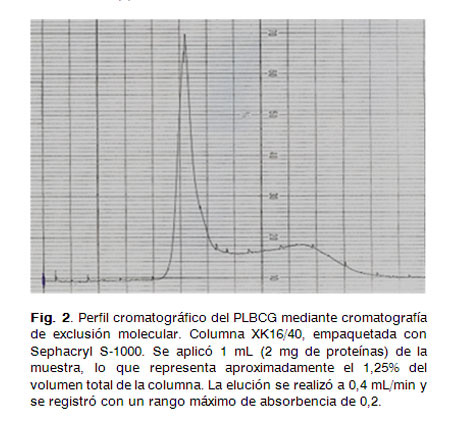
Tomando como referencia los estudios de caracterización a otros PLs (3,4,10),se determinó el cociente Ve/Vt.
El valor que se obtuvo fue de 0,45, el cual sugiere que se trata de una vesícula nanoparticulada, con un tamaño molecular estimado de más de 100 nm, lo que se corresponde con un PL de gran tamaño.
Determinación del tamaño y morfología del PLBCG mediante microscopía electrónica de transmisión
Posterior a la estimación del tamaño del PLmediante cromatografía de exclusión molecular por filtración en gel, se evaluó mediante microscopía electrónica de transmisión con tinción negativa (Fig. 3), las estructuras muestran una configuración vesicular y nanoparticulada, elemento que caracteriza a los PLs derivados de bacterias (21). Los PLs muestran diámetros aproximados de hasta 200 nm lo que confirma los valores estimados a partir de la cromatografía de filtración en gel. Las unidades que se encontraron presentaron homología estructural entre ellas (Fig. 3).

Evaluación del tamaño de PLBCG e índice de polidispersión mediante espectroscopía de correlación fotónica
Se utilizó un método de difracción láser (espectroscopía de correlación fotónica) para determinar la homogeneidad de la muestra y corroborar el tamaño del PLBCG que se estimó por cromatografía y que luego se observó por microscopía electrónica. Se obtuvo como resultado que las partículas presentes en la muestra poseen un tamaño promedio de 109,5 nm, con valores entre 59,9-159,1 nm y un índice de polidispersión equivalente a 0,226, lo que indica que la población es medianamente heterogénea (22).
Si bien las tres técnicas que se emplearon para la estimación y determinación del tamaño de partículas en el PLBCG, utilizan diferentes propiedades para analizar la muestra, se observó una correlación en los resultados obtenidos entre ellas, además se observó en todos los casos que la población de vesículas posee una talla en el rango de 100 a 200 nm. En la literatura que se consultó no existen evidencias de la realización de estos estudios con PLs de M. bovis BCG; sinembargo, índices de polidispersión cercanos a 0,2 se observaron en poblaciones de PL que se obtienen a partir de V. cholerae O1 (23) y B. pertusis (10).
Es relevante el uso de PLs en la preparación de vacunas profilácticas contra enfermedades infecciosas, no sólo como componente antigénico principal, sino también como inmuno-adyuvante en vacunas antivirales y contra la alergia (24).Entre estos PLs se encuentra el de Neisseria meningitidis serogrupo B, el cual se emplea como componente antigénico principal de la vacuna cubana antimeningocócica VA-MENGOC-BC®(4).
El uso de PLs como posibles candidatos vacunales contra la TB pulmonar se aborda escasamente en la literatura. De los dos resultados publicados, uno corresponde al uso de PL que se obtiene a partir de M. smegmatis y señala la inmunogenicidad de dicha formulación, así como la inducción de respuesta de reactividad cruzada contra antígenos de M. tuberculosis en ratones BALB/c (5). El otro resultado, y a su vez el único antecedente que se encontró del uso de PLs obtenidos a partir de M. bovis BCG, es un estudio que se publicó recientemente por el mismo grupo de investigación del presente trabajo, donde se evaluó la reactividad de anticuerpos inducidos por la inmunización con PLBCG en ratones contra antígenos de BCG y otros seleccionados de M. tuberculosis (18). Como continuidad de los resultados, en este estudio resulta necesario profundizar en la caracterización mediante proteómica y lipidómica del PLBCG, con el objetivo de identificar los componentes proteicos y lipídicos que lo componen, así como estudiar su antigenicidad frente al suero de individuos sanos y personas infectadas con M. tuberculosis, todos con exposición a la micobacteria durante un largo período de tiempo.
CONCLUSIONES
En el presente estudio se demuestra, mediante los métodos de caracterización que se utilizaron, que el PLBCG tiene forma esférica, tamaño nanoparticulado y presenta proteínas que por su tamaño molecular pudieran tener homología con proteínas que se declaran para M. tuberculosis. Teniendo en cuenta los resultados de este trabajo, así como los derivados de estudios recientes de inmunogenicidad en ratones BALB/c, se propone profundizar en los estudios de caracterización del PLBCG y avanzar hacia la evaluación de su capacidad protectora en un modelo murino, en aras de demostrar su potencial como candidato vacunal frente a la infección por M. tuberculosis.
AGRADECIMIENTOS
Agradecemos de forma especial a la Lic. Isis García del Instituto Finlay, por facilitarnos la biomasa de M. bovis BCG.
REFERENCIAS
1. World Health Organization. Global Tuberculosis Report. Geneva: WHO;2013.
2. Frick M. The TB vaccines pipeline: where are we going, where have we been? In: Benzacar A. The Pipeline Report: Drugs, Diagnostics, Vaccines, Preventive Technologies, Immune-based and Gene Therapies and Research toward the Cure. New York: Base and Treatment Action Group;2013.p.263-83.
3. Pérez JL, Acevedo R, Callicó A, Fernández Y, Cedré B, Año G, et al. A proteoliposome based formulation administered by the nasal route produces vibriocidal antibodies against El Tor Ogawa Vibrio cholerae01 in Balb/c mice. Vaccine 2009;27:205-12.
4. Sotolongo F, Campa C, Casanueva V, Fajardo EM, Cuevas IE, González N. Cuban Meningococcal BC Vaccine: Experiences & Contributions from 20 Years of Application. MEDICC Review 2008;9(1):16-22.
5. Rodriguez L, Tirado Y, Reyes F, Puig A, Kadir R, Borrero R, et al. Proteoliposomes from Mycobacterium smegmatis induce immune cross-reactivity against Mycobacterium tuberculosis antigens in mice. Vaccine 2011;29:6236-41.
6. Reyes F, Tirado Y, Puig A, Borrero R, Reyes G, Fernandez S, et al. Immunogenicity and cross-reactivity against Mycobacterium tuberculosis of proteoliposomes derived from Mycobacterium bovis BCG. BMC Immunol 2013;14(Suppl 1):S7.
7. Garnier KE, Camus JC, Medina N, Mansoor H, Pryor M, Duthoy SG, et al. The complete genome sequence of Mycobacterium bovis. PNAS 2003;100(13):7877-82.
8. Lowry O, Rosebrough N, Farr A, Randall R. A protein measurement with the folin-phenol reagent. Biol Chem 1951;193:265-75.
9. Laemmli NK. Cleareange of structural proteins during the assembly of the head of bacteriophage T4. Nature 1970;227:680-5.
10. Fernández S, Fajardo EM, Mandiarote A, Año G, Padrón MA, Acosta M, et al.A proteoliposome formulation derived from Bordetella pertussis induces protection in two murine challenge models. BMC Immunology 2013;14(Suppl 1):S8.
11. Woeste S, Demchick P. New version of the negative stain. Appl Environ Microbio1991;57(6):1858-9.
12. Seki IH, Fujita I, Yano I, Yamamoto S, Koyama A. Whole genome sequence analysis of Mycobacterium bovis bacillus Calmette–Guerin (BCG) Tokyo 172: A comparative study of BCG vaccine substrains. Vaccine 2009;27:1710-6.
13. Horth G, Horwitz M, Tabatadize D, Zameenick P. Targeting the Mycobacterium tuberculosis 30/32 kDa mycolil transferase complex as therapeutic strategy against tuberculosis. Proof of principle by using antisense technology. PNAS 2002;99:15614-9.
14. Kremer L, Bouler A, Estoquier J, Content J, Capron A, Locht C. Analysis of the Mycobacterium tuberculosis 85 kDa antigen promoter region. J Bacteriology 1995;177(3):642-53.
15. Brun P, Zumbo A, Castagliuolo I, Delogu G, Manfrin F, Sali M, et al. Intranasal delivery of DNA encoding antigens of Mycobacterium tuberculosis by non-pathogenic invasive Escherichia coli. Vaccine 2008;26:1934-41.
16. Dhar N, Rao V, Tyagi A. Immunogenicity of recombinant BCG vaccine strains overexpressing components of the antigen 85 complex of Mycobacterium tuberculosis. Med Microbiol Immunol 2004;193:19-25.
17. Malin A, Huygen K, Content J, Mackett M, Brandt L, Andersen P, et al. Vaccinia expression of Mycobacterium tuberculosis-secreted proteins: tissue plasminogen activator signal sequence enhances expression and immunogenicity of M. tuberculosis Ag85. Microbes Infect Immun 2000;2:1677-85.
18. Reyes F, Tirado Y, Puig A, Borrero R, Reyes G, Fernandez S, et al. Immunogenicity and cross-reactivity against Mycobacterium tuberculosis of proteoliposomes derived from Mycobacterium bovis BCG. BMC Immunol 2013;14(Suppl 1):S7.
19. Kelkar D, Kumar D, Kumar P, Balakushnan L, Mulliusamy B, Yadav A. Proteogenomic analysis of M. tuberculosis by high resolution mass espectometry. Mol Cell Proteomic 2011;10(12). Disponible en: doi: 10.1074/mcp.M111.011445.
20. Tasneem S, Islam N, Ali R. Cross reactivity of SLE autoantibodies with 70 kDa heat shock protein of M. tuberculosis. Microbiology Inmunol 2001;45(12):841-6.
21. Martínez I, Muñoz Y, Iglesias N, Fajardo E, Balboa J, Riveron L, et al. Aportes Analíticos al Control de Calidad de la Vacuna Cubana VA-MENGOC BC® y de una Nueva Vacuna Antitifoidea. Acta Farm Bonaerense 2006;25(2):231-8.
22. Seymour R. History of Polimer Science and technology. Gene therapy 1996;3:269-73.
23. Acevedo, R. Obtención y Caracterización de una nueva estructura coclear con capacidad adyuvante derivada del proteoliposoma Vibrio cholerae 01. [Tesis Doctoral]. La Habana: BVS; 2011. Disponible en: http://tesis.repo.sld.cu/view/autores/Acevedo_Grogues=3AReinaldo=3A=3A.html
24. Lastre M, Pérez O, Labrada A, Pérez DA, Bracho GR, del Campo JM, et alinventors. Composición vacunal contra las alergias y método para su obtención y empleo en el tratamiento de las mismas. OCPI Patente No. 22983. 2004 Nov 20.
Recibido:Agosto de 2014 Aceptado: Septiembre de 2014













