Introducción
La Organización Mundial de la Salud (OMS) definió el concepto de calidad de vida (CV) desde el año 1948 como el bienestar físico, mental y social y la ausencia de enfermedad. Luego evolucionó su definición a partir de una serie de cuestionarios, con sus dominios de funcionalidad y de síntomas, que permiten medir la percepción del individuo basado en sus experiencias y sus expectativas personales.1
La CV de los pacientes, se ha convertido en un tema de interés en la actualidad, no solo por la implicación que tiene en el propio paciente, sino por su efecto en la familia y su entorno. Anteriormente, la evaluación de los tratamientos para el cáncer se había dirigido a medidas desde la parte biológica, la enfermedad o la supervivencia. A partir de la década de los 90, aumentó el interés por evaluar más profundamente otras dimensiones importantes del paciente y la relación directa sobre la percepción de la CV, con el fin de proporcionar mejor cuidado.1
En la actualidad uno de los instrumentos utilizados para medir dicha percepción es el desarrollado por la “European organization for reseach and treatment of cancer quality life” (EORTC, por sus siglas en inglés). Esta organización es un organismo internacional en el que participan investigadores de diferentes países que trabajan en el área del cáncer y hacen un especial énfasis en aspectos relacionados con la CV de los pacientes que padecen esta patología.2
La vacuna CIMAvaxEGF® contiene el factor de crecimiento epidérmico humano recombinante (EGF-hr), el cual se obtiene a partir de células de la levadura Saccharomyses cerevisiae y se acopla a la proteína transportadora P64k de Neisseria meningitidis (de naturaleza recombinante), producida a partir de células de Escherichia coli y adyuvada en Montanide ISA 51 VG.3
Esta vacuna terapéutica es inmunogénica, por lo que reduce las concentraciones del factor de crecimiento epidérmico (EGF) en sangre, inhibe la fosforilación del receptor de factor de crecimiento epidérmico (EGFR), detiene el ciclo celular de las células tumorales que lo sobreexpresan y ocurre la apoptosis y la inhibición de la angiogénesis, que provocan la destrucción del tumor o, simplemente, la detención de su crecimiento.4
Su desarrollo clínico comenzó en el año 1995 hasta lograr el registro por el Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (CECMED) en el 2008. Se han realizado cinco ensayos clínicos fase I/II en Cuba, dos ensayos clínicos fase II (uno en Cuba y otro en Canadá/Inglaterra), dos fase III y dos fase IV (ambos en Cuba), este último en la Atención Primaria de Salud. Forma parte del cuadro básico de medicamentos cubano desde el año 2014 y desde el 2015, se comercializa como parte de la terapéutica oncológica de segunda línea para el tratamiento del cáncer de pulmón de células no pequeñas en estadios avanzados.3,5
El objetivo de este trabajo es evaluar la CV de los pacientes incluidos en el "Ensayo Clínico Fase III: evaluación de sobrevida de pacientes con tumores avanzados de pulmón de células no pequeñas tratados con la vacuna EGF en comparación con el tratamiento de soporte convencional". Registro público de ensayos clínicos RPCEC00000161.
Materiales y Métodos
Este es un ensayo clínico fase III, abierto, aleatorizado y con dos grupos. Cada paciente incluido en el ensayo clínico se asignó de forma aleatoria, en una relación (2 vacuna: 1 control). El grupo vacunado (GV) recibió CIMAvaxEGF®, las primeras cuatro dosis cada 14 días (período de inducción) y luego re-inmunizaciones mensuales hasta que las condiciones del paciente lo permitieran (período de mantenimiento). El grupo control (GC) recibió el mejor tratamiento de soporte disponible para la enfermedad y estadio de los pacientes (al igual que el GV).6
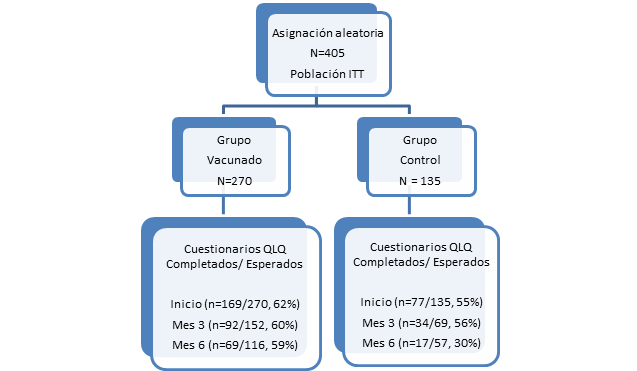
Entre el 5 de julio de 2006 y el 3 de julio de 2012 se incluyeron 405 pacientes. La población por intención de tratar (ITT) estuvo conformada por un total de 270 pacientes en el grupo tratado y 135 en el GC. Las instituciones participantes fueron: Antonio Luaces Iraola (10), Benéfico Jurídico (31), Camilo Cienfuegos (21), Celestino Hernández Robau (12), Centro de Investigación Médico Quirúrgico (4), Carlos Manuel de Céspedes (15), Celia Sánchez (7), Ernesto Guevara de la Serna (9), Gustavo Aldereguía (5), Hermanos Ameijeiras (52), III Congreso (29), Instituto Nacional de Oncología y Radiobiología (4), Juan Bruno Zayas (11), José Ramón López Tabranes (32), Manuel Ascunce Domenech (44), María Curie (10), Salvador Allende (29), Saturnino Lora (28) y Vladimir Ilich Lenin (52).
La CV se evaluó empleando el cuestionario general para cáncer (EORTC QLQ-C30) y el cuestionario específico para cáncer de pulmón (QLQ-LC13) versión 3.0, instrumentos validados y ampliamente usados internacionalmente en ensayos clínicos prospectivos, los cuales fueron aprobados para su uso en este ensayo clínico por la EORTC.7,8,9
Según el protocolo clínico aprobado esta encuesta se realizaría antes del inicio del tratamiento y cada 3 meses hasta el fallecimiento del paciente a criterio del investigador. Teniendo en cuenta la supervivencia alcanzada en el ensayo y el tiempo de deterioro de la salud característica de los pacientes con cáncer de pulmón de células no pequeñas en estadio IIIb o IV, se consideró pertinente realizar los análisis para los datos obtenidos hasta los 6 meses de seguimiento. Se analizaron las encuestas de CV realizadas a los pacientes en los tiempos 0, 3 y 6 meses. La decisión de no continuar después del sexto mes se debió a que la hipótesis del estudio establecía una diferencia entre los estratos desde 5 a 8 meses. Por tal motivo consideramos que, al menos, hasta el sexto mes mantendríamos un nivel de permanencia aceptable del paciente en el estudio clínico, en ambos grupos de tratamiento.
El cuestionario EORTC QLQ-C30 consta de 30 preguntas que incorpora una escala global de salud/CV, cinco escalas funcionales (físico, rol, cognitivo, emocional y social) y tres escalas de síntomas (fatiga, dolor y náuseas-vómitos). También el cuestionario evalúa preguntas individuales de distintos síntomas de la enfermedad y del tratamiento (disnea, insomnio, pérdida de apetito, estreñimiento, diarrea e impacto financiero).7,9,10
Por su parte, el cuestionario EORTC QLQ-LC13 consta de 13 preguntas, es un módulo específico para cáncer de pulmón y comprende una escala de evaluación de síntomas que incluye: disnea, tos, hemoptisis, dolor de boca, disfagia, neuropatía periférica, alopecia, dolor en el pecho, dolor de brazo u hombro y dolor en otras partes.8
Ambos cuestionarios se encuentran validados para ser aplicados en más de 80 idiomas incluyendo el español.
Las respuestas fueron transformadas a una escala de 0-100, donde un alto valor se corresponde con una mejor CV en las escalas funcionales y un bajo valor en los síntomas, con un alto nivel de mejoría de síntomas.
Para el análisis de los síntomas se debe señalar que una disminución de los valores representa una mejoría para el paciente.
Ética
Este protocolo se diseñó y se ejecutó según los principios éticos para la investigación médica con sujetos humanos, establecidos en la actualización de la Declaración de Helsinki en la Asamblea General de la Asociación Médica Mundial, Edimburgo, Escocia, octubre 2000. Este protocolo y sus modificaciones fueron aprobados antes de su aplicación por el comité de ética para la investigación clínica de cada institución y autorizados por el CECMED.
Se obtuvo el consentimiento informado por escrito de todos los pacientes previo a su inclusión en la investigación, con un testigo, preferentemente familiar. Se mantiene la confidencialidad de los datos primarios de los pacientes porque no serán publicados sus nombres, ni sus iniciales, ni los números de registro hospitalario.
Estadísticas
Se realizó un análisis transversal para comparar los valores medios de cada escala evaluada para ambos grupos. Se realizó, además, un análisis longitudinal de las medias de los cambios en cada tiempo evaluado con respecto al nivel basal.
Los análisis fueron realizados teniendo en cuenta los lineamientos de la EORTC en la población por intención de tratar.1
Para comparar las puntuaciones medianas entre los dos grupos de tratamiento se utilizó la prueba no paramétrica U de Mann-Whitney para muestras independientes. Las comparaciones entre el nivel basal y los diferentes tiempos de seguimiento se realizaron a través de la prueba no paramétrica de rangos de signos de Wilcoxon para muestras relacionadas. Se consideró un nivel de significación estadística de α=0.05. Se utilizó para el manejo de los datos el EpiData Versión 3.1 y para el análisis estadístico el IBM SPSS Statistics Versión 25.
Resultados y Discusión
Características de los pacientes
El completamiento de los cuestionarios al nivel basal fue del 62% (169/270) para el GV y 55% (77/135) para el GC. El cumplimiento del completamiento de los cuestionarios varió de 62 a 59 % para el GV y de 55 a 30% para el GC a través del tiempo (Fig. 1), lo cual resultó similar que en estudios realizados por otros autores.11,12,13,14
Las características demográficas y clínicas basales de los pacientes fueron similares en ambos grupos (Tabla 1), lo que se corresponde con otros estudios realizados.11,12,13 La mediana de supervivencia en el ensayo para el caso de los pacientes que recibieron la vacuna fue de 10,83 meses (95% IC: 8,95-12,71) y 8,86 meses (95% IC: 6,69-11,03) para los controles (datos no mostrados). Dichos resultados son similares a los reportados por otros autores.14,15,16
Tabla 1 Características demográficas y de la enfermedad de base.
| Grupo Vacuna (n =270) | Grupo Control (n =135) | |
|---|---|---|
| Sexo | ||
| Masculino | 178 (65,9%) | 86 (63,7%) |
| Femenino | 92 (34,1%) | 49 (36,3%) |
| Origen Étnico | ||
| Caucásico | 182 (67,4%) | 90 (66,7%) |
| Africano | 45 (16,7%) | 22 (16,3%) |
| Otros | 43 (15,9%) | 23 (17,0%) |
| Historia de tabaquismo | ||
| Fumador | 91 (33,7%) | 41 (30,4%) |
| Exfumador | 140 (51,9%) | 71 (52,6%) |
| No fumador | 39 (14,4%) | 23 (17,0%) |
| Estado General (ECOG) | ||
| 0 | 101 (37,4%) | 46 (34,0%) |
| 1 | 148 (54,8%) | 73 (54,1%) |
| 2 | 17 (7,0%) | 12 (8,9%) |
| ND | 4 (1,4%) | 4 (3,0%) |
| Etapa de la enfermedad | ||
| IIIB | 169 (62,3%) | 88 (65,2%) |
| IV | 98 (36,3%) | 36 (26,6%) |
| ND | 3 (1,1%) | 11 (8,1%) |
| Tipo histológico | ||
| Adenocarcinoma | 92 (34,1%) | 46 (34,0%) |
| Carcinoma de células escamosas | 142 (52,6%) | 73 (54,0%) |
| NE | 36 (13,3) | 16 (11,9%) |
| Respuesta al tratamiento de primera línea | ||
| Respuesta Completa | 28 (10,4%) | 10 (7,4%) |
| Respuesta Parcial | 111 (41,1%) | 54 (40,0%) |
| Enfermedad Estable | 116 (43,0%) | 65 (48,1%) |
| Enfermedad en Progresión | 15 (5,6%) | 6 (4,4%) |
| ND: no disponible. NE: no especificado. Cuestionario QLQ-Q30 |
Escalas funcionales
En la CV General (global), los valores medios al nivel basal y final (sexto mes) fueron equivalentes entre ambos grupos. No se observaron diferencias significativas. Estos resultados son comparables a los mostrados en la tabla de valores de referencia internacionales de la EORTC para el cuestionario QLQ-C30 para pacientes de ambos sexos, con cáncer de pulmón de células no pequeñas en estadios IIIb o IV, donde la media de los valores basales es 54,7 con una desviación estándar (DE) de 23,8.1
Sin embargo, la tendencia a la mejoría de la CV global fue a favor del GV en comparación con el GC; representado por niveles superiores a 54,7 según los valores considerados como óptimos para la EORTC.7
En todos los momentos de evaluación en comparación con el nivel basal, los valores para la CV global fueron superiores para los pacientes tratados con CIMAvaxEGF® con respecto a los controles (Fig. 2A).
Particularmente en el tercer mes el GV presentó valores estadísticamente superiores al GC (p=0,014), con un incremento absoluto significativo de 3 puntos al comparar los valores medios con respecto al nivel basal (p=0,035), Tabla 2.
Un hallazgo interesante es la correspondencia para el GV con el incremento de los títulos de anticuerpos contra el EGF en el tercer mes (datos presentados en el informe final), lo cual no ocurre en el GC.
Cuando se analiza cada grupo en el tiempo, se observa que globalmente los pacientes del GV tienen una mejoría significativa (al comparar con el tiempo cero) en ambos meses: 3 (p=0,035) y 6 meses (p=0,017); no siendo así para el GC, en el cual no hay cambio durante los 6 meses evaluados (Fig. 2A).
Para el funcionamiento físico, se observaron altos valores medios que oscilaron entre 75,1 y 81,2 para el grupo tratado y 73,5 y 79,5 para los controles, para el nivel basal y el mes 6, respectivamente. En ambos casos estos puntajes se encuentran por encima de 73,3 puntos que considera a la escala de la EORTC con un nivel de funcionamiento físico alto o saludable según la escala de evaluación empleada.1,17
Estos valores fueron superiores para el GV hasta el mes 6 de seguimiento, aunque sin significación estadística (p>0,05), con respecto a los controles. Para el grupo tratado se observó un incremento absoluto no significativo (p=0,712) de 6,1 en la puntuación media obtenido para funcionamiento físico en el mes 6 con relación el nivel basal, mientras que en el GC se incrementó en 6 puntos (p=0,529) con respecto al nivel basal (Tabla 2).
Para la escala de rol (comportamiento social), se obtuvieron altos valores medios que se encontraron entre 80,6 y 85,3 para el grupo tratado y 77,5 y 85,4 para los controles, para el nivel basal y el mes 6, respectivamente. Estos valores se encontraron por encima de 66,7 puntos, lo que se corresponde con niveles de funcionamiento saludable. Estos valores fueron superiores para el GV en todos los momentos de evaluación Comité de Ética con excepción del mes 6, aunque no se observaron diferencias significativas (p>0,05) al comparar ambos grupos de tratamiento (Fig. 2B). En los pacientes tratados se observó un incremento absoluto significativo (p=0,027) de 1,8 puntos para el mes 3 con relación al nivel basal, a diferencia del GC que experimentó una disminución no significativa (p=0,311) de 2,8 puntos en este mismo periodo, evidenciando una ventaja para el grupo tratado.
Para la escala de funcionamiento emocional se obtuvieron valores que oscilaron entre 63,8 y 70,8 para el brazo tratado y 69,3 y 70,0 para los controles en el nivel basal y el mes 6, respectivamente. Estos valores se encuentran por encima de 66,7 puntos y se corresponden con niveles de funcionamiento emocional altos o saludables según la escala empleada. En este caso los valores medios del grupo tratado fueron inferiores a los controles, con excepción del mes 6 de seguimiento, aunque no fueron detectadas diferencias significativas (p>0,05) entre ambos grupos de tratamiento (Tabla 2).
Para el grupo tratado se observó un incremento absoluto de 7 puntos que fue no significativo (p=0,981) al comparar el mes 6 con respecto al nivel basal, mientras que en los controles se observó un incremento de solo 0,7 que fue no significativo (p=0,206), aunque sin significación, esto representa una ventaja en los pacientes vacunados.
Para la escala de funcionamiento cognitivo fueron determinados valores medios superiores a 83,3 puntos para ambos grupos de tratamiento, los cuales se corresponden con niveles de funcionamiento altos o saludables. Las medias oscilaron entre 85,2 y 85,9 para el brazo tratado y entre 90,8 y 96,2 para los controles en el nivel basal y el mes 6, respectivamente. En el caso de los controles se observó un comportamiento irregular en el tiempo. No se observaron diferencias estadísticamente significativas (p>0,05) entre ambos grupos de tratamiento para cada momento de evaluación.
El GV tuvo un comportamiento estable entre el mes 6 y el nivel basal, mientras los controles experimentaron una disminución absoluta de 4,6 puntos (p=0,263) de los valores medios en el mes 6 con respecto al nivel basal, esto agrega una nueva ventaja para el GV (Tabla 2).
El funcionamiento social también mostró altos valores medios para ambos grupos de tratamiento, superiores a 66,7 puntos en cada momento de seguimiento, los cuales se corresponden con niveles de funcionamiento social altos o saludables. Estos valores fueron superiores para el GV en todos los momentos de evaluación, aunque sin diferencias estadísticamente significativas (p>0,05), con excepción del mes 3 donde el grupo tratado mostró mejores resultados que los controles con un nivel alto de significación estadística (p=0,005), (Fig. 2C). Esto ocurre cuando los pacientes entran en la etapa del mantenimiento, luego de un periodo finalizado de inducción, que se corresponde con el punto de inflexión en el cual comienzan a levantar títulos de anticuerpos y reducir los niveles de EGF en suero. Por otro lado, para el GV se obtuvo un incremento no significativo (p=0,279) de 3 puntos al comparar el mes 6 con el nivel basal, mientras que en el GC este incremento fue de 2,7 puntos (p=0,37).
Tabla 2 Resultados estadísticos de la prueba no paramétrica de rangos de signos de Wilcoxon para muestras relacionadas. Cuestionario QLQ-C30.
| Meses | Prueba de Wilcoxon | |||||
|---|---|---|---|---|---|---|
| Escala | Grupo | 0 M Media (SD) N | 3 M Media (SD) N | 6 M Media (SD) N | 0-3 Meses p-valor | 0-6 Meses p-valor |
| Global | Vacuna EGF | 63,9(25,4)N=169 | 66,9(20,0)N=92 | 62,8(23,6)N=69 | 0,035 | 0,017 |
| Control | 57,3(26,6)N=77 | 57,5(18,5N=34) | 54,9(13,2)N=17 | 0,144 | 0,451 | |
| Físico | Vacuna EGF | 75,1(23,0)N=167 | 79,0(22,4)N=95 | 81,2(23,0)N=81 | 0,238 | 0,712 |
| Control | 73,5(25,0)N=76 | 73,5(24,9)N=33 | 79,5(18,2)N=16 | 0,067 | 0,529 | |
| Rol | Vacuna EGF | 80,6(28,6)N=168 | 82,4(27,3)N=94 | 85,2(24,5)N=69 | 0,027 | 0,238 |
| Control | 77,4(29,4)N=77 | 74,2(31,5)N=33 | 85,4(19,1)N=16 | 0,254 | 0,311 | |
| Emocional | Vacuna EGF | 63,8(28,7)N=169 | 68,9(28,9)N=93 | 70,8(29,5)N=67 | 0,825 | 0,981 |
| Control | 69,3(29,0)N=75 | 77,0(24,7)N=33 | 70,0(28,1)N=17 | 0,629 | 0,814 | |
| Cognitivo | Vacuna EGF | 85,2(20,0)N=168 | 87,9 (21,3)N=93 | 85,9 (22,2)N=69 | 0,866 | 0,375 |
| Control | 90,8(14,8)N=75 | 87,3(19,5)N=33 | 86,2 (25,8)N=17 | 0,291 | 0,263 | |
| Social | Vacuna EGF | 80,0(30,2)N=168 | 89,6 (21,7)N=92 | 83,0 (30,3)N=69 | 0,363 | 0,279 |
| Control | 79,5(28,7)N=74 | 76,7 (28,5)N=33 | 82,2 (23,1)N=16 | 0,115 | 0,766 | |
| Fatiga | Vacuna EGF | 30,8(29,3)N=168 | 24,4 (26,7)N=93 | 25,2(28,4)N=69 | 0,099 | 0,061 |
| Control | 32,5(28,7)N=74 | 29,1 (31,7)N=32 | 20 (25,2)N=15 | 0,103 | 0,566 | |
| Náuseas | Vacuna EGF | 14,6(22,8)N=169 | 11,1 (20,9)N=94 | 10,8 (22,9)N=69 | 0,184 | 0,294 |
| Control | 16,6(28,1)N=76 | 9,3 (19,7)N=34 | 10,4 (15,9)N=16 | 0,357 | 0,666 | |
| Dolor | Vacuna EGF | 25,7(30,3)N=169 | 18,6 (25,8)N=94 | 20,2 (24,8)N=69 | 0,579 | 0,050 |
| Control | 25,2(27,8)N=76 | 27,4 (30,6)N=34 | 19,6 (27,1)N=16 | 0,044 | 0,547 | |
| Disfonía | Vacuna EGF | 25,4(31,6)N=170 | 24,5 (28,8)N=95 | 20,7 (28,6)N=69 | 0,098 | 0,139 |
| Control | 24,2 (27,9)N=77 | 25,4 (31,8)N=34 | 33,3 (34,4)N=16 | 0,471 | 0,149 | |
| Insomnio | Vacuna EGF | 21,3 (30,2)N=170 | 15,0 (26,0)N=95 | 17,1(27,3)N=68 | 0,944 | 0,603 |
| Control | 20,3 (31,6)N=77 | 20,5 (28,4)N=34 | 18,7 (27,1)N=16 | 0,503 | 0,726 | |
| Pérdida de apetito | Vacuna EGF | 23,9 (33,8)N=170 | 19,2 (30,1)N=95 | 15,4 (27,7)N=69 | 0,475 | 0,146 |
| Control | 28,5 (36,1)N=77 | 23,5(33,3)N=34 | 22,9 (31,5)N=16 | 0,329 | 0,395 | |
| Constipación | Vacuna EGF | 20,8 (31,1)N=166 | 18,7 (31,5)N=94 | 12,0 (24,8)N=69 | 0,748 | 0,499 |
| Control | 17,1 (31,0)N=76 | 12,7(25,9)N=34 | 9,8(19,5)N=17 | 0,566 | 0,783 | |
| Diarreas | Vacuna EGF | 57,1 (14,5)N=169 | 63,8 (19,7)N=94 | 48,3(15,4)N=69 | 0,494 | 0,856 |
| Control | 43,8 (14.7)N=76 | 40,4(13.8)N=33 | 39,2(16.1)N=17 | 0,257 | 0,317 | |
| Dificultades Financieras | Vacuna EGF | 29,1 (38,6)N=168 | 25,5(35,7)N=94 | 28,0(38,1)N=69 | 0,842 | 0,059 |
| Control | 26,1 (37,5)N=74 | 21,5(31,6)N=34 | 27,4(35,8)N=17 | 0,719 | 0,427 | |
Escalas de síntomas
Los valores del síntoma fatiga (Tabla 2) mostraron valores por debajo de 44,4 puntos en todos los momentos de evaluación, lo que se corresponde con una valoración de un bajo nivel de síntomas según la escala de evaluación utilizada.1 En el nivel basal ambos grupos mostraron niveles de síntomas comparables (p>0,05) y no fueron halladas diferencias significativas en los restantes tiempos de evaluación. Para el mes 6 de tratamiento se obtuvo una disminución absoluta de 5,6 puntos (p=0,061) con relación al nivel basal en el grupo tratado, no siendo así para el GC redundando en una mejora para el grupo que recibió la vacuna CIMAvaxEGF®.
Los resultados del síntoma náuseas (Tabla 2) mostraron valores superiores a los permitidos por la escala de la EORTC, como mediana es 0 puntos y la media 10,8 puntos en todos los momentos de seguimiento, esto reafirma la condición de pacientes en etapas muy avanzadas de la enfermedad y con un tumor de gran tamaño. Sin embargo, aunque no se determinaron diferencias significativas (p>0,05) en el nivel basal y el resto de los tiempos evaluados en los resultados de ambos grupos, para el brazo tratado se determinó una disminución no significativa (p=0,294) de 3,8 puntos en los valores medios en el mes 6 con respecto al nivel basal; por su parte, el brazo control tuvo un comportamiento inestable y fueron muy pocas las encuestas a analizar en el mes 6, aunque se constató una disminución, esta no puede considerarse porque el tamaño de muestra no es representativo. Ambos grupos, que iniciaron por encima de los valores considerados como saludables para la EORTC, redujeron los valores por lo que mejoraron sus sintomatologías. El hecho de estar incluido en un ensayo clínico y sistematizar tanto el tratamiento en investigación, como el mejor tratamiento de soporte para la mejora de los síntomas asociados con el avance de la enfermedad, les otorga un beneficio terapéutico a los pacientes, incluso estando en el grupo no vacunado.
Los resultados del síntoma dolor mostraron valores bajos por debajo de 33,3 puntos en todos los momentos de seguimiento, los cuales se corresponden con una valoración de bajo nivel de síntomas según la escala empleada.1,18) No se determinaron diferencias estadísticamente significativas (p>0,05) ni en el nivel basal, ni en el resto de los tiempos evaluados en los resultados de ambos grupos. El brazo tratado mostró una disminución significativa (p=0,05) de 5,5 puntos al comparar los valores medios en el mes 6 con relación el nivel basal, sin embargo, en este mismo periodo el GC experimentó una disminución de 5,6 (p=0,547), (Fig. 2D).
Ambos grupos iniciaron cercanos al 25 y la disminución del dolor se hizo más evidente para el GV desde el tercer mes. Para el GC, se observa que en el mes 3 aparece una diferencia significativa en cuanto al dolor que no se mantiene en el sexto, sin embargo, para el GV se aprecia que el síntoma dolor disminuye significativamente en el sexto mes en relación al día cero. Esto podría estar determinado por el efecto del tratamiento que una vez incrementados los títulos de anticuerpo se podrían reducir las concentraciones de EGF circulante que estimulan el crecimiento tumoral.
Para el síntoma disfonía se determinaron valores por debajo de 33,3 puntos en todos los momentos de seguimiento, los cuales se corresponden con una valoración de bajo nivel de síntomas según la escala empleada.1 No se determinaron diferencias estadísticamente significativas (p>0,05) ni en el nivel basal, ni en el resto de los tiempos evaluados en los resultados de ambos grupos. El GV mostró una disminución de los valores medios hasta el mes 6 de tratamiento con 4,7 (p=0,139) puntos al compararlo con el nivel basal, sin embargo, en este mismo periodo de tiempo, el GC experimentó un incremento de 9,1 (p=0,149); en ambos casos las diferencias no fueron estadísticamente significativas, pero de manera absoluta se observa una franca mejoría en el GV en relación al GC (Tabla 2).
Para el insomnio se determinaron valores por debajo de 33,3 puntos en todos los momentos de seguimiento, los cuales se corresponden con una valoración de bajo nivel de síntomas según la escala empleada.1,19) No se determinaron diferencias estadísticamente significativas (p>0,05) ni en el nivel basal, ni en el resto de los tiempos evaluados en los resultados de ambos grupos. El brazo tratado con CIMAvaxEGF® mostró una disminución de los valores medios de 4,2 puntos al comparar el mes 6 con respecto al nivel basal, mientras en el control esta disminución fue de 1,4 puntos; en ambos casos estas diferencias no mostraron significación estadística (p=0,603 y p=0,726, respectivamente), sin embargo, de manera absoluta se observa una disminución más marcada en el tiempo del síntoma que para el grupo no tratado (Tabla 2).
El síntoma pérdida del apetito mostró puntajes por debajo de 33,3 para todos los momentos de seguimiento evaluados, los cuales se corresponden con un nivel bajo de síntomas.1 No se determinaron diferencias estadísticamente significativas (p>0,05) ni en el nivel basal, ni en el resto de los tiempos evaluados en los resultados de ambos grupos. El brazo tratado con CIMAvaxEGF® mostró una disminución de los valores medios hasta el mes 6 (8,5 puntos) pero esta diferencia no fue estadísticamente significativa (p=0,146), mientras en los controles esta disminución fue solo de 5,6 puntos (0,395), siendo, aunque no significativa, una ventaja para el GV (Tabla 2).
El puntaje establecido como saludable para el indicador síntoma constipación es cero como mediana y la media de 22,2 puntos. Los pacientes incluidos en este estudio estaban todos por encima de la mediana, pero inferior a la media establecida. No se determinaron diferencias estadísticamente significativas (p>0,05) ni en el nivel basal, ni en el resto de los tiempos evaluados en los resultados de ambos grupos. El brazo tratado con CIMAvaxEGF® mostró una disminución de los valores medios de 8,8 puntos en el mes 6 con relación al nivel basal y para el GC esta disminución fue de 7,3 puntos. En ambos casos estas diferencias no alcanzaron significación estadística (p=0,499, p=0,783 respectivamente), pero se disminuyen más los síntomas con respecto al valor basal en el GV en relación al GC (Tabla 2).
El síntoma diarreas arrojó valores elevados con un máximo de 63,8 puntos, los cuales son considerados como altos niveles de síntomas y se corresponden con estados no saludables. No se determinaron diferencias estadísticamente significativas (p>0,05) ni en el nivel basal, ni en el resto de los tiempos evaluados en los resultados de ambos grupos. La vacuna provocó una disminución de 8,8 al comparar el mes 6 con el nivel basal (p=0,48), mientras en el GC esta disminución fue solo de 4,66 (p=0,317), ambos grupos estaban por encima de los valores establecidos como saludables por la EORTC de cero y 7,3 en cuanto a puntos de la mediana y la media respectivamente; aunque el GV tiene mayores valores de diarreas que el GC, esto también podría estar asociado con los eventos adversos reportados como frecuentes relacionados con la administración de la vacuna, en este caso la diarrea en uno de los que se reporta, pero en relación al inicio del tratamiento se observa una franca disminución de las mismas (Tabla 2).
La variable dificultades financieras mostró valores que oscilaron entre 21,5 y 41,6 en toda la población de pacientes evaluados. No se determinaron diferencias estadísticamente significativas (p>0,05) ni en el nivel basal, ni en el resto de los tiempos evaluados en los resultados de ambos grupos. La vacuna provocó una disminución de 1,1 puntos al comparar el mes 6 (p=0,059) con el nivel basal, sin embargo, el GC experimentó un incremento 1,3 puntos en el mes 6 con respecto al nivel basal (p=0,427) (Tabla 2).
Cuestionario QLQ-C13
En el síntoma disnea no se determinaron diferencias estadísticamente significativas (p>0,05) ni en el nivel basal, ni en el resto de los tiempos evaluados en los resultados de ambos grupos (Fig. 3A). Los valores del síntoma mostraron una disminución no significativa (p=0,096) de 4,1 puntos al comparar los valores absolutos medios en el mes 6 con relación al nivel basal para el grupo tratado con la vacuna CIMAvaxEGF®, mientras que los controles experimentaron un incremento de 5,3 puntos (p=0,201) lo que habla a favor del grupo de pacientes vacunados. Desde la primera evaluación en el mes 3 se aprecia una mejoría con significación estadística para el GV (p= 0,013) que se mantiene en tendencia a los 6 meses, no siendo así cuando se analiza el comportamiento de los controles en el tiempo, que por demás se aprecia un incremento numérico en el % en relación al inicio del tratamiento.
Como se aprecia en la Tabla 3, el síntoma tos no se determinaron diferencias estadísticamente significativas (p>0,05) ni en el nivel basal, ni en el resto de los tiempos evaluados en los resultados de ambos grupos. Los valores del síntoma tos mostraron una disminución no significativa (p=0,801) de 7,3 puntos al comparar los valores absolutos medios en el mes 6 con relación al nivel basal para el GV, mientras que en los controles esta disminución fue de solo 3 puntos (p=0,768).
En el síntoma hemoptisis no se determinaron diferencias estadísticamente significativas (p>0,05) ni en el nivel basal, ni en el resto de los tiempos evaluados en los resultados de ambos grupos. Los valores del síntoma hemoptisis mostraron una disminución (p=0,058) de 24,2 puntos al comparar los valores absolutos medios en el mes 6 con relación al nivel basal, a diferencia de los controles que experimentaron un incremento de los valores medios de 41,2 puntos (p=0,109) mientras que en los controles esta disminución fue de solo 3 puntos (p=0,768) (Tabla 3).
Tabla 3 Resultados estadísticos de la prueba no paramétrica de rangos de signos de Wilcoxon para muestras relacionadas. Cuestionario QLQ-LC13.
| Meses | Prueba de Wilcoxon | |||||
|---|---|---|---|---|---|---|
| Escala | Grupo | 0 M Media (SD) N | 3 M Media (SD) N | 6 M Media (SD) N | 0-3 Meses p-valor | 0-6 Meses p-valor |
| Disnea | Vacuna EGF | 21,1 (21,5)N=163 | 20,3(20,6)N=93 | 17,0 (16,5)N=62 | 0,013 | 0,096 |
| Control | 19,7 (20,5)N=235 | 24,9(26,6)N=122 | 25 (17,1)N=74 | 0,051 | 0,201 | |
| Tos | Vacuna EGF | 34,5 (29,9)N=164 | 27,2 (25,0)N=93 | 27,2 (25,0)N=93 | 0,801 | 0,801 |
| Control | 29,6 (28,2)N=72 | 26,6 (30,8)N=30 | 26,6 (30,8)N=30 | 0,768 | 0,768 | |
| Hemoptisis | Vacuna EGF | 52,8 (16,8)N=164 | 28,6 (12,6)N=93 | 28,6 (12,6)N=93 | 0,058 | 0,058 |
| Control | 27,7(13,4)N=72 | 68,9 (22,5)N=29 | 68,9 (22,5)N=29 | 0,109 | 0,109 | |
| Dolor de boca | Vacuna EGF | 32,7 (12,4)N=163 | 32,2 (13,9)N=93 | 32,2 (13,9)N=93 | 0,084 | 0,084 |
| Control | 41,6 (14,7)N=72 | 11,9 (6,2)N=28 | 11,9 (6,2)N=28 | 0,157 | 0,157 | |
| Disfagia | Vacuna EGF | 67,0 (18,5)N=164 | 43,0 (14,9)N=93 | 43,0 (14,9)N=93 | 0,046 | 0,046 |
| Control | 55,5 (17,6)N=72 | 88,8 (23,0)N=30 | 88,8 (23,0)N=30 | 0,414 | 0,414 | |
| Neuropatía periférica | Vacuna EGF | 23,0 (28,8)N=162 | 22,4 (29,2)N=92 | 22,4 (29,2)N=92 | 0,647 | 0,647 |
| Control | 18,0 (30,6)N=72 | 17,2 (31,6)N=29 | 17,2(31,6)N=29 | 0,953 | 0,953 | |
| Alopecia | Vacuna EGF | 18,6 (32,0)164 | 10,0(23,4)93 | 10,0 (23,4)93 | 0,045 | 0,045 |
| Control | 15,4 (29,7)N=71 | 2,2 (8,5)N=29 | 2,2 (8,5)N=29 | 0,016 | 0,016 | |
| Dolor de pecho | Vacuna EGF | 15,3 (22,0)N=161 | 10,5(18,4)N=92 | 10,5 (18,4)N=92 | 0,239 | 0,239 |
| Control | 12,9 (22,0)N=72 | 22,2 (31,9)N=30 | 22,2 (31,9)N=30 | 0,031 | 0,031 | |
| Dolor de brazo | Vacuna EGF | 17,6 (29,1)N=164 | 16,4 (26,7)N=93 | 16,4 (26,7)N=93 | 0,090 | 0,090 |
| Control | 19,0 (25,1)N=70 | 25,9 (31,1)N=27 | 25,9 (31,1)N=27 | 0,142 | 0,142 | |
| Dolor en otras partes | Vacuna EGF | 18,1 (28,0)N=158 | 16,1 (26,6)N=89 | 16,1(26,6)N=89 | 0,915 | 0,915 |
| Control | 15,1 (23,3)N=68 | 9,1(17,5)N=29 | 9,1(17,5)N=29 | 0,739 | 0,739 | |

Fig. 3 Puntuaciones medias de las escalas de síntomas del cuestionario QLQ-LC13 para los pacientes tratados con CIMAvaxEGF® y los controles.
Si bien estos resultados no mostraron significación estadística, clínicamente sí resultan relevantes. Los pacientes incluidos en el grupo tratado iniciaron en una condición mucho peor que los controles 52,8 y 27,7 respectivamente, aunque esto no revela diferencias significativas se observa de manera numérica la desventaja de este grupo al iniciar el estudio; sin embargo, al sexto mes de tratamiento el GC incrementa el puntaje a 68,9 mientras que el GV lo reduce a 28,6, esta inversión apuntó a la ventaja en los pacientes vacunados.
Los datos muestran una mejora clínica del síntoma hemoptisis, con una diferencia en el valor absoluto mayor de 24,2 puntos en el mes 6 con relación al nivel basal, a diferencia de los controles donde se produjo un empeoramiento del síntoma con un incremento de 42,1 puntos con respecto al basal.
En el síntoma dolor de boca y lengua no se determinaron diferencias estadísticamente significativas (p>0,05) ni en el nivel basal, ni en el resto de los tiempos evaluados en los resultados de ambos grupos. El síntoma dolor de boca y lengua se encuentra muy estable en el grupo tratado con la vacuna no mostrando ninguna disminución de los niveles absolutos de los valores medios con respecto al nivel basal. Existe una disminución de este parámetro en el GC, aunque no está estadísticamente demostrado. Esta sintomatología no está relacionada con el empeoramiento de la enfermedad a no ser que los pacientes estén recibiendo alguna quimioterapia, lo que sí podría empeorar (Tabla 3).
En el síntoma disfagia, aunque no aparecen diferencias estadísticamente significativas (p>0,05) ni en el nivel basal, ni en el resto de los tiempos evaluados en los resultados de ambos grupos (Fig. 3B), los valores del síntoma disfagia mostraron una disminución absoluta significativa (p=0,046) de los valores medios para los 3 y 6 meses de 24 puntos al compararlos con el nivel basal para el GV, mientras que los controles experimentaron un incremento 33,3 puntos (p=0,414). Este aspecto resultó beneficioso clínicamente para el GV viéndose un empeoramiento en el GC.
En el síntoma neuropatía periférica no se determinaron diferencias estadísticamente significativas (p>0,05) ni en el nivel basal, ni en el resto de los tiempos evaluados en los resultados de ambos grupos. Los valores del síntoma neuropatía periférica mostraron una disminución absoluta de 0,3 puntos al comparar el mes 6 con el nivel basal (p=0.647) (Tabla 3).
En el síntoma alopecia no se determinaron diferencias estadísticamente significativas (p>0,05) ni en el nivel basal, ni en el resto de los tiempos evaluados en los resultados de ambos grupos (Fig. 3C). Para los pacientes vacunados los valores del síntoma alopecia mostraron una disminución absoluta significativa de (p=0,045) de 8,6 puntos al comparar los meses 3 y 6 con el nivel basal.
En el síntoma dolor de pecho no se determinaron diferencias estadísticamente significativas (p>0,05) ni en el nivel basal, ni en el resto de los tiempos evaluados en los resultados de ambos grupos (Fig. 3D). Para los pacientes tratados el valor del síntoma dolor de pecho mostró una disminución absoluta no significativa (p=0,239) de 4,8 puntos al comparar los valores medios del mes 6 con el nivel basal. En este mismo período los controles mostraron incrementos significativos de los valores absolutos de 9,3 puntos (p=0,031). Este indicador tiene una mejoría para el GV, aunque sin significación estadística; sin embargo, para el caso del GC, analizando desde el inicio del tratamiento hasta los 6 meses, hay un empeoramiento significativo.
En el síntoma dolor de brazo no se determinaron diferencias estadísticamente significativas (p>0,05) ni en el nivel basal, ni en el resto de los tiempos evaluados en los resultados de ambos grupos. Para los pacientes tratados el valor del síntoma dolor de brazo mostró una disminución absoluta no significativa (p=0,090) de 1,2 puntos al comparar los valores medios del mes 6 con el nivel basal. En este mismo periodo los controles mostraron incrementos de los valores absolutos de 6,9 puntos (p=0,142). No se explica el incremento en el dolor en el brazo para el GC cuando estos pacientes no fueron vacunados, probablemente los pacientes lo relacionaron con el dolor que refieren por la lesión tumoral, ya que no se beneficiaron del tratamiento, la progresión y supervivencia fue peor en este grupo. Por esto podemos referir que este indicador también resultó beneficiado para los pacientes tratados con la vacuna CIMAvaxEGF® (Tabla 3).
Por último, en el síntoma dolor en otras partes no se determinaron diferencias estadísticamente significativas (p>0,05) ni en el nivel basal, ni en el resto de los tiempos evaluados en los resultados de ambos grupos. Para los pacientes tratados el valor del síntoma dolor en otras partes tuvo una disminución absoluta no significativa (p=0,915) de 2 puntos al comparar los valores medios del mes 6 con el nivel basal (Tabla 3).
Conclusiones
De manera general, como se mostró en cada uno de los parámetros del cuestionario EORTC QLQ-C30, se evidenció que, aunque no se establecieron diferencias significativas de manera global entre los parámetros analizados, de manera absoluta se arrojó un beneficio en cuanto a CV para el GV con la vacuna CIMAvaxEGF® en las cinco escalas funcionales: funcionamiento físico, rol funcional, funcionamientos cognitivo, emocional y social, en las tres escalas de síntomas: fatiga, dolor y náuseas-vómitos.
Igualmente, en los síntomas de la enfermedad y del tratamiento: disnea, insomnio, pérdida de apetito, estreñimiento, diarrea e impacto financiero se observó mejora en la calidad de los mismos a favor de los pacientes tratados con la vacuna CIMAvaxEGF®.
Por su parte, el cuestionario EORTC QLQ-LC13 también evidenció ventajas para el GV, aunque no en todas con significación estadística, pero si desde el punto de vista de beneficio clínico. Se señala como significativo que disminuye la hemoptisis en el grupo con tratamiento de la vacuna, así como la disfagia, la tos y la disnea, observándose un empeoramiento en el GC el cual no recibió el tratamiento en investigación.