Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med v.2003 n.1 Ciudad de la Habana ene.-abr. 2003
Propagación in vitro de Artemisia absinthium L. en Cuba
Ing. Horacio Rodríguez González,1 Téc. Isabel Hechevarría Sosa,2 Téc. Carlos A. Rodríguez Ferradá2 e Ing. María Magdalena Rivera Amitas.3
RESUMEN
Se determinó el efecto de diferentes concentraciones de reguladores, sobre algunos índices del crecimiento en explantes de Artemisia absinthium L., en las fases de multiplicación y enraizamiento durante la micropropagación de esta especie. Explantes nodales de 1 cm provenientes de plántulas obtenidas in vitro se cultivaron en un medio sólido Murashige y Skoog con sacarosa al 3 % y diferentes reguladores del crecimiento. Se probaron distintas concentraciones de 6 bencil aminopurina para la fase de multiplicación y se evaluaron el número de brotes emitidos por explantes y la altura de los mismos. En la fase de enraizamiento se utilizaron distintas concentraciones de ácido indol 3 acético y ácido indol 3 butírico, donde se evaluaron la altura de los brotes, número de raíces y longitud de la raíz principal. Con el aumento de las concentraciones empleadas y el tiempo de evaluación hubo un incremento de los índices estudiados. Correspondió a la concentración media, 0,50 mg/L, el mejor comportamiento con los reguladores utilizados. El mayor por ciento de supervivencia de las plántulas trasplantadas a bolsas para su climatización fue de 88% y se alcanzó a los 30 días de la fecha de cultivo. El trasplante al campo fue satisfactorio en un 95 % en cuyo medio las plantas obtenidas por micropropagación alcanzaron el momento de cosecha con superiores rendimientos 3 meses antes que por el método tradicional de estacas.
DeCS: ARTEMISIA/ crecimiento y desarrollo; CULTIVOS AGRÍCOLAS; INDUSTRIA FARMACEUTICA; ANALISIS DE VARIANZA.
Summary
The effect of different concentrations of regulators on some growth indexes was determined in explants of Artemisia absinthium L. at the stages of multiplication and rooting during the micropropagation of this species. Nodal explants of 1 cm from the plantules obtained in vitro were cultivated in a Murashige and Skoog solid medium with sacarose 3 % and different growth regulators. Different concentrations of 6 benzyl aminopurine were tested for multiplication stage and the number of buds emitted by explants, as well as their height were evaluated. Diverse concentrations of indole 3 acetic acid and indole 3 butyric acid were used in the rooting stage, where the height of buds, the number of roots and the length of the main root were evaluated. A rise of the studied indexes was observed with the increase of the concentrations used and the evaluation time. The best behavior with the regulators used corresponded to the mean concentration , 0.50 mg/L. The highest survival percentage of the plantules transplanted to bags for their climatization was 88 % and it was attained 30 days after being planted. The transplant to the field was satisfactory in 95 %. In this medium, the plants attained by micropropagation reached the harvest time with better yieldings 3 months before than with the traditional stem cutting method.
Subject headings: ARTEMISIA/growth and development; CROPS AGRICULTURAL; DRUG INDUSTRY; ANALYSIS OF VARIANCE.
A pesar de que en Cuba Artemisia absinthium L., es cultivada a escala doméstica en toda la isla, no se propaga fácilmente por vía vegetativa y raramente florece en nuestras condiciones,1 no sucede así en las regiones del sur de Europa de donde es oriunda.2 Esta especie resulta muy estimada por su comprobada acción antiparasitaria,3 debido a la presencia de a - santonina que ha sido usada por muchos años para combatir enfermedades parasitarias,4 además posee otros componentes de potencial eficacia en enfermedades como la malaria.5 Por las razones anteriores y por conocer que el suministro de materia prima de calidad y en cantidades suficientes para la actividad industrial puede obtenerse sólo por medio del cultivo racional de las plantas medicinales, el cultivo de A. absinthium a mayor escala, requiere de la implantación de un método rápido y eficiente para su propagación. En este caso, el cultivo de tejidos puede satisfacer estas expectativas en las condiciones de Cuba.6
Por tales motivos, son imprescindibles las investigaciones cuyos resultados puedan ser aplicados a especies que requieran de estas técnicas de micropropagación.7-9 En este sentido, el presente trabajo tiene como objetivo ofrecer algunos resultados experimentales de la aplicación de la propagación in vitro como vía de multiplicación acelerada de Artemisia absinthium L, de la que no existen antecedentes en Cuba.
MÉTODOS
El presente estudio se realizó en el Laboratorio de Cultivo de Tejidos de la Estación Experimental de Plantas Medicinales "Dr. Juan Tomás Roig ", ubicada en el Municipio de San Antonio de los Baños, Provincia La Habana, Cuba.
Se utilizó como material vegetal inicial segmentos nodales de 1 cm de longitud de plantas de Artemisia absinthium L. procedentes de la propia Estación, que se desinfectaron mediante el lavado con detergente y enjuague en agua y se agitaron durante medio minuto en etanol al 70 % (v/v) y posteriormente en hipoclorito de sodio al 0,5 % durante 8 minutos, se lavaron después 3 veces en agua destilada estéril y se cultivaron sobre el medio Murashige y Skoog10 con 3 % (p/v) de sacarosa, 0,8 % ( p/v ) de agar técnico No. 3. El medio se ajustó a pH.5,8 A las 4 semanas cuando los brotes tenían entre 6 y 8 hojas, se utilizaron explantes nodales como material de propagación básico para los estudios subsiguientes.
Para inducir la brotación masiva, o sea la multiplicación, el medio basal se suplementó además con 6 bencil aminopurina (6 BAP) en 3 concentraciones, ( tabla 1). Para inducir el enraizamiento se utilizó igual medio de cultivo pero suplementado con ácido indol 3 acético (AIA) ó ácido indol 3 butírico (AIB), también con 3 concentraciones cada uno respectivamente, (tabla 2).
Tabla. 1 Tratamientos empleados en la fase de multiplicación.
| Tratamientos | Concentraciones |
| T - 1 ( testigo ) | 0 |
| T - 2 | 0,37 mg / L 6 - BAP |
| T - 3 | 0,50 mg / L 6 - BAP |
| T - 4 | 1,0 mg / L 6 - BAP |
6 - BAP = 6 - benzil amino purina.
Tabla. 2 Tratamientos empleados en la fase de enraizamiento
| Tratamientos | Concentraciones |
| T - 1 ( testigo ) | 0 |
| T - 2 | 0,25 mg / L AIA |
| T - 3 | 0,50 mg / L AIA |
| T - 4 | 1,0 mg / L AIA |
| T - 5 | 0,25 mg / L AIB |
| T- 6 | 0,50 mg / L AIB |
| T - 7 | 1,0 mg / L AIB |
AIA = ácido indol - 3 acético. AIB = ácido indol - 3 butírico
El experimento se repitió 3 veces y se usaron 12 tubos de ensayo (150 cm x 24 cm) por tratamiento, donde cada tubo constituyó una réplica del mismo, con 15 mL del medio de Murashige y Skoog cada uno y un explante por cada tubo, respectivamente. Las vitro plantas utilizadas en la fase de enraizamiento procedieron de la fase de multiplicación.
Durante las fases de cultivo in vitro se evaluaron los siguientes indicadores:
Número de brotes por explante (fase de multiplicación).
Altura de los brotes en cm (fase de multiplicación).
Número de raíces (fase de enraizamiento).
Longitud de la raíz principal en cm (fase de enraizamiento).
Altura de los brotes en cm (fase de enraizamiento).
Se realizaron 3 evaluaciones, la primera a los 20 días de la fecha de siembra y las otras dos, a los 30 y 40 días, respectivamente.
Los cultivos se mantuvieron a una temperatura de 25 ± 2 °C y un fotoperíodo de 16 horas luz con lámparas de luz blanca fluorescente.
Para la climatización se utilizaron bolsas de polietileno pequeñas, 15 x 11 cm, (12 bolsas por tratamiento, una por vitro planta), con suelo y materia orgánica (gallinácea) en proporción de 3:1 y se ubicaron bajo un umbráculo a temperatura ambiente con riego diario por microjet, donde permanecieron por 30 días hasta el trasplante definitivo a campo. Se evaluaron los porcentajes de supervivencia en el umbráculo y en el campo y se determinó el rendimiento por planta.
Los datos se procesaron mediante análisis de varianza modelo bifactorial para todos los índices a excepción de la longitud de la raíz principal a la que se le realizó un análisis de varianza simple. Se aplicó la prueba de rangos múltiples de Duncan11 con un nivel de significación de 5% para comparar las medias de los indicadores.
RESULTADOS
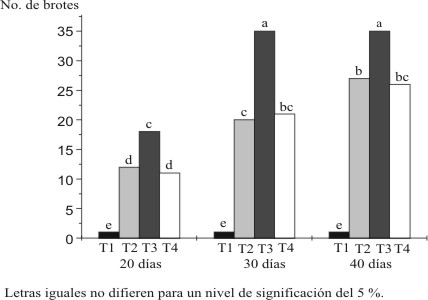
Fase de multiplicación. En la figura 1, se observa que el tratamiento 3 (T-3) con una concentración media de 0,50 mg/L del regulador, ofreció el mayor número de brotes en cada uno de los períodos estudiados. Sin embargo, se encontró depresión en el tratamiento 4 (T-4) que tenía la concentración mayor, 1,0 mg/L del regulador. Este resultado no tuvo diferencias significativas con el encontrado para el tratamiento 2 (T-2), que tenía una baja concentración del regulador, aunque el número de brotes en T-2 fue ligeramente mayor que en T-4 en el primer y tercer período evaluados. Por su parte, el tratamiento sin hormonas (testigo), obtuvo el menor e igual número de brotes en cada uno de los períodos estudiados.
Figura 1. Comportamiento de la brotación según las concentraciones de 6 - BAP en
mg/L utilizadas en los períodos evaluados
Por otra parte, un gran número de brotes no es aconsejable, pues la masividad va en detrimento de la calidad. En la práctica se ve que se necrosan y etiolan por la competencia por la luz, el oxígeno y los nutrientes. Por este motivo se consideró que a los 20 días es el momento adecuado para pasar a la fase de enraizamiento, cuando se aplicó la concentración de 0,50 mg/L de 6 BAP, pues en este período la competencia es menor y se alcanzó un número de brotes aceptable con buen vigor y coloración verde intensa.
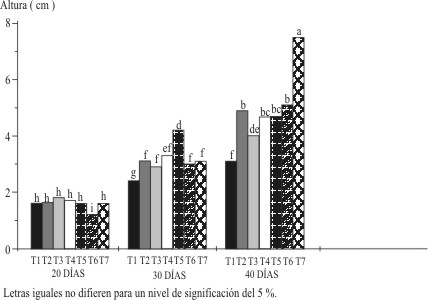
En la figura 2, se muestra el comportamiento de la altura de los brotes con los tratamientos estudiados, donde se aprecia que el tratamiento testigo ( T-1), sin reguladores, obtuvo los mayores valores en este índice en los 3 períodos evaluados que fueron estadísticamente diferentes entre ellos y con el resto de los tratamientos. Estos en su mayoría no difirieron entre sí en cada período. Tales resultados demostraron que el período de siembra tuvo una influencia superior en la altura de los brotes.
Figura 2. Altura de los brotes en la fase de multiplicación según las concentraciones de
6 - BAP en mg/L utilizadas en los períodos evaluados.
Fase de enraizamiento. En la tabla 2 se muestran las concentraciones de los reguladores en los diferentes tratamientos empleados en la fase de enraizamiento. En la figura 3, se muestra en sentido general, que hay un incremento en el número de raíces con las concentraciones media y alta de los reguladores utilizados. Los mayores valores correspondieron a los tratamientos con AIB. Además, se observa que el incremento en el tiempo provocó también un aumento en el número de raíces. Una variación en este patrón de comportamiento sucede cuando disminuye la concentración hormonal utilizada o viceversa, cuando la concentración media o alta coincide con los primeros períodos estudiados, lo que pone de manifiesto la interacción entre dichos factores. También puede verse que el tratamiento testigo ofreció el menor número de raíces en todos los períodos evaluados con diferencias significativas entre los mismos.
Figura 3. Comportamiento del número de raíces según las concentraciones de AIA y AIB en mg/L utilizadas en los períodos evaluados.
La masividad del enraizamiento es aceptable con la concentración media y a los 30 días pueden trasplantarse, pues presenta la plántula las condiciones óptimas. A partir de este período comienzan a etiolarse, toman demasiada altura los brotes, sufren mucho al trasplantarse y tienen menos posibilidades de supervivencia.
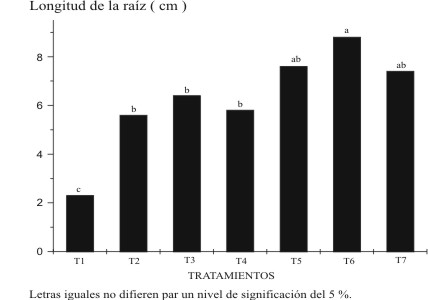
Con relación a la longitud de la raíz principal, figura 4, el análisis de las medias mostró que los tratamientos con AIB ofrecieron los valores superiores y correspondió el mayor valor al tratamiento 6. Es de señalar que también la concentración media de AIA (T-3), obtuvo la mejor respuesta de las concentraciones empleadas de esta hormona. Además se observó depresión con las concentraciones altas utilizadas (T-4 y T-7). Por su parte, el tratamiento testigo se diferenció estadísticamente del resto con el menor valor obtenido para este índice, lo que indicó, también en este caso, una respuesta positiva.
Figura 4. Comportamiento del valor promedio de la longitud de la raíz principal según los tratamientos utilizados.
En la figura 5, se ofrecen los resultados de la altura de los brotes en la fase de enraizamiento donde se aprecia que los mayores valores correspondieron a las concentraciones alta y media de AIB ( T-6 y T-7) en el último período y el menor valor al tratamiento testigo (T-1) en el segundo y tercer períodos y sólo antecedido por ( T-6 ) en el primer período. Sin embargo en este índice, no se observó en sentido general un comportamiento muy definido al parecer, por que los reguladores utilizados tienen una mayor participación en el desarrollo del sistema radicular. Además, se aprecia incremento de este índice en todos los tratamientos estudiados en cada uno de los períodos evaluados lo que demostró la influencia de este factor en el mismo.
Figura 5. Altura de los brotes en la fase de enraizamiento según las concentraciones de AIA y AIB en mg/L utilizadas en los períodos evaluados.
En la tabla 3, se observan los porcientos de supervivencia alcanzados en cada período, donde puede verse que el porciento mayor correspondió a las plantas que fueron trasplantadas a bolsas a los 30 días de sembradas in vitro con un 88 % de supervivencia. El trasplante a campo fue satisfactorio en un 95 %, en cuyo medio las plantas obtenidas por micropropagación alcanzaron el momento de cosecha con superiores rendimientos, 3 meses antes que las obtenidas por el método tradicional de estacas según expresa la tabla 4.
Tabla 3. Porcentaje de supervivencia en cada período evaluado.
| Períodos | Tiempo después de la siembra in vitro | % de supervivencia |
| 1 | 20 días | 83 % |
| 2 | 30 días | 88 % |
| 3 | 40 días | 84 % |
Tabla. 4. Rendimiento promedio de 10 plantas por cosecha.
| Método | No. de Ramas | Peso ( g ) | Edad de las plantas |
| Micropropagación | 39 | 405 | 5 meses |
| Tradicional ( estacas ) | 5 | 161 | 8 meses |
DISCUSIÓN
La depresión en el número de brotes (figura1), con la concentración superior, 1,0 mg/L de 6 BAP puede indicar que la misma resultó excesiva para esta especie, pues los reguladores del crecimiento actúan como estimuladores del mismo en pocas cantidades y las concentraciones excesivas deprimen las plantas, o sea actúan como inhibidores.12
El menor e igual número de brotes en el tratamiento testigo en cada uno de los períodos estudiados, afirmó que este índice tuvo una respuesta positiva a la aplicación de reguladores del crecimiento en esta especie y puso de manifiesto que este factor (concentración hormonal), al parecer tuvo una influencia superior al período de siembra en este caso.
Otros investigadores encontraron también una respuesta positiva al trabajar con esta especie. Así Nin y colaboradores en 1996,13 estimularon el crecimiento de callos derivados de hojas en un medio que contenía 2,22 micromoles de 6 BAP y 2,69 micromoles de ácido a-naftalenacético (ANA). Lógicamente las diferencias en las concentraciones y reguladores utilizados pudieran depender del material del explante empleado, pues las respuestas organogénicas dependen del regulador, de la concentración empleada y del tipo de explante seleccionado.14
Con relación a la altura de los brotes, un comportamiento similar se obtuvo en plátano, donde se encontró superioridad del testigo respecto del resto de los tratamientos, ya que todo pareció indicar que al aumentar la concentración de citoquinina ( 6 BAP), esta influyó en mayor medida sobre la multiplicación y no sobre el alargamiento celular. La información anterior fue dada por el grupo de Vento en 1998 en el trabajo titulado "Efecto de diferentes combinaciones de AIA y 6BAP en el ahijamiento y crecimiento de explantes de plátano FH1A" realizado en el laboratorio de Biotecnología de la universidad Agraria de La Habana. Este resultado también se encontró en este trabajo al corresponder al testigo el menor número de brotes en relación con el resto de los tratamientos y confirmó que existe un efecto antagónico entre el número de brotes y el crecimiento.(Rodríguez Medina N, 1999. Comunicación personal).
El menor número de raíces obtenido con el tratamiento testigo, ratificó la respuesta positiva a estas aplicaciones y la influencia también positiva del incremento del tiempo en este índice.
En general, en la fase de enraizamiento, el AIB tuvo los mayores resultados en los índices evaluados y puso de manifiesto que el mismo tiene una actividad auxínica superior al AIA, que confirmó el criterio de otros autores.12
El aumento de la cosecha con la utilización de estimuladores del crecimiento en determinadas concentraciones, es una consecuencia del esfuerzo de los procesos de crecimiento y desarrollo de la planta; mejora el desarrollo de los sistemas radiculares, aumenta la asimilación y la masa vegetativa lo que trae aparejado un aumento del tamaño de la hoja y aceleración en el paso por las distintas etapas fenológicas. Con el incremento en el número de hojas y su superficie se crean condiciones más favorables para la fotosíntesis según planteó Blagobeshenskii en 1956 en su trabajo titulado " Estimuladores biogenéticos y el período bioquímico de su acción" publicado en el Boletín No. 25 del Jardín Botánico Principal de la antigua URSS.
Sobre la base de los resultados obtenidos, se puede concluir que se encontró una respuesta positiva a la aplicación hormonal en la mayoría de los índices evaluados en las fases de micropropagación analizadas. De forma general, la concentración media (0,50 mg/L) tuvo el mejor comportamiento en cada uno de los reguladores estudiados. Correspondió al AIB esta condición en la fase de enraizamiento. El período de evaluación, tiempo después de la siembra in vitro, influyó positivamente de forma general en el incremento de los índices. La fase de multiplicación debe concluir a los 20 días, período en el cual los brotes alcanzaron su estado óptimo para pasar a la fase de enraizamiento. Esta fase debe extenderse hasta los 30 días para ser llevadas las plántulas a bolsas. El mayor porcentaje de supervivencia de las plántulas trasplantadas a bolsas fue de 88 % y se obtuvo a los 30 días de la siembra in vitro. El trasplante al campo fue satisfactorio en un 95 %, donde las plantas obtenidas por micropropagación alcanzaron el momento de cosecha con superiores rendimientos, 3 meses antes que las obtenidas por el método tradicional de estacas.
REFERENCIAS BIBLIOGRÁFICAS
- Roig Mesa JT. Plantas Medicinales aromáticas o venenosas de Cuba. La Habana: Instituto del Libro;1974.
- Font Quer P. Plantas Medicinales. El Dioscórides Renovado. 11ª Ed. Barcelona: Ed. Labor;. 1988.
- Plantas medicinales. Fitomed. La Habana: Ed. Ciencias Médicas; 1993.
- Pérez Souto N, Linch RJ, Measures G, Hann JT. Use of high performance liquid chromatographic. J of Chromatogr 1992;593: 209-15.
- Rucker G, Mann D, Welbert S. Homoditerpene peroxides from Artemisia absinthium. Phytochemistry 1992;3: 340-2.
- Abelsoni PH, Hinesi PJ. The plants revolution. Science 1999;285:367-8.
- Samiro R, Phukan UP, Kalita MC. In vitro studies on Punnornova (Boerhaavia diffusa L.), a medicinal herb. Indian J Plant Physiol 1999;4:108-10.
- Yu Lin Qing. Study on techniques for rapid propagation of licorice by tissue culture. Grassland of Chine 1999;12:14-8.
- Zhin gen.yu. Fast asexual propagation of Aloe vera.Acta Horticulturae Simca 1999;26:410-11.
- Murashige T, and F Skoog. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant, 1962, 15: 473 - 497.
- Duncan, D.R. Multiple range and multiple F tests. Biometrics. 1965, 11: 1 - 42.
- Pierik RL. Department of Horticulture. Agricultural Univ. Wageningen. The Netherlands. Cultivo in vitro de las Plantas Superiores. Madrid: Edi Mundi Press; 1990.
- Nin S, Morosi ES, Schiff S, Bennice A. Callus culture of Artemisia absinthium. The Netherlands: Kluwer, Academic Plublishers; 1996.
- Tsay Hsing Sheng. Tissue culture technology of medicinal herbs and its application in Taiwán. Proccedings of PSA Symposium.Taipei, Taiwan;1999.p. 137-44.
Recibido: 13 de marzo del 2002. Aprobado: 10 de junio del 2002.
Ing. Horacio Rodríguez González. Estación Experimental de Plantas Medicinales "Dr. Juan Tomás Roig". San Antonio de los Baños. La Habana, Cuba.
1Ingeniero Agrónomo. Investigador Agregado.
2Técnico Medio en Agronomía.
3Ingeniera Agrónoma.