Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med vol.17 no.2 Ciudad de la Habana abr.-jun. 2012
ARTÍCULO ORIGINAL
Estabilidad físico-química y microbiológica de la corteza fresca de Mangifera indica L.
The physical, chemical and microbiological stability of Mangifera indica L. fresh bark
Ing. Lauro Nuevas-Paz,I Ing. Juan Carlos Álvarez de León,II MSc. Ayme Suárez-Torras,III MSc. Lisette Sordo-Martínez,II Lic. Leonora González-Hernández,IV Dr. C. Jhoany Acosta-EsquijarosaV
I Centro Nacional de Genética Médica de Cuba. La Habana, Cuba.
II Empresa del Vidrio, Lisa. La Habana, Cuba.
III Centro Estatal para el Control de Medicamentos (CECMED). La Habana, Cuba.
IV Instituto de Farmacia y Alimentos (IFAL). La Habana, Cuba.
V Centro de Ingeniería de Procesos (CIPRO). Instituto Superior Politécnico José A. Echevarría. La Habana, Cuba.
RESUMEN
Introducción: el extracto acuoso seco que se obtiene a partir de la decocción de la corteza de algunas variedades de Mangifera indica L. es el principio activo de las formulaciones del Vimang®. Este producto de origen natural posee actividad antioxidante, antiinflamatoria, antimicrobiana, espasmolítica, analgésica y antipirética; su componente principal es mangiferina una xantona con varias actividades biológicas reportadas, por lo cual se seleccionó como marcador químico para llevar a cabo los estudios de estabilidad de la corteza y el control de calidad de las formulaciones desarrolladas del extracto de la corteza del árbol del mango, el cual se utiliza en Cuba como suplemento nutricional antioxidante para el tratamiento de diversas enfermedades crónicas.
Objetivo: estudiar la influencia sobre las propiedades físico-químicas, microbiológicas y el contenido de mangiferina en la materia prima vegetal, de las condiciones de almacenamiento propuestas para la corteza de Mangifera indica L.
Métodos: la corteza se trituró y envasó en bolsas de polietileno y fue almacenada durante 70 d con 2 condiciones de almacenamiento a temperatura 22 ± 1 °C y humedad relativa 55 ± 5 %. A la corteza se le determinó la presencia y el conteo total de microorganismos. A los extractos acuosos preparados con la corteza el pH, contenido de sólidos totales y mangiferina; este último por cromatografía líquida de alta resolución.
Resultados: en la corteza se observó un rápido crecimiento microbiano y la presencia de microorganismos indeseables desde el inicio mismo del estudio. A los 31 d de almacenamiento en condiciones de temperatura y humedad se observó la aparición de Pseudomonas aeruginosa, un microorganismo patógeno. El contenido de sólidos totales y mangiferina en los extractos no varió significativamente durante el estudio, lo cual indica la ausencia de degradación química de los componentes de la corteza. En el valor del pH del extracto acuoso se observó una disminución que está relacionada con la aparición de hongos en la corteza.
Conclusiones: se recomienda almacenar la corteza fresca por un período de 30 d como máximo para evitar el deterioro y la contaminación del material vegetal por microorganismos patógenos.
Palabras clave: corteza, estudios de estabilidad, mangiferina, Mangifera indica.
ABSTRACT
Introduction: the dry aqueous extract from the decoction of the bark of some selected Mangifera indica L. varieties is the active principle of some Vimang® formulations. This natural extract was reported to have antioxidant, anti-inflammatory, antimicrobial, spasmolytic, analgesic and antipyretic properties. The main component is mangiferin, a xanthone c-glycosilated, with several reported biological actions. For this reason, mangiferin was chosen as chemical marker for the study of the chemical stability, and the quality control of the different formulations of mango tree bark, commercially used as antioxidant nutritional supplement to treat several chronic diseases.
Objective: to study the influence of the suggested storage conditions for Mangifera indica L. bark on the physical, chemical and microbiological properties and the content of mangiferina in the vegeral raw material.
Methods: the fresh bark material of Mangifera indica L was grounded and stored in polyethylene bags during 70 days under two storage conditions at 22 ± 1°C and 55 ± 5 % relative humidity. Presence and total counting of micro-organisms was determined in the bark, whereas the pH value and the content of total solids and mangiferin were identified in the aqueous extract. The mangiferin was analyzed by high performance liquid chromatography.
Results: there were observed rapid microbial growth and presence of unwanted micro-organisms from the beginning of the study. After 31 day-storage under specified temperature and humidity conditions, a pathogenic micro-organism called Pseudomonas aeruginosa emerged. The content of total solids and mangiferin in the aqueous extract did not significantly change during the study, which indicated the lack of chemical degradation in these components. The pH value of the aqueous extract decreased as a result of the emergence of fungi in the bark.
Conclusions: it is recommended to store the fresh bark for 30 days as maximum, in order to prevent deterioration and contamination of the vegetal material caused by pathogenic micro-organisms.
Key words: bark, stability studies, mangiferin, Mangifera indica L.
INTRODUCCIÓN
El árbol del mango o Mangifera indica L. (Anacardiaceae) crece en las regiones tropicales y subtropicales y sus partes son comúnmente utilizadas en la medicina tradicional para una gran variedad de remedios.1 La composición química de esta planta ha sido muy estudiada, los extractos presentan gran cantidad de triterpenos, flavonoides y polifenoles entre otros compuestos bioactivos.2 El extracto acuoso seco de la corteza del árbol del mango (ECAM) se obtiene solo de 17 de las 273 variedades de Mangifera indica L. que crecen en Cuba y se emplea como un complemento nutricional antioxidante para la mejoría de la calidad de vida en pacientes con diversas enfermedades crónicas.3
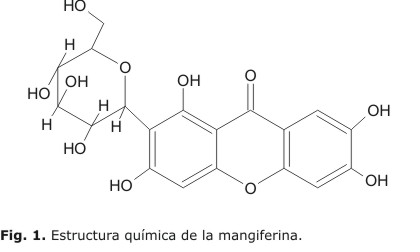
El compuesto mayoritario del ECAM es una xantona C-glucosilada de nombre químico conocida como mangiferina (Fig. 1).
Este compuesto se encuentra entre 5 y 25 % en el extracto. La mangiferina posee actividad antidiabética,4 antiviral, antitumoral, inmunomoduladora y efecto anti VIH5,6 y, además, un potente efecto antioxidante.7 Por ello, se seleccionó como marcador químico para evaluar la estabilidad de la materia prima vegetal y la calidad de las formulaciones desarrolladas del ECAM que se conocen con el nombre comercial de Vimang®.
El proceso de obtención del ECAM consiste en la extracción acuosa de la corteza de algunas variedades seleccionadas de Mangifera indica L. El extracto obtenido es concentrado hasta 10 % de sólidos solubles y posteriormente secado por atomización.8,9 Dentro del esquema tecnológico de obtención del ECAM la etapa de secado y almacenamiento de la corteza vegetal reviste gran importancia, porque si el material vegetal se encuentra contaminado microbiológicamente o si el contenido de mangiferina se encuentra por debajo del límite permisible en la corteza (< 2 %)8, no se obtiene un producto con las especificaciones de calidad establecidas.
Los microorganismos que degradan la celulosa, conocidos como celulolíticos, son abundantes en la naturaleza. Entre ellos se encuentran hongos, bacterias, actinomicetos, protozoos, tanto anaerobios como aerobios, muchos de los cuales pueden crecer en condiciones extremas de temperatura y pH10. De esta manera las plantas deben ser almacenadas en condiciones específicas para evitar su contaminación y deterioro. Se recomienda de forma general evitar la incidencia de la luz, lograr temperatura y humedades bajas, y el envase a emplear no debe interactuar con el material vegetal para evitar la degradación de los componentes bioactivos que puedan ser responsables de la actividad biológica que presente la planta.10
En el desarrollo de la tecnología de obtención del ECAM se han llevado a cabo diferentes estudios previos donde ha sido evaluada la influencia del tamaño de la partícula en la obtención del principio activo, y se ha establecido la relación material vegetal/volumen de disolvente.8 Recientemente, se reportó el estudio de lixiviación de la corteza vegetal, determinándose las etapas de extracción necesarias para la obtención del ECAM y, además, la solubilidad de la mangiferina en agua.11 Sin embargo, no han sido estudiadas las condiciones de almacenamiento a que debe someterse la corteza del árbol del mango para garantizar la producción estable del ECAM, el cual constituye la materia prima de las formulaciones Vimang®.
Teniendo en cuenta lo anterior, en este trabajo se reporta el estudio de la influencia de las condiciones y el tiempo de almacenamiento sobre la estabilidad físico-química y microbiológica de la corteza de M. indica. Estas 2 condiciones de almacenamiento se seleccionaron de acuerdo con las condiciones de conservación de la corteza, que existen en el laboratorio farmacéutico industrial donde se elabora el ECAM.
MÉTODOS
Recolección y preparación del material vegetal
La corteza de M. indica fue colectada de forma manual en agosto de 2006 en la localidad de Corralillo, Villa Clara, Cuba; codificada en el herbario del Instituto de Ecología y Sistemática del Ministerio de Ciencias y Tecnología, (CITMA) con el número de herbario 41722 y autenticada por MSc. Ramona Oviedo Prieto curadora del herbario y MSc. Isora Baró Oviedo, directora del Herbario. La materia prima vegetal húmeda se molió hasta obtener un tamaño de partícula de 2 a 3 cm. La humedad inicial fue de 54 ± 1 %.
Estudio de estabilidad y almacenamiento de la corteza de Mangifera indica L.
El material vegetal molido fue envasado en bolsas de polietileno con una capacidad de 400 g. Se identificaron las muestras según el estudio a realizar. La muestra A se almacenó en un cuarto ventilado, protegido de la lluvia y del sol, a temperatura (T) y humedad relativa (HR) ambiente. La muestra B se almacenó en un lugar con aire acondicionado (T= 22 ± 1 °C y HR= 55 ± 5 %). Se generaron alrededor de 10 muestras para cada condición de almacenamiento. El tiempo de duración del estudio fue de 70 d.
Obtención de los extractos de la corteza de Mangifera indica L.
Para realizar las diferentes determinaciones analíticas como el pH del extracto acuoso, el contenido de sólidos totales, el conteo total de microorganismos y el contenido de mangiferina se hace necesario preparar el material vegetal en forma de extracto. Para esto la corteza ya molida se pesó y se introdujo en un reactor enchaquetado de 2 L de capacidad, utilizando agua como el disolvente de extracción y como medio de calentamiento, aceite. El proceso de extracción se realizó a reflujo constante y se empleó una relación 1/12 de material vegetal/volumen del disolvente.8 Se tomaron 50 mL del extracto obtenido, se filtraron y almacenaron a 4 °C hasta su análisis.
Determinaciones analíticas
Determinación del contenido de humedad, los sólidos totales y del pH del extracto
El ensayo de la determinación del contenido de humedad en el material vegetal y de sólidos totales en el extracto de la corteza de M. indica L., se realizó en una termobalanza MA 40 (Sartorius). El pH del extracto se midió en un peachímetro de laboratorio Metrohm 691, equipado con un electrodo combinado de vidrio y una sonda de temperatura.
Determinación del contenido de mangiferina por cromatografía líquida de alta resolución (HPLC)
El análisis por cromatografía líquida de alta resolución se realizó en un equipo de HPLC conformado por una bomba de gradiente L6200A (Merck-Hitachi) acoplado a un detector UV-VIS PU 4225 (Unicam) ajustado a 254 nm. Para realizar la separación cromatográfica se empleó una columna LiChrospher RP- 18 (Merck) de 250 x 4 mm DI y un tamaño de partículas de 5 µm. La fase móvil consistió en una mezcla de ácido acético 2,5 % y metanol en una relación 72:28 v/v. El volumen de inyección fue de 20 µL.12
Ensayos microbiológicos.
Para la identificación de patógenos que no deben estar presentes en la corteza vegetal, así como el conteo total de microorganismos que incluyen bacterias, hongos y levaduras se hicieron evaluaciones según la norma cubana NC 26-126.13
RESULTADOS
Resultados del estudio de estabilidad y almacenamiento de la materia prima vegetal.
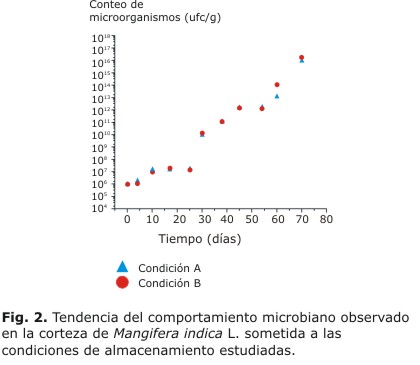
El estudio de estabilidad y almacenamiento del material vegetal estuvo dirigido a evaluar la influencia de 2 condiciones de temperatura y humedad seleccionadas. Durante los 70 d que duró el estudio se observó un aumento exponencial en el contenido total de microorganismos para ambas condiciones de almacenamiento (Fig. 2).
La evaluación cualitativa de Salmonella, Klebsiella sp. y Escherichia coli mostró que estas bacterias estuvieron presentes en las muestras desde el inicio. Sin embargo, las Pseudomonas ferruginosas aparecieron solo en las muestras almacenadas a temperatura ambiente a partir de los 31 d de iniciado el estudio.
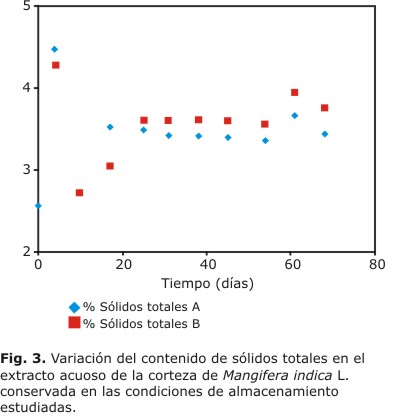
El contenido de los sólidos totales extraídos de la corteza para las 2 condiciones de almacenamiento se muestra en la figura 3.
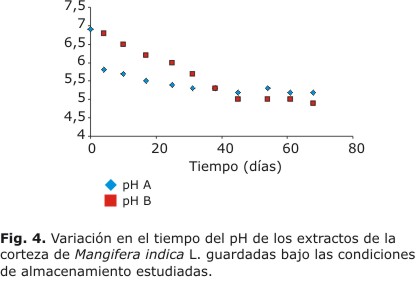
Esta variable no cambió significativamente durante todo el tiempo de estudio. La variación del pH de los extractos preparados con las muestras objeto de estudio se muestran en la figura 4.
Los valores de pH disminuyen con mayor velocidad durante los primeros 30 d del estudio. Sin embargo a partir de los 45 d los valores de pH de los extractos son muy similares con muy poca variación.
Comportamiento del contenido de mangiferina durante el estudio.
La determinación del contenido de mangiferina presente en la corteza vegetal se determinó en 2 momentos, al inicio y al final del estudio de estabilidad. Los resultados obtenidos para las 2 condiciones se muestran en la tabla y se aprecia que el contenido de mangiferina en la muestra A tuvo poca variación al final del estudio. Sin embargo, en el caso de la muestra B la variación fue significativa.
DISCUSIÓN
En el ensayo de determinación de Staphylococus aureus no se detectó su presencia durante el tiempo que duró el estudio, no resultó así para las enterobacterias, las cuales estuvieron presentes por encima del valor máximo permisible (1 x 103 ufc/g)13 durante todo el ensayo. Si bien es deseable que el material vegetal no contenga este tipo de bacterias, no debe ser rechazado teniendo en cuenta 2 razones fundamentales: a) la corteza no se utilizará como producto final y b) la corteza vegetal es sometida a varios procesos de extracción y concentración que emplean temperaturas de hasta 110 °C, en las cuales las células vegetativas de bacterias, hongos y levaduras morirán.14
Con respecto al conteo total de la cantidad de microorganismos, el incremento se debe a su continua reproducción en el tiempo, teniendo en cuenta que el contenido de humedad del material vegetal fue disminuyendo durante el período y la temperatura de las condiciones de almacenamiento sufrió pocas variaciones. La humedad del material vegetal almacenado en aire acondicionado disminuyó a mayor velocidad con respecto a la almacenada a temperatura ambiental, durante los primeros 31 d lo hizo hasta alcanzar un porcentaje de humedad estable (14 % para la condición A y 13 % para la B). La humedad del material vegetal no pudo continuar disminuyendo por haber alcanzado quizá la humedad de equilibrio para ambas condiciones de almacenamiento.
El comportamiento obtenido en la variación del pH es lógico si se tiene en cuenta que en la medida que hay crecimiento de microorganismos, se van produciendo desechos ácidos de su metabolismo, los cuales son incorporados al extracto lo que hace que el valor de pH disminuya. Es conocido que el intervalo de pH óptimo de crecimiento de las bacterias oscila entre 6,5 y 8, mientras que el de los hongos está en el intervalo ácido,14 lo cual permite suponer que estos son los principales contaminantes del material vegetal. No obstante, esta disminución en el valor del pH no afecta la estabilidad de los principales componentes del ECAM, los que mayoritariamente se degradan en medio básico.2
El contenido de los sólidos totales se mantuvo dentro del intervalo de 3 %, establecido durante los estudios de ingeniería y confirmado en los estudios de extracción realizados al material vegetal. 8,11
Los resultados en el contenido de mangiferina permiten suponer que debido a la poca homogeneidad de la corteza vegetal cuando fue envasada para conformar cada muestra, provocó la diferencia en el contenido de mangiferina. Sin embargo, el valor obtenido es similar al que se alcanza en el proceso tecnológico (2,4 g/L),8,11 que es la concentración promedio obtenida para la relación materia vegetal/volumen de disolvente (1/12). Teniendo en cuenta los resultados se puede plantear que si bien hay diferencias en el contenido de mangiferina al finalizar el estudio, el valor se encuentra dentro de los intervalos de concentración de mangiferina permitidos en esquema tecnológico en la producción del ECAM.
Estos resultados indican que no hay degradación de los componentes de la corteza, en particular de mangiferina, en las 2 condiciones de almacenamiento estudiadas. No obstante, se recomienda procesar la corteza de Mangifera indica L. antes de los 30 d de almacenamiento para evitar que la carga microbiana que aparece después de este tiempo, contribuya al deterioro del material vegetal.
REFERENCIAS BIBLIOGRAFICAS
1. Wauthoz N, Balde A, Balde ES, Van Damme M, Duez P. Ethnopharmacology of Mangifera indica L. and pharmacological studies of its main c-glucosylxanthone, mangiferin. Intl J Biomed Pharma Sci. 2007;1(2):112-9.
2. Núñez-Sellés A, Vélez-Castro H, Agüero-Agüero J, González-González J, Nadeo F, de Simoni F, et al. Isolation and quantitative analysis of phenolic constituents, free sugars, and polyols from mango (Mangifera indica L.) stem bark aqueous decoction used in Cuba as nutritional supplement. J Agric Food Chem. 2002;50:762-6.
3. Guevara-García M, González-Laime S, Álvarez-León A, Riaño-Montalvo A, Garrido-Garrido G, Núñez-Sellés AJ. Uso etnomédico de la corteza de Mangifera indica L. en Cuba. Rev Cubana Plant Med. 2004:9:1-9.
4. Miura T, Ichiki H, Hashimoto I, Iwamoto N, Kato M, Kubo M, et al. Antidiabetic activity of a xanthone compound, mangiferin. Phytomed. 2001;8:85-7.
5. Guha S, Ghosal S, Chattopadhyay U. Antitumor, immunomodulatory and anti-HIV effect of mangiferin, a naturally occurring glucosylxanthone. Chemotherapy. 1996;42:443-51.
6. Zhu XM, Song JX, Huang ZZ, Wu YM, Yu MJ. Antiviral activity of mangiferin against herpes simplex virus type 2 in vitro. Chung Kuo Yao Li Hseh Pho. 1993; 14: 452-4.
7. Sato T, Kawamoto A, Tamura A, Tatsumi Y, Fujii T. Mechanism of antioxidant action of Pueraria glycoside (PG)-1 (an isoflavonoid) and mangiferin (a xanthonoid). Chem Pharm Bull (Tokyo). 1992;40:721-4.
8. Amaro D, Acosta J, Hernández N, Gago A. Informe Técnico de proyecto. Centro de Química Farmacéutica: Oficina Secreta; 1998.
9. Acosta-Esquijarosa J, Jáuregui-Haza U, Amaro-González D, Sordo-Martínez L. Spray drying of aqueous extract of Mangifera indica L (Vimang®): Scale up for the Process. WASJ. 2009;6(3):408-12.
10. Hung BR. Obtención de celulosa a partir de materiales lignocelulósicos empleando una cepa de hongo Trichoderma viride 13. [Tesis en opción al titulo de Doctor en Ciencias Biológicas]. Oficina secreta del Centro Nacional de Investigaciones Científicas (CNIC). La Habana, Cuba; 1986.
11. Acosta-Esquijarosa J, Nuevas-Paz L, Amaro-González D, Álvarez-León JC. Estudio del proceso de lixiviación de la corteza vegetal de Mangifera indica L. Lat Am J Pharm. 2009;28(1):27-31.
12. Rivera DG, Hernández I, Merino N, Luque Y, Alvarez A, Martín Y, Amador A, Nuevas L, Delgado R. Mangifera indica L. extract (Vimang) and mangiferin reduce the airway inflammation and Th2 cytokines in murine model of allergic asthma. J Pharm Pharmacol. 2011;63(10):1336-45.
13. Norma Cubana NC 26-126. Medicamentos no estériles. Límites microbianos; 1992.
14. Brizuela AL. Microbiología general. La Habana, Cuba: Editorial Pueblo y Educación; 1986.
Recibido: 29 de marzo de 2010.
Aprobado: 23 de enero de 2012.
Lauro Nuevas-Paz. Laboratorio de Genética Bioquímica, Centro Nacional de Genética Médica. Calle 146 esq. 31. Cubanacán, Playa. CP 11600. La Habana, Cuba. Correo electrónico: lauro@cngen.sld.cu