Introducción
Hasta hace poco era imposible salvar la vida de un niño con leucemia linfoblástica aguda (LLA), pero gracias al estudio de las células madres embrionarias, que son el equivalente al barro en las manos de un alfarero hábil, tienen el potencial de producir prácticamente cualquiera de los más de 200 tipos de células que conforman el ser y, por tanto, ya es posible redimir a los pacientes de esta mortal enfermedad.1
En la etapa infantojuvenil el cáncer es muy poco frecuente a escala mundial y su incidencia representa entre 1,5-2 % de todas las neoplasias malignas diagnosticadas cada año, incluidas las de adultos. En Cuba aparecen como promedio 300 casos nuevos por año en dicha etapa, con fluctuaciones anuales.2)
Las leucemias son procesos neoplásicos del tejido hematopoyético de naturaleza clonal, caracterizadas por ausencia de la regulación fisiológica con anomalías en la proliferación de los leucocitos y de los mecanismos de apoptosis. Se originan en la médula ósea y su evolución sin tratamiento es uniformemente fatal.3
Hay diversas formas de clasificación que se complementan, pero lo primero es el tipo de célula predominante. En relación con la morfología se dividen en linfoides (las más frecuentes) y mieloides, de manera que puede plantearse si se trata de una leucemia aguda o crónica de acuerdo con las características morfológicas y el grado de maduración celular. En la etapa infantojuvenil generalmente son agudas ya sean linfoides o mieloides (LMA), con cerca de 80 y 15 % del total, respectivamente.4,5
La LLA es la enfermedad maligna más frecuente en la infancia y representa 23 % de los diagnósticos de cáncer en niños menores de 15 años. Esta se presenta con una incidencia anual de 31 por millón de niños. Aproximadamente 2 400 niños y adolescentes menores de 20 años son diagnosticados con LLA cada año en los Estados Unidos, aunque existe un aumento marcado de la incidencia en los de 2-3 años de edad (más de 80 por millón de niños por año), con tasas que disminuyen a 20 por millón de menores entre 8-10 años de edad; asimismo, la incidencia de LLA en pacientes de 2-3 años de edad es aproximadamente 4 veces mayor que entre los menores de 2 años y casi 10 veces mayor que entre los de 19 años de edad. Debido a razones inexplicables, la incidencia de LLA en niños blancos es mucho más alta que en los negros, es decir, casi 3 veces mayor en niños de 2-3 años blancos que negros.1-3
Según los datos del Registro Nacional de Cáncer de Cuba, la LLA representa 37 o 38 % de las neoplasias en la infancia y cada año se diagnostican entre 3 y 4 nuevos enfermos por cada 100 000 niños menores de 18 años.5
A pesar de los avances terapéuticos alcanzados, la LLA sigue teniendo un peso importante en la mortalidad del niño mayor de un año. Al respecto, se han identificado numerosos factores al comienzo de la enfermedad, los cuales pueden contribuir a predecir la evolución y el pronóstico.2-4
Para la mayoría de los autores, la edad y la cifra de leucocitos son las alteraciones clínicas y hematológicas más importantes, pero los progresos obtenidos en los últimos años en relación con la inmunología, la citogenética y la biología molecular han permitido definir con más exactitud los distintos grupos de riesgo, aunque también resulta importante la respuesta temprana al tratamiento analizada según diversos parámetros.1,5
La supervivencia es conceptualmente la probabilidad de estar vivo en un tiempo "t" transcurrido desde el diagnóstico, el inicio del tratamiento o la remisión completa para un grupo de pacientes.6
A menudo, en estudios clínicos los tiempos de supervivencia se refieren al tiempo de muerte, al desarrollo de un síntoma particular o a la recaída después de la remisión completa de una enfermedad. Como fracaso se entiende la muerte, la recaída o la incidencia de una nueva enfermedad; sin embargo, en las investigaciones médicas, el evento de interés es usualmente algo no deseado, por ejemplo, la muerte, por lo que el interés científico no se corresponde con el clínico.6
En Cuba, el cáncer es la principal causa de muerte por enfermedad entre los pacientes ente 1-18 años de edad, con predominio del originado en el sistema linfohematopoyético, sobre todo la leucemia. Según datos estadísticos del Ministerio de Salud Pública, ha ocurrido un descenso de la mortalidad por este tipo de cáncer en la etapa infantojuvenil y, por consiguiente, un aumento de la sobrevida.7 Por tanto, la supervivencia de pacientes con leucemia linfoblástica aguda en el Hospital Infantil Docente Sur Dr. Antonio María Béguez César de Santiago de Cuba sirvió de motivación a los autores para desarrollar el presente estudio.
Métodos
Se realizó un estudio descriptivo y retrospectivo de 65 pacientes menores de 19 años atendidos en el Servicio de Hematología del Hospital Infantil Docente Sur Dr. Antonio María Béguez César de Santiago de Cuba en el período 2001-2005, pero seguidos evolutivamente hasta diciembre de 2015, con el objetivo de describir algunos parámetros relacionados con la supervivencia de este grupo poblacional.
Todos los pacientes que presentaron los criterios clínicos y de laboratorio para LLA fueron elegibles, independientemente de las características de presentación.
Para cumplir con el objetivo propuesto se informó a los padres o tutores de los niños leucémicos sobre el estudio en cuestión, quienes dieron su consentimiento informado para incluirlos en el estudio.
Para la obtención de los datos se revisaron las historias clínicas individuales de los niños, que fueron evaluados por los autores mediante un formulario que contenía las variables a investigar. Para obtener mayor confiabilidad, los propios autores llenaron dicho formulario, para lo cual utilizaron 4 horas semanales. La información obtenida se procesó estadísticamente con el programa Excel. Se utilizó el porcentaje como medida de resumen para las variables cualitativas y se comparó mediante el análisis de la prueba de Ji al cuadrado, con un intervalo de confianza de 95 %.
Resultados
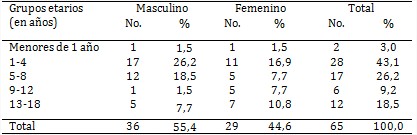
Del total de pacientes con leucemia linfoblástica aguda (tabla 1) predominaron el sexo masculino (55,4 %) y el grupo etario de 1-4 años, seguido por el de 5-8 (43,1 y 26,2 %, respectivamente).
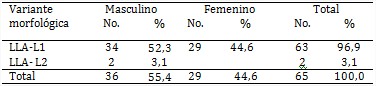
Como se muestra en la tabla 2, prevaleció la LLA del grupo L1 con 63 pacientes (96,9 %), seguida por la del L2 (3,1 %). No hubo diferencia estadísticamente significativa entre ambas variantes morfológicas (p<0,3); asimismo, no se diagnosticaron enfermos en el grupo L3, por lo cual esta variante no se tendrá en cuenta en las tablas restantes.
Para conocer la remisión después de la primera fase de inducción (tabla 3), el día 33 de tratamiento se realizó un medulograma a 59 pacientes, de los cuales 53 presentaban la médula en M1 (89,8 %); 4 en M2 y 2 en M3 (6,8 y 3,4 %, respectivamente). Durante este período fallecieron 6 pacientes por lo que no se realizó medulograma evolutivo. Los que presentaron la médula en M3 fallecieron por resistencia al tratamiento y de los que tenían la médula en M2, solo 2 se encuentran vivos y los otros 2 fallecidos (1 por presentar complicaciones relacionadas con el tratamiento y 1 por recaída de la enfermedad). Por su parte, de los 53 pacientes donde se encontró la médula en M1, 30 viven y 23 fallecieron (20 por recaída y 3 por recaída, además de complicaciones con el tratamiento).
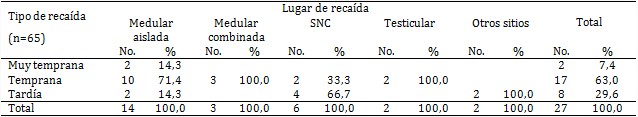
La evaluación de la remisión de la enfermedad (tabla 4) evidenció que 27 pacientes (41,5 %) presentaron recaídas durante el tratamiento y después de este: 14 con recaída medular aislada (2 muy temprana; 10 temprana y 2 tardía). En 3 pacientes las recaídas fueron medular combinada temprana, 6 en el sistema nervioso central (SNC), con 2 de ellas tempranas y 4 tardías, así como 2 en los testículos (de forma temprana) y 2 en otras localizaciones (de forma tardía).
De los pacientes con recaída medular aislada, 13 fallecieron y 1 se encuentra en tratamiento por recaída (en estos momentos en estadio terminal), de los que presentaron recaídas en el SNC, 2 viven y el resto de la recaída testicular, medular combinada y otros sitios fallecieron.
El incremento de la supervivencia y las posibilidades reales de curación de los niños con LLA ha hecho que se preste más atención a los efectos de su tratamiento a largo plazo.
Los integrantes del estudio recibieron 2 protocolos de tratamiento, a saber: más de 50 % fue tratado con ALL-IC-BFM-96 y los restantes con ALL-IC-BFM-02. En la tabla 5 se observa que del total de niños con LLA de esta casuística, sobreviven 32 (49,2 %) y fallecieron 33 (50,8 %), pues más de la mitad de los pacientes fueron tratados con el protocolo de 1996, vigente al momento del diagnóstico, además 41,5 % hizo recaída de la enfermedad (factor de mal pronóstico).
De los pacientes tratados con el protocolo ALL-IC-BFM-96 (43, para 66,2 %), sobreviven 19 (44,2 %) y 41,9 % de estos pertenecen al grupo de riesgo intermedio; mientras que de aquellos que recibieron el protocolo ALL-IC-BFM-02 (22, para 33,8 %), sobreviven 13 (59,1 %), de los cuales 31,9 % se encuentran en el grupo de riesgo intermedio, igual que los resultados de los grupos de riesgo del protocolo anterior.
Las diferencias observadas en el porcentaje de sobrevida son significativas (p<0,01), lo que demuestra que el comportamiento en los 2 grupos no fue homogéneo en relación con el tipo de protocolo utilizado.
Discusión
El predominio del sexo masculino en esta serie coincide con lo descrito en otros estudios consultados.1-3) En la actualidad, la mayoría de los niños y adolescentes con LLA tienen cura, debido al uso combinado de gran variedad de agentes quimioterápicos, la intervención quirúrgica y la radioterapia. Teniendo en cuenta todas las enfermedades malignas en la niñez, el nivel de supervivencia a los 5 años de ser diagnosticado se sitúa en 70 %.1
Al respecto, en estudios efectuados en México, mostró que los pacientes tenían edades comprendidas entre 1 y 5 años cuando se les diagnosticó el cáncer hematológico.2,3 En el Instituto de Hematología e Inmunología de la Habana se observó una mayor incidencia en el grupo de 2-5 años (52,9 %) y un ligero predominio del sexo masculino (49, para 53,3 %) con respecto al femenino (38, para 43,7 %).3) Similar fue la distribución de los pacientes con LLA según la edad y el sexo comunicada por otros autores.4
Existen técnicas de coloración supravital, con las cuales se puede clasificar alrededor de 95 % de las leucemias agudas. En 1975 hubo un acuerdo entre morfólogos de diferentes países, que dio origen a la Clasificación franco-americana-británica, la cual dividió las LLA en 3 grupos: L1, L2 y L3. El tipo L1 es de mejor pronóstico por la mayor madurez de las células; mientras que el L3 el de peor pronóstico, debido a una mayor inmadurez celular. Después de esta clasificación se añadieron modificaciones que han tratado de incorporar los hallazgos del inmunofenotipo y las alteraciones citogenéticas y moleculares.5
La variedad más frecuente es la L1, los linfoblastos son pequeños, con escaso citoplasma, nucléolos no visibles o de difícil visualización y aspecto monomorfo de la médula ósea. Se señala que en la L2 el pronóstico es peor, pues tiene mayor actividad proliferativa, aunque en realidad el pronóstico depende de múltiples factores y no solo de la morfología. No hay una relación entre estos 2 subtipos y el resto de las formas de clasificación, salvo en la L3 que constituye menos de 3 % de las LLA y que se asocia con marcadores de células B maduras.5,8,9
En la presente investigación, la distribución de los diferentes subtipos de LLA en el niño es similar a la que se observa en países como Inglaterra, Estados Unidos, Italia, Alemania Taiwán, Australia, en niños blancos de Sudáfrica, así como en niños mexicanos y caucásicos chilenos.10,11) En tanto, otros autores también hacen referencia a la primacía de la variedad L1 (98,8 %) sobre la L2 (1,2 %).3,4
Muchas personas no son diagnosticadas porque algunos de los síntomas de LLA son inespecíficos y pueden relacionarse con otras enfermedades. Por este motivo, algunos autores predicen que al menos una quinta parte de los pacientes con leucemia aún no han sido diagnosticados.6
La primera fase del tratamiento de la LLA se denomina inducción, se realiza con el propósito de obtener inicialmente la remisión de la enfermedad. Aunque con la combinación de vincristina (VCR) y prednisona (p) se puede obtener la remisión inicial, en aproximadamente 85 % de los afectados, la adición de L-asparaginasa (L-asa) o daunorrubicina (DNR) hace que el porcentaje sea de 95 % o más y se prolongue la duración de la remisión. No está comprobado que la administración de un medicamento más sea útil en los pacientes de bajo riesgo. Los pacientes que no responden a este tratamiento tienen muy mal pronóstico.5
En un estudio similar se obtuvo que 100 niños lograron remisión completa en el período de inducción, es decir con la médula en M1; 7 en M2 y 2 en M3. No se informaron muertes durante este período,12 lo cual no coincide con los resultados de la presente casuística.
El tratamiento exitoso de los niños con leucemia linfoblástica aguda consiste en controlar la médula ósea y la enfermedad sistémica, así como la prevención de la enfermedad en primer lugar, particularmente en el SNC. La piedra angular de esta estrategia es la quimioterapia combinada, administrada sistemáticamente con terapia preventiva al SNC, la cual se logra con quimioterapia intratecal o dosis elevada sistémica y en algunos casos, irradiación craneal.5,8
Varios autores y grupos cooperativos9-11) han encontrado entre 15-20 % de recaídas tardías en pacientes con una larga supervivencia; asimismo, estudios realizados en Colombia y Estados Unidos muestran resultados similares a los de la presente investigación, donde el sitio más común de recaída fue la médula ósea.10,11
La poliquimioterapia y la radioterapia pueden originar secuelas orgánicas relacionadas con el crecimiento y desarrollo, la capacidad intelectual, la función cardiopulmonar y la función gonadal, además de neoplasias atribuibles a ello y afectaciones en distintos aparatos y sistemas. (11,12
Un indicador importante para predecir la curación de la LLA es determinar la proporción de pacientes que permanecen en remisión completa una vez concluida la quimioterapia, mediante un seguimiento a largo plazo. Desde hace varios años distintos autores han publicado numerosas series de pacientes tratados por LLA con larga supervivencia.11
Se concluye que la leucemia linfoblástica aguda en pacientes menores de 19 años de edad, considerada hasta hace unas décadas como incurable, presenta en el territorio una alta sobrevida, relacionada con la aplicación de protocolos de tratamientos modernos e integracionistas.
Se recomienda extender la investigación a pacientes de este grupo poblacional con otros tipos de leucemias a fin de conocer la supervivencia global en esta provincia.