Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Endocrinología
versión On-line ISSN 1561-2953
Rev Cubana Endocrinol v.16 n.3 Ciudad de la Habana sep.-dic. 2005
Hospital Clinicoquirúrgico "Hermanos Ameijeiras"
Síndrome metabólico en familiares de primer grado de pacientes con diabetes mellitus tipo 2
Dr. Raúl Orlando Calderín Bouza,1 Dr. Miguel Angel Yánez Quesada,1 Dra. Ileana Márquez Pérez2 Dr. Gerardo Senra Piedra,3 Dr. Reinaldo Denis de Armas,4 Dr. Adalberto Infante Amorós,5 Dra. Ana del Carmen Argüelles Zayas,6 Dr. Neraldo Orlando González,7 Dra. Marelis Yánez Quesada8 y Dr. Marcos Albert Cabrera9
Resumen
Se realizó un estudio descriptivo y transversal de 340 personas divididas en 2 grupos, con y sin antecedentes patológicos familiares de diabetes mellitus tipo 2 (APF de DM2), con el objetivo de detectar si las que presentaban APF de DM2 tenían más hiperinsulinemia, presencia de síndrome metabólico, factores de riesgo cardiovascular asociados y lesión de órganos diana, expresados en hipertrofia del ventrículo izquierdo de los sujetos que no tenían dicho antecedente. Se obtuvo como resultado que la hiperinsulinemia estuvo presente en 96 pacientes con APF de DM2 (56,5 %) y una significación de p = 0,001. El síndrome metabólico fue más frecuente en las personas con APF DM2 (90) para un 52,9 % y una significación de p = 0,000. La hipertrigliceridemia fue el marcador por excelencia del síndrome metabólico y el factor de riesgo que con más significación estadística se asoció a los sujetos con APF de DM2 (96: 52,9 % y una significación de p = 0,000). La hipertrofia ventricular izquierda (HVI) se asoció como expresión de lesión de órganos diana a los sujetos con APF de DM2 (36: 21,2 % y una significación de p = 0,043). Concluimos que los sujetos con APF de DM2 son más propensos a tener hiperinsulinemia, al síndrome metabólico, a factores de riesgo cardiovascular y a lesión de órgano diana en comparación con los que no tienen dicho antecedente.
Palabras clave: Diabetes mellitus, síndrome metabólico, resistencia a la insulina, hiperinsulinismo.
La diabetes mellitus tipo 2 es una enfermedad que se asocia a un riesgo incrementado de enfermedad coronaria y en la actualidad está adquiriendo el rango de pandemia en la mayoría de los países desarrollados.1 Estudios epidemiológicos han demostrado que la resistencia a la insulina y la constelación de alteraciones metabólicas asociadas, como la hipertensión arterial, la obesidad y la hipercoagulabilidad, influyen en la prematuridad y severidad de la aterosclerosis que desarrollan los pacientes con diabetes mellitus tipo 2.1-3 La relación entre la resistencia a la insulina y el proceso aterogénico es directa y muy compleja. Es probable que la complejidad derive de la interacción que existe entre genes predisponentes a la resistencia a la insulina y otros que de forma independiente regulan el metabolismo lipídico, el sistema de coagulación y la biología de la pared arterial.4,5 Con el desarrollo de la biología molecular hemos podido apreciar que mecanismos inmunológicos e inflamatorios subyacen al proceso de la resistencia a la insulina y de la aterosclerosis.5,6 Hoy día conocemos que el factor de trascripción nuclear kappa-beta regula la expresión de los genes que codifican proteínas proinflamatorias, clave en el desarrollo de la placa de ateroma, y que en el estado de resistencia a la insulina existen múltiples factores activadores que pueden explicar la precocidad y severidad del proceso aterogénico.5-8
La intolerancia a la glucosa y la diabetes mellitus tipo 2 se asocian con frecuencia a la obesidad, la hipertensión arterial, las dislipidemias, la microalbuminuria y la cardiopatía isquémica, mientras el denominado síndrome metabólico (SM) constituye la agrupación de varias de estas entidades.9-11
La resistencia a la acción de la hormona insulina se considera uno de los factores etiopatogénicos fundamentales del SM, ya que está presente en todas loas entidades que lo componen, puede preceder en décadas su aparición y es un predictor de su desarrollo.11-13 La elevada prevalencia del SM y la morbilidad y mortalidad asociadas a este han motivado su inclusión en la lista de prioridades de las políticas de salud de países desarrollados.14-16
Diversos estudios han demostrado que una intervención temprana mediante modificación de los hábitos alimentarios, el incremento de la actividad física y/o fármacos puede modificar favorablemente la historia natural del SM, evitando su aparición o retardando su progresión y, de esta forma, hacemos prevención de la diabetes mellitus tipo 2 y de las complicaciones cardiovasculares que con él se relacionan.17-20 Por lo antes planteado, se hace evidente que nuestro problema científico es el siguiente: ¿Existe un incremento de la prevalencia del síndrome metabólico y daño vascular en los familiares de primer grado de diabéticos tipo 2? El interés de conocer esta respuesta radica en que los familiares de primer grado de los pacientes con diabetes mellitus tipo 2 presentan un riesgo elevado de desarrollar diabetes mellitus y otros componentes del SM a lo largo de la vida 21-24 y constituyen uno de los grupos en los que deberían plantearse intervenciones de tipo preventivo. Estas intervenciones deberían ser tempranas, ya que nuestro segundo problema radica en el siguiente cuestionamiento: ¿Cuántos de estos pacientes presentan otros factores de riesgo cardiovascular y/o lesión de órgano diana en el momento del diagnóstico? Este interés responde a que muchos pacientes con intolerancia a los hidratos de carbono y con diabetes mellitus presentan, en el momento del diagnóstico de los criterios del SM, otros factores de riesgo cardiovascular y lesión de órgano diana, expresado en hipertrofia ventricular izquierda y cardiopatía isquémica,14,25-27 pero no tenemos idea de cuántos de los pacientes con síndrome metabólico y familiares de primer grado diabéticos, excluyendo a los que ya son intolerantes a los hidratos de carbono y diabético, tienen también al momento del diagnóstico la presencia de otros factores de riesgo cardiovascular y/o la presencia o no de lesión de órgano diana, ya que estas intervenciones deberían ser selectivas también porque el porcentaje de familiares de diabéticos con riesgo de desarrollar el SM probablemente no alcanza el 40 por ciento.14,25-28 La importancia del SM consiste en que aquellas personas que lo presenten pueden, además de llevar los diagnósticos de hipertensión arterial, obesidad, dislipidemia y microalbuminuria, tener un estado protrombótico y proinflamatorio generalizado,15,16,20-22 lo que representa un alto riesgo vascular expresado en forma de cardiopatía isquémica y de enfermedad cerebrovascular, como se ha demostrado en importantes estudios longitudinales.23-25 La cardiopatía isquémica es la principal causa de muerte en pacientes con diabetes mellitus tipo 2, pero resulta que también lo es para los pacientes que cumplan con los criterios de síndrome metabólico.5,26-29 Existen evidencias de que los pacientes diabéticos que no han sufrido un síndrome coronario agudo tienen el mismo riesgo de padecerlo que aquellos no diabéticos que lo han sufrido previamente.5,26-28 Esto sugiere que, subyacente a la diabetes mellitus, puede existir una extensa aterosclerosis coronaria sin una obvia manifestación clínica. Además, el riesgo de muerte por un acontecimiento cardiovascular en los pacientes diabéticos es de 2 a 4 veces mayor que en la población no diabética.5,26-28 Este exceso de la mortalidad es más elevado en mujeres (4 a 5 veces) que en varones (2 a 3 veces).5,26-28 Por estos motivos, la American Heart Association considera la DM no como un simple factor independiente de riesgo, sino como una verdadera enfermedad cardiovascular.1,5 Teniendo en cuenta la asociación de la resistencia a la insulina y el SM con los familiares de primer grado de pacientes con diabetes mellitus y sus implicaciones de daño vascular (DV), expresado como cardiopatía isquémica y enfermedad cerebrovascular resultante del síndrome referido,25-28 nos planteamos como objetivo de esta investigación determinar la frecuencia de hiperinsulinemia y síndrome metabólico en familiares de primer grado de pacientes con diabetes mellitus tipo 2 e identificar si existe mayor correlación de factores de riesgo en estos pacientes que justifique por qué tienen más lesiones de órgano diana y mayor morbimortalidad que los sujetos sin historia de DM2.
Métodos
Para la realización de esta investigación descriptiva y transversal se tomó una muestra de 340 pacientes, escogidos al azar, en 2 grupos de sujetos: uno con antecedentes patológicos familiares de pacientes con diabetes mellitus tipo 2 (170 pacientes) y otro sin dicho antecedente, comparables en el número de sujetos a estudiar, la edad, el sexo y el índice de masa corporal, que acudieron a la consulta de medicina interna del Hospital "Hermanos Ameijeiras", consecutivamente entre el primero de septiembre de 2003 y el 30 de abril de 2004 procedentes de su área de salud, y que cumplían con los siguientes criterios:
Criterios de inclusión
- Que acudieran por primera vez a la consulta de medicina interna.
- Que el motivo de consulta fuera realizarse chequeo médico.
- Conformidad por escrito con la realización del estudio.
- Edad comprendida entre 15 y 59 años.
Criterios de exclusión
- Tratamiento con sedantes, antihistamínicos, opiáceos, medicamentos hormonales y esteroideos.
- Tratamiento con IECAS, alfa bloqueadores y beta bloqueadores.
- Pacientes que recibían fármacos hipolipemiantes.
- Sepsis.
- Infarto agudo del miocardio reciente (menos de 3 meses).
- ECV de menos de 3 meses de evolución.
- Hemorragia digestiva reciente ( menos de 3 meses).
- Diabetes mellitus.
- Intolerancia a los hidratos de carbono.
- Enfermedad renal.
- Enfermedad hepática.
- Enfermedad endocrina.
- Hipertensión arterial secundaria.
A todos los pacientes que cumplieron con los criterios de inclusión se les realizó el interrogatorio y el examen físico mediante el método clínico, y además se les realizaron algunos estudios complementarios necesarios (PTG de 2 h con determinación de glicemia e insulinemia en ayunas y a las 2 h, colesterol, triglicéridos, HDL colesterol, fibrinógeno, ácido úrico y ecocardiograma). Se clasificaron los pacientes en 2 grupos: el primero compuesto por los sujetos que tienen antecedentes patológicos familiares de pacientes con diabetes mellitus tipo 2 y el segundo constituido por el resto de los sujetos que no tenían dicha condición.
Se clasificó a los pacientes como hipertensos esenciales según los criterios del VII informe del Comité Conjunto Norteamericano sobre Detección, Evaluación y Tratamiento de la HTA (JNC'VII).30
A todos los pacientes se les realizó un test de tolerancia a la glucosa oral (PTG-oral) con dosificación de insulinemia basal y a las 2 h, siguiendo las normas de la American Diabetes Association (ADA).31 El resultado de la prueba de la tolerancia a la glucosa se evaluó de la siguiente forma:
- Pacientes con síntomas clínicos de diabetes mellitus y glucosa plasmática en ayunas igual o mayor a 7 mmol/L y/o glucosa plasmática de 2 h mayor o igual a 11,1 mmol/L fueron considerados diabéticos al realizarle la prueba en una sola oportunidad .9
- Pacientes sin síntomas clínicos de diabetes mellitus, con glucosa plasmática en ayunas igual o mayor a 7 mmol/L y/o glucosa plasmática de 2 h mayor o igual a 11,1 mmol/L, fueron considerados diabéticos al realizarles la prueba en 2 oportunidades.9
- Pacientes sin síntomas clínicos de diabetes mellitus, con glucemia en ayuna menor de 7 mmol/L y la glucemia a las 2 h después de administrarle al paciente 75 g de glucosa monohidratada de 7,8 a 11 mmol/L, fueron considerados intolerantes a los hidratos de carbono al realizarles la prueba en 2 oportunidades.9
- Pacientes con síntomas clínicos de diabetes mellitus, con glucemia en ayuna menor de 7 mmol/L y la glucemia a las 2 h después de administrarle al paciente 75 g de glucosa monohidratada de 7,8 a 11 mmol/L, fueron considerados intolerantes a los hidratos de carbono al realizarles la prueba en una oportunidad.9
- Los casos que tuvieron una prueba de tolerancia a la glucosa con glucemias en ayunas menor de 7 mmol/L y glucemias a las 2 h menores de 7,8 mmol/L se consideraron como pacientes con una prueba de tolerancia a la glucosa oral normal.9
- Los pacientes con glucemia en ayunas de 6,1 a 6,9 mmol/L y a las 2 h de administrar la glucosa la glucemia era menor a 7,8 mmol/L fueron considerados como pacientes con glucemia en ayunas alterada.9
Se consideró hiperinsulinismo en aquellos pacientes que tenían una insulina en ayunas ³ 13 mU/L y/o ³ 52 mU/L a las 2 h de administrados los 75 g de glucosa monohidratada.29 y/o un índice HOMA ³ 3,8.29 El índice HOMA fue calculado por la siguiente fórmula:9,29
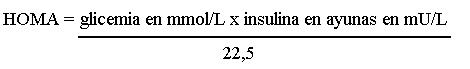
De acuerdo con estos resultados, se clasificaron en pacientes portadores o no de síndrome metabólico, con el uso de la clasificación de la OMS modificada en 1999.32
La dislipidemia fue definida como las concentraciones elevadas de colesterol plasmático mayor de 5,2 mmol/L y/o de triglicéridos plasmáticos (mayor o igual a 1,7 mmol/L) y/o concentraciones bajas de HDL-colesterol (menor 0,9 mmol/L en los hombres y menor de 1,0 mmol/L en las mujeres), mientras la obesidad fue considerada en aquel paciente que presentaba un índice de masa corporal (IMC) elevado (mayor o igual a 30 kg/m2) y/o una elevada proporción del índice cintura cadera (WHR), mayor o igual a 0,90 en los hombres y mayor o igual a 0,85 en la mujeres). El índice de masa corporal fue hallado según la siguiente fórmula:29,30,32-34
![]()
El índice cintura-cadera se obtiene dividiendo la circunferencia de la cintura sobre la circunferencia de la cadera, la cual es utilizada como criterio de síndrome metabólico según la clasificación antes planteada.35 La hipertrofia de ventrículo izquierdo (HIV) se incluirá si cumple con los siguientes criterios electrocardiográficos de voltaje de Sokolow-Lyon (SV1 + RV5 o RV6 mayor o igual a 35 mm)36,37 o por estudio con ecocardiograma bidimensional, con el uso de un ecógrafo ALOKA, de fabricación japonesa, y se calculará la masa ventricular izquierda según las recomendaciones de la American Society of Echocardiography.37,38
Se procedió a identificar los factores de riesgo cardiovascular en los 2 grupos y a la comparación entre ellos. De igual forma, se determinó la lesión de órgano diana expresada en forma de hipertrofia ventricular izquierda en ambos grupos y luego se procedió a su comparación.
Análisis estadístico
Los datos se procesaron mediante el sistema estadístico SPS en su versión 10 y se emplearon medidas de resumen de estadística descriptiva para definir la prevalencia de la hipertensión arterial y de la hipertensión sistólica aislada, así como el grado de control de los hipertensos conocidos.
Se emplearon pruebas estadísticas para evaluar la asociación entre variables de interés (Chi cuadrado para cualitativas y t de Student para cuantitativas). Se consideró que existe diferencia significativa cuando la posibilidad asociada fue menor de 0,05.
Dos pacieentes se consideraron como pérdidas y no fueron sustituidos durante el período de captación, ya que se trasladaron de área de salud y abandonaron la investigación por su propia voluntad. La participación de los pacientes fue totalmente voluntaria.
Resultados
La tabla 1 muestra los datos generales de los pacientes estudiados. El total de la muestra fue de 340 pacientes y la edad promedio de 42,94 años. La tensión arterial sistólica (TSA) fue de 132,96 Mm. de Hg y la tensión arterial diastólica de 85,91 Mm de Hg.
El peso promedio de los pacientes estudiados fue de 77 kg y la talla de 162,83, lo que hace un IMC promedio de 29,04, que refleja que los pacientes estudiados están muy cercanos a dejar el sobrepeso y llegar a la obesidad. Sin embargo, la circunferencia promedio de la cintura (90,43 cm) sobre la de la cadera (97,96 cm) refleja un índice de cintura-cadera de 0,92. Según la clasificación de la OMS modificada, estos pacientes dejan de estar en sobrepeso y clasifican como obesos, a pesar de no llegar su IMC promedio a 30.
Tanto el promedio de la glicemia de ayunas como la de las 2 h eran normales, lo cual refleja que los pacientes estaban en estado normoglucémico. La insulinemia en ayunas promedio fue de 20,30, lo que muestra un estado hiperinsulinémico; la media de los uratos era normal, mientras que la del fibrinógeno fue relativamente alta; el valor promedio del colesterol fue normal y el de los triglicéridos estaba elevado.
Tabla 1. Datos generales
| N | Mínimo | Máximo | Media | Desviación estándar | |
| Edad | 340 | 16 | 59 | 42,94 | 9,93 |
| Tensión arterial sistólica | 340 | 90 | 230 | 132,96 | 20,54 |
| Tensión arterial diastólica | 340 | 60 | 140 | 85,91 | 12,07 |
| Peso | 340 | 45,00 | 380,00 | 77,0029 | 24,8503 |
| Talla | 340 | 100,00 | 190,00 | 162,8324 | 10,0848 |
| Circunferencia cintura | 340 | 63,00 | 175,00 | 90,4324 | 13,2027 |
| Circunferencia cadera | 340 | 74,00 | 146,00 | 97,9647 | 12,7344 |
| Glicemia 1 | 340 | 3,00 | 8,00 | 4,2000 | 0,9962 |
| Glicemia 2 | 340 | 2,00 | 18,00 | 4,8941 | 2,2395 |
| Insulinemia 1 | 340 | 1,00 | 140,00 | 20,3088 | 21,7071 |
| Insulinemia 2 | 340 | 1,00 | 340,00 | 55,8853 | 63,0541 |
| Uratos | 340 | 106,0 | 673,0 | 280,859 | 104,427 |
| Fibrinógeno | 340 | 1,0 | 5,0 | 2,015 | 0,942 |
| Colesterol | 340 | 2,00 | 8,00 | 4,5824 | 1,2233 |
| Triglicéridos | 340 | 0,50 | 8,00 | 1,8809 | 1,3152 |
La tabla 2 muestra la comparación de la presencia de algunos factores de riesgo cardiovascular con la presencia o no de antecedentes patológicos familiares de DM2 (APF de DM2). La hiperinsulinemia estuvo presente en 96 pacientes con APF de DM2, para un 56,5 %, mientras que en los que no tenían APF de DM2, solo se reflejó en 65 sujetos para un 38,2 % (p = 0,001); la comparación de la hipercolesterolemia entre los 2 grupos de estudio no fue significativa (p = 0,895). Igualmente ocurrió con el fibrinógeno y la presencia o no de APF de DM2 (p=0,131); sin embargo, la comparación de la variable hipertrigliceridemia con la presencia o no de APF de DM2 mostró resultado estadísticamente significativo, ya que la hipertrigliceridemia se encontró en 96 pacientes con APF de DM2, para un 56,5 %, con una p=0,001. La hiperuricemia no tuvo significado estadístico cuando se comparó entre los 2 grupos estudiados.
Tabla 2. Comportamiento de algunos factores de riesgo cardiovascular en pacientes con y sin APF de DM2
| Colesterol | Triglicéridos | Uratos | Fibrinógeno | Insulinemia | |||||||||||||||||
| Normal | Alto | Normal | Alto | Normal | Alto | Normal | Alto | Normal | Alto | ||||||||||||
| # | % | # | % | # | % | # | % | # | % | # | % | # | % | # | % | # | % | # | % | ||
| APF | Sí | 134 | 78,8 | 36 | 21,2 | 74 | 43,5 | 96* | 56,5 | 135 | 79,4 | 35 | 20,6 | 15 | 8,8 | 155 | 91,2 | 74 | 43,5 | 96* | 56,5 |
| DM2 | No | 133 | 78,2 | 37 | 21,8 | 106 | 62,4 | 64 | 37,6 | 142 | 83,5 | 28 | 16,5 | 8 | 4,7 | 162 | 95,3 | 105 | 61,8 | 65 | 38,2 |
| Total | 267 | 78,5 | 73 | 21,5 | 180 | 52,9 | 160 | 47,1 | 277 | 81,5 | 63 | 18,5 | 23 | 6,8 | 317 | 93,2 | 179 | 52,6 | 161 | 47,4 | |
P = 0,895. * P= 0,001. P= 0,329. P= 0,131. * P= 0.001.
Cuando se compara la presencia de síndrome metabólico (SM) en ambos grupos (tabla 3), 90 pacientes con APF de DM2 tienen SM, para un 52,9 %, mientras que en los sujetos sin APF de DM2 la presencia de SM es solo de un 32,9. Existe una significación estadística de p=0,043.
Tabla 3. Comparación de la presencia de síndrome metabólico en los grupos de pacientes con y sin APF de DM2
| SM | Total | ||||
| Sí | No | ||||
| APFDM | Sí | # | 90* | 80 | 170 |
| % | 52,9 | 47,1 | 100,0 | ||
| No | # | 56 | 114 | 170 | |
| % | 32,9 | 67,1 | 100,0 | ||
| Total | # | 146 | 194 | 340 | |
| % | 42,9 | 57,1 | 100,0 | ||
* P=0,043.
Por último, la tabla 4 nos muestra la comparación de la presencia de hipertrofia ventricular izquierda, que se hace más evidente en el grupo con APF de DM2 (36 pacientes para un 21,2 %) con respecto a los que no tienen APF de DM2, en el que solo se detectó en 23 pacientes para un 13,5 %. Tuvo significación estadística p=0,043.
Tabla 4. Comparación de la hipertrofia ventricular izquierda en los grupos con y sin APF de DM2
| HVI | Total | ||||
| Sí | No | ||||
| APF de DM2 | Sí | # | 36* | 134 | 170 |
| % | 21,2 | 78,8 | 100,0 | ||
| No | # | 23 | 147 | 170 | |
| % | 13,5 | 86,5 | 100,0 | ||
| Total | # | 59 | 281 | 340 | |
| % | 17,4 | 82,6 | 100,0 | ||
P=0,043*.
Discusión
Nuestros sujetos presentan un índice de masa corporal cercano a la obesidad (dejan casi el sobrepeso), pero al utilizar el índice antropométrico de la cintura-cadera observamos que el valor medio es mayor a 0,90, lo que hace a estos pacientes obesos, según la clasificación de la OMS de 1998, modificada al año siguiente.9,14 Si tenemos en cuenta estudios anteriores que plantean que la obesidad predispone o se asocia a la hiperinsulinemia por resistencia a la insulina y que la empeora, mientras el valor del IMC se relaciona de manera directa y proporcional con la resistencia a la insulina e hiperinsulinemia,9-14 podemos justificar por qué nuestros resultados tienen valores de insulinemia en ayunas mayor de 13 mU/L, cifra que se escogió como valor donde comienza la hiperinsulinemia, ya que otros investigadores, como el grupo de Isomaa,14 demostraron que a ese valor de insulina en sangre, los pacientes tenían una incidencia aumentada de hiperinsulinemia, síndrome metabólico y lo que es más importante: que en seguimiento a largo plazo de estos casos (alrededor de 7 años promedio) ellos tenían 3 veces más morbimortalidad que los sujetos que no presentaban síndrome metabólico.14
Otros investigadores han reflejado en sus publicaciones que también los sujetos con antecedentes patológicos familiares de diabetes mellitus tipo 2 presentan más resistencia a la insulina, hiperinsulinemia y síndrome metabólico, como lo reflejan los resultados de esta investigación, cuando se compara al otro grupo conformado por sujetos sin antecedentes patológicos familiares de diabetes tipo 2.45-48 Las investigaciones mencionadas reflejan que no solo los sujetos con APF de DM2 tienen una predisposición de hasta un 40 % de presentar hiperinsulinemia por mayor resistencia a la insulina y síndrome metabólico concomitante, sino que al momento de su diagnóstico como portadores de síndrome metabólico tienen más factores de riesgo cardiovascular asociado que el grupo que no tiene APF de DM2.47 Se conoce que la hipertrigliceridemia, factor de riesgo cardiovascular asociado que resultó ser estadísticamente significativo en relación con los sujetos que presentan APF de DM2, es un marcador independiente de aterosclerosis, daño vascular y a la vez es un marcador para el diagnóstico de síndrome metabólico.14,22-25 Esta investigación tiene resultados muy parecidos a los de otros autores antes mencionados48-51 y además refleja que los sujetos con APF de DM2 tienen no solo más hiperinsulinemia, síndrome metabólico y factores de riesgo cardiovascular asociados, a su momento de diagnóstico, sino que además tienen mayor lesión de órgano diana, representada en nuestra investigación con la hipertrofia del ventrículo izquierdo. Los estimados de prevalencia de HVI dependen de los métodos utilizados para detectarla.36-38 Estudios epidemiológicos mediante electrocardiografía reportaron una prevalencia de 2,1 % (Framingham),22-28 mientras la ecocardiografía mostró que la prevalencia aumenta a un 16 %. La prevalencia de HVI se incrementa con la edad a un 25 % en el hombre y un 33,0 en la mujer después de los 65 años.22-28 Este incremento está ligado al aumento de la prevalencia de HTA con la edad. Estas razones antes planteadas hicieron que nuestro grupo de investigación excluyera para la realización de este trabajo a los sujetos mayores de 59 años. El desarrollo de la HTA es multifactorial, y aunque la HVI es común en la hipertensión severa, no existe una correlación lineal entre los niveles de TA y el desarrollo de esta. Nuestros sujetos estudiados tenían TAS y TAD medias por debajo de los valores en los que se consideran hipertensos a los pacientes, según el séptimo reporte.34 El monitoreo de la TA ambulatoria tiene una mayor correlación con la HVI porque es capaz de detectar la variabilidad de la TA a lo largo del día y muchos autores plantean dicha variabilidad con una mayor lesión de los órganos diana.34 Otros factores pueden contribuir al desarrollo de HVI, incluyendo agentes humorales como la norepinefrina y la angiotensina, influencias genéticas, viscosidad sanguínea, obesidad y otros elementos asociados al SM.22-28 Creemos que la principal etiopatogenia que está involucrada en los resultados obtenidos en la investigación es la presencia de una hiperinsulinemia por resistencia a la insulina con el síndrome metabólico asociado, que a la vez está muy influenciada, de manera directa, por la obesidad encontrada en nuestros pacientes estudiados. La HVI ha emergido como un poderoso factor pronóstico independiente para eventos cardiovasculares.37,38,48 Los pacientes con HVI tienen una incidencia aumentada de enfermedad cardiovascular (angina de pecho, IMA, arritmias ventriculares, ICC y muerte súbita). Cuando se detecta HVI por ECG se incrementa el riesgo de mortalidad por eventos cardiovasculares de 3 a 6 veces.
Los pacientes que presentan disfunción ventricular sistólica y/o diastólica detectada por ecocardiograma tienen un riesgo 3 a 4 veces mayor de accidente vascular encefálico. Estas evidencias confieren a la HVI un riesgo de muerte por enfermedad cardiovascular, independiente de la enfermedad coronaria. Esto también aumenta 14 veces el riesgo de ICC.22-28,37,48 En nuestro estudio se evidenció una asociación entre HVI y SM y sujetos con APF de DM2 (p=0,043). Esta aproximación pudiera explicar por qué existen elementos de SM que influyen en el desarrollo de HVI, aunque esta no forma parte de los criterios de SM considerados por la OMS.9,14,29 Sin embargo, encontramos una relación estadísticamente significativa entre HVI y sujetos con APF de DM2 e hiperinsulinemia y síndrome metabólico con estos, por lo que podemos inferir que la HVI constituye una lesión de órgano diana que se asocia a los sujetos con APF de DM2, a la hiperinsulinemia y al síndrome metabólico. Estos resultados también se evidencian en la literatura mundial.48-51
Concluimos que en pacientes con antecedentes patológicos familiares de DM2 son muy frecuentes la hiperinsulinemia, el síndrome metabólico, la hipertrigliceridemia como factor de riesgo cardiovascular y la lesión de órgano diana (hipertrofia ventricular izquierda).
Recomendaciones
Se debe estudiar y recomendar un seguimiento estrecho a los sujetos con antecedentes patológicos familiares de DM2 por la alta posibilidad de tener asociados hiperinsulinemia, síndrome metabólico, factores de riesgo cardiovascular al momento de su diagnóstico y más lesiones de órgano diana que los sujetos sin estos antecedentes patológicos familiares.
Summary
Metabolic syndrome in first degree relatives of patients with diabetes mellitus 2
A cross-sectional descriptive study of 340 persons assigned to two groups, with and without family history of diabetes mellitus type 2 (DM2), was carried out. The objective was to detect whether those persons with family history of DM2 had more hyperinsulemia, metabolic syndrome, associated cardiovascular risk factors and target organ lesions, expressed in left ventricle hypertrophy, than subjects without diabetes family history. The result was that hyperinsulemia was present in 96 patients with family history of DM2 (56,5 %) and significance level of p= 0,001. Metabolic syndrome was more frequent in subjects with family history of DM2 (90) for 52,9 % of cases and p= 0,000. Hypertriglyceridemia was both the most noticeable marker of the metabolic syndrome and the most statistically significant risk factor in subjects with family history of DM2 (96 , 52,9 % of cases and p= 0,000). Left ventricle hypertrophy was associated as target organ lesion expression to subjects with family history of DM2 (36: 21,2 % and p=0,043). It was concluded that subjects with family history of DM2 are more likely to have hyperinsulinemia, metabolic syndrome, cardiovascular risk factors and target organ lesions than those persons without such a family history of DM2.
Key words: diabetes mellitus, metabolic syndrome, insulin resistance, hyperinsulinism.
Referencias bibliográficas
1. Grundy SM, Benjamin IJ, Burke GL, Chait A, Eckel RH, Howard BV, et al. Diabetes and cardiovascular disease. A statement for health care professionals from American Heart Association. Circulation. 1999;100:1134-46.
2. Gaede P, Vedel P, Larsen N, Jensen VH, Parving HH, Pedersen O. Multifactorial intervention and cardiovascular disease in patients with type 2 diabetes. N Engl J Med. 2003;348:383-93.
3. Stanler J, Vaccano O, Neaton JD, Wenworth D. Diabetes mellitus and other risk factors and 12 year mortality for men screened in the multi risk factor intervention trial. Diabetes Care. 1993;10:434-44.
4. Hill JM, Zalos G, Halcox J, Schenke WH, Waclawiw MA, Quyyumi AA, Finkel T. Circulating endothelial progenitor cells, vascular function, and cardiovascular risk. N Engl J Med. 2003;348:593-600.
5. Sánchez-Recalde A, Kaski JC. Diabetes mellitus, inflamación y aterosclerosis coronaria: perspectiva actual y futura. Rev Esp Cardiol. 2001;54(6):751-83.
6. Sambola A, Osende J, Hacthcok J, Degen M, Nemerson Y, Fuster V, et al. Role of risk factors in the modulation of tissue factor activity and blood thrombogenicity. Circulation. 2003;107(7):973-7.
7. Bonetti PO, Lerman LO, Lerman A. Endothelial dysfunction: a marker of atherosclerotic risk. Artrioscler Thromb Vasc Biol. 2003;23(2):168-75.
8. Zamora A, Marrugat J. Pronóstico de los pacientes diabéticos con cardiopatía isquémica. Rev Esp Cardiol. 2002;55(7):751-62.
9. Alberti KGMM, Zimmet PZ. Definition, diagnosis and classification of diabetes mellitus and its complications. Part 1: Diagnosis and classification of diabetes mellitus, provisional report of a WHO consultation. Diabet Med. 1998;15:539-53.
10. Chatuverdi N. Differing aspects of insulin resistance in diabetes complications: The shape of things to come. RD Lawrence Lecture. 2000. Diabet Med. 2002;19(12):973-7.
11. Pratley RE, Weyer C. Progression from IGT to type 2 diabetes mellitus: the central role of impaired early insulin secretion. Curr Diab Rep. 2002;2(3):242-8.
12. Smith Sr, Ravussin E. Emerging paradigms understanding fitness and diabetes risk. Curr Diab Rep. 2002;2(3):223-30.
13. Bonora E, Kiechl S, Willeint J, Oberhollenzer F, Egger G, Tagher G, et al. Prevalence of insulin resistance in metabolic disorders: the Bruneck study. Diabetes. 1998;47:1643-9.
14. Isomaa B, Almgrem P, Tuomi T, Forsén B, Lhati K, Nissén M, et al. Cardiovascular morbility and mortality associated with the metabolic syndrome. Diabetes Care. 2001;24:683-9.
15. Expert panel on detection, evaluation and treatment of high blood cholesterol in adults (adult treatment panel III). Executive summary of the third report of the national cholesterol education program (NCEP). JAMA. 2001;285(19):2486-96.
16. Zapico E, Ordóñez J. Nuevas recomendaciones del national cholesterol education program (NCEP). Consecuencias en el laboratorio clínico. Práctica clínica y arterioesclerosis. Clínica e investigación en arterioesclerosis. 2002;14(5):272-6.
17. Lovejoy JC. The influence of dietary fat on insulin resistance. Curr Diab Rep. 2002;2(5):435-40.
18. Sathyaprakash R, Henry RR. Preventing diabetes by treating aspects of the metabolic syndrome. Curr Diab Rep. 2002;2(5):416-22.
19. Mullooly C. Cardiovascular fitness and type 2 diabetes. Curr Diab Rep. 2002;2(5):441-7.
20. Van Gaal LF, De Leew IH. Rationale and options for combination therapy in the treatment of type 2 diabetes. Diabetología. 2003;46(1):44-50.
21. Freeman Ms, Mansfield MW, Barrett JH, Grant PJ. Heritability of features of the insulin resistance syndrome in a community-based study of healthy families. Diabet Med. 2002;19(12):994-9.
22. Bouchard C, Perusse L. Genetics of causes and manifestations of the metabolic syndrome. In: Crepaldi G, Tiengo A, Manzato E (eds). Diabetes, obesity and hyperlipidemia: The plurimetabolic syndrome. Amsterdam. Elsevier Science.1993:67-74.
23. Meigs JB, D'Agostino RB, Wilson PWF, Copples LA, Nathan DM, Singer DE. Risk variable clustering in the insulin resistance syndrome: The Framinghan offspring study. Diabetes. 1997;46:1594-600.
24. Kannel WB. The Framinghan Study: ITS 50-year legacy and future promise. J Atheroscler Thromb. 2000;6(2):60-6.
25. Meigs JB, Mittleman MA, Nathan DM, Tofler GH, Singer DE, Murphy-Sheehy PM, et al. Hyperinsulinemia, hyperglicemia and impaired hemostasis: The Framingham offspring study. JAMA. 2000;283(2):221-8.
26. Cases A. Morbimortalidad cardiovascular en la diabetes mellitus tipo 2. Hipertensión. 2002;19(5):193-6.
27. Bueno H. Prevención y tratamiento de la cardiopatía isquémica en pacientes con diabetes mellitus. Puesta al día. Diabetes y enfermedades cardiovasculares. 2002;55(9):975-86.
28. Herranz L. Diabetes y aterosclerosis. El corazón diabético. 2000;8(19):1017-23.
29. Isomaa B, Almgrem P, Tuomi T, Forsén B, Lhati K, Nissén M, et al. Cardiovascular morbidity and mortality associated with the metabolic syndrome. Diabetes Care. 2001;24:683-9.
30. National Institutes of Health. (NIH). Publication No. 03-5233. May 2003.
31. American Diabetes Association. Standards of medical care for patients with diabetes mellitus. Diabetes Care. 2001;24(Suppl 1):S33-43.
32. Lorenzo C, Okoloise M, Williams K, Stern MP, Haffner SM. The metabolic syndrome as predictor of type 2 diabetes: the San Antonio heart study. Diabetes Care. 2003;26(11):3153-9.
33. Robin SJ. Cardiovascular disease with diabetes or the metabolic syndrome should statins or fibrates be first line lipid therapy? Curr Opin Lipidol. 2003; 14(6):575-83.
34. Bray GA, Champagne CM. Obesity and metabolic syndrome: Implications for dietetics practitioners. J Am Diet Assoc. 2004;104:86-9.
35. Mitchell BD, Zaccaro D, Wagenknecht LE, Scherzinger AL, Bergman RN, Haffner SM, et al. Insulin sensitivity, body fat distribution and family diabetes history: The IRAS family study. Obes Res 2004;12(5):831-9.
36. Vázquez Vigoa A, Vázquez Cruz A, Calderín RO, Buchaca EF, Cruz Álvarez NM, Jiménez Paneque R, et al. Metabolic syndrome in patients with essential hypertension. Nefrología. 2003;23(5):423-31.
37. Ninomiya JK, Italien GL, Criqui MH, Whyte JL, Gams TA, Chen RS. Association of the metabolic syndrome with history of myocardial infarction and stroke in the third national health and nutrition examination survey. Circulation. 2004;109:42-6.
38. Deveraux RB, Liebson PR, Horan MJ. Recommendations concerning the use of echocardiography in hypertension and general population research. Hypertension. 1987;9(11):97-104.
39. Von Clauss A. Acta Haemat. 1957;17:237.
40. Distamg G. Paths et Biol. 1960;8:1615.
41. Tietz NW. Clinical Guide to Laboratory Test. Philadelphia. WB Saunders. 1995.
42. Reaven GM. The insulin resistance syndrome. Curr Atheroscler Rep. 2003;5(5):364-71.
43. Meigs JB. Epidemiology of the insulin resistance syndrome. Current Diabetes Reports. 2003;3:73-9.
44. Mitchell BD, Zaccaro D, Wagenknecht LE, Scherzinger AL, Bergman RN, Haffner SM, et al. Insulin sensitivity, body fat distribution and family diabetes history: The IRAS family study. Obes Res. 2004;12(5):831-9.
45. Goran MI, Bergman RN, Avila Q, Watkins M, Ball GD, Shaibi GG, et al. Impaired glucose tolerance and reduced B-cell function in overweight latino children with a positive family history for type 2 diabetes. J Clin Endocrinol. Metab. 2004;89:207-12.
46. Cruz ML, Weigensberg J, Huang TTK, Ball G, Shaibi G, Goran M. The metabolic syndrome in overweight Hispanic youth and the role of insulin sensitivity. J Clin Endocrinol Metab. 2004;89:108-13.
47. Goldin LR, Camp NJ, Keen KJ, Martin LJ, Moslehi R, Ghosh S, et al. Analysis of metabolic syndrome phenotypes in Framingham heart study families from genetic analysis workshop 13. Genet Epidemiol. 2003;25(1):78-89.
48. Hauser ER, Mooser V, Crossman DC, Haines JL, Jones CH, Winkelmann B, et al. Design of the genetics of early onset cardiovascular disease (GENECARD) study. Genetics. Clinical investigations. Am Heart J. 2003;145:602-13.
49. Mitchell BD, Zaccaro D, Wagenknecht LE, Scherzinger AL, Bergman RN, Haffner SM, et al. Insulin sensitivity, body fat distribution and family diabetes history: The IRAS family study. Obes Res. 2004;12(5):831-9.
50. Robinson LE, Van Soeren MH. Insulin resistance and hyperglycemia in critical illness: role of insulin in glycemic control. AACN Clin Issues. 2004;15(1):45-62.
51. Ahren B, Pacini G. Importance of quantifying insulin secretion in relation to insulin sensitivity to accurately assess beta cell function in clinical studies. Eur J Endocrinol. 2004;150(2):97-104.
Recibido: 4 de julio de 2005. Aprobado: 23 de agosto de 2005.
Dr. Raúl Orlando Calderín Bouza. Hospital Clinicoquirúrgico "Hermanos Ameijeiras". Ciudad de La Habana, Cuba.
1 Especialista de I Grado en Medicina Interna.
2 Especialista de I Grado en Endocrinología. Hospital Tarará.
3 Especialista de I Grado en Cardiología.
4 Especialista de I Grado en Laboratorio Clínico.
5 Especialista de II Grado en Endocrinología.
6 Especialista de I Grado en Reumatología.
7 Especialista de I Grado en Endocrinología y en MGI. Instituto Nacional de Endocrinología.
8 Especialista en MGI. Residente de Endocrinología. Instituto Nacional de Endocrinología.
9 Especialista de I Grado en Medicina Interna. Hospital "Manuel Fajardo".














