Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Endocrinología
versión On-line ISSN 1561-2953
Rev Cubana Endocrinol vol.23 no.1 Ciudad de la Habana ene.-abr. 2012
ARTÍCULO ORIGINAL
Caracterización clínica y epidemiológica de los pacientes menores de 15 años de edad con diabetes mellitus tipo 1
Clinical-epidemiologic characterization of patients aged under 15 presenting with type 1 diabetes mellitus
MSc. Dra. Juliette Navarrete Cabrera,I Dr. Francisco Carvajal Martínez,I Dr. Oscar Díaz Díaz,I Dra. Emma Domínguez Alonso,I MSc. Dra. Esther Cabrera Benítez,II MSc. Dr. Yoine Villamil MenéndezIII
IInstituto Nacional de Endocrinología (INEN). La Habana, Cuba.
IIHospital Docente "Ángel Arturo Aballí". La Habana. Cuba.
IIIPoliclínico "Reinaldo Pi Mirabal". La Habana. Cuba.
RESUMEN
Objetivo: identificar las características clínico epidemiológicas de los pacientes menores de 15 años de edad, diagnosticados con diabetes mellitus tipo 1 durante el período comprendido entre el 1º de enero de 2000 y el 31 de diciembre de 2008 de la provincia Ciudad de La Habana.
Métodos: se realizó un estudio descriptivo-retrospectivo con los pacientes menores de 15 años de edad, diagnosticados con diabetes mellitus tipo 1 durante el período ya mencionado. El grupo de estudio estuvo constituido por 293 pacientes, a los que se realizó la revisión de la historia clínica. Las variables estudiadas fueron: sexo, edad al diagnóstico, color de la piel, duración de lactancia materna exclusiva, forma clínica al diagnóstico y factores ambientales. Se realizó el análisis estadístico mediante cálculo de por cientos y de tasas de incidencia por grupo de edad y sexo durante el período estudiado.
Resultados: los resultados más importantes mostraron un predominio de los pacientes que recibieron lactancia materna exclusiva por un tiempo menor de 3 meses. Las formas clínicas menos graves al diagnóstico de la enfermedad fueron las más frecuentes. Entre los factores ambientales predominaron las enfermedades respiratorias agudas. La tasa de incidencia media del período fue de 8,4 x 100 000 habitantes.
Conclusiones: la incidencia de la enfermedad durante el período fue más alta en relación con los estudios previos realizados en el país, con un desplazamiento hacia edades tempranas.
Palabras clave: diabetes mellitus tipo 1, incidencia de la enfermedad, características clínicas al diagnóstico.
ABSTRACT
Objective: to identify the clinical-epidemiologic features of the patients aged under 15, diagnosed with type 1 diabetes mellitus from January 1, 2000 to December 31, 2008 from Ciudad de La Habana province.
Methods: a descriptive-retrospective study was conducted in patients aged under 15 diagnosed with type 1 diabetes mellitus over above mentioned period. The study group included 293 patients and the review of medical record. Study variables were: sex, age at diagnosis, skin color, length of exclusive breast feeding, clinical way at diagnosis and environmental factors. A statistic analysis was carried out by means of percentage calculation and the incidence rates by age group and sex over the study period.
Results: the more important results showed predominance of patients received exclusive breastfeeding over a period less than three months. The less severe clinical ways at disease's diagnosis were the more frequent ones. Among the environmental factors there was predominance of acute respiratory diseases. The mean incidence rate of the period was of 8.4 x 100 000 inhabitants.
Conclusions: the disease's incidence over the period was higher in relation to the previous studies conducted in our country with a displacement towards early ages.
Key words: type 1 diabetes mellitus, disease's incidence, clinical features at diagnosis.
INTRODUCCIÓN
La diabetes es un padecimiento conocido desde hace siglos; sin embargo, a fin del milenio el conocimiento de su etiología, historia natural y epidemiología es aún incompleto.1
La diabetes mellitus tipo 1 (DM 1) constituye más del 90 % de los casos diagnosticados en la infancia y adolescencia.2,3 En los años 80, existían pocos registros monitoreando la incidencia de la enfermedad, había información limitada, con identificación de diferencias geográficas en la incidencia, por lo que se hizo evidente la necesidad de métodos epidemiológicos rigurosos, no existentes hasta entonces, para establecer la magnitud y el impacto de esta enfermedad. Esta circunstancia condujo a la creación de 2 proyectos: el DIAbetes MONDiale (DiaMond), y el estudio EURODIAB, ambos patrocinados por la OMS, uno de cuyos objetivos principales fue la disponibilidad de registros basados en estudios de población para monitorear las tendencias de la enfermedad en niños y adolescentes menores de 15 años. En ambos proyectos se usaron definiciones estandarizadas, formularios para la recolección de datos y métodos para validar cuán completos eran estos. Ellos dieron origen a uno de los mayores esfuerzos colaborativos a través de distintos países en el campo de la diabetes, y quizás de cualquier enfermedad crónica. El proyecto DiaMond incluyó más de 110 registros, en 57 países, representando 84 000 000 de niños y adolescentes, con información de 43 000 pacientes diagnosticados entre los años 1990 y 1999. El estudio EURODIAB abarcó 44 centros europeos, e incluyó 47 000 niños como parte del registro.1,2
Estos proyectos monitorean la incidencia global de la enfermedad, evalúan factores de riesgo, variaciones estacionales, mortalidad y aspectos socioeconómicos relacionados con la DM 1. Actualmente existen 168 registros en 69 países (24 en América), que monitorean el 7,2 % de la población mundial,1 y es Cuba uno de ellos. Según datos históricos del INEN, el primer registro de la enfermedad en nuestro país, en menores de 15 años de edad, se efectuó en 1978, antes de la creación del proyecto DiaMond.
El aumento de la incidencia de la DM 1 es un hecho reconocido. El proyecto DiaMond, basado en sus estudios epidemiológicos a nivel mundial, así lo ha confirmado.1,2,4,5 Este aumento ha sido más importante en países como Suecia y Noruega, que han reportado un incremento en la incidencia anual de 3,3 %, y Finlandia un 2,4 %, preferentemente en pacientes menores de 15 años y de sexo masculino. En este grupo de edad se ha descrito a nivel mundial una incidencia muy variable, que va desde 0,1 casos/100 000 habitantes por año en China y Venezuela, hasta 37,8 nuevos casos cada 100 000 habitantes en Cerdeña (Italia) y Finlandia.6 En términos absolutos, este incremento es semejante en los grupos entre 0-4 años, 5-9 y 10-14 años, pero se considera más importante en los grupos de menor edad.7-9
En la incidencia de la DM 1 se describen variaciones cíclicas estacionales y a largo plazo. Los casos de nuevo diagnóstico aparecen con mayor frecuencia en los meses de otoño e invierno, tanto en el hemisferio norte como en el sur, las variaciones estacionales son más evidentes cuando el diagnóstico de la enfermedad ocurre en la adolescencia.10-12
Varios han sido los estudios publicados sobre el comportamiento epidemiológico de la enfermedad en América Latina,13,14 tal es el caso de Chile, donde se desarrolló una investigación que muestra la tendencia creciente de la incidencia en menores de 15 años de edad,14,15 así como Perú, con datos publicados sobre el registro de 10 años de incidencia (1985-1994) de DM 1 en la población infantil.16
En nuestro país también se han efectuado investigaciones sobre el tema. En 1983 se desarrolló un estudio nacional sobre la epidemiología de la enfermedad en menores de 15 años de edad, y se evidenciaron variaciones estacionales.12 Posteriormente se publicó nuevamente el comportamiento epidemiológico en este grupo de edad durante diferentes períodos, y se encontró un incremento de la incidencia en la década 1990-1999.11,17,18 Las provincias de Matanzas y Camagüey cuentan también con estudios epidemiológicos publicados sobre DM 1 en menores de 15 años de edad. En Matanzas se estudió el comportamiento de la enfermedad por quinquenios, y se obtuvieron las cifras más elevadas de incidencia en el grupo de 5-9 años de edad.19 En Ciudad de La Habana existe el antecedente, según datos históricos del INEN, de un estudio epidemiológico efectuado desde 1979 hasta 1998, que muestra las variaciones de la incidencia durante un período de 20 años.
Frente al incremento de la incidencia ocurrido en algunos contextos, y debido a la necesidad de actualizar el comportamiento clínico y epidemiológico de la DM 1 en menores de 15 años de edad en la provincia Ciudad de La Habana, se hizo necesario realizar esta investigación, en la que nos planteamos las interrogantes siguientes: ¿cómo se comporta la incidencia de la DM 1 en los menores de 15 años de edad en Ciudad de La Habana?, ¿qué formas clínicas predominan al diagnóstico de la enfermedad?, ¿existe predominio de algunos de los posibles factores desencadenantes? Es por ello que nos propusimos como objetivos: describir las características de los pacientes con DM 1 menores de 15 años de edad según variables demográficas de interés, duración de la lactancia materna exclusiva (LME), formas clínicas al diagnóstico, y factores ambientales; así como identificar el comportamiento de la incidencia en el período, por grupo de edad y sexo, y la variación estacional al diagnóstico de la enfermedad.
MÉTODOS
Se realizó un estudio descriptivo-retrospectivo con todos los pacientes menores de 15 años de edad, diagnosticados con DM 1 durante el período comprendido entre el 1º de enero de 2000 y el 31 de diciembre de 2008 de la provincia Ciudad de La Habana. El grupo de estudio quedó constituido por 293 pacientes que cumplían los criterios de inclusión siguientes:
- Ser diagnosticado con DM 1 (según criterios de la Asociación Americana de Diabetes)20 en el período comprendido entre el 1º de enero del año 2000 y el 31 de diciembre del año 2008.
- Ser menor de 15 años de edad en el momento del diagnóstico de la enfermedad.
- Residir en Ciudad de La Habana al ser diagnósticada la enfermedad.
Para efectuar la investigación fue imprescindible la cooperación de los endocrinólogos y pediatras que brindan su asistencia médica a niños y adolescentes diabéticos en la provincia Ciudad de La Habana. Cada uno de estos especialistas aportó la relación que posee de sus pacientes con diagnóstico de DM 1, y, con la previa autorización del jefe de servicio de endocrinología del centro, se revisó la historia clínica de cada paciente que cumplía con los criterios de inclusión, obtenida de los archivos de cada uno de los hospitales pediátricos de Ciudad de La Habana ("Ángel Arturo Aballí", "William Soler", "Juan Manuel Márquez", "Marfán", "Leonor Pérez", Hospital Pediátrico del Cerro, de San Miguel del Padrón y de Centro Habana, Materno-Infantil de 10 de Octubre, y del servicio de pediatría del Hospital "Luis Díaz Soto"), así como también del archivo del Departamento de Endocrinología Pediátrica del INEN, del archivo del policlínico "Pedro Borrás" y del archivo del Internado para Niños Diabéticos en Tarará. Los datos de interés (edad y fecha al diagnóstico de la enfermedad, sexo, color de la piel, duración de la LME, forma clínica al diagnóstico, antecedentes de enfermedades infecciosas virales, consumo de medicamentos diabetógenos y antecedente de trauma físico o psíquico durante el año previo al diagnóstico de la enfermedad) fueron vaciados hacia una planilla de recolección, la cual se confeccionó según los objetivos propuestos.
Se calculó la tasa de incidencia (por 100 000 habitantes) para cada año estudiado (2000 a 2008), como el cociente del número de casos nuevos y la población menor de 15 años, según sexo. La tasa de incidencia media del período (por 100 000 habitantes) se calculó como el cociente del promedio de casos nuevos y la población promedio del período estudiado, ambos por sexo y grupos quinquenales de edad. El cálculo de las tasas se llevó a cabo utilizando el programa Microsoft Excel 2002.
Se determinaron distribuciones de frecuencia de las variables cualitativas, y se utilizó el paquete estadístico SPSS en su versión 11,5. Las poblaciones por grupo de edad y sexo (datos necesarios para la incidencia) se obtuvieron a partir de la Oficina Nacional de Estadística.21
RESULTADOS
El color de la piel blanco fue el que predominó entre los pacientes con DM 1, con un 74 %, le siguió en orden de frecuencia la piel mestiza, con un 18 %. La piel negra se encontró en el 8 % de los pacientes. Con respecto al tiempo de duración de la LME, la información se encontró reflejada en 280 historias clínicas, 42 pacientes (15 %) no se beneficiaron con ella. Solo el 14,7 % la recibió hasta los 5-6 meses de edad. El 58,3 % de los pacientes presentaron formas clínicas no graves al ser diagnosticada la enfermedad (hiperglucemia, cetosis) (tabla 1).
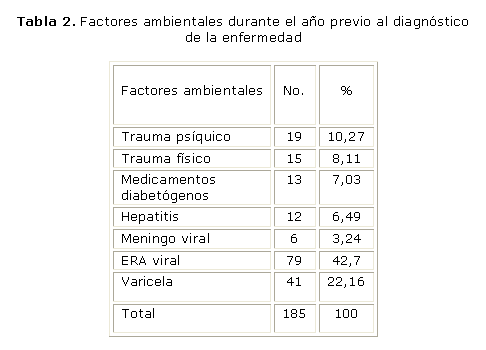
El 63 % de los pacientes presentaron al menos uno de los factores ambientales descritos por la literatura que están involucrados en la etiología de la enfermedad, con predominio de las infecciones de tipo viral: las enfermedades respiratorias agudas (ERA) en un 42,7 % de los casos y la varicela (22,16 %) (tabla 2). Las ERA se presentaron en la mayoría de los pacientes en un intervalo entre 15 días y 3 meses previos al inicio de la enfermedad.
La incidencia anual de la enfermedad en ambos sexos fue similar (figura 1). La tasa de incidencia media del período fue de 8,4 x 100 000 hab. La incidencia media del período en el sexo femenino fue de 7,9 x 100 000 hab y en el masculino de 8,9 x 100 000 hab, cifras que no muestran diferencia notable entre ambos sexos.
El grupo de 10-14 años mostró la mayor tasa de incidencia media del período (9,2 x 100 000 hab), seguido por el grupo de 5-9 años, con una incidencia casi similar, de 9,1 x 100 000 hab (figura 2).
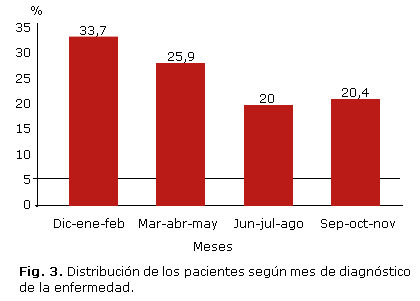
Se observó que en los meses de diciembre, enero y febrero (invierno) se produjo un incremento del diagnóstico de la enfermedad (33,7 % de los pacientes), mientras que en los meses de verano intenso (junio, julio y agosto) disminuyó la aparición de casos nuevos (20 %) (figura 3).
DISCUSIÓN
La frecuencia de DM 1 varía en distintos estudios realizados; no obstante, la mayoría de los investigadores están de acuerdo en que la DM 1 ha aumentado, y que todas las edades y ambos sexos han experimentado este incremento.16
Las nuevas cifras del Atlas de Diabetes, de la Federación Internacional de Diabetes, sugieren que más de 70 000 niños desarrollan DM 1 cada año; o sea, 440 000 niños de todo el mundo menores de 14 años viven hoy con la enfermedad.22 Registros epidemiológicos internacionales muestran que la DM 1 afecta principalmente a la raza caucásica,5,23 y algo similar se encontró en el primer registro realizado en Cuba en 1978-89.12 Es rara en japoneses, chinos, filipinos, indios asiáticos, indios americanos, negros africanos, polinesios y esquimales.5,16,23,24 En nuestro estudio se encontró un predominio evidente del color de la piel blanca en los niños diabéticos tipo 1, lo cual coincide con lo expresado anteriormente, aunque en Cuba predomina la piel blanca en la población general con un 65 %,21 lo cual pudiera explicar dicho resultado, sin embargo el color de la piel no es un índice exacto, dado el notable mestizaje de nuestra población. Barceló y otros plantean que la presencia del componente amerindio en la población de América Latina protege contra la DM 1,13 pero esta realidad genética no es muy importante en Cuba.
La DM 1 es una enfermedad multifactorial, en la que el tipo de alimentación recibida en los primeros 6 meses de vida, se ha señalado que puede condicionar su desarrollo.25-28 Con respecto a la duración de la LME, predominaron los pacientes que lactaron durante un período muy breve, menos de 3 meses, con un inicio precoz de la ablactación, aunque no dispusimos de un grupo control para verificar la influencia de este factor. Medina encontró en su investigación, que solo el 28 % de los pacientes recibieron LME hasta los 4 meses de edad,29 resultados semejantes a los nuestros. Padilla y otros señalan, por su parte, una asociación significativa entre el tipo de lactancia antes de los 6 meses de edad y la DM 1. La lactancia artificial resultó ser un factor de riesgo para la DM 1, mientras que la LME constituyó un factor protector.25
Con respecto a las formas clínicas al diagnóstico, más de la mitad de los niños y adolescentes de este estudio no presentaron una cetoacidosis al inicio, sino formas clínicas menos graves, resultado que pudiera ser atribuido a la cobertura y eficacia del sistema de salud de la provincia. El episodio de cetoacidosis diabética ha sido señalado por diferentes autores como la forma clínica más frecuente al diagnóstico de la DM 1,30,31 lo cual difiere de nuestros resultados.
Comparando con estudios nacionales se puede citar que Díaz O y otros, en su investigación desarrollada a nivel nacional, señalan que solo el 26,8 % presentó al inicio cetoacidosis,17 años mas tarde Medina, en tanto, encontró en su investigación en Camagüey, que el 52,6 % de los pacientes presentaron cetoacidosis diabética,29 resultado superior al nuestro; sin embargo, Díaz A, en Matanzas, comprobó que el 60 % de los pacientes presentó el inicio clínico de la enfermedad con hiperglucemia o cetosis,19 resultados muy similares a los de este estudio. Con respecto a estudios internacionales, en una investigación desarrollada en Galicia, los autores encontraron que el 31,7 % de los pacientes comenzaron con cetoacidosis diabética, resultado inferior al nuestro,32 sin embargo, en Cataluña (1989-2002), se encontró que el 50 % de los casos presentó cetoacidosis al diagnóstico.33
Es conocido que la conjugación de factores genéticos y ambientales son elementos fundamentales para el desarrollo de la DM 1.1,3,22,24,34-36 Rytkonen, Karvonen y otros afirman que ha existido un incremento rápido en la incidencia de la DM 1 en muchos países europeos en las últimas décadas, y que este incremento no se puede explicar por la susceptibilidad genética, sino que la presencia de factores ambientales es una explicación más plausible.6,37
Diferentes estudios experimentales indican que existen componentes nutricionales, químicos, virus, toxinas, drogas que presentan un efecto diabetogénico, y la mayoría de ellos afectan a la célula beta a través de mecanismos autoinmunes o directamente.5,24,36,38,39 Algunos de los virus que se han relacionado con la DM 1 en humanos son el virus de la rubéola, de la parotiditis, coxsackie b, citomegalovirus, Epstein-Barr, varicela, herpes zóster y rotavirus.18,40 Cabrera y otros encontraron en Cuba una elevada frecuencia de ácido ribonucleico de enterovirus en niños con diagnóstico de DM 1, en comparación con niños sanos.41
Las ERA de etiología viral son las más frecuentes en edad pediátrica, y en nuestro estudio se presentaron como antecedente en el 42,7 % de los casos, seguido de la varicela, aunque no se dispuso de un grupo control para verificar la influencia de estos factores en la aparición de la DM 1. Estos resultados son semejantes a los obtenidos en un estudio epidemiológico efectuado en Bajadoz,42 donde el 54,6 % de los pacientes presentaron antecedentes de procesos infecciosos, con predominio de las faringoamigdalitis y las otitis; la varicela estuvo presente en el 12,5 % de los casos. Hallazgo similar encontró Castillo,43 ya que el 61 % de los pacientes presentaron ERA o gastrointestinales en los 3 meses previos al inicio, y el 44,8 % el antecedente de varicela, hepatitis, sarampión o parotiditis. Con respecto a estas 2 últimas, los resultados difieren de los nuestros, pues ninguno de los pacientes estudiados las presentó, lo cual se debe al esquema de vacunación que se efectúa en nuestro país.
Ningún país está exento de DM 1, pero su incidencia varía en gran medida.18,24 En los últimos años se ha observado un incremento de la DM 1, que se ha producido demasiado rápido como para ser justificado exclusivamente por los factores genéticos, por lo que cobran fuerza los factores ambientales dentro de su etiología, son múltiples las cuestiones que quedan por responder sobre la etiología de esta enfermedad. El estudio epidemiológico de la incidencia puede contribuir al conocimiento de sus causas, e incluso, a su prevención en un futuro no muy lejano.18
El proyecto DiaMond monitorea la incidencia global y la clasifica en muy baja (< 1), baja (1-4,9), intermedia (5-9,9), alta (10-19,9) y muy alta (> 20), según las tasas de incidencia por 100 000 habitantes por año en menores de 15 años de edad.24
Al realizar el análisis del período se observó menor incidencia en los 2 primeros años, probablemente relacionado con el transcurso del tiempo al momento de la recogida de los datos. A partir del año 2002 la incidencia se incrementa en ambos sexos y se mantiene estable en los años sucesivos. Se ha descrito una incidencia similar en cuanto al sexo, con variaciones puntuales en algunos países a favor de los varones.32 En general, la incidencia de la enfermedad en esta investigación fue similar en ambos sexos. Sin embargo, Zorrilla en Madrid,44 y Cepedano en Galicia,32 encontraron una mayor incidencia en el sexo masculino. En Cuba, durante el período 1990-1995, se encontró que el sexo femenino fue el más afectado,17 resultado que difiere del nuestro.
La tasa de incidencia media del período en Ciudad de La Habana fue de 8,4 por 100 000 hab, intermedia según la clasificación del proyecto Diamond, la cual es superior al promedio anual de incidencia que ha presentado nuestro país en años anteriores: durante el período 1990-1993 de 2,9 por 100 000 hab,11 1990-1995 de 2,7 por 100 000 hab,5,17 1990-1999 de 3,0 por 100 000 hab.18 También supera a la tasa obtenida en la provincia de Camagüey durante los años de 1993-2002, la cual fue de 3,1 por 100 000 hab.29 Según datos históricos del INEN, en la década comprendida entre 1989 y 1998, la incidencia en Ciudad de La Habana se mantuvo baja, con cifras que oscilaron entre 0,9 y 4,3 por 100 000 hab. A partir del año 2000 y hasta 2008 se observó un incremento de esta (en posible relación con factores ambientales), con tasas que oscilaron entre 3,8 y 10,4 por 100 000 hab. Sin embargo, nuestros datos, restringidos a Ciudad de La Habana, no permiten confirmar de una manera definitiva esta observación de la creciente incidencia de la DM 1 en Cuba. En estos momentos se está desarrollando una investigación con el objetivo de determinar la incidencia a nivel nacional, resultado que posteriormente podrá ser comparado con el de La Habana.
Al comparar la tasa obtenida en Ciudad de La Habana con la del resto de los países de América en el mismo grupo de edad, se observa que Canadá tiene la tasa más alta (23 por 100 000 hab), y en Estados Unidos las tasas oscilan entre 10,2 y 19,1. México, con influencia indígena, tiene tasas bajas de 2,0 por 100 000 hab, seguramente relacionadas con la alta carga genética amerindia. Más interesante resulta Puerto Rico, con una población muy parecida a la de Cuba, muestra una tasa de 17,4 por 100 000 hab,16,24 la cual pudiera estar explicada por algún factor ambiental, quizás relacionada con factores nutricionales. En América del sur, Venezuela presenta una tasa muy baja (0,1 por 100 000 hab), Perú y Bolivia también muestran tasas bajas influidas por su etnia amerindia (0,9 por 100 000), Brasil, Argentina y Uruguay tienen tasas de alrededor de 8,0 por 100 000 hab, y Chile muestra tasas intermedias entre 6,5 y 8,6 por 100 000 hab.18 Fuera de América, el proyecto DiaMond muestra incidencias aún más heterogéneas, con altas cifras en Europa y el norte de América, y bajas en Asia y América Latina, teniendo en cuenta que, tanto en los países desarrollados como subdesarrollados, existe un subregistro.16,18
Al realizar el análisis por grupo de edad, se observó que el grupo de mayor incidencia durante el período fue el de 10-14 años, le siguió con una incidencia casi similar el grupo de 5-9 años. Estudios realizados en Estados Unidos indican que existen máximos de presentación de esta enfermedad en 2 grupos de edades: entre los 5-7 años y en el momento de la pubertad. El primer máximo, al parecer, se relaciona con el momento de mayor exposición a agentes infecciosos, coincidente con el comienzo de la escolarización. El segundo grupo de edad está relacionado con la pubertad, inducido por los esteroides gonadales y por el aumento de la secreción de hormona de crecimiento, análisis aplicable a nuestros resultados.29
Estudios efectuados a nivel nacional durante el período 1990-1995 encontraron la mayor incidencia en el grupo de 10-14 años con una tasa de 3,9 por 100 000 hab.17 En los últimos años se ha observado un incremento más rápido de la incidencia en los grupos de menor edad, los estudios del proyecto DiaMond confirman que el incremento de la enfermedad ha sido considerable en los niños menores de 5 años en países de alta y baja incidencia, pero este ha sido más pronunciado en los países de baja incidencia, lo cual apunta hacia un desplazamiento del comienzo de la enfermedad a edades más tempranas.18 En nuestro estudio se comprobó un desplazamiento del diagnóstico hacia edades inferiores, en concreto, al grupo de 5-9 años, aunque la incidencia obtenida en el grupo de 0-4 años también es considerable (6,4 por 100 000 hab). Será necesaria la continuidad de la investigación para poder corroborarlo. Nuestros resultados son semejantes a los obtenidos por Zorrilla en Madrid,44 Carrasco en Santiago de Chile,38 Cepedano en Galicia32 y Díaz A en Matanzas,19 donde las mayores tasas de incidencia se observaron en el grupo de 5-9 años de edad.
Desde 1926 se encuentran en la literatura científica reportes sobre la presencia de variaciones estacionales en la diabetes de presentación aguda. Con posterioridad a esta fecha han aparecido publicaciones que en general confirman este hallazgo.24,32,36,45 Estas observaciones han tenido lugar en países con tasas elevadas, así como en regiones de incidencia media, e incluso, bajas.45
En este estudio, existió predominio en la aparición de los casos en los meses de diciembre-enero-febrero, en comparación con los meses de verano de junio-julio-agosto, es decir, se encontró cierta estacionalidad a pesar de no ser el clima de nuestro país el mejor exponente de las 4 estaciones del año. Este resultado coincide con el primer registro realizado en nuestro país por Díaz O y otros,12 así como por Cepedano en su estudio en Galicia, donde encontró que el 33 % de los pacientes se diagnosticaron en invierno y el 20,8 % en verano.32 Igualmente, en Canadá, la mayor frecuencia ocurre en otoño-invierno. Reporte de países del hemisferio sur también señalan un aumento en la ocurrencia de casos durante la época del año que corresponde a estas estaciones climáticas.45 Resultado similar al de este estudio han obtenido autores nacionales como Díaz A en la provincia de Matanzas, quien observó un predominio al diagnóstico de la enfermedad en los meses de diciembre a febrero.19 En general, estas variaciones estacionales hablan a favor de un factor ambiental jugando un papel aún desconocido, aunque también sugiere la posibilidad de infecciones virales asociadas.
Se concluyó que la presencia de ERA y el corto período de LME fueron características del grupo estudiado, aunque no por ello se puede establecer relación causal definitiva con la enfermedad. Las formas clínicas menos graves predominaron al diagnóstico, probablemente relacionadas con la elevada cobertura del sistema nacional de salud en Ciudad de La Habana. La incidencia de DM 1 en menores de 15 años de edad en Ciudad de La Habana durante el período 2000-2008 fue más alta, y en general, sostenida, en relación con los estudios previos realizados en el país. Se observó un desplazamiento de la enfermedad hacia edades tempranas.
Agradecimientos
Nuestro más sincero agradecimiento a los doctores endocrinólogos pediatras y pediatras de La Habana: Manuel Vera González, Tania Espinosa Reyes y Cecilia Pérez Gensen, del INEN; Teresa Montesino Estévez, Katiuska Martín Durán y Asney Díaz Sánchez, del Hospital Pediátrico Docente del Cerro; Pedro González Fernández, del Hospital Pediátrico Docente "William Soler"; Orlando Araújo Herrera, del Hospital Pediátrico Docente de Centro Habana; María del Carmen Valdés Alonso y Annia Ladrón de Guevara Casals, del Hospital Pediátrico Docente "Juan Manuel Márquez"; Regino Piñeiro Lamas, del Centro de Investigación y Referencia de Ateroesclerosis de La Habana; Mirtha Romero Delgado, del Hospital Docente Materno Infantil "Dr. Ángel Arturo Aballí"; Mirtha Prieto Valdés, del Policlínico-Hospital "Pedro Borrás Astorga"; Yaquelín Ricardo González, del Hospital Pediátrico Docente de San Miguel del Padrón; y a la epidemióloga doctora Deysi Aldana Padilla, del INEN, por su inestimable ayuda en la realización del presente trabajo.
REFERENCIAS BIBLIOGRÁFICAS
1. Moreno L. Epidemiología y Diabetes. Rev Fac Med UNAM. 2001;44(1):35-7.
2. Zimmet P, Shaw J, Murria S, Sicree R. La epidemia de diabetes en crecimiento: predecir el futuro. Diabetes Voice. 2003;48:12-6.
3. Soltész G. La diabetes en niños: tendencias cambiantes dentro de una epidemia emergente. Diabetes Voice. 2007;52(número especial):13-5.
4. Soltész G, Patterson C, Dahlquist G. Global trends in childhood type 1. In: International Diabetes Federation. Brussels: Diabetes Atlas third edition. IDF; 2006. p. 154-90.
5. The DIAMOND Project Group. Incidence and trends of childhood Type 1 diabetes worldwide 1990-1999. Diabetic Medicine. 2006;23(8):857-66.
6. Karvonen M, Viik-Kajander M, Moltchanova E, Libman I, LaPorte R, Tuomilehto J. Incidence of childhood type 1 diabetes world wide. Diabetes Mondiale (Diamond). Project Group. Diabetes Care. 2000;23(10):1516-26.
7. Knip M. Prediction and prevention of type 1 diabetes. Acta Paediatrica. 1998;87:54-62.
8. Nicolino M, Chatelain P. Diabetes mellitus infantil: Clasificación, diagnóstico, epidemiología y etiología. En: Pombo M. Tratado de Endocrinología Pediátrica. 3ra. ed. Madrid: ESPAX; 2002. p. 1122-35.
9. Haller MJ, Atkinson MA, Schatz D. Type 1 Diabetes mellitus: etiology, presentation, and management. Pediatr Clin N Am. 2005;52:1553-78.
10. Bahillo P, Hermoso F, García JA, Ochoa C, Rodrigo J, De la Torre SI, et al. Epidemiología de la Diabetes tipo 1 en menores de 15 años en las provincias de Castilla y León. Anales Españoles de Pediatría. 2006;65(1):15-21.
11. Collado F, Díaz O, Hernández I. Comportamiento epidemiológico de la diabetes mellitus insulinodependiente en menores de 15 años de edad. Cuba 1990-1993. Rev Cubana Endocrinol. 1997;8(2):119-25.
12. Díaz O, Carvajal F, Fernández L, Rodríguez J. Epidemiología de la diabetes mellitus tipo 1 en menores de 15 años. Evidencia de variaciones estacionales. Rev Cubana Invest Biomed. 1983;2:316-25.
13. Collado F, Barceló A, Arheat KL, Messiah SE. Análisis ecológico de la incidencia y prevalencia en América latina de diabetes tipo 1 con inicio en la niñez. Rev Panam Salud Pública. 2004;15(6):388-94.
14. Carrasco E, Pérez F, Dorman J, Mondragón A, Santos JL. Increasing incidence of type 1 diabetes in population from Santiago of Chile: trends in a period of 18 years (1986-2003). Diabetes Metab Res Ver. 2006;22(1):34-7.
15. Eyzaguirre F, Peláez JM, Sepúlveda C, Gaete X, Codner E, Unanue N, et al. Diabetes mellitus tipo 1 (DM 1) en niños menores de 5 años: características al debut vs. otros grupos etáreos en Chile. Rev Chil Pediatr. 2006;77(4):375-81.
16. Seclén S, Rojas MI, Núñez O, Millones B, Valdivia H. Registro de 10 años de incidencia (1985-1994) de diabetes mellitus tipo 1 en la población infantil. Proyect DIAMOND Perú. Revista Diagnóstico. 2002;41(2):63-75.
17. Díaz O, Hernández I, Collado F. Comportamiento epidemiológico de la diabetes mellitus insulinodependiente en menores de 15 años, Cuba 1990-1995. Rev Cubana Endocrinol. 1997;8(1):62.
18. Zipris D. Epidemiology of type 1 diabetes and what animal models teach us about the role of viruses in disease mechanisms. Clinical Immunology. 2009;131(1):11-23.
19. Díaz A, Romero O, Montalbán G. Aspectos epidemiológicos de la diabetes mellitus en menores de 15 años en la provincia de Matanzas. Quinquenios 1980-1984, 1985-1989, 1990-1994. Rev Cubana Endocrinol. 1997;8(1):59-60.
20. Asenjo S, Muzzo S, Pérez MV, Ugarte F, Willshaw ME. Consenso en el diagnóstico y tratamiento de la diabetes tipo 1 del niño y el adolescente. Rev Chil Pediatr. 2007;78(5):534-41.
21. Oficina Nacional de Estadística [homepage en internet]. Censo de Población y Viviendas; Cuba 2002. Informe Nacional. La Habana; 2002 [citado el 3 de junio de 2011]. Disponible en: http://www.cubagob.cu/otras_info/censo/poblacion.htm
22. Vehik K, Hamman RF, Lezotte D, Norris JM, Klingensmith G, Bloch C, et al. Increasing incidence of type 1 diabetes in 0 to 17 years old Colorado youth. Diabetes Care. 2007;30(3):503-9.
23. Soltesz G, Patterson CC, Dalquist G. EURODIAB Study Group. Worldwide childhood type 1 diabetes incidence-what can we learn from epidemiology? Pediatric Diabetes. 2007;8(Suppl 6):6-14.
24. Luzuriaga C, Roman M, Argumosa A, Castañol L, Bilbao R, Leyva-Cobian F. Aspectos epidemiológicos de la diabetes mellitus tipo 1. Bol Pediatr. 2002;42:283-95.
25. Padilla J, Pendavis M, Pimentel M. DM 1 y lactancia artificial antes del 6to. mes de vida. Paediatrica. 2006;8(1):59-63.
26. Cabrera-Rode E, González P. Diabetes mellitus tipo 1. Avances médicos. 2000;7(23):20-3.
27. Cabrera-Rode E, Perich PA, Licea M. Diabetes autoinmune latente del adulto o diabetes tipo 1 de lenta progresión: definición, patogenia, clínica, diagnóstico y tratamiento. Rev Cubana Endocrinol. 2002;13(1):43-52.
28. Simpson M, Norris JM. Mucosal immunity and type 1 diabetes: looking at the horizon beyond cow's milk. Pediatric Diabetes. 2008;9(5):431-3.
29. Medina FE, Guerra Y, Gutiérrez A, Carbajal M, Ruiz de la Villa Y. Comportamiento Epidemiológico de la diabetes mellitus tipo 1 en la provincia de Camagüey 1993-2002. Ciencias Holguín. 2004;10(3):34-9.
30. Güell R. Cetoacidosis diabética en el niño y adolescente diabético. Situaciones de emergencia. La Habana: Editorial Ciencias Médicas; 1998. p. 3-4.
31. Güell R. El niño diabético menor de 5 años. Rev Cubana Endocrinol. 2000;11(3):189-91.
32. Cepedano A, Barreiro J, Pombo M. Incidencia y características clínicas al manifestarse la diabetes mellitus tipo 1 en niños de Galicia (España, 2001-2002). An Pediatr (Barc). 2005;62(2):123-7.
33. Borrás MV. DM 1 en niños menores de 5 años. Estudio epidemiológico en Cataluña 1989-2002. Rev Clin Med Fam. 2003;2(6):269-74.
34. Pérez B, Calnillan M, Santos M. Diabetes mellitus insulino-dependiente en Santiago de Chile: rol patogénico de factores inmunogenéticos y ambientales. Rev Med Chile. 1996;124(10):1177-86.
35. Viskari H, Ludvigsson J, Uibo R, Salur L, Marciulionyte D, Hermann R, et al. Relationship between the incidence of type 1 diabetes and enterovirus infections in different european populations: results from de EPIVIR project. Journal of Medical Virology. 2004;72(4):610-7.
36. Libman IM. Epidemiología de la diabetes mellitus en la infancia y adolescencia: tipo 1, tipo 2 y ¿diabetes "doble"? Rev Argent Endocrinol Metab. 2009;46(3):22-36.
37. Rytkonen M, Moltchanova E, Ranta J, Taskinen O, Tuomilehto J, Karvonen M. The incidence of type 1 diabetes among children in Finland-rural-urban-difference. Health Place. 2003;9(4):315-25.
38. Carrasco E, Ángel B, Codner E, García D, Ugarte F, Bruzzone ME, et al. Incidencia de la diabetes mellitus tipo 1 en Santiago de Chile: análisis por comunas de la Región Metropolitana en el período 2000-2004. Rev Med Chile. 2006;134(10):1258-64.
39. Stan L. Las supuestas causas genéticas y ambientales de la diabetes mellitus tipo 1. Diabet Hoy Med Sal. 2007;8(4):1868-73.
40. Sarmiento L, Cabrera-Rode E, Lekuleni L, Cuba I, Molina G, Fonseca M, et al. Occurrence of enterovirus RNA in serum of children with newly diagnosed type 1 diabetes and islet cell autoantibody-positive subjects in a population with a low incidence of type 1 diabetes. Informa healthcare-Autoimmunity. 2007;40(7):540-5.
41. Cabrera-Rode E, Sarmiento L, Molina G, Pérez C, Arranz C, Galvan T, et al. Islet cell related antibodies and type 1 diabetes associated with echovirus 30 epidemic: a case report. Journal of Medical Virology. 2005;76(3):373-7.
42. Méndez P, Hernández R, Núñez M, Pérez C. Epidemiología de la Diabetes Mellitus tipo 1 en el Hospital Materno Infantil Bajadoz. Vox Paediatrica. 2005;13(2):31-8.
43. Castillo U. Factores ambientales predisponentes para desarrollar diabetes mellitus insulino-dependiente. Rev Fac Med UNAN. 1999;42(1):42-5.
44. Zorrilla B. Incidencia de Diabetes Mellitus Tipo 1 en Niños de la Comunidad de Madrid. Período 1997-2005. Med Clin. 2009;132(14):545-8.
45. Moltchanova EV, Schreier N, Lammi N, Karvonen M. Seasonal variation of diagnosis of Type 1 diabetes mellitus in children worldwide. Diabetic Medicine. 2009;26(7):673-8.
Recibido: 13 de agosto de 2011.
Aprobado: 7 de noviembre de 2011.
Juliette Navarrete Cabrera. Instituto Nacional de Endocrinología. Departamento de Endocrinología Pediátrica. Calle 27 # 503, entre E y F, Vedado, municipio Plaza. La Habana, Cuba. Correo electrónico: juliette.navarrete@infomed.sld.cu