Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
MediSur
versión On-line ISSN 1727-897X
Medisur vol.16 no.4 Cienfuegos jul.-ago. 2018
ARTÍCULO ORIGINAL
Factores de riesgo para la neumonía asociada al ictus isquémico agudo
Risk factors for pneumonia associated to acute ischemic stroke
Alexis Suárez Quesada , Alexis Álvarez Aliaga , Andrés Quesada Vázquez
Hospital General Provincial Carlos Manuel de Céspedes, Bayamo, Granma, Cuba
RESUMEN
Fundamento: La neumonía asociada al ictus isquémico agudo es un factor de riesgo independiente de mortalidad a corto plazo, también se asocia con una pobre recuperación funcional. La revisión del estado del tema, demuestra que se requiere de estudios, tanto a nivel local como nacional, que ayuden a ganar en claridad acerca de los factores de riesgo en las unidades de instituciones hospitalarias cubanas.
Objetivo: identificar los factores de riesgo de neumonía asociada al ictus isquémico agudo.
Métodos: estudio de casos (N=50) y testigos (N=100) anidado en una cohorte prospectiva de 343 pacientes con el diagnóstico de ictus isquémico agudo, admitidos de modo consecutivo en el Hospital General Universitario Carlos Manuel de Céspedes, desde enero de 2015 hasta diciembre de 2017. Los factores de riesgo independientes se obtuvieron usando la regresión logística binaria.
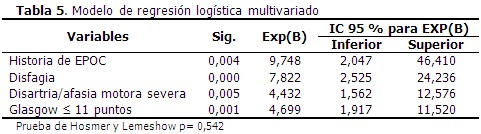
Resultados: el total de casos con neumonía asociada al ictus isquémico agudo fue de 33,3 %. Se identificaron los siguientes factores de riesgo: historia de enfermedad pulmonar obstructiva crónica (OR: 9,74; IC 95 % 2,047-46,410), disfagia (OR: 7,822; IC 95 % 2,525-24,236), puntuación de Glasgow ≤ 11 puntos (OR: 4,699; IC 95 % 1,917-11,520) y disartria/afasia motora severa (OR: 4,432; IC 95 % 1,562- 12,576).
Conclusión: los factores de riesgo de neumonía asociada al ictus isquémico agudo, más influyentes en la serie estudiada, también lo han sido en estudios similares, realizados tanto dentro como fuera de Cuba, sobresaliendo más unos u otros en las diferentes investigaciones.
Palabras clave: Accidente cerebrovascular, neumonía, infección hospitalaria, factores de riesgo.
ABSTRACT
Foundation: pneumonia associated to acute ischemic stroke is a risk factor for short term mortality, it is also associated with a poor functional recovery. The review of the topic state shows that it requires studies, at local and national levels which help to clarify on the risk factors in the Cuban hospital institutions.
Objective: to identify th erisk factors of pneumonia associated to acute ischemic stroke.
Methods: case study (N=50) and witness (N=100) nested in in prospective cohort of 343 patients with the diagnosis of acute ischemic stroke, admitted consecutively in the University General Hospital Carlos Manuel de Céspedes, from January 2015 to December 2017. Independent risk factors were obtained by using binary logistic regression.
Results: the total of cases with pneumonia associated to acute ischemic stroke was of 33,3 %. The following risk factors were identified: History of chronic obstructive pulmonary disease (OR: 9,74; IC 95 % 2,047-46,410), dysphagia (OR: 7,822; IC 95 % 2,525-24,236), scale of Glasgow ≤ 11 points (OR: 4,699; IC 95 % 1,917-11,520) and severe motor dysarthria/aphasia (OR: 4,432; IC 95 % 1,562- 12,576).
Conclusion: the most influential risk factors for pneumonia associated to acute ischemic stroke in the series studied have been similar in other studies realized in Cub and in other countries, some standing out more than others in different research.
Key words: Stroke, pneumonia, cross infection, risk factors.
INTRODUCCIÓN
El ictus continúa como la tercera causa de muerte a nivel mundial, superado solamente por las enfermedades cardiovasculares y por el cáncer; sus complicaciones llegan a triplicar la mortalidad en la etapa aguda.1,2 Cerca del 85 % de todos los pacientes con ictus sufren una determinada complicación, entre las cuales, las infecciosas son las más comunes.3 Estas se presentan en el 5-40 % de los pacientes; cuando se trata de las neumonías el pronóstico clínico es peor, y el riesgo de muerte, mayor.4,5 La neumonía asociada al ictus isquémico agudo (NAIIA) es un factor de riesgo independiente de mortalidad a corto y largo plazo, así como de disminución de la capacidad funcional al egreso; constituye un desafío constante debido al actual espectro microbiológico, la resistencia microbiana, su elevada mortalidad, morbilidad y los costos hospitalarios.6 El riesgo de infección se relaciona fundamentalmente con el estado clínico y la edad del paciente, suele ocurrir entre el segundo y el séptimo día tras el inicio del ictus; su incidencia varía dependiendo del tipo de estudio, de los criterios empleados para el diagnóstico de neumonía asociada al ictus, del sitio o unidad de tratamiento del paciente y del estado inicial de este.6-8 Los estudios realizados en las unidades de cuidados intensivos (UCI) neurológicos muestran una incidencia entre 9,5 % y 56,6 %, en las UCI polivalentes se encuentra entre 17 % y 50 %, en la mayoría de los estudios realizados en las unidades de ictus y en las unidades mixtas de atención al paciente grave, la incidencia de NAIIA se ubica entre el 3,9 % y 12 %.7,8 Entre los principales factores con influencia independiente para el desarrollo de esta entidad, se describen la severidad de esta cuantificada mediante la escala del National Institute of Health Stroke Scale (NIHSS, por sus siglas en inglés) al ingreso, la escala modificada de Rankin, la disfagia, la ventilación mecánica, la puntuación APACHE II, la fibrilación atrial y la puntuación en la escala de Glasgow.4,9-11 Recientemente, se ha documentado que el daño neurológico agudo induce inmunodepresión, la cual incrementa el riesgo de infecciones durante el evento, particularmente la neumonía; dicha inmunodepresión es proporcional a la magnitud de la lesión.12-14 La revisión del estado del tema, demuestra que se requiere de estudios, tanto a nivel local como nacional, que ayuden a ganar en claridad acerca de los factores de riesgo en las unidades de las instituciones hospitalarias cubanas. Esta investigación tiene como objetivo identificar los factores de riesgo de NAIIA en pacientes atendidos en el hospital de Bayamo, provincia Granma.
MÉTODOS
Se realizó un estudio analítico, de casos y testigos, anidado en una cohorte prospectiva de pacientes con diagnóstico clínico y por tomografía axial computarizada de infarto cerebral isquémico agudo, atendidos en el servicio de Ictus del Hospital General Universitario Carlos Manuel de Céspedes, del municipio Bayamo, provincia de Granma, desde el primero de enero de 2015 hasta el 31 de diciembre de 2017. Para el diagnóstico del ictus isquémico agudo (IIA) se tuvieron en cuenta los criterios de la actual Guía Cubana de Práctica Clínica para la Enfermedad Cerebrovascular;15 ningún paciente recibió ventilación mecánica artificial. Del total de los 343 pacientes incluidos en la cohorte, se consideraron como casos potenciales a 80 pacientes que desarrollaron NAIIA, y como testigos potenciales a 263 pacientes que no desarrollaron NAIIA. El total de casos y testigos que constituyeron la muestra se seleccionaron por método aleatorio simple de entre el total de casos potenciales y testigos potenciales respectivamente, un caso por cada dos testigos (1:2). Se decidió investigar una muestra de 150 pacientes (50 casos y 100 testigos). Los casos (incidentes) fueron aquellos pacientes que cumplieron con los criterios clínicos y microbiológicos diagnósticos de neumonía asociada a los servicios de salud,16 con uno o más de los siguientes criterios clínicos diagnósticos de NAIIA: Después de las primeras 48 horas: Más al menos dos de los siguientes: Y dos o más radiografías de tórax seriadas con al menos uno de los siguientes: Como criterio microbiológico: A) Cultivo cuantitativo positivo a partir de una muestra posiblemente contaminada del tracto respiratorio inferior: 1. Aspirado endotraqueal con muestra de vía aérea inferior > de 25 polimorfonucleares (PMN) y < de 10 células epiteliales escamosas por campo de 100 aumentos. Cultivo cuantitativo de muestra de aspirado endotraqueal con un punto de corte de 106 UFC/ml. B) Uso de algún método microbiológico alternativo: Hemocultivo positivo no relacionado con otro foco de infección. 2. Crecimiento positivo en cultivo de líquido pleural. 3. Evidencia de neumonía en examen histológico pulmonar. C) Cultivo positivo de esputo o no cuantitativo de muestra de tracto respiratorio inferior. Los testigos fueron pacientes con diagnóstico de IIA que no cumplieron con los criterios clínicos, radiológicos ni microbiológicos de neumonía asociada a los servicios de salud. Fueron excluidos los pacientes con tuberculosis pulmonar, SIDA definido, las gestantes, así como los pacientes con recolección insuficiente de datos. Todos tuvieron al IIA como principal diagnóstico de hospitalización. El tamaño de la muestra para el estudio se determinó mediante el programa EPIDAT 4.0. Para su estimación fueron considerados los parámetros siguientes: nivel de confianza al 95 %, poder del estudio al 90 %, relación de casos y testigos de 1:2, proporción de casos expuestos 58,8 %, proporción de testigos expuestos 19,8 % y odds ratio (OR) mínimo a detectar 5,0. Con estos parámetros la muestra mínima para el estudio fue de 81 pacientes. La prevalencia necesaria para calcular el tamaño de la muestra, se obtuvo de cortes parciales a la cohorte de estudio ya publicados, y fue 30,3 %.6 En relación a la variable dependiente (NAIIA), se analizaron como independientes: edad (años cumplidos), escala de Glasgow (puntos), cifras de leucocitos (x109/l) y cifras de glucemia (mmol/L), y otras de carácter cualitativo: sexo (masculino/femenino), fumador activo, enfermedad pulmonar obstructiva crónica (EPOC), diabetes mellitus (DM), enfermedad renal crónica (ERC), hepatopatía crónica, alcoholismo, neoplasias, insuficiencia cardiaca (IC), hipertensión arterial (HTA), hospitalización en los últimos 30 días, uso previo de antibiótico en los últimos 30 días, historia de ictus/accidente transitorio de isquemia (ATI) previo, presencia de disartria/afasia motora severa o de disfagia al ingreso. Excepto para el sexo, para todas ellas se determinó (presente: si o no). El análisis estadístico comenzó por la caracterización de la muestra, lo que implicó una descripción de todas las variables. Para las variables cuantitativas se determinaron las medias, medianas y desviaciones estándar (DE), así como los valores mínimos y máximos de cada distribución. Para las variables cualitativas se obtuvieron las frecuencias absolutas y relativas, y se calculó el coeficiente de Pearson (Chi cuadrado). En las variables cuantitativas, cuando la distribución de la variable presentó una forma aceptablemente parecida a la normal (evaluada por inspección del histograma y cálculo de la asimetría) se empleó la prueba t de Student; o la U de Mann Whitney, cuando se observó una distribución diferente a la normal, dada sobre todo por asimetría; también se determinó el nivel de significación para cada una de ellas. Para el análisis de los factores de riesgo de NAIIA se utilizó una estrategia univariada, basada en la estimación del riesgo a través del valor obtenido del OR. Se obtuvieron estimaciones puntuales y por intervalo de confianza (del 95 %) de los OR. Para cada variable se probó la hipótesis de que el OR poblacional fuese realmente mayor de cinco con un nivel de significación menor de 0,05. La estrategia multivariada se basó en el ajuste de un modelo de regresión logística binaria mediante el método "paso a paso hacia delante" (forward stepwise) con todas las variables que obtuvieron un OR≥5,0 en el análisis univariado. El ajuste de la función de regresión logística, equivalente a la estimación de sus parámetros, se realizó por el método de máxima verosimilitud. Se aplicó también el estadístico de bondad de ajuste Chi Cuadrado de Hosmer y Lemeshow. Se evaluó la capacidad del modelo predictivo para diferenciar los individuos que sufrieron NAIIA de los que no la sufrieron, asignándole a cada paciente el valor del coeficiente de regresión, y se generó la curva receptor-operador (ROC, por sus siglas en inglés). Se determinó la sensibilidad y especificidad del modelo de regresión logística. Este proceso se realizó con el algoritmo incluido en el paquete estadístico SPSS en su versión 18.0 para Windows. Antes de ser incluidos en el estudio, se le solicitó a cada paciente, o en su defecto al familiar (en caso de deterioro importante de nivel de conciencia o afasia severa), su consentimiento informado verbal y escrito. El estudio fue aprobado por el Consejo Científico y Comité de Ética del Hospital.
RESULTADOS
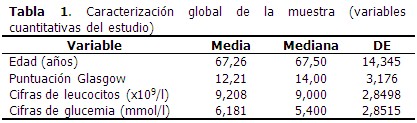
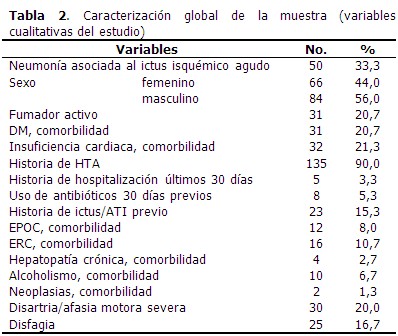
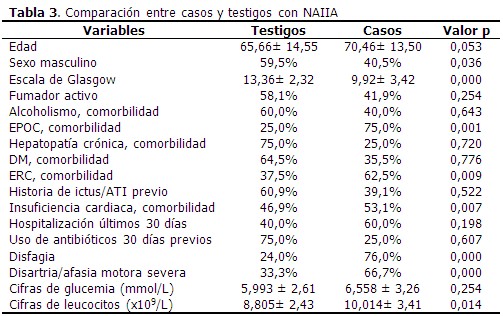
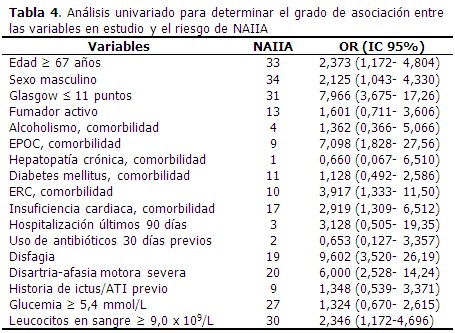
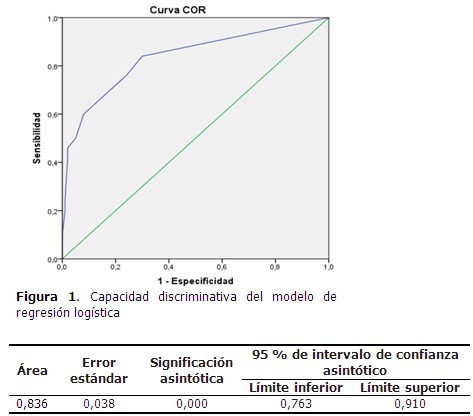
La edad media de los pacientes que formaron parte del estudio fue de 67,26 años, y el valor medio de escala de Glasgow fue de 12,21 puntos. (Tabla 1). El 33,3 % de los pacientes presentó NAIIA y 56,0 % fueron de sexo masculino. Predominó el antecedente de HTA (90,0 %), la disartria/afasia motora se identificó en el 20,0 % de los casos. (Tabla 2). Al comparar los casos y los testigos con relación a las variables en estudio, las diferencias significativas se observaron en la puntuación según escala de Glasgow, el antecedente de EPOC y de insuficiencia cardiaca, así como en la presencia de disfagia y disartria/afasia motora severa al ingreso. Los casos tenían más edad (70,46 años) que los testigos. (Tabla 3). En el análisis univariado se identificó la relación de las variables con el riesgo de NAIIA. Las variables que alcanzaron un OR superior a 5,0 fueron la escala de Glasgow ≤ 11 puntos, la EPOC como comorbilidad, la presencia al ingreso de disfagia y de disartria/afasia motora severa. (Tabla 4). El modelo de regresión logística binaria, ajustado por el método paso hacia delante, identificó como principales factores de riesgo independientes a la presencia de EPOC como comorbilidad, la presencia de disfagia, una escala de Glasgow con puntaje ≤ 11 puntos, seguido de disartria/afasia motora severa. (Tabla 5). Cuando se probó la capacidad de predecir la aparición de NAIIA, estimada con la función obtenida por el modelo de regresión, se encontró un área bajo la curva ROC significativamente mayor de 0,75 (0,836; IC 95 % 0,763-0,910). (Figura 1). La capacidad del modelo de regresión para detectar un sujeto enfermo fue de 82,14 %, la probabilidad condicional de que los individuos con la prueba positiva tuvieran realmente la enfermedad, fue del 92,0 %. Los enfermos tuvieron 3,9 veces más probabilidad de que el modelo de regresión los diagnosticara con NAIIA, respecto a los no enfermos. (Tabla 6).
DISCUSIÓN
En los últimos años se han introducido numerosos cambios en la atención al ictus, los cuales han modificado de forma clara y positiva la evolución de este proceso, pero a pesar de ello el impacto de la infección sobre el pronóstico, la mortalidad y el costo, ha cambiado poco.17, 18 La infección afecta al pronóstico del ictus por varias vías: prolongación de la inmovilización, mayor fragilidad del paciente y retraso en la rehabilitación integral debido a mayor estancia hospitalaria. Además, la NAIIA incrementa de manera importante el costo del proceso hospitalario. Según datos de un estudio estadounidense, la neumonía en pacientes con ictus provocaría un incremento de más de 14 836 dólares en los costos; los pacientes con neumonía necesitarían una extensión de los cuidados de forma significativa (OR 1,73; 95 % CI: 1,32-2,26).18 La recomendación actual es tratar las infecciones de forma precoz, pero no está indicada la administración profiláctica de antibióticos; los ensayos clínicos realizados hasta el momento para evaluar si la antibioticoterapia preventiva mejora las tasas de infección, no han tenido la suficiente potencia para demostrarlo.19 Identificar a los pacientes que en el momento del ingreso tienen un mayor riesgo de sufrir una NAIIA, puede ayudar en el manejo de este proceso. En el presente estudio la EPOC emergió como variable de mayor influencia independiente para determinar el riesgo de NAIIA. Esta entidad se encuentra entre los llamados factores de riesgo que disminuyen las defensas locales del tracto respiratorio, e incluso, la inmunidad sistémica, y que suelen ligarse a alteraciones de los mecanismos defensivos del huésped (intrínsecas).20 La EPOC cursa con una inflamación progresiva en las vías aéreas que conduce a destrucción, distorsión y obliteración, que hacen difícil el reflujo de aire. Esta inflamación alcanza también los alveolos contiguos, donde se exacerba el proceso inflamatorio; conduce a la destrucción de la estructura pulmonar y con ello, mayor propensión a las infecciones respiratorias.17 En este sentido, los resultados coinciden con los obtenidos por otros investigadores.21,22 El riesgo de aspiración se incrementa en estos pacientes por la pérdida del reflejo de deglución y el bajo nivel de conciencia. Muchos afectados por neumonía presentan disfagia y esta favorece la aspiración de material orofaríngeo o de contenido gástrico.4,5 Los pacientes con disfagia tienen dificultades para tragar los alimentos, líquido y saliva, resultando el inicio para la neumonía aspirativa.23 La disfagia es el único parámetro que puede tener cierta variabilidad en su forma de medirse, y cuyo diagnóstico puede tener mayor complejidad; su frecuencia depende del método de diagnóstico, siendo superior si se utiliza una evaluación instrumental (videofluoroscopia o nasofibrolaringoscopia), que si se utilizan técnicas de cribado o de evaluación clínica; aun así, aproximadamente el 50 % de los pacientes que sufren un ictus isquémico presentan disfagia.4,23 En este estudio la disfagia constituyó la segunda variable con mayor influencia independiente sobre el riesgo de NAIIA, lo cual coincide con otros estudios similares.3,10,21,23 Yapeng identificó a la disfagia como la variable con mayor influencia independiente para el pronóstico de NAIIA (OR 11,76; 95 % IC 7,21-19,19; p<0,001).3 Otro autor con resultados similares a los de esta investigación fue Li (OR 25,51; 95 % IC17, 53-37,12; p 0,001).24 Estudios previos han identificado una fuerza de asociación consistente para la alteración del nivel de conciencia medida mediante la escala de Glasgow.3,6,21 En una cohorte prospectiva de pacientes con infarto cerebral agudo, Suárez y colaboradores identificaron a la puntuación de Glasgow ≤ 11 puntos (OR 26; 95 % IC 7,164-85,075; p 0,000) como la principal variable con capacidad para predecir el desarrollo de NAIIA;6 también Ji y colaboradores relacionaron la baja puntuación en la escala de Glasgow al ingreso con un alto riesgo de neumonía (OR 1,04; 95 % IC 1,01–1,08; p 0,005).21 Las conclusiones anteriores coinciden con los resultados de este estudio. El deterioro inicial de la conciencia conduce a una serie de epifenómenos, tales como: el empeoramiento de los trastornos del lenguaje, de la deglución y de reflejos que sugieren el uso de sondas nasogástricas, aunque también puede conducir a depresión de la función cardiorrespiratoria y con ello a la neumonía aspirativa.6 La disartria y afasia motora severas también se relacionan en varios trabajos con el riesgo de NAIIA, lo cual también se pudo constatar con el análisis de esta serie.4,17,19 En el estudio ya citado de Suárez y colaboradores,6 esta variable (OR 4,22; 95 % IC 1,37–12,97; p 0,012)17 representó la quinta variable con influencia independiente para predecir el desarrollo de NAIIA, resultado similar al obtenido en esta ocasión. Dicho trastorno severo del lenguaje favorece la aspiración de determinada cantidad de secreciones orofaríngeas, contenido gástrico y alimentos, lo cual advierte al personal médico y de enfermería sobre la posibilidad de neumonía aspirativa, además de las limitaciones para la adecuada nutrición, hecho que motiva la aplicación de medidas de compensación deglutoria desde las primeras horas de arribo del paciente. Se concluye que los factores de riesgo de NAIIA más influyentes en la serie estudiada, también lo han sido en estudios similares, realizados tanto dentro como fuera de Cuba, sobresaliendo más unos u otros en las diferentes investigaciones. En este sentido, el modelo de regresión logística resulta útil para identificar a sujetos con mayor probabilidad de desarrollar NAIIA, y puede ser empleado de manera sencilla a la cabecera del paciente.
REFERENCIAS BIBLIOGRÁFICAS
1. Carnesoltas L, Serra MA, O’Farrill R. Factores de riesgo y mortalidad por neumonía intrahospitalaria en la Unidad de Terapia Intensiva de Ictus. Medwave. 2013;13(2):1-9
2. Kumar D, Rasool R, Masoodi KZ, Bhat IA, Verma S, Saleem S. Stroke-induced Immune Depression–A Randomized Case Control Study in Kashmiri Population of North India. J Stroke Cerebrovasc Dis. 2014;23(8):2041-46
3. Yapeng l, Bo S, Hui F, Yuan G, Lu Z, Yusheng L, et al. Risk factors for stroke-associated pneumonia in a chinese population: a prospective cohort study. LifeSci J. 2014;11(6):378-82
4. Ramírez JM, Martínez M, Córdova R, Roa AM, Constantino AB, Ceberino D, et al. Validación externa de las escalas A2DS2 e ISAN para predecir la infección respiratoria asociada al ictus isquémico. Neurología. 2016;982:1-8
5. Kwan J, Pickering RM, Kunkel D, Fitton C, Jenkinson D, Perry VH, et al. Impact of stroke-associated infection on on long-term survival: A cohort study. J Neurol Neurosurg Psychiatry. 2013;84(3):297-304
6. Suárez A, López E, García N, Serra MA. Predictores clínicos de neumonía intrahospitalaria asociada al ictus isquémico agudo. Finlay [revista en Internet]. 2015 [citado 2 Jul 2015];5(2):[aprox. 7p]. Disponible en: http://revfinlay.sld.cu/index.php/finlay/article/view/359/1405
7. Hannawi Y, Hannawi B, Venkatasubba CP, Suarez JI, Bershad EM. Stroke-Associated Pneumonia: Major Advances and Obstacles. Cerebrovasc Dis. 2013;35:430-443
8. Yeh SJ, Huang KY, Wang TG, et al. Dysphagia screening decreases pneumonia in acute stroke patients admitted to the stroke intensive care unit. J Neurol Sci. 2011;306(1-2):38-41
9. Ifejika NL, Arun N, Peng H, Elizabeth A, Grotta JC, Francisco GE. The interaction of aspiration pneumonia with demographic and cerebrovascular disease risk factors is predictive of discharge level of care in acute stroke patient. Am J Phys Med Rehabil. 2012;91(2):141-7
10. Zhang X, Yu S, Wei L, Ye R, Lin M, Li X, et al. The A2DS2 Score as a Predictor of Pneumonia and In-Hospital Death after Acute Ischemic Stroke in Chinese Populations. PLoSONE. 2016;11(3):1-9
11. Cugy E, Sibon I. Stroke-Associated Pneumonia Risk Score: Validity in a French Stroke Unit. Journal of Stroke and Cerebrovascular Diseases. 2017;26(1):225-29
12. Brämer D, Hoyer H, Günther A, Nowack S, Brunkhorst FM, Witte OW, et al. Study protocol: prediction of stroke associated infections by markers of autonomic control. BMC Neurology. 2014;14(9):1-6
13. Winklewski PJ, Radkowski M, Demkow U. Cross-talk between the inflammatory response, sympathetic activation and pulmonary infection in the ischemic stroke. J Neuroinflammation. 2014;11(1):213
14. De Raedt S, De Vos A, Van Binst AM, De Waele M, Coomans D, Buyl R, et al. High natural killer cell number might identify stroke patients at risk of developing infections. Neurol Neuroimmunol Neuroinflamm. 2015;2(2):71
15. Buergo MA, Concepción O, Pérez J, Pando A. Guías de práctica clínica. Enfermedad cerebrovascular. La Habana: ECIMED; 2009
16. Smith CJ, Kishore AK, Vail A, Chamorro A, Garau J, Hopkins SJ, et al. Diagnosis of Stroke-Associated Pneumonia Recommendations From the Pneumonia in Stroke Consensus Group. Stroke. 2015;46(8):2335-40
17. Westendorp WF, Vermeij JD, Zock E, Hooijenga IJ, Kruyt ND, Bosboom HJLW, et al. The Preventive Antibiotics in Stroke Study (PASS): a pragmatic randomised open-label masked endpoint clinical trial. Lancet. 2015;385(9977):1519-26
18. Katzan IL, Dawson NV, Thomas CL, Votruba ME, Cebul RD. The cost of pneumonia after acute stroke. Neurology. 2007;68(22):1938-43
19. Smith CJ, Bray BD, Hoffman A, Meisel A, Heuschmann PU, Wolfe CD, et al. Can a novel clinical risk score improve pneumonia prediction in acute stroke care? A UK multicenter cohort study. J Am Heart Assoc. 2015;4(1):e001307
20. Blanquer J, Aspa J, Anzueto A, Ferrer M, Gallego M, Rajas O, et al. SEPAR Guidelines for Nosocomial Pneumonia. Arch Bronconeumol. 2011;47(10):510-20
21. Ji R, Shen H, Pan Y, Wang P, Liu G, Wang Y, et al. Novel risk score to predict pneumonia after acute ischemic stroke. Stroke. 2013;44(5):1303-9
22. Ji R, Wang D, Shen H, Pan Y, Liu G, Wang P, et al. Interrelationship among common medical complications after acute stroke: pneumonia plays an important role. Stroke. 2013;44(12):3436-44
23. Sugiyama N, Nishiyama E, Nishikawa Y, Sasamura T, Nakade S, Okawa K, et al. A Novel Animal Model of Dysphagia Following Stroke. Dysphagia. 2014;29(1):61-7
24. Li Y, Song B, Fang H, Gao Y, Zhao L, Xu Y. External validation of the A2DS2 score to predict stroke-associated pneumonia in a chinese population: a prospective cohort study. PlosOne. 2014;9(10):1-6
Recibido: 08 de marzo de 2018.
Aprobado: 16 de julio de 2018.
Alexis Suárez Quesada. Especialista de II Grado en Medicina Interna, Medicina Intensiva y Emergencias. Profesor Asistente. Máster en Enfermedades Infecciosas Correo electrónico: alexsua.grm@infomed.sld.cu