Introducción
El lupus eritematoso sistémico (LES) es una enfermedad autoinmune, cuyos indicios se remontan a la Edad Media. Su nombre se atribuye al doctor Rogerius, quien lo empleó por primera vez haciendo alusión al eritema malar típico de la enfermedad. El descubrimiento en 1948 por el hematólogo Malcolm Hargraves de las células del lupus eritematoso o “células LE” marcó un hito en el conocimiento de la fisiopatología y los hallazgos de laboratorio específicos.1 Aun así y a pesar de los avances tecnológicos, la causa del LES continúa siendo un enigma e involucra a una gran variedad de inmunoglobulinas (Ig) autoinmunes.
Las globulinas se cuantifican por medio del proteinograma electroforético (PE) y están constituidas por las α-1 y α-2 globulinas, las β globulinas y las gammaglobulinas o Ig. Se describen hasta cinco clases de Ig (IgG, IgA, IgM, IgD e IgE) y 18 subtipos en correspondencia con el orden de la cadena en su composición.2
Para estimar la presencia de periodos de remisión o actividad en el LES se han validado numerosos marcadores de laboratorio. Las dianas de medición de estos marcadores en su mayoría son Ig autoinmunes específicas, lo que incrementa la sensibilidad a diferencia de una medición global de globulinas. El valor total de las Ig está sujeto a variaciones establecidas por diversos factores, entre ellos destacan las infecciones crónicas causantes de hipergammaglobulinemia. El objetivo de este artículo es describir la utilidad del cociente albúmina/globulina como un indicador de actividad en el LES.
Desarrollo
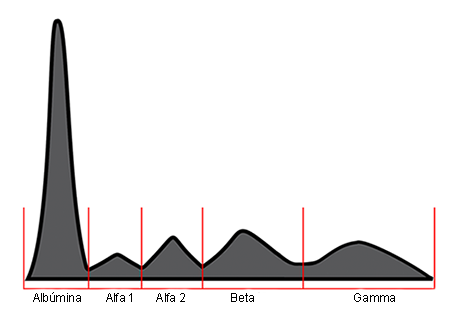
Alrededor del 50 % de los pacientes con LES presentan una hipoalbuminemia con una hipergammaglobulinemia, lo que constituye un factor causal de la inversión del cociente albúmina/globulina. La hipergammaglobulinemia es de tipo policlonal, con predominio de la IgG e IgM (Figs. 1 y 2).2
Sakthiswary y D’Cruz3 demostraron, mediante un metaanálisis con 216 pacientes con LES, que el uso de concentrados de Ig por vía endovenosa (IgEV) redujo significativamente los valores de los índices de actividad SLEDAI, SLAM y LAI (p=0,002; IC=95 %). El mecanismo de acción de las IgEVen el LES no está del todo claro. Se ha postulado que la porción Fc de las IgEV se unen a los receptores Fc de los macrófagos e inhiben la unión de las Ig autoinmunes del propio paciente, e inciden positivamente en la evolución clínica.3 Esta condición de las IgEV sugiere que la elevación de las Ig autoinmunes en el LES desencadena una positividad en los índices de actividad. La elevación de un tipo específico de Ig autoinmune altera la carga global y provoca una hipergammaglobulinemia.
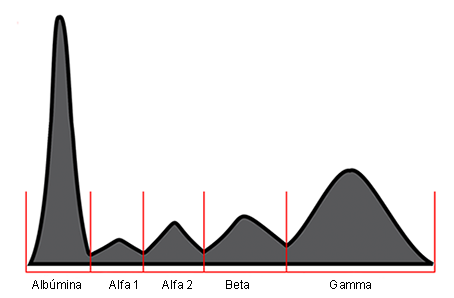
Fig. 2- Representación esquemática de una hipergammaglobulinemia policlonal en los pacientes con lupus eritematoso sistémico.
Los anticuerpos antinucleares (ANA) presentes en el LES son Ig autoinmunes y se clasifican en dependencia de las estructuras que afecten. Estas estructuras abarcan al nucleosoma, las proteínas no histonas asociadas al ADN, las proteínas no histonas asociadas al ARN o antígenos extraíbles del núcleo (ENA), el nucléolo y los antígenos citoplasmáticos. El Consenso Internacional de Patrones ANA (ICAP, por sus siglas en inglés) realizado en el 2016, definió 28 variantes. Las variantes pueden abarcar desde la anti-cell (AC-1) hasta la AC-28 y se agrupan a su vez en patrones nucleares, citoplasmáticos o mitóticos.4
Otros tipos de Ig autoinmunes que cursan con el LES y se relacionan con los patrones ANA e incrementan en periodos de actividad son los anticuerpos anti-ADN de doble cadena (anti-dsADN) (60-83 %),4,5 los anticuerpos anti-P ribosomal (12-16 %), el factor reumatoideo (15-25 %), los anticuerpos ENA (anti-Ro o SSA [25-50 %], anti-La o SSB [10-20 %], anti-Sm [5-30 %] y anti-RNP [25-50 %]), y en menor medida los anticuerpos antifosfolípidos (aPL).4 La hipergammaglobulinemia policlonal está en relación con la diversidad de clases y subtipos de Ig autoinmunes. Los epítopos específicos de las Ig autoinmunes tienden a formar inmunocomplejos circulantes y son causantes de daño orgánico renal.
La hipoalbuminemia se vincula a la presencia de nefritis lúpica, la cual oscila entre el 40-70 % del total de pacientes con LES. Ding y otros hallaron que un incremento en la concentración de albúmina en orina de 7,53 µg/mL cuenta con un 67 % de sensibilidad y un 82 % de especificidad para detectar lesiones renales graves.6Blanco-Mesa y otros estimaron que la proteinuria en 24 horas fue mayor a medida que aumentaba el tiempo de evolución de la enfermedad y disminuía el filtrado glomerular.7Faria-Miguel y otros hallaron que la proteinuria en 24 horas fue mayor en niños diagnosticados con nefritis lúpica de comienzo temprano (p<0,001; IC 95 %), los cuales contaban con un índice de actividad SLICC incrementado (p=0,004; IC 95 %).8
La proteinuria glomerular es el resultado del aumento de la permeabilidad de la pared capilar del glomérulo. Este tipo de proteinuria puede ser selectiva o no selectiva con pérdida de IgG, IgA e IgM. La positividad del antisuero anti-IgM indica la salida de moléculas de elevado peso molecular a través del glomérulo.9 Esta salida es más evidente en los estadios avanzados de la nefritis lúpica con glomeruloesclerosis. La proteinuria en estadios avanzados es similar a la del síndrome nefrótico y se estima que la presenta el 50 % de los pacientes con nefritis lúpica.10 En estos casos se pierde más albúmina que globulinas por su bajo peso molecular, lo que incide directamente en el valor del cociente albúmina/globulina y provoca su inversión parcial o total.
Las entidades clínicas con capacidad para elevar la banda gamma del PE en su forma policlonal abarcan, además del LES, un gran número de enfermedades infecciosas y procesos inmunitarios posteriores a infecciones, artritis reumatoidea, cirrosis hepática, poliarteritis nudosa, esclerodermia, entre otras.2
El hallazgo de un cociente albúmina/globulina invertido resulta insuficiente para afirmar la presencia de actividad lúpica. Es necesario vincular el cociente albúmina/globulina invertido con una valoración clínica y de laboratorio en dependencia de los diversos criterios o índices para determinar actividad (BILAG, ECLAM, SLAM, SLICC, SLEDAI, LAI y SLAQ).11,12 Se debe también excluir las entidades clínicas modificadoras de la banda gamma en su forma policlonal.
La imposibilidad de realizar la exclusión de dichas entidades obliga a realizar un perfil inmunológico completo para poder cuantificar un incremento en los diversos tipos de autoanticuerpos indicadores de actividad. La detección de anticuerpos es imprescindible en estos casos, porque la inversión del cociente albúmina/globulina es un reactante de fase aguda inespecífico con poca utilidad de forma aislada.
Conclusiones
Aun cuando existen muchos factores capaces de modificar el cociente albúmina/globulina, este podría resultar en una prueba de laboratorio útil para determinar actividad en el LES. La interpretación de la prueba debe ir necesariamente aparejada a la estimación de actividad por los criterios clínicos de mayor uso (SLICC, SLEDAI, BILAG, entre otros). Se requieren nuevas investigaciones que evalúen la sensibilidad y especificidad de este hallazgo como un indicador de actividad en pacientes con LES.