Introducción
La esclerosis sistémica es una enfermedad autoinmune del tejido conectivo en la que ocurre inicialmente la vasculopatía y persiste durante toda la enfermedad. El componente inmunitario inicia desde el instante en que se desencadena el proceso inflamatorio que se mantiene por un tiempo, pero disminuye hasta que se detiene en el curso evolutivo de la enfermedad y se sustituye por fibrosis, la cual adquiere gran significación en el proceso patogénico.1
Todo lo anteriormente citado hace inferir que la intensidad del modelo terapéutico debe basarse en el tratamiento más intenso desde el inicio de la enfermedad. Relacionar el tratamiento con la expresividad clínica, cuando tiene lugar, casi siempre es tardío e irreversible el daño vascular. Es necesario vincular el tratamiento médico al acontecer patogénico de la esclerosis sistémica para lograr mejores resultados.
Los instrumentos utilizados para la evaluación de esta enfermedad, ya validados en el consenso de expertos de la liga europea y americana, han sido la guía para el desarrollo de las investigaciones que existen en el mundo.2) Pueden dividirse en tres grupos:
Los que evalúan solo el grado de afectación cutánea (Test de Rodnan Modificado).
Los que exploran la extensión y gravedad de las alteraciones de los diferentes órganos y sistemas (criterios de afectación sistémica y el índice de actividad).
Los cuestionarios que evalúan la capacidad funcional (Cochin Hand Funtion Scale [CHFS]) y el de afección de la cara y la boca (Mouth Handicap in Systemic Sclerosis [MHISS]).
En este trabajo se abordó el índice de actividad, según el validado por el grupo de expertos de la Liga EUSTAR en el año 2002. Los periodos críticos de la enfermedad se demuestran mediante el índice de actividad. Se produce la exacerbación de parámetros clínicos y humorales, que pueden desencadenar estados de agravamiento, consecuencias fatales para el paciente o conducir a la muerte.1,2,3,4
El objetivo de este trabajo es evaluar la evolución clínica del índice de actividad de pacientes con esclerosis sistémica con la terapéutica aplicada.
La ciclofosfamida (CYC) es uno de los inmunosupresores más utilizados en la enfermedad, y de los más estudiados. Algunos autores reportan resultados alentadores y otros le confieren una eficacia moderada.5,6,7 La prednisona es el medicamento de elección, pero tiene particularidades que la diferencian de su modo de empleo en otras enfermedades del colágeno.1,4,6
Métodos
El estudio fue cuasi experimental terapéutico (o prevención secundaria) para determinar si el esquema terapéutico propuesto disminuye las manifestaciones clínicas de actividad sistémica. Inició en marzo del 2013 a marzo del 2016, con una duración de 24 meses, en el Hospital Clínico Quirúrgico Lucía Íñiguez Landín de Holguín.
Se incluyó a 31 pacientes con diagnóstico de esclerosis sistémica que se dividieron en dos grupos según las etapas clínicas obtenidas del índice de desarrollo integral aplicado.3,5 En el grupo A (etapas clínicas I y II) se incorporaron 16 pacientes y en el grupo B (etapas clínicas III y IV), 15 pacientes, teniendo en cuenta el diferente compromiso de daño orgánico.5 A todos los pacientes se les solicitó la firma del consentimiento informado, para el uso del esquema terapéutico validado en la investigación, antes de su aplicación.
La evolución se evaluó según variables del instrumento de evaluación índice de actividad al inicio, a los 6 y 12 meses de aplicado el esquema terapéutico. La incorporación de los pacientes a la terapéutica fue hasta marzo de 2014.
En ambos grupos se utilizó el mismo esquema terapéutico con una combinación de CYC a razón de 0,75 mg/m2 de superficie corporal sin sobrepasar 1 g por cada dosis el primer año de tratamiento; con frecuencia mensual durante 6 meses, y luego cada 2 meses los restantes 6 meses. El segundo año cada 2 meses hasta completar los 24 meses.
La prednisona se administró a una dosis inicial de 20 mg durante 4 semanas y luego se disminuyó la dosis a 5 mg semanal hasta 5 mg diarios.6
Criterios de inclusión para este momento investigativo:
Pacientes con esclerosis sistémica sin contraindicaciones para el uso de CYC.
Voluntariedad para participar.
Criterios de exclusión:
Pacientes con contraindicaciones para el uso de CYC.
Pacientes con enfermedad pulmonar obstructiva crónica según el volumen espiratorio forzado en un minuto y capacidad vital forzada (VEF-1 /CVF >70 %) de lo pronosticado.
Pacientes con trastornos que afectan la función pulmonar como: infarto del miocardio agudo, insuficiencia cardiaca, enfermedad valvular grave, enfisema e hipertensión pulmonar.
Criterios de salida:
Suspensión voluntaria del tratamiento.
Leucopenia persistente por debajo de 3 x 109mm3, infecciones graves y neoplasias.
Reacciones adversas graves al tratamiento que persisten por más de 5 días, a pesar de las medidas para minimizarlas.
El instrumento de evaluación índice de actividad utilizado fue validado por el grupo de expertos de la Liga EUSTAR en el año 2002, con una escala desarrollada que incluye 10 aspectos de la enfermedad, con el nombre de Score de índice de actividad (Tabla 1). Contiene 10 aspectos de la enfermedad; por cada uno de ellos la puntuación es de 0 a 3, y la calificación contempla cada criterio. El resultado en la sumatoria total de 1: actividad mínima; de 2 a 20: actividad moderada; mayor de 20: actividad intensa; se considera 30 la actividad máxima.
Para conocer la asociación de las variables cualitativas analizadas, se empleó la prueba T o la prueba exacta de Fisher cuando los valores eran igual a tres o menores, el grado de significación se fijó en p≤ 0,05. El cálculo de la media, el análisis porcentual y la prueba de Wilcoxon se usaron para conocer la relación de variables a lo largo del tiempo, los que completaron el análisis estadístico de los resultados.
Tabla 1- Instrumento de evaluación índice de actividad
| Aspectos a evaluar | Criterios | Actividad | |
|---|---|---|---|
| Moderada | Intensa | ||
| Piel | TRM >20 | ||
| Vascular | Síndrome de Raynaud/necrosis digital | ||
| SOMA | Artritis/miositis/deformidad | ||
| Digestivo | RGE/hipomotilidad esofágica | ||
| Respiratorio | PFR: Ligera=1, Moderada=2, Severa=3 | ||
| Cardiovascular | Cambios EKG/ECO Doppler | ||
| Renal | Proteinuria/creatinina | ||
| Laboratorio | VSG>30 | ||
| Inmunológicos | Inmunocomplejos circulantes ↑ | ||
| Factor reumatoideo + | |||
Leyenda: EKG: electrocardiograma; TRM: células T de memoria residentes; RGE: reflujo gastroesofágico; PFR: prueba de función respiratoria; VSG: velocidad de sedimentación globular.
Resultados
Al evaluar el índice de actividad, en esta serie predominó la actividad moderada, tanto a los 6 como a los 12 meses durante el tratamiento médico.
En las figuras 1 y 2 para la actividad moderada en el grupo A (etapas clínicas I y II) se muestra la mejoría evidente para el factor reumatoideo y a los 6 y 12 meses con p= 0,023 y p= 0,006, respectivamente, para la piel con células T de memoria residentes (TRM) (p=0,023), así como el RGE con p= 0,014 a los 12 meses.
 Leyenda: FR: factor reumatoideo; ICC: inmunocomplejos circulantes; VSG: velocidad de sedimentación globular o eritrosedimentación; EKG: electrocardiograma; PFR: pruebas funcionales respiratorias; RGE: reflujo gastroesofágico; TRM: células T de memoria residentes.
Leyenda: FR: factor reumatoideo; ICC: inmunocomplejos circulantes; VSG: velocidad de sedimentación globular o eritrosedimentación; EKG: electrocardiograma; PFR: pruebas funcionales respiratorias; RGE: reflujo gastroesofágico; TRM: células T de memoria residentes.Fig. 1 Índice de actividad moderada en pacientes con esclerosis sistémica en el grupo A.
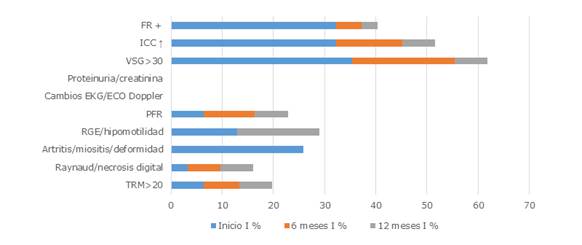 Leyenda: FR: factor reumatoideo; ICC: inmunocomplejos circulantes; VSG: velocidad de sedimentación globular o eritrosedimentación; EKG: electrocardiograma; PFR: pruebas funcionales respiratorias; RGE: reflujo gastroesofágico; TRM: células T de memoria residentes.
Leyenda: FR: factor reumatoideo; ICC: inmunocomplejos circulantes; VSG: velocidad de sedimentación globular o eritrosedimentación; EKG: electrocardiograma; PFR: pruebas funcionales respiratorias; RGE: reflujo gastroesofágico; TRM: células T de memoria residentes.Fig. 2 Índice de actividad intensa en pacientes con esclerosis sistémica en el grupo A.
A los 6 meses, hubo mejoría significativa en la actividad intensa para los siguientes criterios: sistema musculoesquelético (p=0,005) y a los 12 meses (p = 0,004); estudios de laboratorio como VSG > 30 mm/h (p= 0,008); ICC con p= 0,005 a los 12 meses; y el factor reumatoideo positivo a los 6 y 12 meses (p= 0,008 y p= 0,003, respectivamente).
En las figuras 3 y 4 se muestra cómo el grupo B (etapas clínicas III y IV) presentó mejoría significativa en la actividad moderada a los 6 y 12 meses en el ecocardiograma Doppler (p=0,020 y p=0,015), así como en las PFR a los 6 y 12 meses (p= 0,014-0,001).
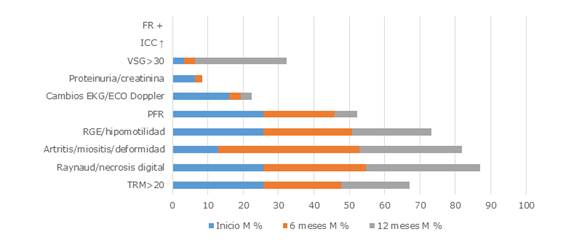 Leyenda: FR: factor reumatoideo; ICC: inmunocomplejos circulantes; VSG: velocidad de sedimentación globular o eritrosedimentación; EKG: electrocardiograma; PFR: pruebas funcionales respiratorias; RGE: reflujo gastroesofágico; TRM: células T de memoria residentes.
Leyenda: FR: factor reumatoideo; ICC: inmunocomplejos circulantes; VSG: velocidad de sedimentación globular o eritrosedimentación; EKG: electrocardiograma; PFR: pruebas funcionales respiratorias; RGE: reflujo gastroesofágico; TRM: células T de memoria residentes.Fig. 3 Índice de actividad moderada en pacientes con esclerosis sistémica en el grupo B.
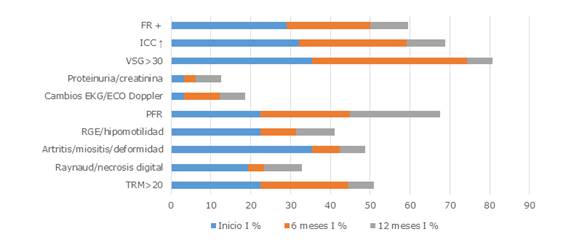 Leyenda: FR: factor reumatoideo; ICC: inmunocomplejos circulantes; VSG: velocidad de sedimentación globular o eritrosedimentación; EKG: electrocardiograma; PFR: pruebas funcionales respiratorias; RGE: reflujo gastroesofágico; TRM: células T de memoria residentes.
Leyenda: FR: factor reumatoideo; ICC: inmunocomplejos circulantes; VSG: velocidad de sedimentación globular o eritrosedimentación; EKG: electrocardiograma; PFR: pruebas funcionales respiratorias; RGE: reflujo gastroesofágico; TRM: células T de memoria residentes.Fig. 4 Índice de actividad intensa en pacientes con esclerosis sistémica en el grupo B.
En la actividad intensa hubo mejoría evidente para los criterios relacionados con TRM a los 12 meses (p= 0,023); RGE e hipomotilidad para el sistema digestivo a los 6 y 12 meses (p=0,008 y p= 0,014). Los exámenes de laboratorio y otros auxiliares, a los 6 y 12 meses como ICC (p=0,025 y p=0,008), así como el factor reumatoideo positivo con p=0,014 a los 12 meses.
Se concluyó que en ambos grupos la mejoría del índice de actividad fue significativa, tanto para la actividad moderada como la intensa, más notable a partir de los 12 meses con p≤0,05, para el grupo A.
Se demostró baja susceptibilidad para la mejoría de los sistemas gastrointestinal y respiratorio, en el trascurso de la evaluación de este índice.
Discusión
Fue llamativo cómo el índice de actividad alcanzó una mejoría más significativa en etapas clínicas tempranas (I y II) que, en las más avanzadas con mayor compromiso de órganos internos, mejor reversibilidad y menor índice de actividad, de ahí la evolución más favorable con la terapéutica aplicada. Esto confirmó la necesidad de terapéuticas agresivas y protocolizadas desde etapas tempranas de la enfermedad, considerada por muchos autores como grave desde su diagnóstico.3,4,5,6,7,8,9
En las etapas III y IV se evidenció una actividad inestable con picos de exacerbaciones, donde las diferentes variables no logran disminuir de forma significativa la actividad sistémica de la enfermedad, a pesar de que mantiene estabilidad en la evolución clínica y función de órganos vitales como el corazón y los riñones.5
La CYC, como agente alquilante, afecta a las células de división rápida, altera el ciclo celular, disminuye las células B y T, la proliferación celular y la producción de anticuerpos; como consecuencia, modifica la respuesta humoral y celular.3,4
El mecanismo de acción anteriormente descrito no distingue las células alteradas de las normales, e induce el estado de inmunosupresión.1,3,4,7,8
El empleo de la CYC es amplio en la gama de las enfermedades reumáticas, donde sus efectos secundarios pueden ser prevenibles y controlables. En la esclerosis sistémica ha demostrado su poder inmunosupresor, efectos antiinflamatorios y antifibróticos importantes.9,10,11,12
En el caso específico de la CYC, se muestra experiencia en su uso desde 1997, diversas publicaciones reportaron su aplicación en diferentes esquemas, dosis y vías de administración.
Inicialmente fue ensayada en la enfermedad intersticial pulmonar y en las crisis renales. La observación de los pacientes tratados evidenció mejoría clínica en otros órganos y sistemas como la piel, musculoesquelético, microvascular, digestivo y cardiovascular. Es más eficaz si el tratamiento se administra antes del compromiso funcional. Se sugiere la necesidad de la inmunosupresión a largo plazo para mantener la respuesta favorable inicial.9,10,11,12
Es importante reconocer la diversidad de los resultados con el tratamiento de CYC en la comunidad científica en el mundo, relacionado con limitaciones de los diseños de estudio, el escaso número de pacientes por series de estudio, las dosis utilizadas, la combinación o no con dosis de esteroides, el tiempo de evolución de la enfermedad al emplear el medicamento, así como el tiempo de uso y la vía de administración.
Se comprobó que no ofrece iguales ventajas cuando se emplea sola la CYC que asociada a esteroides. Ensayos clínicos multicéntricos a doble ciegas con CYC por vía oral a dosis menor de 2 mg/kg o igual durante 1 año han reportado efectos significativos pero modestos sobre la disnea, la función pulmonar y el engrosamiento cutáneo.13
Un ensayo clínico multicéntrico a doble ciegas con placebo controlado concluyó que la administración de CYC intravenosa con esteroide oral durante 6 meses, seguida de azatioprina oral durante 1 año, en pacientes con fibrosis pulmonar, estabiliza la función respiratoria.14
Las dosis de CYC utilizadas varían de un estudio a otro, así como los esquemas de tratamientos. Herrick y otros15 emplearon una dosis por vía intravenosa de 500 mg/m2 de superficie corporal mensual durante 6-12 meses, mientras que por vía oral 1-2 mg/kg/día durante 12 meses, al cabo de este tiempo se cambió a metotrexate o azatioprina.
Otro de los esquemas contempló la posología inicial en infusiones intravenosas mensuales de 600 mg/m2 de superficie corporal, durante 6 meses. Si la respuesta es clínicamente favorable (mejora de las pruebas de función pulmonar y de las pruebas de imagen), la frecuencia puede reducirse a cada 2 meses durante otro medio año, luego cada 3 meses, y, por último, cada 6 meses.16,17
Como alternativa a la administración intravenosa, se puede emplear la vía oral, en dosificación continua de 2 mg/kg/día durante 1 año, se reevalúa la respuesta al final del tratamiento, según autores españoles integrantes del Consenso General de Colegios Oficiales de Farmacéuticos y de la Sociedad Argentina de Dermatología.16
En La Habana el estudio realizado en el Hospital Hermanos Ameijeiras puso en práctica dos protocolos. Uno para un grupo A: se administró CYC en pulsos intravenoso a razón de 0,75 mg a 1 g/m2 de superficie corporal (dosis máxima 1 g) mensual, durante 6 meses y bimensual los 6 meses restantes, más prednisona a 1 mg/kg/día durante 4 semanas, y después se fue disminuyendo la dosis a razón de 5 mg cada 2 semanas hasta llegar a 10 mg. Al grupo B se le administró CYC a igual dosis y de igual forma que el primer grupo, unida a prednisona por vía oral 10 mg diaria.18
La investigación demostró que ambos grupos de tratamiento se favorecieron, con un perfil de seguridad bueno para el tratamiento de la afectación pulmonar y cutánea en la esclerosis sistémica.18
Derivado de resultados de estudios procedentes de ensayos clínicos, el uso de CYC fue considerado por EULAR, en el Congreso de Barcelona del 2009, para el tratamiento de la esclerosis sistémica. Se recomendó que los pacientes afectados fueran tratados desde estadios tempranos para lograr una mejor respuesta.19
La asociación a esteroide se sugirió a dosis menor de 20 mg, y en caso de factores de riesgo de desarrollar crisis renal aguda se indicó por debajo de 10 mg diarios. Entre 1998 y el 2008 la mayoría de los estudios publicados tenían como centro determinar la mejor dosificación de los esteroides. Se comprobó que dosis por encima de 15 y 20 mg por un periodo de 1-6 meses se asociaba a incremento de las crisis renales, mientras que bajas dosis no se asociaron con el incremento de la actividad para este sistema.13,14
Estudios controlados con placebo a doble ciegas demostraron efectos favorables sobre la actividad cutánea y pulmonar. Su principal indicación es la alveolitis, pero también se usa en las vasculitis y gangrenas distales rápidamente progresivas en pulsos de 500 mg a 1 g, seguidos de la administración por vía oral de 100 mg/día.14,15,16,17,18
Estudios prospectivos abiertos comparan los efectos entre el uso de inmunosupresores como CYC y micofenolato de mofetil. Hasta ahora no se contemplan relevantes diferencias, pero continúan las series de estudios.16,19
Está demostrado que un paciente con esclerosis sistémica y afectación grave de un órgano tiene mayor probabilidad de involucrar a otros órganos en la evolución de la enfermedad.
En la literatura se plantea que estas alteraciones asociadas a enfermedad activa justifica el uso de tratamientos más agresivos, entre ellos esteroides e inmunosupresores, por la presencia de actividad inflamatoria sistémica, con alteraciones que pueden ser eventuales, susceptibles a cambios o permanentes que dejen secuelas o conduzcan a la muerte.3,4,5,6,7,16,17,18,19
Las evidencias y recomendaciones de las guías prácticas e investigaciones de varios países del mundo, incluyendo el área geográfica de las Américas, han constituido un punto de partida para establecer un referente nacional que contemple un mejor manejo del paciente con esta enfermedad.20,21,22














