GENERALIDADES DE LAS ARRITMIAS VENTRICULARES
Las arritmias ventriculares malignas (AVM) son procesos diversos de gran complejidad, que transitan entre la estabilidad y la inestabilidad; en ellas intervienen factores dinámicos (restitución del potencial de acción, velocidad de conducción, memoria de corto plazo, corrientes electrotónicas) en interacción (heterogeneidad tisular con mayor o menor riesgo de AVM) con la homogeneidad; la isotropía; la anisotropía; los gradientes del potencial de acción; la remodelación estructural (fibrosis, infarto), eléctrica (hipertrofia, miocardiopatía [MCP, cardiomyopathy en su idioma original]) y neurológica; y los defectos genéticos (canalopatías, MCP). Dentro de ellas, la fibrilación ventricular (Figura 1) es una condición heterogénea con mecanismos y desencadenantes variados1.

Figura 1 Paciente con infarto miocárdico e insuficiencia cardíaca, reanimado de evento de muerte súbita por fibrilación ventricular. Se observan extrasístoles ventriculares con intervalo corto de acoplamiento. En el trazado inferior, respuestas ventriculares repetitivas. También hizo rachas de taquicardia ventricular y tormenta eléctrica. Se implantó cardioversor-desfibrilador automático.
Dispersión
La dispersión espacial y temporal es uno de los signos eléctricos premonitorios más importantes, presente entre ápex y base, septum y paredes libres, ambos ventrículos (circunferencial) y en la pared miocárdica1.
Taquicardia ventricular
La taquicardia ventricular es uno de los grandes capítulos dentro de las taquicardias con QRS ancho, con mecanismos y modelos electrocardiográficos múltiples (Figura 2). Su circuito puede implicar una vía común diastólica, sitios de entrada y salida, asas interiores y exteriores, y vías contempladoras finales, muertas en diversas localizaciones.

Figura 2 Miocardiopatía e insuficiencia cardíaca. Se observa taquicardia ventricular bidireccional, polaridad positiva y negativa alternante del complejo QRS.
Insuficiencia cardíaca
El 85% de los pacientes con insuficiencia cardíaca (IC) avanzada presenta AVM (incluidas las no sostenidas) y al identificar alto riesgo se implantaría un cardioversor-desfibrilador automático (Figura 3). La muerte súbita (MS) se presenta en la IC, pues la taquicardia ventricular monomorfa puede degenerar en fibrilación ventricular y originar la mayor parte de las MS arrítmicas. Las diversas AVM (fibrilación ventricular, taquicardia ventricular sostenida y no sostenida, y extrasístoles ventriculares [EV], trascendentes no sólo por su densidad sino por su irregularidad), son facilitadas por factores como: la hipertrofia ventricular, el infarto miocárdico, la activación simpática, las alteraciones electrolíticas, las bradiarritmias, la disociación electromecánica, los fármacos antiarrítmicos (proarritmia) y la fibrilación auricular2-4.
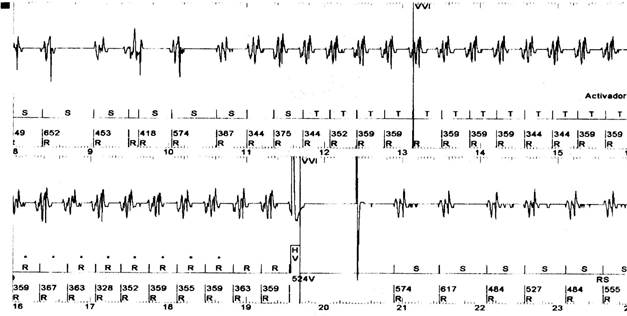
Figura 3 Paciente con miocardiopatía dilatada isquémica, aneurisma del ventrículo izquierdo, taquicardia ventricular, tormenta eléctrica y choque eléctrico del cardioversor-desfibrilador automático, que revierte la arritmia a ritmo sinusal.
Los mecanismos de la MS arrítmica en la IC pueden ser múltiples: actividad disparada, receptores de estiramiento, automatismo anormal, reentradas y posdespolarizaciones tempranas2-4.
Signos eléctricos premonitorios
La IC y las arritmias coexisten, se agravan o una origina la otra. En el recuadro se enumeran algunos de los signos eléctricos premonitorios que estratifican riesgo de AVM (tanto de debut como de recidivas) y de MS, todos son de baja sensibilidad y especificidad; algunos de ellos pueden transitar desde la normalidad hasta lo patológico5.
Recuadro. Algunos de los signos eléctricos premonitorios para estratificar riesgo de arritmias ventriculares malignas y de muerte súbita5.
Nada debe considerarse aislado, ser olvidado, ni tampoco concedérsele valor absoluto; se requiere una visión integral para poner todo en su lugar y acercarse lo más posible a la realidad de cada paciente, lo cual aún no se ha logrado por completo a pesar de los numerosos trabajos científicos y publicaciones sobre estos temas. Se han descrito más de 70 signos eléctricos que pueden representar un mal pronóstico pero son esquivos, ninguno es despreciable pero tampoco absoluto, otros fueron olvidados y se han retomado con posterioridad. Un sujeto reanimado de un episodio de AVM o de MS, puede tener un electrocardiograma y secuencias eléctricas normales, o presentar las alteraciones eléctricas propias de su enfermedad basal (isquemia, MCP, valvulopatía, enfermedad congénita). Si el paciente ha tenido AVM o ha sido reanimado de un episodio de MS, resulta fácil retroceder y precisar los signos eléctricos premonitorios así como observar los que aparezcan en su seguimiento. Pero lo realmente difícil o imposible es adelantarse a los acontecimientos en quienes no han tenido el episodio fatal y predecir quiénes van a presentarlo. Los pacientes con alto riesgo sólo representan el 10% y en ellos es fácil estratificar pronóstico y tomar la conducta adecuada. Lo verdaderamente conflictivo es, entre los de bajo riesgo (90%, los no protegidos), precisar los que son de alto riesgo5.
Torsión de puntas
En la torsión de puntas, Kirchhof et al6 señalan algunos índices para predecir riesgo de presentarla: inicio de la arritmia con onda TU gigante, TU anormal, posdespolarización temprana como desencadenante, ascenso lento del QRS de la EV, ciclos corto-largo-corto, pausas, mayor duración del QRS en el primer latido de la torsión, menor ángulo del QRS, onda U prominente, alternancia del intervalo QT y de la onda T (en duración, configuración, polaridad, amplitud), fragmentación del QRS, aumento del intervalo QT y del TPICO-TFINAL.
En la disfunción de ventrículo izquierdo se destacan algunos predictores de AVM: la duración del complejo QRS, la dispersión del intervalo QT, las alteraciones en el estudio Holter y en el electrograma de señales promediadas, la variabilidad anormal de la frecuencia cardíaca, la alternancia de la onda T, la estimulación eléctrica programada (si es positiva indica alto riesgo, si es negativa no siempre resulta concluyente). Kentta et al7 estudiaron la heterogeneidad espacial de la despolarización y de la repolarización (ondas R, J y T) en el electrocardiograma de doce derivaciones con métodos automáticos, en sujetos con corazón sano y en reanimados de MS. Esta heterogeneidad puede llevar a una arritmia letal7.
Wellens escribió en el 2008: “Despite extensive efforts to better identify people dying an arrhythmic death out of hospital, we are able to recognize only (10% of those victims as being at high risk before the event”8.
Entonces se llega a la gran conclusión a la que no querríamos arribar: los signos eléctricos premonitorios de AVM y de MS, son buenos para identificar grandes grupos de riesgo pero no lo son tanto para, dentro del gran grupo de bajo riesgo (la mayoría), identificar los individuos de alto riesgo.
Sistema His-Purkinje
El sistema His-Purkinje es importante en la génesis de las AVM, en general se trata de EV estrechas y con intervalo corto de acoplamiento, que participan en mecanismos de reentrada, ectopia y actividad disparada, y cuya ablación se realiza en algunos laboratorios9.
Fibrilación ventricular
Ideker et al10 discuten cuántos tipos de fibrilación ventricular existen, varios, muchos, 300000, en alusión al número anual de MS en Estados Unidos; esta variabilidad se explica porque un corazón no es exacto a otro, cada uno tiene su tipo de inestabilidad, el mismo órgano puede tener diferentes tipos de fibrilación ventricular en distinto momento, e incluso el mismo corazón puede tener diferentes tipos, en distintas regiones al mismo tiempo. En general existen dos mecanismos en la fibrilación ventricular: tipo I, onditas reentrantes rápidas, de vida corta, cambiantes y con poca repetición; y tipo II, rotor madre con onditas hijas, más lentas, frentes largos y vías similares con repetibilidad. O ambos tipos, porque no se excluyen, pueden interactuar y resultan influenciados por la enfermedad de base, el empleo de fármacos antiarrítmicos y la propia duración de la arritmia10,11.
Extrasístoles ventriculares
Las EV pueden ser predictoras o desencadenantes de AVM, consecuencia o causa de una MCP inducida por EV. Las EV pueden desencadenar una AVM y originar muerte arrítmica, pero también dar lugar a una MCP reversible, disfunción ventricular izquierda y funcionar como factor modificable de riesgo (con y sin enfermedad cardíaca estructural, inducirla o agravar una preexistente). La conducta podrá variar: la abstención, el empleo de fármacos antiarrítmicos o la ablación, siempre con el objetivo de lograr la mejoría de la función ventricular12-16.
En cuanto a la MCP inducida por EV, existen varios factores a tomar en cuenta: la enfermedad básica, la función del ventrículo izquierdo, las alteraciones iónicas, la comorbilidad, el grado de disincronía, la taquicardia, la bradicardia, la remodelación ventricular y sus dimensiones. Por otro lado, hay factores dependientes de las EV: la densidad, el pleomorfismo, la anchura, el origen, el acoplamiento largo, el carácter interpolado, el aumento de la dispersión y la duración del potencial de acción, el número de focos, las alteraciones iónicas, la heterogeneidad, los modelos y el tiempo de duración.
Se impone determinar en cada caso, qué es primero: la EV que lleva a disfunción grave o sutil y a la MCP, o la disfunción es la que origina las EV, en todo lo cual puede haber solapamientos y cambios. La densidad de las EV es un factor de riesgo, no el único, para predecir un final adverso en pacientes con o sin enfermedad cardíaca estructural; de existir alguna alteración preexistente, las EV frecuentes potencian la disfunción del ventrículo izquierdo (que sería reversible). Aun cuando la MCP inducida por EV es una enfermedad real, surgen algunas dudas: presencia de numerosas EV sin IC; primera evidencia de MCP (marcador de enfermedad cardíaca estructural subyacente preclínica), incluso si se suprimen las EV; sustratos ocultos (identificables por resonancia magnética nuclear o por mapeos), inflamación, miocarditis, fibrosis; epifenómenos; causas y mecanismos variados; densidad requerida (“dosis”) para que se produzca; empleo de fármacos antiarrítmicos y sus conflictos (estudio CAST); ablación efectiva de EV de bajo riesgo (se normaliza la fracción de eyección y no hay IC); densidad semejante de las EV en casos con y sin disfunción ventricular izquierda; diversos sitios de origen (tracto de salida de ventrículo derecho, seno de Valsalva, pared libre de ventrículo derecho e izquierdo, epicardio e intramural); cuándo la EV es predictora de IC y de mortalidad; cuál es la duración del QRS que carece de riesgo de MCP inducida por EV y cuánto para que la supresión de las EV mejore la función del ventrículo izquierdo. En algunos casos la EV es un predictor independiente de disfunción ventricular izquierda12-17.
La disincronía es un factor trascendente en la MCP por pacing del ventrículo derecho, por bloqueo de rama izquierda y por preexcitación (induce disfunción del músculo papilar, regurgitación mitral, sobrecarga de volumen del ventrículo izquierdo y respuesta autonómica modificada por la conducción ventrículo-auricular). Las EV del ventrículo derecho resultan más adversas que las del izquierdo y las de la pared libre del ventrículo derecho o izquierdo más que las del tracto de salida del ventrículo derecho. El tratamiento debe hacerse si empeoran los síntomas relacionados con las EV (no siempre es así), se deteriora la función cardíaca o se presentan taquiarritmias ventriculares12-16.
La MCP inducida por extrasístoles tiene que ver con la remodelación electrofisiológica en el contexto de la remodelación de las cámaras cardíacas. Las contracciones tempranas y frecuentes pueden asociarse a enfermedad cardíaca estructural con aumento de la MS y de la mortalidad total12-16.
En cuanto a tratar o no las EV, existen opiniones a favor, en contra y todo lo contrario… porque ¿qué tan agresivos debemos ser? Las EV son modestas, humildes, pero si se suprimen mejora la función cardíaca en la MCP inducida por extrasístoles, entonces ¿debe ser tratamiento de primera línea? Otros opinan que seríamos tontos otra vez al tratar las EV postinfarto como cuando su supresión se proponía con fármacos antiarrítmicos en los años 80 y se recibió una dura lección al interpretar que las EV postinfarto miocárdico aumentaban el riesgo de AVM al desencadenarlas, y que al suprimirlas disminuiría ese riesgo pero… se encontró que existía peligro incluso si se lograba mejoría de la fracción de eyección. El estudio CAST revolucionó estos conceptos, se podía disminuir el número de las EV pero aumentar la mortalidad y junto al Electrophysiology Studyvs Electrocardiographic Monitoring, se independizó la densidad de las EV y su tratamiento exitoso con el empleo de antiarrítmicos, del riesgo de AVM sostenida. La misma idea renació tiempo después con los procedimientos ablativos que podían revertir la MCP y cambiar la población potencial de alto riesgo. No siempre existe una relación entre la frecuencia de las EV y la fracción de eyección; puede haber un subregistro de las EV de una o dos formas, con fracción dañada, y obtenerse un mayor beneficio con su supresión. Otro factor a tomar en cuenta es la potenciación postextrasistólica que también puede mejorar la fracción de eyección, al menos a corto plazo18-21.
En este terreno hay muchas más preguntas que respuestas: ¿cuántas EV son demasiadas?, ¿es efectiva la ablación de las EV y disminuye la necesidad del cardioversor-desfibrilador automático implantable?, ¿qué pacientes postinfarto miocárdico requieren la ablación?, ¿por qué pacientes con EV pueden tener menos escara?, ¿cuál es la explicación para la MCP inducida por EV?, ¿qué pacientes con disfunción ventricular necesitan el cardioversor automático implantable?; la ablación de las EV en pacientes seleccionados postinfarto puede mejorar la fracción de eyección pero ¿esto es suficientemente bueno y mejora el final?; aumenta la sobrevida, pero ¿puede haber recurrencias meses y años después de la MCP inducida por EV?18-21
Fibrilación auricular
La asociación de la IC con la fibrilación auricular es común y trascendente, aumenta el riesgo de ictus, el tiempo de hospitalización y la mortalidad. También puede haber MCP inducida por la arritmia. Se ha discutido si el control del ritmo con fármacos antiarrítmicos es superior o no al control de la frecuencia cardíaca en pacientes con IC y fibrilación auricular, pero la morbilidad y la mortalidad son más altas que en la insuficiencia aislada. En tiempos recientes, se ha discutido el tratamiento de la fibrilación auricular mediante la ablación frente a su terapia medicamentosa y se defiende que la primera disminuye la mortalidad hospitalaria, mejora la fracción de eyección y los episodios de la arritmia (estudio CASTLE-AF, Catheter Ablation vs.Standard conventional Therapy in patientswith Left Ventricular dysfunction and atrial fibrillation). Se trata de dos epidemias emergentes y dos emergencias epidémicas vinculadas. La fibrilación auricular y la disfunción ventricular constituyen un círculo vicioso electromecánico: la fibrilación como causa o consecuencia de la disfunción sistólica ventricular, con reducción de la fracción de eyección y presentación de IC, se le considera predictor independiente de muerte cardiovascular a todas las edades, en hombres y mujeres. Existe la fibrilación sin enfermedad cardíaca estructural preexistente con grave disfunción ventricular izquierda reversible (poco común, pero no rara), la arritmia que lleva a una disfunción ligera o moderada, más común, y la disfunción preexistente que lleva a la fibrilación con reducción de la función ventricular izquierda no reconocida clínicamente22,23.
Tormenta eléctrica
La tormenta eléctrica es un marcador independiente de mayor mortalidad en pacientes con disfunción ventricular y cardioversor-desfibrilador automático implantable, causada por empeoramiento de la IC y se presenta dos veces más si la fracción de eyección es inferior al 35%. Sin embargo, es difícil identificar el factor precipitante de la tormenta eléctrica, lo cual sólo se logra en el 26% de los casos. En nuestra experiencia, se pudo identificar el factor precipitante de la tormenta en el 26,7% en pacientes con cardioversor y, en la mitad de ellos, la IC fue el detonante24.
PALABRAS FINALES
Existen estrechos vínculos entre la IC, las AVM, la fibrilación auricular, otras arritmias y la MS. Como la frase histórica y la canción: ¿quién tiró la primera piedra? Dada la complejidad de las arritmias, su variada fisiopatología, los muchos factores que intervienen, su propia variabilidad y los numerosos predictores eléctricos descritos, ¿puede el médico acercarse a la estratificación eléctrica de riesgo por grupos?: ¡Sí! ¿Y por individuos?: ¡Muy difícil o imposible! Y ¿cuál es el papel de la ablación de las EV y de la fibrilación auricular en pacientes con IC?















