Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Finlay
versión On-line ISSN 2221-2434
Rev. Finlay vol.5 no.4 Cienfuegos oct.-dic. 2015
ARTÍCULO ORIGINAL
Factores de riesgo de neumonía asociada al ictus: cohorte prospectiva de estudio
Risk Factors for Stroke-associated Pneumonia: A Prospective Cohort Study
Alexis Suárez QuesadaI , Ezequiel López EspinosaI , Noelsis García VerdeciaI , Miguel Ángel Serra ValdésII
I Hospital General Universitario Carlos Manuel de Céspedes, Bayamo, Granma, Cuba, CP: 85100
II Hospital General Docente Enrique Cabrera, La Habana, La Habana, Cuba
RESUMEN
Introducción: la neumonía asociada al ictus agudo incrementa la estadía hospitalaria y constituye un importante factor de riesgo de mortalidad y morbilidad.
Objetivo: determinar los factores de riesgo para pronosticar neumonía asociada al ictus.
Métodos: se realizó un estudio observacional analítico de cohorte única prospectiva en 390 pacientes con criterios clínicos y de neuroimagen de ictus agudo, con edades comprendidas entre 16 y 93 años de edad, admitidos en el Hospital Carlos Manuel de Céspedes desde enero 2012-marzo-2015. La comparación univariante de las variables cualitativas se realizó mediante uso de tablas de supervivencia de Kaplan-Meier, se empleó el modelo de regresión de Cox para el análisis multivariante de los factores de riesgo de neumonía, el área bajo la curva ROC se utilizó para determinar el poder de discriminación del modelo.
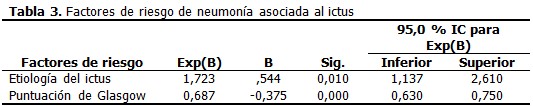
Resultados: se estudiaron 213(54,6 %) pacientes con ictus isquémico y 177(45,4 %) con ictus hemorrágico. La totalidad de casos con neumonía intrahospitalaria tras el ictus agudo fue de 25, 4 %. Los sujetos que desarrollaron neumonía tenían menor puntuación en la escala de Glasgow y una alta puntuación en la escala modificada de Rankin. Se identificaron los siguientes factores de riesgo mediante regresión de Cox: puntuación de Glasgow (Exp (B): 0,687; IC 95% 0,630 a 0,750) y el subtipo de ictus (Exp (B): 1,723; IC 95% 1,137 a 2,610); el área bajo la curva ROC fue de 0,88.
Conclusiones: los factores de riesgo que favorecen la aparición de neumonía intrahospitalaria en pacientes con ictus agudo son: el deterioro del nivel de conciencia, unido a la variedad hemorrágica del ictus. Otras variables con influencia fueron: la enfermedad pulmonar obstructiva crónica y la enfermedad cardiaca como comorbilidad.
Palabras clave: accidente cerebrovascular, neumonía, infección hospitalaria, factores de riesgo, mortalidad, morbilidad.
ABSTRACT
Background: stroke-associated pneumonia prolongs hospital stay and is an important risk factor for morbidity and mortality.
Objective: to determine risk factors for stroke-associated pneumonia.
Methods: a prospective single-cohort study was conducted involving 390 patients aged 16-93 years who met clinical and neuroimaging criteria for acute stroke treated at the Carlos Manuel de Céspedes Hospital from January 2012 through March 2015. Univariate comparison of qualitative variables was performed by using the Kaplan-Meier method. The Cox regression model was applied for multivariate analysis of risk factors for pneumonia. The area under the ROC curve was used to determine the discriminatory power of the model.
Results: two hundred thirteen patients (54.6 %) with ischemic stroke and 177 (45.4 %) with hemorrhagic stroke were studied. Cases of nosocomial pneumonia after acute stroke accounted for 25.4 %. Subjects who developed pneumonia had lower scores on the Glasgow scale and higher scores on the modified Rankin scale. The following risk factors were identified using the Cox regression model: Glasgow coma score (Exp (B): 0.687; 95 % CI 0.630 to 0.750) and stroke subtype (Exp (B): 1.723; 95 % CI 1.137 to 2.610). The area under the ROC curve was 0.88.
Conclusions: the risk factors for the development of nosocomial pneumonia after acute stroke found were the level of consciousness and suffering a hemorrhagic stroke. Other influencing variables are chronic obstructive pulmonary disease and heart disease as a comorbid condition.
Key words: stroke, pneumonia, cross infection, risk factors, mortality, morbidity.
INTRODUCCIÓN
Las complicaciones médicas son comunes entre los pacientes que sufren ictus en la fase aguda de hospitalización. La evidencia ha demostrado que estas complicaciones médicas no solo incrementan la estadía hospitalaria y los costos médicos sino que también son la mayor causa de mortalidad y morbilidad tras el ictus.1,2 La infección postictus ocurre generalmente entre los primeros 7 días. Las infecciones urinarias alcanzan entre el 10 y el 29 % respectivamente, y la infección respiratoria entre el 11,2 % y el 18 % de los casos,3 aunque otros informes reportan una incidencia desde el 2,4 % hasta un 47 % para la neumonía asociada al ictus agudo (NAIA) dependiendo del tipo de unidad de tratamiento del paciente y de la severidad del ictus en la población estudiada4,5 la importancia es aún mayor al identificarse que la NAIA triplica el riesgo de morir en este grupo de pacientes.6 A pesar de las intervenciones eficaces para el tratamiento y prevención de la NAIA esta encabeza las causas de mortalidad.4 Debido a la variabilidad en los diseños de los estudios de investigación sobre neumonía en el ictus (mezclando pacientes agudos y no agudos, limitado número de factores bajo consideración, la inclusión de pacientes sin ictus junto a pacientes con ictus) ha sido difícil identificar el conjunto de factores de riesgo independientes.4 Los factores más consistentes son: la disfagia, la severidad del ictus, el deterioro del nivel de conciencia y la comorbilidad asociada,7,8 otros que también han sido identificados son: la edad, índice de Barthel menor de 5 puntos, escala de Rankin modificada mayor o igual 4, el vómito al inicio del ictus, el uso de sondas nasogástricas.9, 10 En nuestro país no son frecuentes los estudios que aborden esta temática; en nuestra provincia, particularmente en nuestro hospital, se han realizado estudios observacionales analíticos que han identificado un 19, 9 % de neumonía asociada al ictus isquémico11 y un 36,2 % en la hemorragia intraparenquimatosa espontánea,12 en cambio, no se han encontrado artículos que evalúen la incidencia y factores de riesgo de NAIA en ambos tipos etiológicos de ictus simultáneamente, ni el comportamiento de esos factores durante el período de evolución intrahospitalaria de los pacientes. Motivados por lo expuesto con anterioridad, se decidió realizar esta investigación que tiene como objetivo: identificar los factores de riesgo de neumonía en los pacientes con ictus agudo.
MÉTODOS
Se realizó un estudio observacional analítico de cohorte única prospectiva en pacientes con criterios clínicos y de neuroimagen de ictus agudo (IA), admitidos en la sala de ictus del Hospital Provincial Universitario Carlos Manuel de Céspedes, de la ciudad de Bayamo, provincia Granma, en el período comprendido desde enero del 2012 hasta marzo del 2015. Fueron incluidos en este estudio los pacientes con diagnóstico al ingreso de IA por la clínica y la tomografía axial computarizada. Los criterios de inclusión de neumonía intrahospitalaria (NIH) fueron: la existencia, luego de las primeras 48 horas del ingreso y durante los primeros 7 días, de un infiltrado nuevo en la radiografía de tórax y dos o más de los siguientes: a) temperatura > 38 °C; b) leucocitosis > 10,000 células/ml o leucopenia < 4,000 células/ml; c) esputo purulento (> 25 leucocitos/campo y < 10 células escamosas/campo), y d) ingreso en una unidad de hospitalización convencional (sala de ictus); lo anterior se consideró teniendo en cuenta The Centers for Disease Control Nosocomial Infection definitions.13 Se excluyeron los pacientes con antecedentes de ictus, los menores de 15 años de edad, los pacientes con hemorragia subaracnoidea, pacientes portadores de hemorragia intracerebral secundaria y las gestantes. Ningún paciente recibió ventilación mecánica artificial ni tratamiento neuroquirúrgico, todos ellos tuvieron al ictus como principal diagnóstico al ingreso. El evento inicial para incluirse en la cohorte de estudio fue el inicio del ictus agudo y el evento final el desarrollo de neumonía intrahospitalaria en los primeros 21 días como complicación. Entre las variables del estudio se encuentran: Covariables: como variables escala (cuantitativas) se consideraron a la edad (años cumplidos), las cifras de glucemia (mmol/l), la puntuación en la escala Glasgow al ingreso y estadía en sala (días). Como variables nominales dicotómicas se consideraron el sexo (femenino o masculino), hábito de fumar, la variedad etiológica del ictus (isquémico=0 y hemorrágico=1), la comorbilidad asociada antecedentes de enfermedad pulmonar obstructiva crónica (EPOC), enfermedad cardiaca, diabetes mellitus, insuficiencia renal crónica, alcoholismo o neoplasias), la presencia de disfagia14 y una puntuación en la escala de Rankin modificada ≥ 4. Se obtuvieron las frecuencias absolutas y relativas (porcentajes) de las variables cualitativas. Para las variables cuantitativas se obtuvieron las medias, medianas y desviaciones estándar. Para valorar la asociación entre las variables cualitativas se empleó el test de Ji-Cuadrado de Mantel. Como parte del análisis univariante se determinó el tipo de distribución de las variables continuas, con tal propósito se empleó la prueba de normalidad de Kolmogórov-Smirnov y el estadístico de homogeneidad de varianza Levene. Las variables cualitativas se compararon usando Kaplan-Meier, las proporciones acumuladas se estimaron luego de analizar las tablas de supervivencia, para las comparaciones globales se utilizó el test de Log Rank (Mantel-Cox). Las variables que resultaron significativas en el univariante se incorporaron al análisis multivariante. En el análisis multivariante de los factores pronósticos se empleó el modelo de regresión proporcional de Cox, mediante el cual se modela el riesgo de la ocurrencia de un suceso (NAIA) en cada instante del tiempo en función de diferentes covariables. Se evaluó la capacidad del modelo de regresión para diferenciar a los individuos que sufrieron NAIA de los que no lo sufrieron, asignándole a cada paciente el valor del Exp (B) y se generó la curva receptor- operador (ROC) (por sus siglas en inglés). El paquete estadístico SPSS versión 18,0 se utilizó para todo el análisis estadístico realizado. Antes de ser incluidos en el estudio se les solicitó a cada paciente, o en su defecto al familiar (en caso de deterioro importante de nivel de conciencia o afasia severa), su consentimiento informado verbal y escrito. El estudio, el cual forma parte de un proyecto de investigación de la institución, fue aprobado por el consejo científico y comité de ética del Hospital Provincial Universitario Carlos Manuel de Céspedes, de Bayamo, Granma, quienes evaluaron la calidad metodológica y el cumplimiento de los principios bioéticos.
RESULTADOS
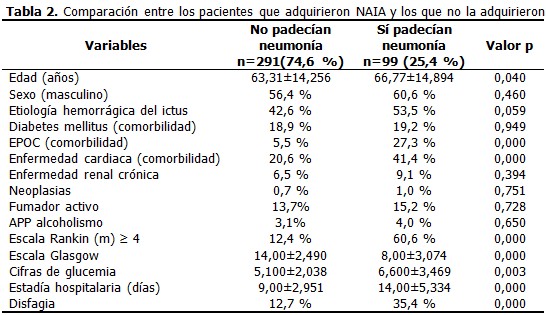
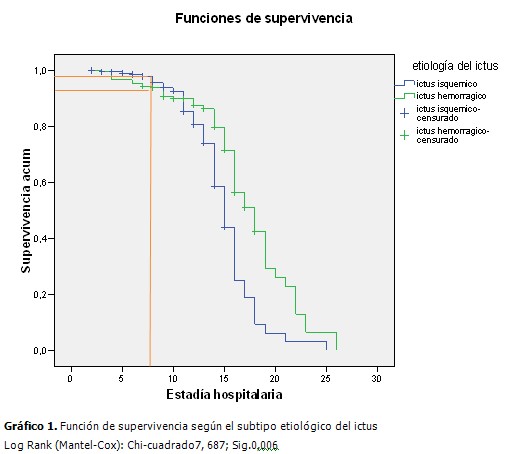
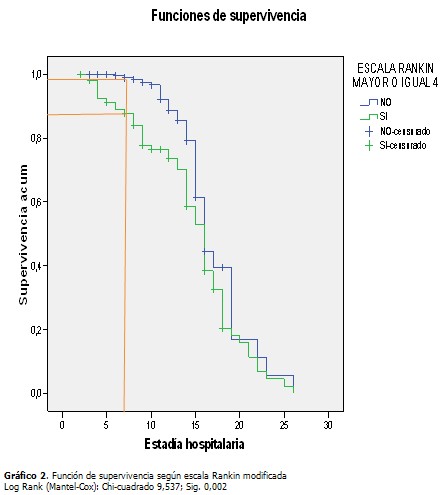
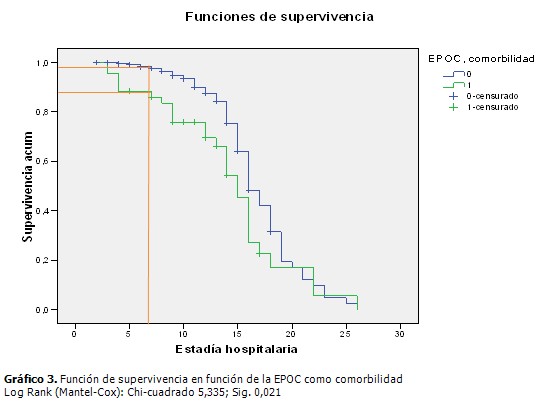
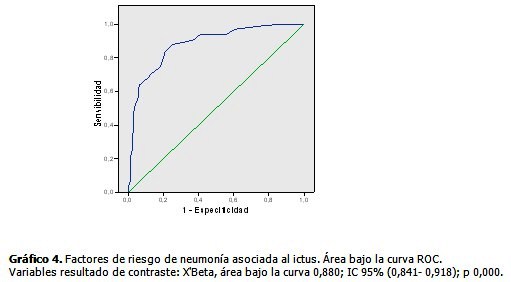
En la cohorte de estudio constituida por 390 pacientes predominó el sexo masculino (57,4 %) sobre el femenino (42,6 %), la edad (media± desviación estándar) fue de 64,18± 14,4,177 pacientes sufrieron ictus hemorrágico (45,4 %) y el 25,4 % de todos los pacientes sufrieron NAIA, la estadía hospitalaria fue de 10,35±4,1. (Tabla 1). Al comparar el grupo de pacientes que sufrieron NAIA con los que no presentaron esta complicación se demostró que existieron diferencias estadísticamente significativas respecto a la edad (p=0,040), en la puntuación en la escala de Glasgow y la estadía hospitalaria, ambas con p=0,000. Se encontró mayor proporción de pacientes con escala Rankin (m) ≥ 4 (60,6 %) y de disfagia al ingreso (35,4 %) en el grupo de pacientes con NAIA, entre la comorbilidad se destacó el antecedente de EPOC y de enfermedad cardiaca, ambas con un valor p de 0,000. (Tabla 2). A continuación se comparan los grupos de pacientes con ictus isquémico y hemorrágico. A partir del décimo día ocurrió una caída de la curva para los pacientes con ictus isquémico, sin embargo, la proporción acumulada de neumonía al quinto día fue de 1 % para el ictus isquémico y de 4,5 % en el hemorrágico, al día 7 fue de 2,1 % para el isquémico y de 5,6 % en el hemorrágico. (Gráfico 1). Los pacientes con una escala de Rankinm≥ 4 tuvieron una proporción acumulada de 12,3 % y 23,6 % los días 7 y 10 respectivamente, en tanto que en los que tuvieron un Rankinm< 4 fue de 1,1% y 3,4%. (Gráfico 2). Los pacientes que tenían EPOC se encontró que al quinto día el 11,6 % de dichos pacientes sufrían neumonía contra solo el 0,9 % en los que no tenían ese antecedente, al séptimo día esa proporción aumentó en los pacientes con EPOC a 14 % contra un 2,5 % sin EPOC. (Gráfico 3). Se muestra el resultado del modelo de regresión de Cox por pasos hacia delante. Los valores Exp(B) son las constantes de proporcionalidad que afectan a los impactos una vez eliminado el efecto del resto de las covariables. El riesgo de adquirir NAIA es 1,7 veces mayor en el ictus hemorrágico. En tanto que, el riesgo de NAIA se redujo en un 31,3 % por cada punto que aumentó la escala Glasgow por encima de 11. (Tabla 3). Cuando se probó la capacidad de predecir la aparición de NAIA, estimada con la función obtenida por el modelo de regresión, se encontró un área bajo la curva ROC significativamente mayor de 0,5 y muy cerca de 1 (0,880 IC 95 % 0,841-0,918), lo que indica una excelente capacidad del modelo para predecir la aparición de ésta complicación. (Gráfico 4).
DISCUSIÓN
En el presente estudio se pudieron determinar los factores de riesgo en función de la variable tiempo. Que solamente emergieran dos variables supone que el resultado sea expresión del principio de parsimonia del resultado de la regresión, validado por un buen poder de discriminación (88,0 %) del estudio. Con el propósito de lograr la aplicabilidad de los resultados se optó por incluir en la investigación, solamente aquellas variables obtenidas desde la primera consulta en la unidad emergencias y a la llegada a sala de ictus; no se incluyeron aquellas que, aun con presunta influencia en la aparición de esta complicación, pudieron incorporarse en días posteriores con la evolución del paciente. Sin embargo, se pudo haber incluido otras variables como la severidad del ictus medido mediante National Institutes of Health Stroke Scale (NIHSS) (por sus siglas en inglés), la afasia motora severa/disartria severa, estado nutricional previo del paciente, nivel de dependencia preexistente y las características cualitativas de la sala de atención del paciente, lo cual constituye una limitación de este estudio. Los resultados obtenidos son consistentes con otros ya analizados por otros autores, se confirmó que el nivel de conciencia es la principal variable con influencia sobre la neumonía y que el ictus hemorrágico es un factor de riesgo para la NAIA en los primeros 7 días. Numerosos estudios observacionales analíticos han identificado varios factores predictores de neumonía tales como: la disfagia, la puntuación en la escala Rankinm≥4, la enfermedad cardiaca y el EPOC, sin embargo, en dichos estudios el análisis multivariante estuvo basado en la regresión logística.12, 15-17 En esta investigación tanto la puntuación de Rankinm≥ 4 como el antecedente de EPOC tuvieron significación estadística a pesar que no emergieron entre las variables del estudio multivariante. Lo novedoso de dicha investigación radica en que permite evaluar, progresivamente en el tiempo, el riesgo del paciente con ictus en fase aguda; hasta donde se ha revisado, este es el primer estudio observacional analítico realizado en nuestro medio que evalúa conjuntamente los factores de riesgos de neumonía tanto en el ictus isquémico como el hemorrágico. En un estudio realizado en China, en una cohorte prospectiva de 14 702 paciente Ji R18 confirmó que la puntuación en la escala de Glasgow tuvo una asociación significativa con la neumonía asociada al ictus agudo (OR 1,04; 95 % IC 1,01–1,08; p 0,005); en este estudio solo se evaluó el ictus de etiología isquémica según clasificación de Oxfordshire Community Stroke Project. En otro estudio Li-Fu C, 19 luego del uso del modelo de regresión de Cox para el análisis multivariante, la escala de Glasgow<9 resultó la única variable significativa (Hazard ratio 6,72; 95 % IC 2,12 – 21,30; p 0,001); a diferencia de esa investigación, este estudio este logró relacionar la neumonía con el riesgo de morir a los 30 días. En un reporte local de Suárez-Quesada A11 identificó el Glasgow ≤ 11 (OR: 26,099; IC 95 % 7,164- 85,075) como la principal variable pronóstica en una cohorte de 201 pacientes con ictus isquémico. El resultado de esta investigación coincide con los anteriores trabajos. La reducción del nivel de conciencia se encuentra entre las situaciones clínicas que facilitan la aspiración silente de secreciones, aumentan la cantidad y patogenicidad de los microorganismos inoculados y disminuyen las defensas locales del tracto respiratorio e incluso la inmunidad sistémica. Esta última observación ha sido validada por varios estudios recientes en los que se demuestra que el daño cerebral agudo, incluyendo al ictus, induce profundas alteraciones en la inmunidad periférica que contribuye sustancialmente a la morbilidad y mortalidad en estos pacientes.20-22 La fase inicial se caracteriza por una respuesta inflamatoria primero local y luego generalizada que deriva en una producción masiva de factores inflamatorios y extravasación de linfocitos hacia el cerebro; esta fase de activación tempana es seguida por inmunosupresión sistémica, a dicho proceso se la ha denominado inmunodepresión inducida por ictus y se ha relacionado con el riesgo de este grupo de pacientes para desarrollar complicaciones sépticas.20-22 La severidad del ictus se encuentra muy relacionada con su propia variedad etiológica y está en dependencia de la población en estudio. Los datos disponibles sobre la influencia del ictus hemorrágico como factor de riesgo de NAIA son limitados. Suárez-Quesada A12 identificó un 36,2 % de pacientes con neumonía nosocomial precoz en una cohorte de 177 pacientes con hemorragia intracerebral espontánea (HICE) contra un 19, 9 % en una cohorte de 201 pacientes con ictus isquémicos.11 El ictus hemorrágico, particularmente, la hemorragia intracerebral espontánea, contribuye desproporcionadamente a las estadísticas de mortalidad, al acaparar el mayor número de fallecimientos por ictus; ese riesgo de muerte se incrementa tres veces cuando el paciente adquiere neumonía nosocomial.6,23 En este grupo de pacientes existen una serie de situaciones médicas (convulsiones, vómitos al inicio del ictus, crecimiento del hematoma intracerebral, aumento del edema cerebral, intubación endotraqueal, ventilación mecánica artificial, inmovilidad prolongada, anticoagulación por riesgos de trombosis venosa profunda, necesidad del uso de protectores gástricos contra el sangrado digestivo) que aumentan el riesgo de neumonía por aspiración.23 En este estudio se identificó que el ictus hemorrágico incrementa casi 2 veces el riesgo de neumonía lo cual es consistente con los elementos anteriormente descritos. Es necesario evaluar la influencia NAIA sobre el pronóstico de muerte de estos pacientes lo cual deberá ser objetivo de otro estudio. El nivel de conciencia, medido mediante la escala de Glasgow, unido a la variedad hemorrágica del ictus agudo, determinan el riesgo de adquirir NAIA, otras variables con influencia pero no independientes son la EPOC como comorbilidad y un Rankinm≥4.
REFERENCIAS BIBLIOGRÁFICAS
1. Kumar S, Selim MH, Caplan LR. Medical complications after stroke. Lancet Neurol. 2010;9(1):105-18
2. Ji R, Wang D, Shen H, Pan Y, Liu G, Wang Y, et al. Interrelationship among common medical complications after acute atroke: pneumonia plays an important role. Stroke. 2013;44(12):3436-44
3. Heikinheimo T, Broman J, Haapaniemi E, Kaste M, Tatlisumak T, Putaala J. Preceding and poststroke infections in young adults with first-ever ischemic stroke: effect on short-term and long-term outcomes. Stroke. 2013;44(12):3331-7
4. Chumbler NR, Williams LS, Wells CK, Lo AC, Nadeau S, Peixoto AJ, et al. Derivation and validation of a clinical system for predicting pneumonia in acute stroke. Neuroepidemiology. 2010;34(4):193-9
5. Westendorp WF, Nederkoorn PJ, Vermeij JD, Dijkgraaf MG, van de Beek D. Post-stroke infection: A systematic review and meta-analysis. BMC Neurol. 2011;11(1):1-7
6. Sellars C, Bowie L, Bagg J, Sweeney P, Miller H, Tilston J, et al. Risk factors for chest infection in acute stroke. Stroke. 2007;38(8):2284-91
7. Li Y, Song B, Fang H, Gao Y, Zhao L, Xu Y. External validation of the A2DS2 score to predict stroke-associated pneumonia in a Chinese population: a prospective cohort study. Plos One. 2014;9(10):e109665
8. Winklewski PJ, Radkowski M, Demkow U. Cross-talk between the inflammatory response, sympathetic activation and pulmonary infection in the ischemic stroke. J Neuroinflammation. 2014;11(1):213
9. Westendorp WF, Nederkoorn PJ, Vermeij JD, Dijkgraaf MG, van de Beek D. Post-stroke infection: a systematic review and meta-analysis. BMC Neurol. 2011;11(1):110
10. Pandian JD, Kaur A, Jyotsna R, Sylaja PN, Vijaya P, Padma MV, et al. Complications in acute stroke in India (CAST-I): a multicenter study. J Stroke Cerebrovasc Dis. 2012;21(8):695-703
11. Suárez A, López E, García N, Serra MA. Predictores clínicos de neumonía intrahospitalaria asociada al ictus isquémico agudo. Finlay [revista en Internet]. 2015 [citado 2 Jul 2015];5(2):[aprox. 7p]. Disponible en: http://revfinlay.sld.cu/index.php/finlay/article/view/359
12. Suárez A, García N. Predictores de neumonía nosocomial precoz en pacientes con hemorragia intracerebral espontánea. Multimed. 2015;19(3):1-14
13. García E, Hernández A, Herrero JA, Gómez J. Protocolo terapéutico empírico de la neumonía nosocomial. Medicine. 2014;11(56):3330-2
14. Perry L, Love CP. Screening for dysphagia and aspiration in acute stroke: a systematic review. Dysphagia. 2001;16(1):7-18
15. Zhang X, Wang F, Zhang Y, Ge Z. Risk factors for developing pneumonia in patients with diabetes mellitus following acute ischaemic stroke. J Int Med Res. 2012;40(5):1860-5
16. Harms H, Grittner U, Droge H, Meisel A. Predicting post-stroke pneumonia: the PANTHERIS score. Acta Neurol Scand. 2011;128(3):178-84
17. Li Y, Song B, Fang H, Gao Y, Zhao L, Li Y, et al. Risk factors for stroke-associated pneumonia in a Chinese population: a prospective cohort study. Life Sci J. 2014;11(6):378-82
18. Ji R, Shen H, Pan Y, Wang P, Liu G, Wang Y, et al. Novel risk score to predict pneumonia after acute ischemic stroke. Stroke. 2013;44(5):1303-9
19. Chen LF, Chang CY, Hsu LC, Tsai PH, Chang SJ, Chang SC, et al. Bacterial pneumonia following acute ischemic stroke. J Chin Med Assoc. 2013;76(2):78-82
20. De Raedt S, De Vos A, Van Binst AM, De Waele M, Coomans D, Buyl R, et al. High natural killer cell number might identify stroke patients at risk of developing infections. Neurol Neuroimmunol Neuroinflamm. 2015;2(2):e71
21. Liesz A, Dalpke A, Mracsko E, Antoine DJ, Roth S, Zhou W, et al. DAMP signaling is a key pathway inducing immune modulation after brain injury. J Neurosci. 2015;35(2):583-98
22. Folyovich A, Biró E, Orbán C, Bajnok A, Varga V, Béres AK, et al. Relevance of novel inflammatory markers in stroke-induced immunosuppression. BMC Neurol. 2014;14(1):41
23. Maramattom BV, Weigand S, Reinalda M, Wijdicks E, Manno EM. Pulmonary complications after intracerebral hemorrhage. Neurocrit Care. 2006;5(6):115-9
Recibido: 14 de julio de 2015.
Aprobado: 14 de diciembre de 2015.
Alexis Suárez Quesada. Especialista de I Grado en Medicina Interna. MSc. en Enfermedades Infecciosas. Profesor Instructor. Hospital General Universitario Carlos Manuel de Céspedes. Granma. Correo electrónico: alexsua.grm@infomed.sld.cu