Meu SciELO
Serviços Personalizados
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Farmacia
versão On-line ISSN 1561-2988
Rev Cubana Farm v.44 n.1 Ciudad de la Habana jan.-mar. 2010
ARTÍCULOS ORIGINALES
Estudio de estabilidad de tabletas de propiltiouracilo 50 mg
Study of the 50 mg Propylthiouracil tablets stability
María Olga Valdés BendoyroI; Caridad Margarita García PeñaII; Juan Lugones FernándezI; Vivian Martínez EspinosaIII
IMáster en Tecnología y Control de Medicamentos. Empresa Farmacéutica "Reynaldo Gutiérrez". La Habana, Cuba.
IIMáster en Tecnología y Control de Medicamentos. Investigador Agregado. Centro de Investigaciones y Desarrollo de Medicamentos (CIDEM). La Habana, Cuba.
IIITécnico en Tecnología Farmacéutica. CIDEM. La Habana, Cuba.
RESUMEN
Se desarrolló el estudio de estabilidad de las tabletas de propiltiouracilo 50 mg y se determinó su fecha de vencimiento. Este estudio se realizó por los métodos de vida de estante y de estabilidad acelerada mediante cromatografía líquida de alta eficiencia, validados en el Centro de Investigación y Desarrollo de Medicamentos. El estudio de vida de estante se desarrolló por un periodo de 24 meses a temperatura ambiente; mientras que el estudio de estabilidad acelerada se efectuó sometiendo el producto a la influencia de la luz, la humedad y la temperatura; se realizó el análisis durante 3 meses, para los 2 primeros y durante 6 meses para el estudio de la temperatura. La formulación de propiltiouracilo tabletas 50 mg cumplió con las especificaciones de calidad descritas en la farmacopea. Los resultados del estudio de estabilidad por vida de estante después de transcurridos los 24 meses indicaron que el producto mantenía los parámetros que determinan su calidad durante ese tiempo, y en los estudios acelerados no se observó degradación significativa del producto. Se estableció 2 años como fecha de vencimiento en las condiciones señaladas.
Palabras clave: Propiltiouracilo, estabilidad acelerada, vida de estante, cromatografía líquida de alta eficiencia.
ABSTRACT
Autors developed a stability study of 50 mg Propylthiouracil tablets and determination of its expiry date. This study was conducted by fixed life methods and of accelerated stability by high-performance liquid chromatography, validated in Drugs Research and Development Center. Fixed life study was conducted during 24 months at room temperature; whereas the accelerated stability study was conducted exposing the product to light influence, humidity and temperature; during 3 months a analysis was performed for the two first ones and over 6 months in the case of temperature study. Propylthiouracil formula (50 mg tablets) fulfilled the quality specifications described in Pharmacopeia. Results of stability study by fixed life after 24 monhts showed that thr product maintain the parameter determining its quality during this period, and in the accelerted studies there was not a significant degradation of product. Two years was the expity date established in above mentioned conditions.
Key words: Propylthiouracil, accelerated stability, fixed life, high-performance liquid chromatography.
INTRODUCCIÓN
El propiltiouracilo inhibe la síntesis de la hormona tiroidea mediante la inhibición de la incorporación de yodo a la tirosina y del acoplamiento de las iodotirosinas no interfiere con las acciones de la hormona tiroidea exógena. Es el medicamento de elección en la tormenta tiroidea y se indica en el tratamiento del hipertiroidismo.1,2
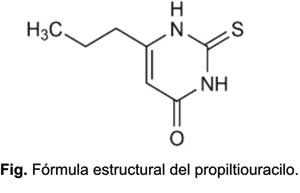
El nombre genérico del principio activo es propiltiouracilo y el nombre químico es 2-tio-4-oxo-6 propil-1,3 pirimidina; la fórmula global y el peso molecular son C7H10 N2 OS y 107,24, respectivamente. En la figura se muestra la fórmula estructural del principio activo.
La estabilidad de los productos farmacéuticos representa un importante eslabón en el desarrollo y formulación de toda forma terminada. De esta manera se puede definir las condiciones de almacenamiento en el envase propuesto y establecer la vida útil del producto farmacéutico. Estos estudios contemplan la conservación de la potencia, pureza, características organolépticas y su efectividad.3
El Centro para el Control Estatal de los Medicamentos (CECMED), La Habana, Cuba, exige para el registro de un nuevo medicamento la realización de los estudios de estabilidad. En el presente trabajo se empleó un método analítico validado en el Centro de Investigación y Desarrollo de Medicamentos (CIDEM) para el estudio de estabilidad del producto terminado.
El presente trabajo tuvo como objetivo realizar el estudio de estabilidad de una formulación de tabletas de propiltiouracilo 50 mg producidas en la Empresa Farmacéutica «Reynaldo Gutiérrez» y determinar su fecha de vencimiento.
MÉTODOS
Para el desarrollo de la formulación se empleó como materia prima propiltiouracilo procedente de China, lote 10425, fecha de fabricación 02/2005, la cual fue analizada siguiendo las especificaciones de calidad descritas en la monografía de la USP 27.
El presente estudio se realizó por los métodos de vida de estante y estabilidad acelerada. Se emplearon muestras de los lotes LP1, LP2 y LP3 (fecha de fabricación enero del 2006), producidos en la Empresa Farmacéutica "Reynaldo Gutiérrez" y envasados en sobres termoconformados de aluminio y poli-cloruro de vinilo.
En el estudio se empleó un cromatógrafo (KNAUER) con detector UV/VIS (KNAUER) ajustado a 272 nm, un dosificador (Loop) de 20 µL e integrador (SHIMADZU CR 8 A). La separación se realiza isocráticamente sobre una columna Lichrospher 100, RP-18 (5 µm). La fase móvil consistió en una mezcla desgasificada del buffer fosfato de potasio monobásico 0,025 M a pH= 4,6, y acetonitrilo en una proporción de 80:20, con una velocidad de flujo de 0,5 mL/min. La sustancia de referencia química de propiltiouracilo fue suministrada por el grupo de sustancias de referencia del CIDEM, La Habana, Cuba, la cual fue analizada por el método cromatográfico establecido para realizar el control de la calidad de la materia prima con una pureza de 99,6 %.
Estabilidad acelerada
En los estudios de estabilidad acelerada, se almacenaron las muestras de los lotes estudiados en un horno a temperatura controlada de 40 ºC y 75 % de humedad relativa, se valoraron al inicio, 3 y 6 meses. Además se realizaron los estudios de humedad y de la luz (a luz natural); se analizaron al inicio y a los 3 meses, con el objetivo de determinar la estabilidad del medicamento ante el efecto de la luz y la humedad, así como la efectividad del envase empleado.
Estabilidad por vida de estante
En el estudio de estabilidad por vida de estante, los lotes estudiados se almacenaron a temperatura ambiente (30 ºC) y protegidos de la luz; se valoraron al inicio, a 6, 12 y 24 meses de fabricados.
RESULTADOS
Los resultados del estudio de estabilidad acelerada a 40 ºC y 75 % de humedad relativa, correspondiente a los lotes LP1, LP2 y LP3, se muestran en la tabla 1; se demostró que el producto terminado no presenta cambios significativos.
Los resultados del estudio de humedad al 98 %, que se realizaron a temperatura controlada, se presentan en la tabla 2; se evidenció que el medicamento no se afecta con la influencia de la humedad.
Los resultados del estudio de la influencia de la luz, se reportan en la tabla 3; se demostró que el producto terminado no presenta cambios significativos, por la incidencia de la luz.
Los resultados del estudio de vida de estante, al inicio, 6, 12 y 24 meses, se muestran en la tabla 4; se observó que el producto terminado cumple con las especificaciones de calidad durante el estudio.
DISCUSIÓN
La selección del envase utilizado se realizó teniendo en cuenta las características del producto y el envase empleado en las tabletas de popiltiuracilo que actualmente se fabrican en Cuba, a las cuales se les realizó un estudio de estabilidad en blister, para lo cual se sometió el producto envasado en estas condiciones, a diferentes variables como: luz, humedad y temperatura por un periodo de 3 meses.
El conjunto de los resultados del estudio de estabilidad acelerada a 40 ºC y 75 % de humedad relativa, demuestran la estabilidad del producto. Durante el período evaluado, los 3 lotes analizados mantienen las características organolépticas, la disolución y la valoración. Se demostró la estabilidad térmica del producto, ya que después de transcurridos 6 meses se mantuvo la concentración conforme con los límites establecidos en las especificaciones de calidad del producto terminado.2-4
En el tiempo de duración del estudio de humedad, los 3 lotes analizados del producto mantienen los parámetros analizados dentro de los límites establecidos, por lo que se demuestra la estabilidad de la formulación ante estos efectos y la efectividad del envase seleccionado para la formulación.2-4
Por otra parte, los resultados de la valoración de las muestras sometidas al efecto de la luz probaron que el tratamiento no alteró el contenido de principio activo en las tabletas a los 3 meses de realizado el estudio, ya que como se observa en la tabla 3, el medicamento no presentó cambios en los valores de concentración, disolución ni en las características organolépticas.2-4
De los resultados mostrados en la tabla 4 se infiere que el producto mantiene los parámetros que determinan su calidad, tanto en su etapa inicial como transcurridos 6, 12 y 24 meses. Además, no se observan cambios en los aspectos organolépticos, la disolución y la valoración durante el tiempo de almacenamiento estudiado. A partir de estos resultados se proponen 2 años de validez, como tiempo de expiración, para la formulación de tabletas de propiltiouracilo 50 mg producido en el CIDEM empleando como material de envase los sobres termoconformados de aluminio y poli-cloruro de vinilo.2-4
Los resultados de los estudios de estabilidad acelerada y de vida de estante, reportados en la Regulación 16-2000 del CECMED para Buenas Prácticas de Fabricación de Productos Farmacéuticos, demostraron la estabilidad física y química del producto por espacio de 24 meses a temperatura ambiente, ya que en todos los casos los resultados se encontraron dentro de los límites establecidos en las especificaciones de calidad de las tabletas de propiltiouracilo 50 mg.
REFERENCIAS BIBLIOGRÁFICAS
1. Goodman A, Gilman A. Las bases farmacológicas de la terapéutica. Tomo II. 3ra ed. La Habana: Editorial Científico Técnica; 1994. p. 466-7. (Edición Revolucionaria).
2. PDR. Physician´s Desk Reference. 57 ed. New York: Inc at Montuale; 2003. p. 332, 2193, 2905, 3270.
3. Regulación No. 16-2000: Buenas Prácticas de Fabricación de Productos Farmacéuticos. La Habana: Centro Estatal para el Control de Medicamentos (CECMED); 2000.
4. United States Pharmacopoeial Convention, USP 29. Validation of Compendial Methods. 29 ed. Rockville: Mack Printing; 2006. p. 1256-8, 1982-4.
Recibido: 18 de septiembre de 2009.
Aprobado: 21 de octubre de 2009.
M. C. Caridad Margarita García Peña. Centro de Investigación y Desarrollo de Medicamentos (CIDEM). Ave 26, No. 1 605 entre Boyeros y Calzada de Puentes Grandes, CP 10 600, municipio Plaza de la Revolución, La Habana, Cuba. Correo electrónico: caridadgp@infomed.sld.cu