Introducción
La colangitis biliar primaria (CBP) es una enfermedad hepática crónica que destruye los conductos biliares de pequeño y mediano calibre, interlobares y septales.1 Es una afección genética y autoinmune, compleja, de patogenia no totalmente conocida.2 Su prevalencia se ha incrementado en las últimas décadas con una incidencia global anual de 0,7 a 49 casos por millón de habitantes y varía de acuerdo con el país estudiado; por ejemplo, Israel presenta 19 casos por millón de habitantes y los Estados Unidos, 402 casos. Este último y el norte de Europa tienen las mayores tasas a nivel mundial. Los reportes más recientes en la región de Asia y el Pacífico estiman su prevalencia en 118,75 casos por millón.3
El tratamiento con ácido ursodesoxicólico (AUDC) ha mejorado ostensiblemente la esperanza de vida de los pacientes.4 Actualmente, dos de cada tres diagnosticados con colangitis y tratados con AUDC tienen una supervivencia similar a la de la población sana.5 Este medicamento disminuye el daño histológico estructural y los niveles séricos de bilirrubina (BIL), fosfatasa alcalina (FAL), colesterol e inmunoglobulina M (IgM).6,7,8 Cuando el tratamiento a largo plazo se inicia en fases tempranas de la enfermedad, se retrasa la progresión histológica.( ) Los estados histológicos avanzados, la deficiente respuesta terapéutica, el sexo masculino, los síntomas al diagnóstico, la bilirrubina sérica >2,0 mg/dL sostenida y la fosfatasa alcalina en valores dos veces por encima del límite superior normal después de 6 meses de tratamiento son factores que se relacionan con la mala respuesta al tratamiento farmacológico.10,11 Teniendo en cuenta lo anteriormente expuesto, el objetivo del presente estudio fue describir la respuesta terapéutica del ácido ursodesoxicólico en pacientes cubanos con colangitis biliar primaria.
Métodos
Se realizó un estudio descriptivo, longitudinal y ambispectivo para describir la respuesta clínica de los pacientes con colangitis biliar primaria al año de tratamiento farmacológico. El universo de estudio se constituyó por los casos atendidos en el periodo entre septiembre de 2003 y enero de 2020 en la consulta de Enfermedad hepática autoinmune del Instituto de Gastroenterología. Los criterios diagnósticos utilizados se basaron en las recomendaciones de las Guías prácticas para diagnóstico y tratamiento de pacientes con CBP de la Asociación Europea para el Estudio del Hígado 2017.5
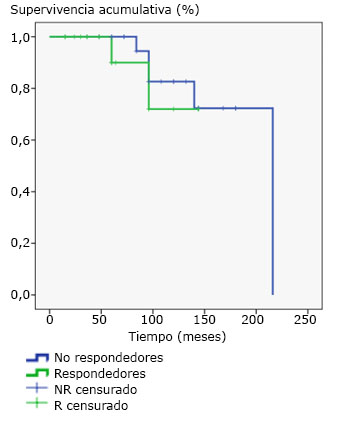
Además se utilizaron los criterios de Chazouilleres o de Paris para determinar la superposición de colangitis biliar primaria-hepatitis autoinmune (HAI-CBP).12 Se excluyeron 12 casos con registros clínicos insuficientes y la muestra finalmente quedó conformada por 45 sujetos. El seguimiento mínimo fue de 12 meses. Los datos primarios de las historias clínicas se llevaron a un cuestionario o ficha de recolección de datos para evaluar características demográficas, presentación clínica, hallazgos bioquímicos e histológicos y los tratamientos. Los estratos analizados se basaron en la respuesta al tratamiento (fig. 1).
Para el procesamiento de las diferentes variables se utilizó el paquete estadístico SPSS versión 21.0. Las diferencias entre los grupos respondedores y no respondedores al tratamiento se compararon con la prueba de Log-rank. El intervalo de confianza y los valores de P fueron de dos colas, con un nivel de significación α=0,05. Se utilizó el análisis univariado, regresión de Cox, para determinar los factores asociados a la respuesta al tratamiento. Los resultados fueron resumidos en tablas y gráficos.
Se solicitó a cada participante su consentimiento informado, verbalmente y por escrito. Todos los datos de los pacientes fueron anónimos. Se respetaron los principios de la Declaración de Helsinki y la investigación fue aprobada por el Comité de Ética de las Investigaciones del Instituto de Gastroenterología. El manuscrito final se adhirió a las recomendaciones STROBE para el reporte de estudios observacionales.
Resultados
En el estudio predominó el sexo femenino (95,6 %), y la mediana de edad fue de 54 años. De los 45 pacientes de la muestra, se trataron 44 (97,7 %) con ácido ursodesoxicólico y uno no recibió tratamiento por diagnosticarse con cirrosis hepática complicada. El medicamento se administró de la siguiente manera: dosis altas >15 mg/kg/día en 4 pacientes, dosis bajas <13 mg/kg/día en 15 pacientes y la dosis recomendada 13-15 mg/kg/día en 25 pacientes.
Según los criterios de Paris i o ii, 21 pacientes fueron clasificados como respondedores al tratamiento para un 47,7 % y 23 como no respondedores para un 52,2 %. En cuanto a la edad, presentación de la enfermedad y el estadio histológico, no hubo diferencias entre los respondedores y no respondedores. Sin embargo, los niveles bajos de aspartato amino transferasa y fosfatasa alcalina se relacionaron con una respuesta idónea al ácido ursodesoxicólico (p < 0,05). En el grupo de pacientes respondedores 10 casos presentaron cirrosis (32 %) mientras que en los no respondedores la cifra ascendió a 21 (67,7 %), (p < 0,001). Los pacientes con síndrome de superposición CBP-HAI tuvieron una peor respuesta terapéutica.
Tabla 1 Análisis por regresión de Cox de los factores asociados a la respuesta terapéutica al ácido ursodesoxicólico
| Factores | Sig. | Exp (b) | IC 95,0 % | |
|---|---|---|---|---|
| inf | sup | |||
| Edad | 0,298 | 1,02 | 0,98 | 1,06 |
| Modo de presentación | ||||
| Cirrosis hepática | 0,535 | 1,47 | 0,43 | 5,01 |
| Estadio histológico n(%) | ||||
| Estadio avanzado | 0,734 | 0,82 | 0,27 | 2,46 |
| Estudios de laboratorio | ||||
| ALAT | 0,178 | 0,99 | 0,99 | 1,00 |
| ASAT | 0,009 | 0,98 | 0,98 | 0,99 |
| FAL | 0,005 | 0,99 | 0,99 | 0,99 |
| GGT | 0,596 | 1,00 | 0,99 | 1,00 |
| Albúmina | 0,903 | 0,99 | 0,92 | 1,06 |
| Colesterol | 0,140 | 0,84 | 0,67 | 1,05 |
| Bilirrubina total | 0,824 | 0,99 | 0,98 | 1,00 |
| Tiempo de protrombina | 0,776 | 0,96 | 0,74 | 1,24 |
| Complicaciones | ||||
| Cirrosis | <0,001 | 0,44 | 0,28 | 0,69 |
| Fallecidos | 0,409 | 0,54 | 0,12 | 2,32 |
| Superposición(CBP-HAI) | 0,046 | 3,08 | 1,02 | 9,35 |
Leyenda: ASAT-aspartato amino transferasa; ALAT-alanina amino transferasa; FAL-fosfatasa alcalina; GGT-gammaglutamil transferasa
Fuente: Instituto de Gastroenterología 2003-2020
No se observaron diferencias en la supervivencia de los pacientes de acuerdo con su respuesta al tratamiento. Log Rank (Mantel-Cox) p =0,585 (fig. 1).
Discusión
Más de la mitad de los pacientes tratados con ácido ursodesoxicólico no respondieron al tratamiento. Sin embargo, en la literatura consultada más del 60 % de los pacientes asimilan muy bien el AUDC.8,9) Esta respuesta deficiente se relaciona con múltiples factores:13 la adherencia terapéutica, el uso de dosis personalizadas por debajo de las recomendadas, el retraso del tratamiento y la forma de presentación sintomática de la enfermedad.
En estudios realizados en Reino Unido, los pacientes con dosis bajas tuvieron menor respuesta terapéutica.14) Otro artículo refiere que los pacientes de origen hispano responden exiguamente al tratamiento15 y así lo confirman Yerragorda y colaboradores.16 Publicaciones recientes muestran que los mayores de 70 años reaccionan bien terapéuticamente;13,17,18 igualmente en esta investigación los pacientes con más de 50 años respondieron al tratamiento de forma positiva. Teniendo en cuenta los criterios utilizados para clasificar a los participantes en respondedores o no respondedores, los datos de este estudio son equiparables a estudios comparativos realizados en otras latitudes.7,19
En el síndrome de superposición destaca el daño colestásico y la adición necroinflamatoria del hepatocito, un fenotipo agresivo de la colangitis biliar primaria.5,20 Esto explicaría el rechazo de los pacientes con síndrome de superposición CBP-HAI al tratamiento, tal y como se constata en los hallazgos de esta investigación.
Los niveles elevados de fosfatasa alcalina y aspartatoaminotransferasa son indicadores de que el organismo no responde al ácido ursodesoxicólico; así lo demuestran varios estudios que también hacen referencia a las altas concentraciones de bilirrubina.13,19,21) La fosfatasa alcalina refleja la severidad del daño biliar y determina la efectividad del AUDC.13) Una respuesta terapéutica adecuada se relaciona con menor progresión a cirrosis y sus complicaciones, más tiempo de supervivencia libre de trasplante y disminución de la mortalidad.22) El menor porcentaje de cirrosis en pacientes que reaccionan positivamente al tratamiento coincide con hallazgos previos de la comunidad científica.13 El AUDC, al ser un ácido biliar hidrófilo, disminuye la toxicidad con la acción citoprotectora de los efectos de acumulación de los ácidos biliares.4
Aunque no disminuyó la mortalidad entre los pacientes respondedores, múltiples son los estudios que reportan una mayor supervivencia libre de trasplante en pacientes con una respuesta adecuada al AUDC.4,9,13,14,18 El estudio estuvo limitado porque el número de individuos aptos para la investigación no fue suficiente, esto se corresponde con la generalización de los resultados a la población cubana con colangitis biliar primaria. Sin embargo, constituye la mayor serie de casos estudiados desde un centro de atención terciaria que incluye a pacientes de todo el país.
La respuesta al tratamiento con AUDC fue efectiva en menos de la mitad de los tratados, los principales factores asociados a la mala respuesta terapéutica fueron la presencia de cirrosis, el síndrome de superposición CBP-HAI y los niveles elevados de fosfatasa alcalina y aspartatoaminotransferasas. No se observaron diferencias en la supervivencia de los pacientes de acuerdo con su respuesta al tratamiento.