Introducción
La inclusión de árboles y arbustos en los pastizales es una alternativa viable, debido a su contribución en la disminución de la erosión, el mejoramiento de la fertilidad del suelo por el aporte de nitrógeno atmosférico y el reciclaje de nutrientes, entre otros aspectos. Además, se ha comprobado que en los sistemas donde se emplean las especies arbóreas, aumenta la biomasa comestible y el contenido de proteína bruta de las gramíneas, en comparación con aquellos de gramíneas mejoradas sin fertilizar (Crews et al., 2016).
Según Hernández-Hernández et al. (2020), la especie arbórea más utilizada en los sistemas silvopastoriles es Leucaena leucocephala (Lam) de Witt cv. Cunningham. Sin embargo, a pesar de estas ventajas, sus semillas están cubiertas por una ligera capa de polisacáridos, galactosa y manosa (Gutiérrez-de-Gotera et al., 2007), que impide el paso de agua y de oxígeno, disminuye el vigor germinativo y propicia porcentajes de germinación inferiores a 20 %, lo que limita su utilización (Sánchez-Paz y Ramírez-Villalobos, 2006).
Para atenuar estas limitantes, se han identificado diferentes tratamientos pregerminativos, como la escarificación a partir de la remoción manual de la testa, con papel lija, los tratamientos hidrotérmicos, y la inmersión en agua a temperatura ambiente o en ácido sulfúrico (Reino-Molina y Sánchez-Rendón, 2022).
La utilización de IHPLUS ® BF, solo o en combinación con los métodos de escarificación descritos anteriormente, pudiera ser una alternativa viable. Este bioproducto, elaborado en la Estación Experimental de Pastos y Forrajes Indio Hatuey (EEPFIH), sobre la base de la tecnología de los microorganismos, ha tenido gran aceptación por los productores. Está certificado para su utilización como biofertilizante y con su aplicación se logran efectos benéficos, como el de promover la germinación, la floración, el desarrollo de los frutos y la reproducción de las plantas (Díaz-Solares et al., 2020).
Tradicionalmente se han utilizado los microorganismos para estimular la germinación, el crecimiento y el desarrollo de las plantas, debido a que producen numerosos compuestos bioactivos (López-Dávila et al., 2017). En Cuba, se ha empleado como bioestimulante de la germinación en diferentes cultivos (Tellez-Soria y Orberá-Ratón, 2018; Morocho y Leiva-Mora, 2019; Calero-Hurtado et al., 2019), efecto que se puede relacionar con la capacidad de este bioproducto de excretar vitaminas, ácidos orgánicos, minerales, quelatos y sustancias antioxidantes que contribuyen a suprimir el crecimiento de los microorganismos fitopatógenos y generar nutrientes asimilables por las plantas, lo que estimula su crecimiento. Sin embargo, no existen resultados de la aplicación del IHPLUS ® BF en semillas de L. leucocephala. A partir de esta condición, el objetivo de este estudio fue evaluar el efecto de la inoculación con el biofertilizante IHPLUS® BF en la germinación de semillas de L. leucocephala cv. Cunningham.
Materiales y Métodos
Localización. El estudio se realizó en el Laboratorio de Semillas de la EEPFIH, situada a los 22º 48” y 7” de latitud norte y 79º 32” y 2” de longitud oeste, a 19 msnm, en Perico, provincia Matanzas, Cuba.
Tratamiento y diseño experimental. Para estudiar la respuesta germinativa de las semillas de L. leucocephala cv. Cunningham a la aplicación de diferentes diluciones y tiempos de imbibición (tabla 1), se realizó un experimento con un diseño completamente al azar, con arreglo factorial 3 x 4. Los tratamientos se conformaron por combinaciones de dos factores: a) tiempo de imbibición con tres tiempos diferentes (8, 10 y 28 horas) y b) diluciones de IHPLUS® BF, con cuatro diluciones (2,5; 5; 10; 15 mL L-1), y un control con semillas con escarificación térmica (agua a 80 ºC durante dos minutos).
Tabla 1 Descripción de cada tratamiento en estudio.
| Tratamiento | Descripción |
|---|---|
| 1 | STT+ IHPLUS® BF (2,5 %) 8 h |
| 2 | STT+ IHPLUS® BF (2,5 %) 10 h |
| 3 | STT+ IHPLUS® BF (2,5 %) 28 h |
| 4 | STT+ IHPLUS® BF (5 %) 8 h |
| 5 | STT+ IHPLUS® BF (5 %) 10 h |
| 6 | STT+ IHPLUS® BF (5 %) 28 h |
| 7 | STT+ IHPLUS® BF (10 %) 8 h |
| 8 | STT+ IHPLUS® BF (10 %) 10 h |
| 9 | STT+ IHPLUS® BF (10 %) 28 h |
| 10 | STT+ IHPLUS® BF (15 %) 8 h |
| 11 | STT+ IHPLUS® BF (15 %) 10 h |
| 12 | STT+ IHPLUS® BF (15 %) 28 h |
| Control | STT |
STT - Semillas tratadas con escarificación térmica en agua a 80 ºC durante dos minutos. IHPLUS® BF.
Procedimiento experimental. Se utilizaron semillas de L. leucocephala cv. Cunningham recién cosechadas, a las que se les hizo un análisis de germinación estándar y de viabilidad con la aplicación del método del tetrazolio (Suárez y Melgarejo, 2010). Los embriones se clasificaron según su coloración en: 1) vivos con vigor alto, totalmente teñidos de rojo intenso, 2) vivos con vigor bajo, coloración rojo pálido y 3) no viables, incoloros. El resultado del análisis de germinación y viabilidad se expresó como porcentaje de embriones viables y no viables (Maldonado-Peralta et al., 2016).
Todas las semillas antes de la siembra se sometieron a escarificación térmica, en agua a 80 ºC, durante dos minutos (González y Mendoza, 1995). Posteriormente se combinaron con los diferentes tratamientos de disoluciones del biofertilizante IHPLUS®BF y tiempos de imbibición, según su patrón trifásico de absorción de agua, a 25 ºC.
Determinaciones. Se calcularon los siguientes índices de germinación, según la metodología de Bewley y Black (1994):
Potencial germinativo (G %): valor total de germinación, expresado en porcentaje.
Índice de velocidad de germinación (IVG): Se obtiene al dividir el número de semillas germinadas entre los días evaluados (desde la siembra hasta el último día de evaluación).
Donde
ni |
= número de semillas germinadas desde el primer al último. |
ti |
= tiempo en días (desde el día de siembra hasta el final de la evaluación). |
Tiempo promedio para alcanzar la germinación (TPG): Se obtiene a partir de la multiplicación del tiempo en días (se inicia desde la siembra) y el número de semillas que completaron la germinación divido entre el número de semillas germinadas.
Tiempo para alcanzar la máxima germinación (TMax): Contempla el día en que el número de semillas germinadas no aumentó más.
Análisis estadístico. Los datos se procesaron mediante análisis de varianza factorial y las medias comparadas mediante la dócima de Duncan para 5 % de significación, después de verificar que cumplían con el ajuste de distribución normal (prueba de Kolmogorov-Smirnov) y de homogeneidad de varianza (prueba de Levene). El procesamiento de los datos se realizó con el paquete estadístico InfoEstat® (Di Rienzo et al., 2017).
Resultados y Discusión
La cinética de germinación en cada uno de los tratamientos se muestra en la figura 1. En sentido general, se observó un comportamiento similar en todos los tratamientos. En cada dilución, el tiempo de imbibición a las 28 horas, fue el que mejor respuesta mostró.
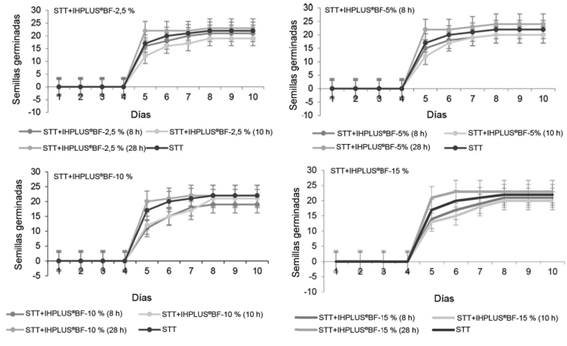
Figura 1 Cinética de germinación de semilla de L. leucocephala cv. Cunningham con diferentes diluciones imbibición.
Esta cinética muestra que el tratamiento que combinó el método de escarificación térmica con 28 horas de imbibición, a los 10 días, logró 96 % de germinación. Este comportamiento se cataloga como normal y muestra que, en todos los tratamientos, incluso en el control, las semillas no presentaron ningún tipo de dormancia innata después de la escarificación. Este resultado se relaciona con lo referido por Sánchez-Gómez et al. (2018), quienes plantean que el agua caliente ablanda la testa, al mismo tiempo que presiona la barrera física de las macroesclereidas, de modo que los espacios intercelulares quedan conectados. Estos tratamientos, por lo tanto, permiten o facilitan el contacto del agua con el embrión y estimulan su desarrollo. Además, eliminan y lavan los inhibidores presentes en la cubierta de la semilla, lo que favorece la germinación (Flores-Romayna et al., 2020).
A lo anterior se adiciona el efecto aditivo del bioproducto IHPLUS® BF con la entrada hacia las semillas de sustancias reguladoras del crecimiento: auxinas, citoquininas y giberelinas presentes en el biofertilizante mediante el proceso de imbibición. Estos compuestos estimulan la división y el alargamiento celular, procesos que permiten el crecimiento de las diferentes estructuras vegetales (Iqbal y Hasnain, 2013).
En la tabla 2 se muestra el comportamiento de diversos indicadores que permiten conocer con mayor detalle diferentes características de la germinación en las semillas. Según lo informado por Sobrevilla-Solís et al. (2013), entre dichos indicadores se pueden citar el potencial germinativo, el índice de velocidad de germinación (IVG), el tiempo máximo (TMAX) y el tiempo promedio (TPG) para alcanzar la germinación.
Tabla 2 Indicadores relacionados con la germinación de semillas de L. leucocephala cv. Cunningham.
| Tratamiento | Potencial germinativo, % | IVG, semillas días-1 | TPG, días | TMAX, días |
|---|---|---|---|---|
| STT+ IHPLUS® BF (2,5 %) 8 h | 84,0bc | 2,1ab | 4,43bcd | 5,5 |
| STT+ IHPLUS® BF (2,5 %) 10 h | 76,0c | 2,0b | 4,39abcd | 6,8 |
| STT+ IHPLUS® BF (2,5 %) 28 h | 92,0ab | 2,3a | 4,65de | 6,5 |
| STT+ IHPLUS® BF (5 %) 8 h | 80,0bc | 2,1ab | 4,56cde | 6,5 |
| STT+ IHPLUS® BF (5 %) 10 h | 80,0bc | 2,1ab | 4,63de | 7,0 |
| STT+ IHPLUS® BF (5 %) 28 h | 96,0ª | 2,5a | 4,62de | 7,0 |
| STT+ IHPLUS® BF (10 %) 8 h | 76,0c | 2,0b | 4,80e | 7,0 |
| STT+ IHPLUS® BF (10 %) 8 h | 84,0b | 2,1ab | 4,63de | 6,8 |
| STT+ IHPLUS® BF (10 %) 28 h | 88,0ab | 2,3a | 4,07a | 5,5 |
| STT+ IHPLUS® BF (15 %) 8 h | 84,0bc | 2,1ab | 4,17ab | 5,5 |
| STT+ IHPLUS® BF (15 %) 10 h | 80,0bc | 2,0ab | 4,24abc | 5,8 |
| STT+ IHPLUS® BF (15 %) 28 h | 92,0ab | 2,0ab | 4,14ab | 6,0 |
| Control STT | 88,0b | 2,2ab | 44,48bcde | 6,3 |
| Valor - P | 0,0093 | 0,0093 | 0,0001 | 0,184 |
| EE ± | 3,82 | 0,10 | 0,11 | 0,45 |
PG-potencial germinativo, IVG- índice de velocidad de germinación, TPG- tiempo promedio de germinación, Tmáx- tiempo para alcanzar la máxima germinación.
a, b, c, d y e: Medias con letras desiguales en una misma columna difieren significativamente para p ≤ 0,05.
Todos los indicadores evaluados (índice de velocidad de germinación, índice de germinación, tiempo promedio de germinación y tiempo para alcanzar la máxima germinación) presentaron mejores valores en los tratamientos donde se utilizó el bioproducto con las cuatro dosis (2,5, 5, 10 y 15 %), embebidas durante 28 horas, sin diferencias significativas entre ellas. Hubo mayor eficiencia germinativa y transcurrieron seis días, como mínimo, para alcanzar la máxima germinación.
Al parecer, este comportamiento se relaciona con la curva de absorción de agua en las semillas frescas de L. leucocephala cv. Cunningham. Reino-Molina (2005), al determinar el patrón de imbibición de las semillas en agua, describió que cuando las semillas frescas del mencionado cultivar se hidrataron a temperatura alterna de 25/30 ºC siguieron un patrón trifásico de absorción de agua, como sucede en la generalidad de las semillas de todos los cultivos. El autor citado planteó que el final de la fase I se alcanza a las 8 horas; la II es un largo proceso de absorción de agua, que hasta las 25 horas constituye un segmento estacionario de la curva, y la fase III constituye la última etapa de la imbibición que representa la emergencia de la radícula (germinación visible), la cual se alcanzó al cabo de las 30 horas de hidratación de estas semillas.
El tiempo de imbibición de las semillas depende de numerosos factores: especie, calidad de la semilla, (sanidad, tamaño y peso). También tiene que ver con factores internos, como la madurez, y extrínsecos, como la humedad, la temperatura, la provisión de oxígeno, la presencia o la ausencia de luz y la latencia de la semilla. Todo esto influye en el porcentaje de germinación, según refiere Valdez-Yopla (2017).
Existen diferentes informes en cuanto al tiempo de imbibición. González-Fuente (2017), en un estudio similar en semillas de Sorghum bicolor L. (Moench) cv. UDG-110, tratadas con IHPLUS® BF, encontraron que los mayores valores se obtuvieron con la variante 6 % - cuatro horas de inmersión con porcentaje superior a 80 %. Carrillo-Sosa et al. (2017), en un estudio donde evaluaron la efectividad del bioproducto LEBAME (obtenido por el Instituto Cubano de Investigaciones de los Derivados de la Caña de Azúcar ICIDCA) no encontraron diferencias significativas entre los tres tiempos de imbibición (15, 30 y 60 minutos). Por lo tanto, desde el punto de vista práctico, la imbibición de las semillas de tomate en LEBAME durante 15 minutos (menor tiempo), se señaló como la mejor propuesta.
Los resultados de la presente investigación coinciden también con los obtenidos por diferentes autores, que estudiaron el efecto de diferentes biopreparados basados en microorganismos aislados de la rizosfera en el proceso de germinación de diversas especies (Quintero et al., 2018).
Conclusiones
Se demostró la efectividad de este bioproducto en diferentes indicadores relacionados con el proceso de germinación de las semillas de L. leucocephala cv. Cunningham. La mejor combinación fue la utilización de este bioproducto al 5 % con mayor eficiencia germinativa (seis días como mínimo para alcanzar su máxima germinación).














