Introducción
Pseudomonas aeruginosa es una bacteria que produce simultáneamente dos compuestos importantes desde el punto de vista biotecnológico: ramnolípidos y polihidroxialcanoatos.1,2,3
Los ramnolípidos representan una de las principales clases de surfactantes microbianos y están compuestos por una o dos unidades azúcar ramnosa unidas por enlaces glicosídicos a cadenas de ácidos grasos o β-hidroxiácidos (3-hidroxialcanoatos). Son considerados como los biotensoactivos más promisorios en términos de producción industrial, pues presentan características físico-químicas y biológicas distintas, dependiendo de su composición química. Pueden ser obtenidos en concentraciones superiores a otros biosurfactantes, lo que contribuye a la difusión del uso de estas moléculas, especialmente en situaciones en las cuales el beneficio de la aplicación supera los costos de producción.4 Debido a su diversidad estructural, su baja toxicidad y biodegradabilidad, estas moléculas pueden ser utilizadas en la fabricación de cosméticos, medicamentos y alimentos como agentes emulsificantes, humectantes, preservativos y detergentes. Además, como son ecológicamente seguros, pueden aplicarse en la biorremediación y en el tratamiento de residuales.5
Los polihidroxialcanoatos son compuestos poliméricos sintetizados por las bacterias como reserva de carbono, energía y equivalentes reductores. Forman una clase de poliésteres naturales de ácidos grasos que pueden acumularse en forma de gránulos intracelulares, y representan hasta el 80 % de la masa seca de las células.6 Estructuralmente contienen unidades monoméricas de ácidos (R)-3-hidroxialcanoicos.
Estos biopolímeros son termoplásticos naturales, biocompatibles y no tóxicos, características que los convierten en importantes alternativas como substitutos de los polímeros sintéticos de origen petroquímico.7 Considerando sus propiedades mecánicas, tienen un amplio rango de potenciales aplicaciones, entre las cuales se incluyen la producción de artículos de la industria de embalaje, materiales desechables y producción de artículos biodegradables de higiene personal.8 Por su biocompatibilidad, estos poliésteres se han empleado para diversas aplicaciones médicas como material osteosintético, en placas óseas, suturas quirúrgicas, implantes, sustitución de vasos sanguíneos, y como vehículos de liberación sostenida de drogas.9
A pesar de las ventajas mencionadas, el uso a mayor escala de estas moléculas se encuentra limitado por sus altos costos de producción, asociados a una baja productividad, lo cual representa el principal obstáculo para su comercialización.1
Una alternativa considerada para la reducción de los costos de producción de ambos productos es obtenerlos de forma simultánea en un único proceso.10-12 La síntesis de ramnolípidos y polihidroxialcanoatos está relacionada, pues ambas rutas metabólicas comparten un intermediario común: los ácidos 3-hidroxialcanoicos.13 Además, los polihidroxialcanoatos se encuentran en el interior de la célula bacteriana, por lo que, para su recuperación es necesaria la ruptura de la membrana y la pared celular, con la consecuente liberación de los mismos. Por otra parte, la producción de materiales secretados como la mayoría de los tensoactivos, en combinación con la producción de polihidroxialcanoatos, representa un aumento en la viabilidad de los procesos de biocatálisis, porque las células pueden ser utilizadas para la producción de materiales excretados al medio antes de la recuperación final de los bioplásticos, y las técnicas convencionales como la centrifugación pueden utilizarse para la separación de ambos productos.1
En este contexto, el presente trabajo tuvo como objetivo evaluar la cinética del proceso fermentativo de obtención simultánea de ramnolípdos y polihidroxialcanoatos por la cepa P. aeruginosa ORA9, en un cultivo en biorreactor, como un aspecto esencial para establecer un bioproceso eficiente, donde se obtengan concentraciones adecuadas de ambos bioproductos.
Materiales y métodos
Microorganismo
En el estudio se utilizó la cepa P. aeruginosa ORA9,14 la cual se encuentra depositada en la Colección de Cultivos del Centro de Estudios de Biotecnología Industrial, de la Universidad de Oriente. La cepa se mantuvo en cuñas de agar nutriente (extracto de carne 3,0 g L-1, peptona 5,0 g L-1, agar 15,0 g L-1) a 4 oC, y subcultivada cada dos semanas.
Preparación de inóculo
Se tomaron colonias aisladas en placa de agar nutriente (24 h, 30 oC), se inocularon en 100 mL de caldo nutriente, y se incubaron en zaranda (Zaranda rotacional P Selecta España) por 24 h, 150 rpm y 30 oC. Este cultivo se utilizó para inocular un medio mineral15 modificado, de composición (para 1 L): 4,6 g de NaNO3; 0,6 g de KH2PO4; 0,3 g de MgSO4 . 7 H2O; 1 g de NaCl; 1 mL de disoluciones de CaCl2.2 H2O (1 %), Citrato Férrico Amoniacal (6 %) y 2 mL de disolución de elementos trazas: B (0,03 %), Co (0,02 %), Zn (0,01 %), Mn (0,003 %), Mo (0,003 %), Ni (0,002), Cu (0,001 %). Además, aceite residual de fritura (ARF) (aproximadamente 9 gL-1) como fuente de carbono. Un volumen apropiado de este cultivo constituyó el inóculo para el cultivo en biorreactor.
Condiciones de cultivo
El cultivo se realizó en un fermentador B. Braum Biostat B de 5 L con 2,5 L de volumen de trabajo. La temperatura se controló en 30 oC y el pH en 7,0 (con disoluciones de NaOH y H2SO4, 0,5 N). La formación de la espuma se controló manualmente añadiendo pequeñas cantidades de antiespumante. La tasa de aireación se fijó en 0,5 L min-1, y la agitación en 900 rpm para mantener el oxígeno disuelto superior al 40 %. Durante el cultivo se tomaron muestras para analizar masa celular seca, pH, concentración de ramnolípidos y contenido de polihidroxialcanoatos.
Purificación de los ramnolípidos
El medio de cultivo libre de células se acidificó con H2SO4 6 N hasta pH 2,0 y se dejó toda la noche a 4 oC. Los ramnolípidos precipitados se separaron por centrifugación (8 000 rpm, 15 min, 4 oC), se resuspendieron en una solución de bicarbonato 50 mM (pH 7,0) y nuevamente se precipitaron siguiendo el procedimiento descrito anteriormente. Finalmente, el bioproducto se secó por liofilización.
Extracción de los polihidroxialcanoatos
El polímero se extrajo de la biomasa celular liofilizada con cloroformo durante 5 h en un aparato Sohxlet. El extracto clorofórmico se concentró en rotoevapor (Büchi RE111, Flawil, Suiza). El polímero se purificó por precipitación a partir del concentrado clorofórmico, sobre un exceso de diez volúmenes de metanol frío.16
Estudio cinético
Se determinaron los parámetros cinéticos velocidad específica de crecimiento celular (µ x, h-1), velocidad volumétrica de formación de producto (r p , g L-1 h-1) y la velocidad específica de formación de producto (q p , g g-1 h-1), calculadas por las ecuaciones (1)-(3), respectivamente
donde X es la concentración de biomasa (g L-1), 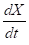 es la variación de la concentración de biomasa en el tiempo, y
es la variación de la concentración de biomasa en el tiempo, y 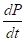 es la variación de la concentración de producto en el tiempo.
es la variación de la concentración de producto en el tiempo.
La velocidad específica máxima de crecimiento µ máx (h-1) se calculó a partir del gráfico ln X/Xo vs t, mediante un análisis de regresión lineal de la fase logarítmica en la curva de crecimiento celular.
El rendimiento del producto relacionado con la biomasa formada (Y P/X ) fue el parámetro estequiométrico calculado por la ecuación (4)
siendo P la concentración de producto (g L-1). Estos parámetros se calcularon siguiendo los métodos estándar de Aiba y col. (1973).17
Metodología analítica
Determinación de pH
Al sobrenadante, obtenido por centrifugación del cultivo, se le determinó el pH en un potenciómetro (Tecnal TEC-2) previamente calibrado con soluciones buffer de pH 4 y 7
Masa Celular Seca (MCS)
Las muestras del cultivo (10 mL) se centrifugaron (Spectrafuge 24 D Labnet) a 10000 rpm por 10 min a 4 oC, se lavaron dos veces con una solución de NaCl (0,85 % m/v) y Tween 80® (0,1 % v/v) y se sometieron a liofilización. Luego del secado, se determinó la masa de las muestras y la concentración de la MCS.
Cuantificación de los polihidroxialcanoatos
Aproximadamente 10 mg de células liofilizadas se sometieron a propanólisis.18 Los propilésteres se analizaron por cromatografía gaseosa en cromatógrafo Agilent 7890A equipado con una columna HP5, detectándose los propilésteres por medio de ionización de llama, luego de una inyección fraccionada (1:20). Las temperaturas del inyector y detector fueron 250 oC y 300 oC, respectivamente. El programa de temperatura de la columna empleado para separar los propilésteres, consistió en 100 oC por 3 min, aumentando hasta 180 oC a razón de 6 oC min-1, 180 oC por 5 min, aumentando hasta 240 oC a razón de 6 oC min-1 y mantenido a 240 oC por 3 min. El gas de arrastre empleado fue helio a una razón de 0,8 mL min-1. El ácido benzoico se utilizó como patrón interno, y ácidos grasos de composición conocida se utilizaron como patrones externos.
Cuantificación de los ramnolípidos
Se analizaron los β-hidroxiácidos y la ramnosa presentes en el sobrenadante. La ramnosa se determinó mediante hidrólisis ácida según la metodología descrita por Lopes (2011),19 utilizando un cromatógrafo líquido (HPLC) Ultimate 3000 (Dionex, Sunnyvale, CA, Estados Unidos) con detector por índice de refracción (Shodex,Kawasaki, Kanagawa, Japan) a 40 °C, columna HPX-87H (Bio-Rad, Hércules, CA, Estados Unidos) a 45 °C, fase móvil de H2SO4 5 mM con flujo de 0,6 mL min-1 y volumen de inyección de 10 μL. Se prepararon soluciones de ramnosa en las concentraciones de 0,01; 0,1; 0,2; 0,5; 1,0 y 2,5 g L-1, y se utilizaron como patrón para la elaboración de la curva de calibración. Los ácidos grasos se cuantificaron según procedimiento descrito anteriormente.
Análisis estadístico
Se realizaron tres réplicas para cada determinación, y se calcularon los estadígrafos media aritmética y desviación estándar. Se realizaron análisis de varianza (ANOVA) simple para comparar las medias. En todos los casos se utilizó un nivel de significación del 5 %. Los análisis y los gráficos se realizaron con la ayuda del software estadístico STATGRAPHICS Centurión XV 15.2.20
Resultados y discusión
Existen varios enfoques para reducir los costos de un proceso biotecnológico, y uno de ellos es la obtención de varios productos en el mismo proceso. Por tal motivo, con vistas a producir estos bioproductos a gran escala con un proceso optimizado, se necesitan estudios para la adquisición de información sobre los parámetros cinéticos que describen el crecimiento celular y la acumulación de los productos.
El cultivo en biorreactor de la cepa ORA9 en medio mineral y con ARF como fuente de carbono fue seguido por 72 h (figura 1).
A las 2 h de iniciado el cultivo, la biomasa comenzó a incrementarse alcanzando un valor máximo de 4,95 ± 0,25 g L-1 a las 18 h, momento a partir del cual el cultivo entró en la fase estacionaria del crecimiento bacteriano, debido, posiblemente, a la limitación de un nutriente esencial en el medio de cultivo.
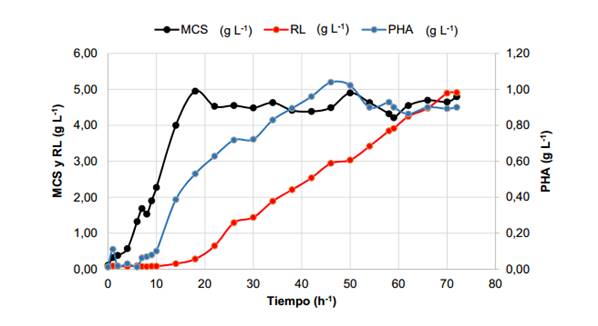
Fig. 1 Variación en el tiempo de la producción de ramnolípidos, la acumulación de polihidroxialcanoatos y masa celular seca en el cultivo de la cepa ORA 9 con ARF como fuente de carbono en biorreactor de 5 L
Por otra parte, se observó que la síntesis de ramnolípidos y polihidroxialcanoatos comenzó en diferentes momentos del crecimiento microbiano.
La concentración de ramnolípidos comenzó a aumentar a partir de las 14 h (0,15 ± 0,02 g L-1), coincidiendo con el final de la fase logarítmica del crecimiento microbiano, y continuó incrementándose durante toda la fase estacionaria, alcanzando, al cabo de las 72 h de cultivo, concentraciones de aproximadamente 5 g L-1
Este hecho corrobora el comportamiento de dichos compuestos como metabolitos secundarios, con una producción no asociada al crecimiento microbiano.
Por otra parte, la acumulación de polihidroxialcanoatos en la biomasa microbiana se detectó desde horas tempranas de la fermentación, pero comenzó a aumentar a partir de las 7 h, durante la fase exponencial del crecimiento microbiano, alcanzando un máximo de 1,04 ± 0,07 g L-1 (23 % de la MCS) a las 46 h, momento en que el cultivo ya se encontraba en su fase estacionaria. Posteriormente se observó una disminución hasta un valor de 0,90 g L-1 al finalizar el cultivo. De esta forma, la acumulación de polihidroxialcanoatos está asociada al período en que se observa crecimiento celular.
El estudio de la producción simultánea de ramnolípidos y polihidroxialcanoatos se ha reportado por varios autores y los resultados varían, en función de las condiciones de cultivo y de las cepas microbianas empleadas. Hori y col. (2002)1 observaron que la producción simultánea comenzó cuando cesó el crecimiento microbiano en el cultivo de la bacteria P. aeruginosa IFO3924, utilizando decanoato como fuente de carbono. Un comportamiento similar reportaron Marsudi y col. (2008)21, durante la producción simultánea de ramnolípidos y polihidroxialcanoatos por esta misma cepa (P. aeruginosa IFO3924) en condiciones de cultivo análogas, pero utilizando ácido oleico, aceite de palma y glicerol.
Por otra parte, Costa y col. (2009)22 observaron un comportamiento similar al obtenido en esta investigación, con la cepa P. aeruginosa L2-1 cultivada en diferentes sustratos oleosos. La síntesis de polihidroxialcanoatos ocurrió durante el crecimiento celular activo, en las primeras 48 h del cultivo, y la producción de ramnolípidos mostró una producción máxima a las 96 h.
La diferencia en los períodos de inducción para la síntesis de ramnolípidos y polihidroxialcanoatos puede deberse a sus diferentes mecanismos de regulación.1 La síntesis de ramnolípidos en P. aeruginosa está estrechamente regulada a nivel transcripcional por el mecanismo de sensor de quorum, y por las condiciones de cultivo. Por otro lado, la regulación de la síntesis de polihidroxialcanoatos depende de la fuente de carbono y de la cepa bacteriana. Para sustratos no-carbohidratos, la acumulación de polihidroxialcanoatos pudiera estar simplemente controlada por la competencia por los metabolitos.23
Parámetros cinéticos de la producción de ramnolípidos y polihidroxialcanoatos
En el cultivo en medio mineral con ARF como fuente de carbono, la cepa P. aeruginosa ORA9 mostró una velocidad específica máxima de crecimiento (µmáx.) de 0,28 h-1 en la fase exponencial del crecimiento microbiano (figura 2), un valor superior a 0,114 h -1 obtenido por De Lima (2007)24 durante la producción de biosurfactantes por la cepa Pseudomonas aeruginosa PALC, utilizando aceite de soya residual. Este hecho indica que la cepa ORA9 creció adecuadamente en el sustrato utilizado, lo cual viabiliza la obtención de los bioproductos de interés.
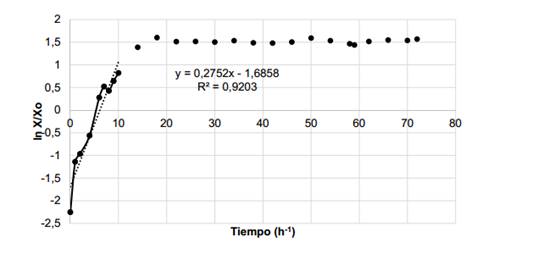
Fig. 2 Velocidad específica máxima de crecimiento (µmáx.) de la cepa ORA9 en el cultivo con ARF como fuente de carbono
El cálculo de los parámetros cinéticos y estequiométricos determinados a diferentes intervalos de tiempo (tabla 1) revelaron que el mayor rendimiento de ramnolípidos se logra al finalizar el cultivo (YP/X = 1,024), no ocurriendo lo mismo para la producción de polihidroxialcanoatos, cuyo rendimiento máximo (YP/X = 0,209) se alcanzó a las 50 h de cultivo.
Tabla 1 Parámetros cinéticos y estequiométricos de la producción de ramnolípidos y polihidroxialcanoatos por la cepa ORA 9 creciendo en medio mineral con ARF como fuente de carbono
| Tiempo (h) | ramnolípidos | polihidroxialcanoatos | |||||
| rP (g L-1 h-1) | qP (g g-1 h-1) | YP/X | rP (g L-1 h-1) | qP (g g-1 h-1) | YP/X | ||
| 4 | 0,019 | 0,033 | 0,130 | 0,007 | 0,013 | 0,053 | |
| 18 | 0,016 | 0,003 | 0,057 | 0,029 | 0,006 | 0,107 | |
| 30 | 0,048 | 0,011 | 0,321 | 0,024 | 0,005 | 0,161 | |
| 50 | 0,061 | 0,012 | 0,619 | 0,020 | 0,004 | 0,209 | |
| 72 | 0,068 | 0,014 | 1,024 | 0,013 | 0,003 | 0,188 | |
rP- velocidad volumétrica de formación del producto, qP- velocidad específica de formación del producto, YP/X- rendimiento del producto relacionado con la biomasa formada.
Por otra parte, el perfil no asociado al crecimiento que tiene la producción de ramnolípidos se pone de manifiesto al observarse el incremento de las velocidades, tanto volumétrica (rP, g L-1 h-1) como específica (qP, g g-1 de formación del producto a partir de las 18 h de cultivo, coincidiendo con el inicio de la fase estacionaria del crecimiento microbiano.
En este período es donde la bacteria comienza la excreción celular de los metabolitos secundarios al medio, estimulada por la escasez de nutrientes y por el mecanismo de sensor de quorum debido al aumento de la concentración celular, tal y como ha sido descrito para la producción de ramnolípidos por las bacterias pertenecientes al género Pseudomonas.4
Por otro lado, en la acumulación de polihidroxialcanoatos, las velocidades volumétrica y específica de formación del biopolímero tuvieron su máximo valor a las 18 h de cultivo alcanzando valores de 0,029 g L-1 h-1 y 0,006 g g-1 h-1, respectivamente, indicando la acumulación activa del polímero por la célula bacteriana durante el crecimiento celular, pues fue en este período donde se observaron los mayores valores de concentración de biomasa.
El perfil cinético obtenido en este estudio para la producción simultánea de ramnolípidos y polihidroxialcanoatos por la cepa ORA 9 indica que es posible establecer un bioproceso integrado, siempre que se establezca un tiempo de cultivo óptimo en el cual se alcancen concentraciones aceptables de ambos productos, pues como se ha observado, un tiempo de cultivo prolongado favorece la producción de ramnolípidos, pero es contraproducente para la obtención de concentraciones adecuadas de polihidroxialcanoatos.
Uno de los factores que puede contribuir en la reducción de los costos es la duración de la fermentación para la producción de algunos biosurfactantes. Las fermentaciones de los ramnolípidos en la mayoría de los procesos reportados en la literatura, continúan hasta las 100 h, mientras que la mayor producción puede haber ocurrido en las primeras 48 h. Prolongar el tiempo de producción para lograr un poco más de rendimiento puede no ser particularmente económico, teniendo en cuenta que la expresión de los genes que participan en la producción de ramnolípidos ocurre en las primeras 24 h de la fermentación.25 Por ello, las estrategias futuras estarían dirigidas a la optimización de las condiciones de cultivo, siendo el tiempo de fermentación una variable clave por mejorar.
Conclusiones
Se demostró que la producción de ramnolípidos por la bacteria Pseudomonas aeruginosa ORA9 cultivada en ARF presentó una cinética de producción no asociada al crecimiento, mientras que la acumulación de polihidroxialcanoatos en la biomasa estuvo asociada al crecimiento microbiano. Los resultados obtenidos corroboran la factibilidad de producir ramnolípidos y polihidroxialcanoatos, teniendo en cuenta su cinética de producción como punto de partida para diseñar un proceso económico, y alcanzar concentraciones adecuadas de ambos productos en un único proceso.


















