Introducción
En la planta de producción del Centro de Ingeniería Genética y Biotecnología (CIGB) de La Habana, se llevan a cabo procesos de obtención de Ingrediente Farmacéutico Activo (IFA) de diversos medicamentos ampliamente usados en Cuba y en otros países, entre los que se encuentra la vacuna Abdala contra la COVID-19, primera vacuna desarrollada, producida y con autorizo de uso en emergencia en Latinoamérica. Tiene las potencialidades de ser muy segura e inmunogénica, al emplear para su fabricación la plataforma de vacunas de subunidad, tecnología con más de treinta años de uso en Cuba. El inmunógeno es capaz de neutralizar las variantes ómicron y delta del virus SARS-CoV-2, las que más circulan en la nación, y así se evidenció en los estudios realizados de conjunto con el Instituto de Medicina Tropical Pedro Kourí con sueros de vacunados con Abdala.1
Los procesos farmacéuticos requieren servicios que se deben suministrar con alto grado de calidad. Para garantizar el cumplimiento de las especificaciones establecidas por los órganos regulatorios tanto nacionales (Centro Estatal para el Control de Medicamentos y Dispositivos médicos [CECMED]) 2, como internacionales (Organización Mundial de la Salud [OMS]).3 Entre estos servicios se incluyen el suministro de aire comprimido, vapor limpio, agua purificada y agua para inyección.
Los procesos productivos del CIGB, se han considerado como una impresionante línea de productos de la Ingeniería Genética.4) Estos no solo reportan beneficios de incalculable valor para la salud de la población, sino también, a través de su comercialización en el exterior, lo que genera ingresos para el desarrollo y el crecimiento económico sostenido del país.
El agua de calidad farmacéutica se emplea en los procesos de formulación, fermentación y purificación, y para la limpieza de los recipientes y accesorios, que han tenido contacto directo con los componentes y el producto farmacéutico. Por ello, debe cumplir especificaciones químicas y microbiológicas establecidas en monografías tales como la United States Pharmacopeia (USP).5
La USP5) define el agua purificada (AP), como la que se emplea para preparar un producto farmacéutico, que no necesita agua estéril y apirogénica, y que se puede obtener a partir de agua potable, a través de procesos de destilación, ósmosis inversa, intercambio iónico y otros métodos adecuados. El AP debe cumplir con estándares exigentes con respecto a la conductividad, Carbón Orgánico Total (TOC, por sus siglas en inglés), conteo de aerobios mesófilos y presencia de microorganismos patógenos (referidos a Escherichia coli y Pseudomonas aeruginosa)5. El CECMED2, coherente con la OMS y la USP, establece que el agua purificada debe cumplir con los atributos de calidad; por su parte; los productores del CIGB para mantener las regulaciones vigentes, aprobaron las especificaciones, Número de Parte (NP) para el AP, aparecen el NP 186 (tabla 1).
Tabla 1 Atributos de calidad establecidos para el agua purificada en el NP 186
| Parámetro | Especificación |
|---|---|
| Conductividad | ( 1,3 (S/cm |
| Carbón orgánico total (TOC) | ( 500 µg/L |
| Conteo total de aerobios mesófilos | ( 100 UFC/mL |
| Presencia de patógenos | Ausencia/200 mL |
El control en el AP tiene como propósito poseer una evidencia documentada de que el sistema produce consistentemente agua con los atributos de calidad establecidos en el NP. Los métodos de ensayos utilizados para controlar la calidad del AP, se seleccionaron de acuerdo con los requisitos establecidos en las Farmacopeas5 y Buenas Prácticas de Laboratorio (BPL) vigentes; e incluyen atributos físico-químicos y microbiológicos. La eficiencia en la respuesta analítica de estos ensayos es crucial para detectar desviaciones de los rangos aceptables (límites de alerta y acción) y tomar acciones preventivas en el proceso, de forma tal que aseguren que el sistema se encuentra bajo control y produce agua de calidad consistente.6
La operación de los elementos del sistema de generación, almacenamiento y distribución de AP se debe controlar de forma permanente, no solo desde el punto de vista de los parámetros de operación,5 sino también incluyendo atributos de calidad del agua que se está produciendo. El programa de muestreo debe establecerse de manera concisa y abarcar todos los puntos de interés, tanto para el sistema, como para los consumidores; se recomienda que las muestras sean tomadas antes y después de los elementos que conforman el sistema, para asegurar que cualquier sección que presente desviaciones de las condiciones y parámetros de operación establecidos, pueda ser identificada.7
Antes de efectuar la toma de muestra8 los puntos deben ser higienizados y drenados de acuerdo con procedimientos establecidos. Los frascos para el muestreo deben ser de material inerte, con cierre hermético para evitar riesgos de contaminación cruzada. La identificación de las muestras se realiza de forma tal que las etiquetas estén firmemente adheridas. Los laboratorios de control dispondrán de evidencias documentadas de las condiciones y la temperatura de la muestra,9 así como del momento en que comienza el ensayo microbiológico, que será efectuado en laboratorios equipados con adecuados recursos, que cumplan las BPF y las BPL.
Para controlar la calidad del agua purificada se establecen gráficos con límites de alerta, de acción y de especificación para los atributos físico-químicos y microbiológicos, cuyo objetivo es asegurar que el sistema de agua esté bajo control.10
La evaluación de los resultados graficados permite elaborar tendencias en el comportamiento de los parámetros, durante la producción y distribución de AP, que indican cuáles etapas del sistema de agua no funcionan como se esperaba. Por otra parte, permite realizar investigaciones y tomar acciones correctivas específicas; para que el proceso vuelva a estar bajo control operativo normal y mitigar el riesgo de que la calidad final del agua se vea afectada.11
Los sistemas de producción de Aguas para Uso Farmacéutico (AUF), son considerados como servicios críticos en la elaboración de IFAs, dado su alto nivel de impacto en la calidad del producto final.12,13
Tomando en cuenta los elementos anteriores, el presente artículo tuvo como objetivo controlar la calidad del agua purificada que se suministra a la producción del IFA de la vacuna Abdala.
Materiales y métodos
Programa de muestreo
Durante 21 días se tomaron muestras de agua por los operadores entrenados para esta operación, como parte del Programa de Monitoreo Ambiental (PMA) aprobado por la Dirección de Gestión de la Calidad y Asuntos Regulatorios (GCAR) del CIGB. La información sobre los puntos de muestreo (PM) es presentada, de forma resumida, en la tabla 2, donde se exponen los cuatro PM ubicados en el sistema de generación de APy nueve puntos de uso (PU), ubicados en el área productiva para analizar la distribución en la planta 1, dedicada a la producción de IFA de la vacuna Abdala e integrada por áreas con clasificaciones ambientales que van desde clases D hasta clases A, que son las de mayor exigencia para la industria.14
Tabla 2 Descripción y ubicación de puntos de muestreo y puntos de uso para monitorear la calidad del agua purificada
| Código | Local | Descripción | Tipo de Punto |
|---|---|---|---|
| AP-PM009 | Sistema | Entrada al tanque de AP | Punto de muestreo |
| AP-PM012 | Sistema | Salida de la lámpara UV del lazo | Punto de muestreo |
| AP-PM013 | Sistema | Salida del tanque de distribución | Punto de muestreo |
| AP-PM014 | Sistema | Retorno del lazo de distribución | Punto de muestreo |
| AP-PU012 | Planta 1 | Fregadora. Área de apoyo fermentación | Punto de uso |
| AP-PU013 | Planta 1 | Local de ultrafiltración. Purificación | Punto de uso |
| AP-PU014 | Planta 1 | Local de adsorción. Purificación | Punto de uso |
| AP-PU015 | Planta 1 | Preparación de soluciones. Área de apoyo | Punto de uso |
| AP-PU016 | Planta 1 | Preparación de soluciones. Purificación | Punto de uso |
| AP-PU017 | Planta 1 | Local de fregado y limpieza de tanques. Purificación | Punto de uso |
| AP-PU018 | Planta 1 | Fregadora. Área de apoyo purificación | Punto de uso |
| AP-PU021 | Planta 1 | Área de fermentaciones. Fermentación-recobrado | Punto de uso |
| AP-PU023 | Planta 1 | Área de fregado de rotores. Fermentación-recobrado | Punto de uso |
La calidad del AP obtenida y suministrada a la producción en planta 1, se controló mediante ensayos atendiendo a los atributos establecidos en las farmacopeas vigentes, con la frecuencia recomendada por las regulaciones vigentes, 3,15 y según los resultados de la validación del sistema para los PM y los PU (tabla 3).
Métodos de ensayos
Para el ensayo de conductividad se empleó un conductímetro de la firma Mettler Toledo, con una sensibilidad de ( 0, 01 (S/cm.
Conductividad. La conductividad del AP debe ser menor de 5 µS/cm, en función de la temperatura y del pH16. Además, se ve afectada por la presencia de gases disueltos (fundamentalmente dióxido de carbono); por esas razones el ensayo es multi-etapa.17
Etapa 1
Se determina la temperatura del agua y la conductividad usando un conductímetro calibrado y colocado en la línea. Si no es posible la medición en línea, la muestra debe ser tomada en un recipiente cerrado y realizar la medición inmediatamente.
Usando la tabla de requerimientos de temperatura y conductividad de la etapa 1 (tabla 4), se halla el valor de temperatura que no sea mayor que la temperatura medida. El valor de conductividad correspondiente es el límite superior a esa temperatura.
Si la conductividad medida no es mayor que el valor de la tabla, el agua cumple los requerimientos de conductividad; si la conductividad es mayor que el valor de la tabla se procede a la etapa 2.
Etapa 2
Se transfiere suficiente cantidad de agua (100 mL o más) a un recipiente adecuado y se agita la muestra. Se ajusta la temperatura si es necesario y mientras se mantiene a 25 ± 1 °C, se agita vigorosamente la muestra, mientras se observa continuamente la conductividad. Cuando el cambio de conductividad, debido a la absorción del dióxido de carbono del aire, sea menor que 0,1 μS/cm en 5 min, se anota la conductividad.
Si la conductividad no es mayor de 2,1 μS/cm cumple con los requerimientos; en caso contrario se procede con la etapa 3.
Etapa 3
El ensayo se realiza dentro de aproximadamente los 5 min posteriores a la determinación de la conductividad del paso 5, mientras se mantiene la temperatura de la muestra a 25 ± 1 °C. Se añade la solución de cloruro de potasio saturada a la misma (0,3 mL por 100 mL de muestra) y se determina el pH.
Usando la tabla de requerimientos de conductividad y pH de la etapa 3 (tabla 4), se determina el límite de conductividad al valor del pH medido. Si la conductividad medida en el paso 4, no es mayor que la obtenida en el paso 6, el agua cumple los requerimientos de conductividad. Si la conductividad medida es mayor que este valor o el pH está fuera de rango de 5,0 a 7,0; el agua no cumple los requerimientos de conductividad.
Tabla 4 Requerimientos para mediciones de la conductividad en el agua purificada
| Etapa 1: Requerimientos de temperatura y Conductividad (para mediciones de conductividad sin compensación de temperatura) | Etapa 3: Requerimientos para pH y Conductividad (para muestras equilibradas a atmósfera y temperatura ambiente) | ||
| Temperatura (°C) | Requerimientos de Conductividad (μS/cm) | pH | Requerimientos de Conductividad (μS/cm) |
| 0 5 10 15 20 25 30 35 40 45 50 55 60 65 70 75 80 85 90 95 100 | 0,6 0,8 0,9 1,0 1,1 1,3 1,4 1,5 1,7 1,8 1,9 2,1 2,2 2,4 2,5 2,7 2,7 2,7 2,7 2,9 3,1 | 5,0 5,1 5,2 5,3 5,4 5,5 5,6 5,7 5,8 5,9 6,0 6,1 6,2 6,3 6,4 6,5 6,6 6,7 6,8 6,9 7,0 | 4,7 4,1 3,6 3,3 3,0 2,8 2,6 2,5 2,4 2,4 2,4 2,4 2,5 2,4 2,3 2,3 2,1 2,6 3,1 3,8 4,0 |
Carbono orgánico total (TOC)
Es una medida directa de la calidad del agua producida, útil en los procesos de validación e higienización de los sistemas de producción biofarmacéutica. Este método se desarrolla en el analizador de TOC, modelo Sievers 900 (Metler Toledo, Suiza).
El analizador oxida los componentes del carbono para formar dióxido de carbono (CO2) mediante radiación UV en presencia de ácido orto fosfórico al 45 % ± 1 % m/m y persulfato de amonio al 14,8 % ± 0,7 % m/v, suministrado por Sievers. El CO2 se mide utilizando una técnica de detección conductimétrica sensible y selectiva por membrana. La comprobación de funcionamiento se realiza de forma periódica, según lo establecido en la USP 43 para los instrumentos analizadores de TOC. Para ello evalúa la capacidad funcional del equipo para oxidar y detectar TOC en materiales de referencia sacarosa 500 ppb y 1,4-benzoquinona, empleando agua reactivo de suministrados por Sievers. Todos constan con su certificados de acreditación AT-2118, que constatan que los materiales de referencia fueron evaluados en un laboratorio acreditado por la ISO/IEC 17025.
Conteo de aerobios mesófilos (ufc/mL) y presencia de microorganismos objetables, por el método de filtración por membrana
Se determinó el total de microorganismos viables presentes en las 277 muestras, con el empleo del método de limite microbiano establecido en Test<61> de la USP, la filtración de un volumen de AP por una membrana analítica y su posterior inoculación en R2A (medio de cultivo), incubación de 30 a 35 ºC en 72 h, y conteo del número de unidades formadoras de colonias presentes en la membrana. Test(61( Microbial Enumeration, mediante el empleo del Test<63> Test for Specified Microorganisms de la USP,5 se determinó la posible presencia de microorganismos patógenos que puedan estar presentes en la muestra como Escherichia coli y Pseudomonas aeruginosa en los medios de Agar cetrimide y Agar pseudomona.
Los métodos de ensayos utilizados en el control fueron verificados, según establecen las BPL, de acuerdo con las condiciones de uso.6
Resultados y discusión
Las 277 muestras tomadas fueron analizadas de inmediato, en los casos en los que no se podía ejecutar el ensayo en los tiempos indicados en el procedimiento de muestreo aprobado; se mantuvieron a temperatura controlada entre 2 ºC y 8 ºC.
Monitoreo de la calidad
El monitoreo de la calidad del AP tiene como objetivo garantizar la inocuidad de la vacuna y prevenir la contaminación con agentes extraños, según indican las monografías generales sobre vacunas para uso humano: "Los métodos de preparación deben ser diseñados para mantener las propiedades inmunogénicas adecuadas".14
Para evaluar los resultados de los ensayos, se realizó la comparación entre los valores reportados y los límites establecidos en la Especificación para Agua Purificada (USP 43), y se tomaron del protocolo de validación vigente del sistema los límites de alerta y de acción (tabla 5).
Resultados obtenidos en el control de la calidad de los parámetros físico-químicos y microbiológicos establecidos del sistema y los puntos de uso
Conductividad
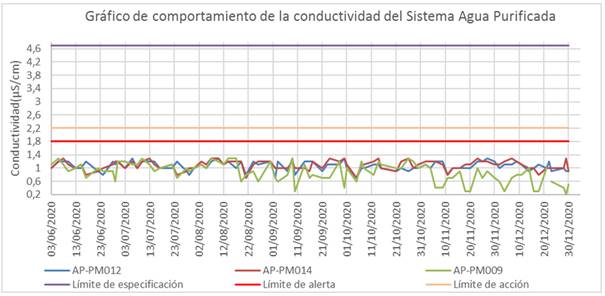
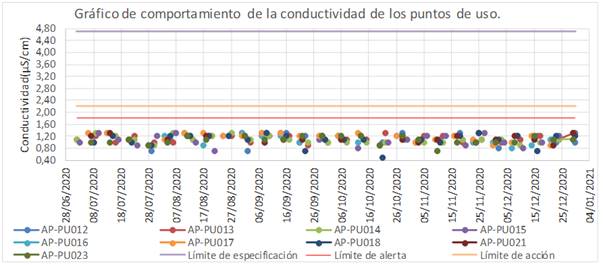
Los resultados obtenidos en los ensayos de conductividad, durante el período evaluado se encontraron por debajo de los límites de especificación. En las figuras 1 y 2 se observó un comportamiento homogéneo del parámetro de control, y los resultados no excedieron los límites establecidos en la USP 43. No se registraron valores que sobrepasaran el límite para la etapa II (2,1 (S/cm).
Carbono Orgánico Total (TOC)
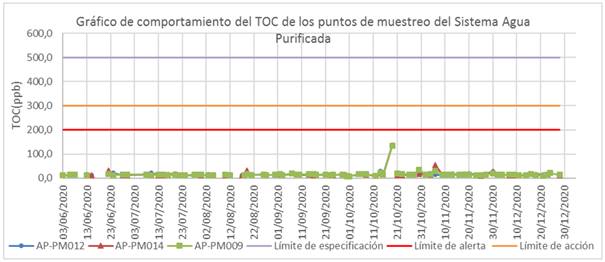
Los 88 resultados de TOC obtenidos en los puntos muestreados fueron aceptables, según se muestra en la figura 3. Todos los valores estuvieron por debajo de 500 µg/L (límite de especificación para el AP) y de 200 µg/L(límite de especificación para el AP). Ello evidencia la estabilidad del comportamiento del TOC del agua purificada en todo el sistema de distribución en el período analizado.
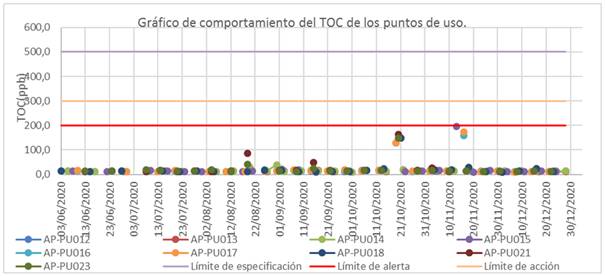
De los 189 resultados de TOC reportados en los PU, sólo se obtuvo un valor cercano (197 µg/L) al límite de alerta, en el punto AP-PU015, ubicado en el local de preparación de soluciones del área de apoyo el día 13 de noviembre del 2020, que no representó riesgo para la producción en planta 1.
Conteo de aerobios mesófilos
En los procesos para obtener AUF se presta particular atención a su calidad microbiológica, porque los microorganismos son las formas más costosas de contaminación en la industria biofarmacéutica. Entidades biológicas vivas y muertas se encuentran en todos los sistemas de agua, y se requiere de grandes esfuerzos para minimizar el daño que puedan ocasionar.14
En el período analizado, se evaluó el comportamiento de los resultados mediante comparaciones con los límites, teniendo en cuenta las pautas que establece la USP 5) en su monografía sobre atributos microbiológicos de productos no estériles; y las indicaciones que es responsabilidad de cada fabricante evaluar su producto, la forma en que se fabrica y establecer un nivel de acción aceptable para la contaminación, de no exceder el máximo, sobre la base del producto de mayor riesgo elaborado con el agua.
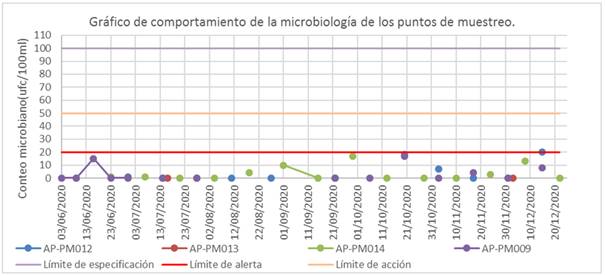
Los valores de conteos de aerobios mesófilos obtenidos en los cuatro puntos de muestreo seleccionados, se muestran en la figura 5. De un total de 84 muestras, los ensayos realizados tuvieron resultados conformes, y el crecimiento estuvo por debajo del límite de especificación de 100 ufc/100 mL.
Se puede observar que en el conteo de aerobios mesófilos se encuentran cuatro resultados cercanos al límite de alerta (20 ufc/100 mL) y no se detectaron patógenos en las muestras analizadas. Considerando que los microorganismos existen en un sistema de agua flotando libremente o adheridos a las paredes de tuberías, accesorios y tanques, conocidos como biopelículas, se observa que la contaminación no está distribuida de manera uniforme en el sistema, y es posible que una muestra no sea representativa del tipo y nivel de contaminación; es por ello que se tomaron acciones de higienización que permitieron evitar la contaminación en el sistema de AP.
Estos resultados evidencian la estabilidad del comportamiento en el sistema y la efectividad del esquema de higienización establecido, teniendo en cuenta además que el AP-PM14 es el punto crítico del sistema.
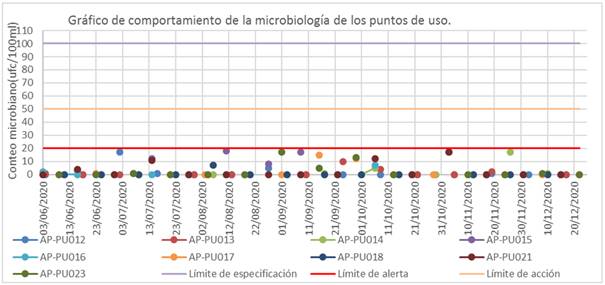
En los puntos de uso no se repostaron resultados fuera de la especificación (figura 6). De un total de 189 muestras, solo se obtuvieron seis resultados cercanos al límite de alerta, y no se detectaron patógenos en ninguna de las muestras analizadas.
Conclusiones
La evaluación realizada del sistema de agua demostró que el agua suministrada a la producción del IFA de la vacuna Abdala contra la COVID-19 cumple con las especificaciones de forma consistente evidenciado por: resultados de conductividad conformes de acuerdo con la especificación de agua purificada; niveles de TOC consistentes durante todo el período evaluado, y conformidad de los ensayos microbiológicos.
Los resultados para el control de calidad del AP en los puntos de muestreo y en los puntos de uso demuestran el cumplimiento de los límites establecidos para los tres parámetros evaluados, y evidencian en la documentación disponible, que el sistema produce consistentemente agua con los atributos de calidad establecidos en el NP.