Introducción
Los carcinomas en piel son una enfermedad recurrente hoy en día y cuya aparición se encuentra ligada mayormente a la exposición de la piel a los rayos UV, al tipo de piel y a inmunodeficiencia.1 Una combinación de estos factores, sumada a una predisposición genética puede resultar en un gran riesgo de contraer cáncer de piel. Aunque la mayoría de estos carcinomas permanecen poco invasivos, los de célula escamosa y aunque menos frecuente los de células basales, pueden difundir hasta nódulos linfáticos y órganos distantes generando metástasis, estadio considerado como una condición terminal.1
Conjuntamente con la cirugía y la radiación, la quimioterapia constituye una alternativa de tratamiento para los carcinomas en piel. Las formulaciones actuales presentan una desventaja fundamental, la inespecificidad. (1 Para alcanzar los niveles terapéuticos requeridos en el sitio de acción se hace necesaria la administración de altas dosis, incrementándose su citotoxicidad.3) Uno de los agentes quimioterapéuticos más empleados lo constituye el 5-Fluorouracilo (5-FU), un análogo de la pirimidina que interviene en la síntesis del ADN inhibiendo la división celular2,4 Aunque el 5-FU presenta más efectividad en células cancerosas que en células normales, es un antimetabolito inespecífico que presenta variados efectos secundarios, que son la causa probable del abandono prematuro del tratamiento por parte de los pacientes, conduciendo a una disminución de la tasa de curación.2 Las formulaciones que contienen el 5-FU libre exhiben un corto período de exposición en niveles terapéuticos a la lesión porque sufre una rápida eliminación in vivo, motivo por el cual es administrado en altas dosis para mantener un intervalo de concentración adecuado.2
Actualmente los esfuerzos se han orientado hacia el desarrollo de nuevos vehículos farmacéuticos capaces de incrementar la afinidad del fármaco con la piel, dando lugar a mejores efectos terapéuticos con dosis más bajas, resultando en una disminución de los efectos secundarios. En este sentido, las nanoformulaciones de liberación controlada representan un camino favorable. Medicamentos a base de nanopartícula han mostrado resultados prometedores para muchas enfermedades de la piel 5, especialmente los basados en sistemas de partículas poliméricas, capaces de regular la cantidad a entregar y sostener el efecto terapéutico en el sitio de acción.2 Mediante la liberación controlada se reduce la cantidad requerida para alcanzar los niveles terapéuticos, decrece la concentración en sitios no deseados y se posibilita la reversión del proceso de multirresistencia que desarrollan algunas células.2,6
Las matrices poliméricas presentan ventajas como biocompatibilidad, biodegradabilidad y relativa facilidad de preparación y mezcla, además de facilidad de moldeo y adaptación a un diseño determinado, lo que les ha permitido ser empleadas en aplicaciones biomédicas.7 Los policianoacrilatos de alquilo (PACA) han sido ampliamente estudiados como portadores de fármacos, entre ellos varios anticancerígenos 8, mostrando buenos resultados. Estos polímeros inducen un incremento en la acción terapéutica del citostático. Un primer criterio considera el aumento de la toxicidad del citostático, a la vez que las altas concentraciones de los productos de degradación en la membrana celular inducen toxicidad. Otro criterio sugiere que revierten la resistencia de algunos tipos de células cancerosas a los medicamentos debido a la adsorción de las partículas en las células y a la formación del par iónico citostático-poli(ácido cianoacrílico) durante el proceso de degradación, el cual es capaz de cruzar la membrana celular sin ser reconocido por la p-glicoproteína.9,10
El policianoacrilato de n-butilo (PBCA) perteneciente a esta familia exhibe características que lo hacen viable como portador de moléculas pequeñas con actividad citostática como el 5-FU. Su monómero precursor presenta baja toxicidad y es biodegradable, mientras es fácil de polimerizar en medio ácido, sin necesitar la administración de energía, promoviendo una mayor “carga mecánica” del fármaco y protección a la perdida de actividad biológica.11 En relación a la toxicidad, los resultados obtenidos de los análisis de fase clínica I y II han revelado la tolerancia y efectividad de esta familia.11,12
Los sistemas coloidales poliméricos biodegradables a base de partículas de PBCA son factibles para la liberación de fármacos dada la relativa facilidad de su producción y escalado 13, además de su conveniente eliminación del organismo de manera natural.14) Una ventaja importante de emplear partículas submicrométricas es su tamaño subcelular, el cual permite una acumulación eficiente del fármaco en el sitio deseado.7
En el caso de tratamientos locales pueden aumentar el índice terapéutico debido a la reducción de la absorción sistémica. Dichas partículas pueden ser preparadas mediante disímiles técnicas y cuando presentan diámetros que bajan de 1µm, pueden ser llamadas nanocápsulas o nanoesferas dependiendo de su composición.14 Las características más importantes que presentan para ser empleadas como sistemas de liberación controlada (SLC) son el tamaño, la eficiencia de encapsulación, el potencial zeta y la capacidad de liberación del fármaco.15 Como medio para mejorar la biodistribución del fármaco pueden ser direccionadas, colocándolas sobre la zona afectada o en sus cercanías. Asimismo, la propiedad del PBCA de ser un adhesivo de probada efectividad 11,15 ofrece una estrategia promisoria para la preparación de un medicamento de administración tópica.
En el presente trabajo se investiga la obtención de un sistema coloidal de partículas submicrométricas de PBCA cargadas con 5-FU con potencial utilidad como SLC para tratar lesiones malignas en piel. La preparación de las partículas se realiza empleando la técnica de polimerización en emulsión.8 El proceso de cargado de las partículas con el citostático sigue dos metodologías, la adsorción superficial del 5-FU a las partículas poliméricas previamente formadas y la encapsulación del 5-FU en la matriz polimérica mediante su adición al medio de polimerización, durante el proceso de elaboración de las partículas. La elección del PBCA como matriz polimérica portadora para este antimetabolito está basada además, en la probada actividad que presenta en estudios contra diferentes líneas celulares, tanto de cánceres resistentes como no resistentes.10,11
En este trabajo se propone determinar cuál metodología de síntesis permite depositar mayor cantidad de citostático en las partículas obtenidas en las condiciones de trabajo empleadas, para su posterior liberación en el sitio de acción. Las técnicas de IR, RMN, MALDI-TOF, SEM, DLS, UV y HPLC se aplicaron en el estudio de la composición estructural, distribución de masas moleculares, morfología, tamaño y cantidad de fármaco portado en los sistemas obtenidos.
Materiales y métodos
Materiales
Los reactivos empleados fueron de calidad analítica. Procedentes de las siguientes firmas: cianoacetato de n-butilo (Probus), hidróxido de potasio (Convol®), dextrana 40 (Panreac®),dextrana 70 (Sigma-Aldrich), ácido clorhídrico (BDH) paraformaldehído (Prolabo), ácido nítrico y acetona (UNI-CHEM®). El monómero cianoacrilato de n-butilo fue obtenido en el laboratorio y el 5-Fluorouracilo suministrado por el CIDEM (lote 10G-371). El agua empleada para la experimentación fue desionizada y filtrada por un filtro de membrana (Milli-Q Academic).
Preparación del monómero BCA
La metodología seguida consistió de dos pasos fundamentales: (a) Obtención de una mezcla de oligómeros mediante una técnica de síntesis asistida por microondas, según se describe a continuación: en un balón de 250 mL se añadieron 50 mL de cianoacetato de n-butilo, 11,689 g de paraformaldehído, 0,3 g de hidrocloruro de piperidinio y 37 mL de tolueno. El balón se situó en un horno de microondas (horno doméstico marca Frigidaire, adaptado para síntesis con frecuencia de trabajo de 2,45 GHz) y se conectó a un condensador de reflujo de alta eficiencia, acoplado a una trampa Dean-Stark. Se programó la potencia de trabajo del equipo al 40% durante 15 min y se siguió el avance de la reacción midiendo la cantidad de agua depositada en la trampa Dean-Stark. La irradiación se detuvo una vez que el agua recogida se acercó al valor estequiométrico y no se observaron cristales de paraformaldehido dentro del sistema. En el segundo paso (b) se provocó la pirólisis de la mezcla obtenida, en presencia de P2O5, acoplándola a un sistema de destilación a presión reducida por debajo de 10 mmHg. Seguidamente el monómero se purificó por destilación en presencia de inhibidores radicálicos y aniónicos.
Preparación de partículas sub-micrométricas de PBCA
Las síntesis se llevaron a cabo mediante la polimerización en emulsión del monómero BCA en medio acuoso; donde el mecanismo se corresponde a un proceso aniónico iniciado por bases covalentes presentes en el medio.12
El procedimiento seguido consistió en el goteo bajo agitación mecánica de una disolución del monómero en acetona (0,50mL de BCA/5,00mLde acetona) sobre una disolución acuosa ácida que contenía el agente estabilizante. Pasadas 4h de reacción, la polimerización se terminó por la neutralización del medio acuoso con la adición de cantidad suficiente de una disolución de KOH (0,1 mol/L). La emulsión obtenida se sometió a rotoevaporación a 37°C (IKA ®RV 10 basic) para extraer la acetona y luego a un proceso de lavado que incluyó repetidos ciclos de centrifugación de 10 min a 13 000rpm (microcentrífuga 5424 R Eppendorf) ó concentración de la emulsión en un agitador de células con flujo de 1mL/min, P=2bar y 330 rpm de agitación (Amicon® 8050 con membrana de celulosa regenerada de10KDa) y redispersión en agua hasta que la conductividad del sobrenadante resulto 0 ≤ 10 µS/cm, indicativo de que la suspensión estaba libre de impurezas.
Se realizaron dos variantes del experimento en las cuales se cambió el ácido empleado para producir el medio acuoso, el surfactante y la velocidad de agitación para producir las partículas. En la tabla 1 se muestran los reactivos y cantidades empleadas.
Tabla 1 Condiciones de síntesis de las nanoesferas de PBCA.
| Variante A | Agitación (rpm) | Variante B | Agitación (rpm) | ||||
| Reactivos | Cantidades | 14 000 | Reactivos | Cantidades | 1200 | ||
| BCA | 0,50mL | BCA | 0,50mL | ||||
| HNO3 (10-3 mol/L) | 50mL | HCl(10-3 mol/L) | 50mL | ||||
| Dextrana-40 | 4,0% (w/v) | Dextrana-70 | 2,0% (w/v) | ||||
| Acetona | 5,0mL | Acetona | 5,0mL | ||||
Métodos de caracterización
Para el monómero se empleó la espectroscopía infrarroja (espectrómetro FT-IR Jasco 4100) y Resonancia Magnética Nuclear (RMN-1H) (Bruker Advance DRX 500, SB, 11.7 T, 500 MHz). Para las partículas se usó (FT-IR) modo ATR (Perkin-Elmer,modelo Frontier), RMN -1H y 13C (Bruker-Ascend, 400 MHz) y espectrometría de masas (MALDI-TOF, Bruker modelo Autoflex con láser Nd: YAG, Smartbeam de 355 nm). Los espectros se registraron en modo lineal y en modo reflectrón (21 keV). Los iones se detectaron en modo positivo.
El tamaño de partícula, el potencial Zeta y el índice de polidispersión de las nanoesferas de PBCA, fueron determinados por DLS (Dinamyc Light Scattering) (Beckman Caulter) a 25°C y empleando agua como medio de dispersión. Mientras que la morfología se verificó mediante SEM (Scanning Electron Microscopy) (Hitachi S-530 con filamento de Tungsteno) depositando las partículas en una cinta conductora de carbono doble adhesiva y recubriéndolas con oro.
Determinación del 5-Fluorouracilo cargado en las partículas
La determinación del (5-Fluorouracilo, 5-FU) cargado en las partículas que fueron producidas por la Variante A se realizó mediante espectrofotometría UV (Genesys 10 S, Thermo Scientific), a 266nm. La curva de calibración se adquirió entre 0,386-1,99mg/mL.
En la variante B se obtuvo partículas con un tamaño menor que atravesaron los filtros produciendo una disolución de aspecto turbio, impidiendo la medición por espectrofotometría UV. Estas muestras fueron inyectadas directamente en el HPLC empleando en la remoción de las mismas un filtro en línea. Las mediciones se llevaron a cabo en un cromatógrafo Shimadzu Prominence (bombas LC-20AT, Inyector manual Reodyne 7725i, Horno CTO-20A y detector ultravioleta SPD-M20A) a 264 nm, a 30°C en sistema isocrático, con una duración de 10min. La muestra se introdujo mediante inyección manual (5μL). Como fase móvil se empleó ácido fórmico 1,0% en agua (fase móvil A) y metanol puro (fase móvil B) 97:3 (V/V) manteniendo un flujo de 1,0 mL/min. La curva de calibración fue preparada en el intervalo de 0,025-0,750mg/mL. Para la medición de la muestra fueron tomados 50 μL cada vez. Ambas curvas de calibración (UV y HPLC) produjeron valores de R2 ≥0,99.
Se emplearon dos metodologías para cargar las partículas de PBCA con 5-FU: adsorción superficial del fármaco a las partículas previamente formadas y luego incubadas en una disolución del fármaco y la encapsulación del fármaco en la matriz polimérica mediante la adición del 5-FU al medio de polimerización durante el proceso de obtención de las partículas.
En el primer caso se comenzó por la determinación de la absorbancia del sobrenadante de las partículas de PBCA cargadas con 5-FU, luego de ponerlas en contacto [0,03%(m/v)] con una disolución acuosa de 5-FU a una concentración específica (10-4mol/L), bajo agitación mecánica (750 rpm) a 25°C. La disolución acuosa contenía HNO3 (0,1mmol/L) y cantidades suficientes del agente estabilizante (4,0% m/v). La determinación del 5-FU sorbido se realizó por espectrofotometría UV. Los experimentos fueron realizados con las partículas de PBCA producidas por la Variante A. El sobrenadante fue obtenido luego de centrifugar a 13000 rpm (microcentrífuga 5424 R Eppendorf) por 10 min y filtrar la suspensión de las partículas empleando microfiltros(Minisart®) con un tamaño de poro de 0,10 µm. (EXP 1).
Las partículas producidas por la Variante B se estudiaron por HPLC empleando el sobrenadante de las mismas cargadas con 5-FU [0,03%(m/v)] luego de puestas en contacto con una disolución de 5-FU (10-3mol/L), a 25°C y bajo agitación mecánica (130 rpm), donde la disolución contenía HCl (1mmol/L) y 2%m/v de Dextrana 70 (EXP 2). Para cada caso se realizó una cinética de sorción durante 72 h.
Teniendo en cuenta los resultados de los dos estudios previos y del análisis estadístico que se les efectuó a dichos experimentos, se procedió a la realización de nuevos ensayos de carga superficial del fármaco durante un período de tiempo de 8 h. En este caso fueron utilizadas las partículas poliméricas previamente obtenidas en la variante B de síntesis [0,3%(m/v)], una concentración de 5-FU de 10-3mol/L, una concentración de HCl de 1mmol/L y una agitación de 130 rpm. El procedimiento fue el mismo empleado en los experimentos previos y las mediciones del fármaco se efectuaron mediante HPLC como se explicó con anterioridad.
Después de la encapsulación del fármaco, la determinación por HPLC del 5-FU sorbido en las partículas, se determinó por la diferencia con el porcentaje de 5-FU libre en disolución, partiendo de una concentración inicial de citostático de 1mg/mL. La síntesis se realizó empleando en la disolución acuosa el 5-FU disuelto, HCl (10-3 mol/L) y Dextrana-70 [2,0%(m/v)]. El monómero fue goteado cuidadosamente sobre esta disolución bajo agitación mecánica (1200rpm) para producir las partículas. Todas las mediciones se llevaron a cabo por triplicado.
Resultados y discusión
Caracterización estructural del monómero BCA
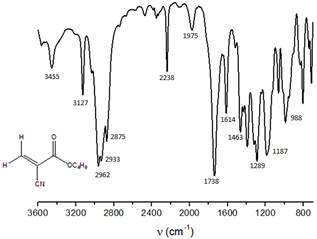
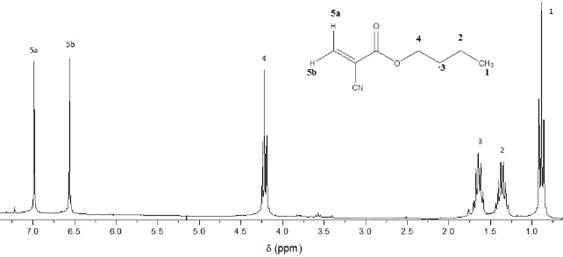
Los espectros obtenidos representativos del monómero, se muestran en las figuras 1 y 2. Ambos espectros indican que la sustancia obtenida, estructuralmente se corresponde con el monómero BCA. En el espectro IR de dicho compuesto se observan tanto las bandas correspondientes a los grupos funcionales del monómero: banda estrecha de intensidad media, 2238 cm-1(ν C≡N) valor típico de nitrilos enlazados directamente a grupos vinílicos; banda ancha de gran intensidad, 1738 cm-1(ν C=O) valor cercano a los típicos para ésteres acoplados a dobles enlaces C=C); así como bandas que indican la formación del enlace vinílico característico de la estructura del BCA:3127 cm-1(ν Csp2-H), 1614 cm-1(ν C=C) y las bandas notables en 1289 y 1187 cm-1 correspondientes a las vibraciones de valencia acopladas C-O (ν C-O) de ésteres derivados de ácidos α,β insaturados. Por otro lado, en el espectro de RMN-1H se observa la presencia de dos singletes en la región de los dobles enlaces: 7.00 ppm (5a, Int = 1) y 6,56 ppm (5b, Int= 1), que se corresponden con los protones del grupo metileno del enlace vinílico presente en la estructura del compuesto.
Preparación y caracterización de las partículas de PBCA libres
Caracterización espectroscópica IR y RMN
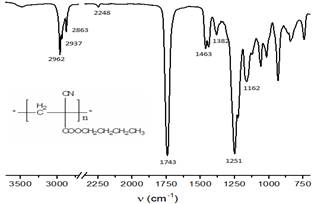
En el espectro IR (figura 3), solo se observa la presencia de los grupos funcionales propios del polímero, haciéndose notar la desaparición de las bandas correspondientes al doble enlace vinílico del monómero y el corrimiento a mayores números de onda y la disminución en intensidad de la banda (ν C≡N), confirmando que la polimerización tuvo lugar, pues el nuevo valor cae dentro del rango de nitrilos alifáticos. El corrimiento a mayores números de onda de la banda (ν C=O) del éster fue indicativo de la ausencia de dobles enlaces característicos del monómero.
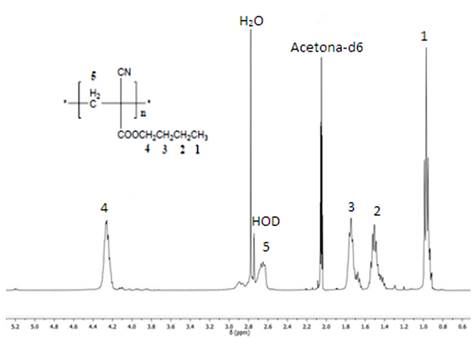
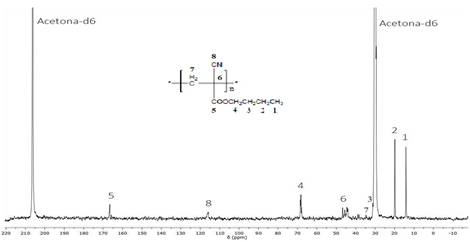
Por su parte en el RMN-1H (figura 4) se observa un ensanchamiento típico de las señales respecto al monómero, característico de la formación de macromoléculas. De igual forma, la ausencia de señales en la zona vinílica sugiere la ocurrencia de una polimerización por adición. En cambio, aparece una banda nueva muy ancha en el rango de 2,6-3,0 ppm, con máximos centrados en 2,65 y 2,89 ppm, y que integra en su conjunto a dos protones. Esta banda corresponde a los protones del grupo CH2 (5) alquílico de la cadena principal que resulta de la reacción de polimerización. En el espectro de RMN-13C (figura 5) se observan todas las señales correspondientes a los carbonos del polímero destacándose la señal ancha sobre los 46,75 ppm del carbono cuaternario producto de la polimerización ((6) en la cadena principal).
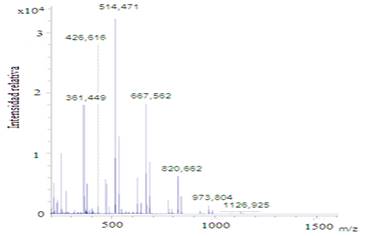
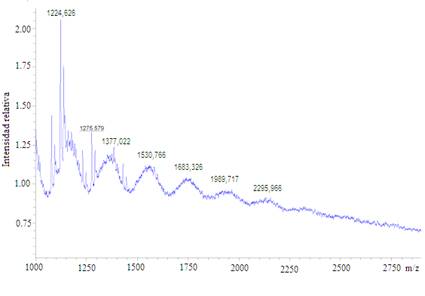
El análisis de masas mediante MALDI-TOF permitió conocer la distribución de masas moleculares del sistema. Los experimentos fueron realizados en modo reflectrón para analizar la fracción oligomérica y en modo lineal para las macromoléculas de mayor tamaño, aunque estas últimas con una menor presencia (figura 6 y 7). En el primer caso se observa que la mayor abundancia se encuentra en dímeros, trímeros y tetrámeros, mientras que en el segundo caso se encontró presencia de cadenas con grado de polimerización hasta 15. Estos resultados indican que el sistema obtenido está compuesto por partículas con cadenas de bajo peso molecular, condición que puede ser favorable en sistemas biodegradables.2 Una de las vías de liberación depende de la combinación de la erosión del polímero, favorecida por bajas masas moleculares, unido a la difusión a través de los poros.
Determinación de tamaño, morfología y potencial zeta
A partir de la técnica de síntesis desarrollada fue posible lograr la formación de emulsiones de nanopartículas esferoidales con buena estabilidad y una distribución homogénea de tamaños en el orden sub-micrométrico. Las mediciones por DLS indicaron que el diámetro promedio de las partículas producidas por la variante A se encuentra sobre los 303 nm, en un intervalo que comprende de 200-450nm y para la variante B sobre los 196 nm,en un intervalo de 180-220nm. En ambos casos existe una baja polidispersión (PI<1) como criterio general para analizar homogeneidad en sistemas de partículas y (PI<0,3) considerando el posible empleo de las partículas como sistemas de liberación controlada.17 Por otro lado, las dimensiones logradas por ambas variantes de síntesis se encuentran dentro del rango de 50-300nm,reportado para partículas obtenidas empleando la polimerización en emulsión.18
La morfología de las partículas fue reconocida mediante SEM observándose una topología esferoidal con presencia de poros. En la figura 8a es posible apreciar poblaciones de partículas lo cual se corresponde con las condiciones de síntesis donde se obtuvieron algunas partículas en el orden de los micrómetros. La figura 8b muestra partículas aisladas, pero de menor tamaño que en el caso anterior. Esto puede deberse mayoritariamente al surfactante empleado, su porcentaje empleado o a la velocidad de agitación, factores que tienen influencia en el tamaño de partícula.

Fig. 8 Micrografías de las partículas de PBCA obtenidas por SEM. (a) partículas sintetizadas por la variante A y (b) partículas sintetizadas por la variante B
Es conocido que los poros tienen un papel fundamental en la encapsulación de moléculas hidrofílicas de bajo peso molecular como es el 5-FU.19 Estudios previos con empleo de la técnica de polimerización en emulsión para monómeros ACA, produjo también una morfología esferoidal porosa. La topología observada es favorable en los procesos de liberación por degradación, acorde a varios autores 9,19,20 ya que son un factor que, conjuntamente con el pequeño tamaño, afecta el área superficial de las partículas haciendo mayor su valor, lo cual permite una mejor solvólisis. La presencia de poros ayuda a la difusión del compuesto hacia el medio aumentando su concentración y por ende su acción in situ.
El potencial Zeta de ambos sistemas de partículas fue determinado encontrándose cercano a -17mV, reportado para nanopartículas de PACA cuando son producidas con polisacáridos como agentes estabilizantes (-5 a -27 mV).8) Las nanoesferas obtenidas presentan una baja tendencia a la agregación y por tanto las emulsiones poseen buena estabilidad. El valor negativo de este potencial puede estar relacionado con la disociación de grupos acrílicos libres presentes en la superficie de las partículas y debe verse disminuido con la interacción electrostática favorecida de las partículas con especies de carga neutra, presumiblemente originadas por la protonación de los grupos NH de la molécula de 5-FU durante el proceso de adsorción del mismo a pH ácido.9 De modo complementario, las partículas cargadas negativamente reducen la interacción celular y exhiben propiedades de larga circulación en el organismo, comparadas con positivas y neutras.20
Adsorción superficial del 5-FU
Los experimentos preliminares de 72 h mostraron un comportamiento similar (tabla 2). Tanto para las partículas obtenidas mediante la variante A de síntesis como para las obtenidas mediante la variante B se logra apreciar una eficiencia de encapsulación similar. Nótese como los porcentajes del fármaco remanente en disolución no presentan grandes diferencias entre un proceso y otro, destacándose que para EXP 1 al cabo de 72 h se logró una EE de un 24,9 % y para EXP 2 una EE de un 21,2 %.
Tabla 2 Estudio preliminar de tiempo de sorción superficial de 5-FU
| Tiempo (hrs) | EXP 1( 5-FU libre %) | EXP 2( 5-FU libre %) |
| 0 | 100,0 | 100,0 |
| 8 | 101,2 | 101,2 |
| 24 | 93,4 | 99,9 |
| 48 | 76,9 | 95,4 |
| 72 | 75,1 | 78,8 |
Las pequeñas diferencias observadas en el comportamiento dentro y entre ambos estudios, y en la eficiencia de encapsulación (EE) con un valor ligeramente mayor para EXP 1 pudiera estar relacionado con una conjugación de factores como el pH, el tamaño de partícula, potencial zeta y la velocidad de agitación. Una comparación estadística (t-Student) mostró que no existen diferencias significativas entre los valores alcanzados a las 72 h (p-Valor=0,15).
Los rangos de tamaños de partícula en ambos casos son diferentes, mientras el potencial zeta es similar -17,04 para las nanoesferas producidas por la variante A y -16,2 para las partículas producidas por la variante B, esperándose entonces que la sorción superficial del fármaco también sea similar (72h). El pH afecta la interacción entre las partículas y el 5-FU, que en medio ácido se encuentra mayoritariamente en su forma neutra aunque coexisten especies con el N en posición 1 libre que son capaces de protonarse a medida que el pH del medio disminuya. Así para pHs más bajos la interacción entre las partículas poliméricas y el 5-FU resulta más efectiva.
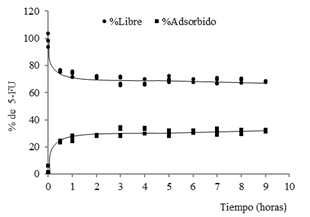
Dado que el tiempo de sorción del 5-FU resultó de larga duración se decidió cambiar la concentración de polímero (0,3%m/v) y estudiar la sorción durante 8 h. En la figura 9 se muestran los resultados.
En las 8 h de seguimiento se observa una tendencia a la disminución de la concentración del 5-FU libre en disolución, indicativo de la sorción del citostático en las partículas (3-8h; aproximadamente 30%). A partir de las 3 horas no se obtiene una variación apreciable de ese valor, por lo que se observa un comportamiento aparente de equilibrio de sorción-desorción, lo cual se confirma al realizar un análisis de contraste múltiple de rango (tablas 3 y 4) (StatGraphics 5.1). Los relativamente bajos porcentajes de adsorción del 5-FU a este polímero hidrofóbico pueden ser explicados teniendo en cuenta la naturaleza hidrofílica del fármaco y su bajo LogP [-0,89] pues su interacción desde el medio acuoso a la superficie hidrófoba de las partículas no se encuentra favorecida.17
Tabla 3 Comparación de toma de muestras entre 0-4 horas (Contraste Múltiple de Rango 95,0 porcentaje LSD o Menor diferencia significativa)
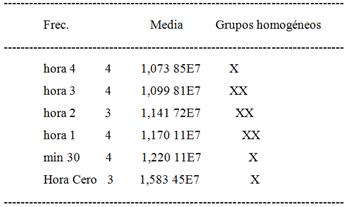
Tabla 4 Comparación de toma de muestras entre 3-8 h (Contraste Múltiple de Rango, 95,0 porcentaje LSD o Menor diferencia significativa)
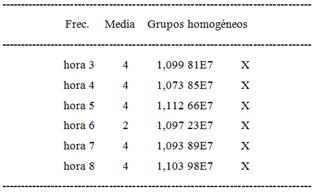
Estos resultados muestran que solo es necesario mantener el proceso de cargado superficial de las nanopartículas de PBCA con 5-FU en agitación durante 3-4h para lograr una EE que ronde un 30 %, en las condiciones de trabajo fijadas. Este tiempo se puede considerar adecuado si se tiene en cuenta el posible empleo de estos portadores como SLC para el 5-FU, donde el proceso de producción tomaría aproximadamente 10 horas teniendo en cuenta la obtención de las nanoesferas y luego el proceso de sorción superficial.
Encapsulación del 5-FU
En la tabla 5 se muestran los resultados de los experimentos realizados.
Tabla 5 Influencia de la Temperatura de almacenamiento de las partículas submicrométricas en la encapsulación de 5-FU.
| Temperatura almacenamiento | Muestras | Conc. libre (mg/mL) | % Sorbido | Diferencia(%) |
| Congelación (-10°C) | 1c | 0,82 | 18,3 | 1a-1c =11,4 2a-2c=12,7 3a-3c=14,3 |
| 2c | 0,78 | 21,6 | ||
| 3c | 0,76 | 23,9 | ||
| Ambiente (20-24°C) | 1a | 0,70 | 29,7 | |
| 2a | 0,66 | 34,3 | ||
| 3a | 0,62 | 38,2 |
En los porcentajes mostrados en la tabla 5 se observa que la cantidad de 5-FU cargada por los portadores en las condiciones de trabajo descritas se encuentran entre18,3-23,9 %. Esto puede ser explicado teniendo en cuenta que la cinética del proceso de polimerización depende básicamente de la cantidad de iones OH- presentes en el medio. Mientras el pH del medio aumenta, la velocidad de la polimerización crece, de aquí que la concentración de H+ determine ambos procesos, la velocidad de la polimerización y la absorción del citostático. El 5-FU es esencialmente no iónico en medio ácido (pKa1=7,18; pKa2=12,01) así que una polimerización a pH 2-3 atrapará mecánicamente el 5-FU.Otras investigaciones señalan que las moléculas de bajo peso molecular, como el 5-FU, presentan una baja tendencia de encapsulación debido a que el fármaco escapa de la red polimérica en formación, particularmente cuando este es soluble en el medio de polimerización.21
Al almacenar a temperatura ambiente (20°C) cierta cantidad de la emulsión (2 semanas) (tabla 5) fue posible notar, que el porcentaje de 5-FU captado por las nanoesferas poliméricas se incrementó entre 11,4-14,3%. En opinión de los autores, parte del 5-fluorouracilo libre en disolución se adhirió a la superficie de las partículas. Este incremento produjo una sorción final de 29,7-38,2% comparado con 18,3-23,9% inicial.
Conclusiones
En este trabajo se describe la síntesis del monómero de partida y la obtención y carga de partículas submicrométricas de PBCA con 5-FU, viable como SLC de uso tópico en el tratamiento de lesiones malignas en piel. La caracterización estructural de las partículas reveló la obtención de nanoesferas de PBCA compuestas por cadenas de bajo peso molecular, adecuadas para administración tópica y transdérmica. El tamaño de partícula y la morfología obtenidas en ambas condiciones de trabajo descritas, mostraron resultados favorables para su uso como vehículo farmacéutico, capaz de mejorar la biodisponibilidad del citostático. De los estudios de carga realizados se concluye que el equilibrio de sorción/desorción es alcanzado en 3h cuando se obtienen los portadores poliméricos previamente y luego son puestos en contacto con el 5-FU. Los experimentos de encapsulación, realizados con 5-FU en el medio de síntesis de las partículas se obtuvieron en un tiempo de 4h. En ambos casos los porcentajes de impregnación de 5F-FU obtenidos están en concordancia con otras metodologías propuestas, constituyendo esta una alternativa viable.