Meu SciELO
Serviços Personalizados
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Farmacia
versão On-line ISSN 1561-2988
Rev Cubana Farm vol.50 no.1 Ciudad de la Habana jan.-mar. 2016
ARTÍCULO ORIGINAL
Neutropenia febril postquimioterapia, Instituto de Oncología y Radiobiología
Febrile neutropenia after cytostatic therapy observed in the Institute of Oncology and Radiobiology
Daniel Ricardo Martínez Ávila, Horacio Santos González, Sailyn Reyes Castilla
Instituto de Oncología y Radiobiología. La Habana, Cuba.
RESUMEN
Objetivo: caracterizar a los pacientes oncológicos que presenten episodios de neutropenia febril postquimioterapia ingresados en el Instituto de Oncología y Radiobiología en el periodo de enero a mayo del 2015.
Métodos: se realizó un estudio descriptivo de corte transversal a una muestra de 36 pacientes. Se revisaron las historias clínicas donde se tomaron las variables analizadas.
Resultados: predominaron los pacientes del sexo femenino (61,1 %). Dentro de las enfermedades oncológicas predominaron los pacientes con Linfomas no Hodgkin (25,0 %) y los medicamentos citostáticos vinculados a la neutropenia fueron el carboplatino, paclitaxel, ifosfamida y etopósido. La recuperación hematológica se logró en la mayoría de los casos antes de las 72 horas y el mayor número de pacientes (72,2 %) fueron clasificados como una neutropenia de bajo riesgo, según los criterios de la Multinational Association for Supportive Care.
Conclusiones: en la muestra estudiada la neutropenia febril presenta un incremento proporcional con la edad y las enfermedades de origen hematopoyéticos, cuyos esquemas quimioterápicos consisten en altas dosis de agentes citostáticos.
Palabras claves: neutropenia febril; reacciones adversas; quimioterapia.
ABSTRACT
Objective: to characterize the oncological patients who present with post chemotherapy febrile neutropenia and were admitted to the Institute of Oncology and Radiobiology in the period of January to May, 2015.
Methods: a descriptive cross-sectional study of a sample of 36 patients. Their medical histories were checked from which the analyzed variables were taken.
Results: females predominated in the study (61,1 %). Among the oncological diseases, non-Hodgkin lymphomas (25,0 %) prevailed whereas the cytostatic drugs found related to neutropenia were carboplatin, paclitaxel, ifosfamide and etoposide. The hematological recovery was reached in most cases before 72 hours and a lot of patients (72, 2 %) were classified as low risk neutropenia according to the Multinational Association for Supportive Care criteria.
Conclusions: in the study sample, the febrile neutropenia increases with the age and with hematopoietic diseases whereas chemotherapy schemes are based on high dose cytostatic agents.
Keywords: febrile neutropenia; adverse reactions; chemotherapy.
INTRODUCCIÓN
Del 10 % al 50 % de los pacientes con tumores sólidos frecuentemente aparece fiebre durante la quimioterapia inductora de neutropenia. La bacteriemia ocurre en el 10 % al 25 % de todos los pacientes, la mayoría de estos episodios ocurre durante el curso de una neutropenia prolongada o profunda y los sitios usuales de ocurrir las infecciones incluyen el tracto intestinal, los pulmones y la piel. En muchas ocasiones los pacientes no muestran bien documentada la etiología de la enfermedad infecciosa, la que solo aparece en el 20 % al 30 % de los episodios febriles.1-3
La neutropenia febril (NF) constituye una complicación frecuente con tasas de mortalidad superiores al 10 % en algunos estudios;4 no obstante, los pacientes que presentan esta complicación conforman una población muy heterogénea, con un comportamiento clínico variable. Esta particularidad determina que en un mismo paciente, un episodio de NF puede requerir la admisión en cuidados intensivos, con riesgo para la vida; mientras que en otros los episodio pueden ser manejado de manera ambulatoria con antibióticoterapia oral, reduciendo la toxicidad, los costos y la afectación de la calidad de vida de los enfermos.5
La NF es uno de las mayores complicaciones de la quimioterapia contra el cáncer y la mayor causa de morbilidad, a pesar de los avances actuales en la prevención y el tratamiento. En pacientes con bacteriemia comprobada el pronóstico de la NF es desfavorable con una tasa de mortalidad de 18 % en pacientes con cultivos donde se aíslan bacterias Gram negativas y del 5 % con cultivos de crecimiento de gérmenes Gram positivo.6
La terapia antimicrobiana empírica puede ser utilizada como monoterapia en pacientes con alto riesgo que necesitan hospitalización, los agentes más empleados son los β-lactámicos con actividad antipseudomónica, como cefepime, ceftazidima, carbapenémicos (meropenem o imipenem), o piperacillin-tazobactam. Otros antimicrobianos (Aminoglucósidos, Fluoroquinolonas y Vancomicina) pueden ser añadidos para el régimen inicial en caso de complicaciones (hipotensión y neumonía).7
El objetivo de esta investigación fue caracterizar a los pacientes oncológicos que presenten episodios de neutropenia febril postquimioterapia ingresados en el Instituto de Oncología y Radiobiología (INOR).
MÉTODOS
Se realizó un estudio descriptivo y prospectivo de corte transversal. Para definir la neutropenia febril se utilizaron los criterios diagnósticos de la American Sociaty of Infectious Disease, que establece los parámetros de fiebre para la temperatura en una ocasión sea mayor de 38,3 ºC (101 oF), o temperatura mayor o igual a 38 ºC (100,4 oF), medida oralmente, durante al menos una hora y para la neutropenia si el conteo absoluto de neutrófilos (CAN) es menor de 500/μL (o en células/mm3) o un recuento de neutrófilos <1 000/μL si se espera un descenso menor o igual de 500/μL en las 48 horas más próximas.
Fueron estudiados los pacientes ingresados en el INOR entre los meses de enero y mayo del 2015 con el diagnóstico de neutropenia febril. Las variables estudiadas fueron: edad, sexo, diagnóstico histológico, etapa clínica, esquema de quimioterapia, tiempo trascurrido desde la administración de la última quimioterapia (QTP) y el evento de NF, el valor calculado del CAN, la presencia de anemia, trombocitopenia y de los síntomas asociados, además los antecedentes de ocurrencia de neutropenia, las comorbilidades y el tiempo de la recuperación hematológica. Se calculó el sistema de puntuación para estratificación del riesgo de la Multinational Association for Supportive Care (MASCC).
RESULTADOS
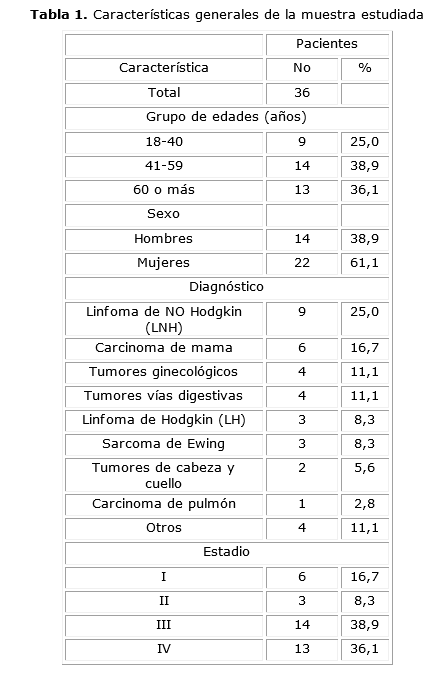
En la tabla 1 se describen las características generales de los 36 pacientes estudiados, existió un predominio de los pacientes entre 41 y 59 años con un 38,9 %. En relación con el sexo predominaron las mujeres con un 61,1 %. Dentro de las enfermedades oncológicas predominaron los Linfomas no Hodgkin (LNH) con un 25,0 % y en las etapas al diagnóstico predominaron los estadios avanzados III y IV con un 38,9 % y 36,1 % respectivamente.
En la tabla 2 se relacionan los esquemas con mayores episodios de neutropenia como el ICE (ifosfamida, carboplatino, etopósido) y el carboplatino/taxol presentes en el 13,9 % y 11,1 % de los afectados respectivamente. El tiempo que trascurrió entre la última quimioterapia y la aparición de los primeros síntomas fue el comprendido entre 7 y 14 días con un 77,8 %. Predominaron los casos de neutropenia severa con conteo absoluto de neutrófilos menor de 100 cel/mm3. La anemia y la trombocitopenia estuvieron presentes en un 61,1 % y 47,2 % respectivamente.
Tabla 2. Esquemas de QTP y resultado de complementarios
| Pacientes | ||
| Característica | No | % |
| Total | 36 | |
| Esquema de QTP | ||
| AC | 3 | 8,3 |
| carbotaxol | 4 | 11,1 |
| CDDP-RTP | 2 | 5,6 |
| CHOP-14 | 2 | 5,6 |
| CHOP-21 | 1 | 2,8 |
| ICE | 5 | 13,9 |
| R-ICE | 1 | 2,8 |
| P6 brazo A | 3 | 8,3 |
| IGEF | 1 | 2,8 |
| TIP | 1 | 2,8 |
| ICE/Taxol | 1 | 2,8 |
| CDDP/5FU | 1 | 2,8 |
| CMF | 1 | 2,8 |
| CVPA | 1 | 2,8 |
| Fludarabina-CPA | 1 | 2,8 |
| Irinotecan | 1 | 2,8 |
| MTX-ARA C | 1 | 2,8 |
| ADM-CMF | 1 | 2,8 |
| CDDP-ADM | 1 | 2,8 |
| Carbo/Gencitabina | 1 | 2,8 |
| Otros | 3 | 8,3 |
| Tiempo de la última QTP (días) | ||
| menos de 7 | 5 | 13,9 |
| de 7 a 14 | 28 | 77,8 |
| más de 14 | 3 | 8,3 |
| Valor del CAN (cel/mm3) | ||
| Menos de 100 | 24 | 66,7 |
| 500 o menos | 7 | 19,4 |
| Más de 500 | 5 | 13,9 |
| Reacciones adversas | ||
| Anemia | 22 | 61,1 |
| Trombocitopenia | 17 | 47,2 |
AC: doxorrubicina/ciclofosfamida; carbo: carboplatino; R: rituximab;
CHOP: ciclofosfamida/doxorrubicina/vincristina/prednisona; CDDP: cisplatino;
ICE: ifosfamida/carboplatino/etopósido; TIP: taxano/ifosfamida/cisplatino;
P6 Brazo A: ciclofosfamida/doxorrubicina/vincristina; 5FU:5-fluoruracilo;
IGEV: ifosfamida/gemcitabina/vinorelbine/prednisona; CPA: ciclofosfamida;
CMF: ciclofosfamida/methotrexate/5-fluorouracilo;
CVPA: ciclofosfamida/vincristina/prednisona/melfalan;
MTX/araC: methotrexate/citosina arabinósido;
ADM/CMF: doxorrubicina/ciclofosfamida; CDDP/ADM; cisplatino/doxorrubicina;
CAN: conteo absoluto de neutrófilos.
En la tabla 3 se incluyen variables como síntomas asociados a la fiebre, los más representados fueron el decaimiento (86,1 %) y la anorexia (36,1 %). La recuperación hematológica se logró antes de las 72 horas en un 41,7 % de los casos y tres pacientes fallecieron por causas asociadas a la NF. Según los criterios MASCC fueron clasificadas como neutropenias de bajo riesgo de complicaciones o muerte con un 72,2 %. Los antecedentes de episodios de neutropenias estuvieron presentes en el 11,1 % y la hipertensión arterial y la diabetes mellitus estuvieron presentes en un 41,7 % y 16,7 % respectivamente.
DISCUSIÓN
El tratamiento con drogas citotóxicas en el paciente oncológico, tiene como toxicidad limitante de dosis más común la neutropenia y sus complicaciones infecciosas. Su aparición provoca retrasos y reducción de dosis en los ciclos posteriores de quimioterapia, así como deterioro en la calidad de vida de los pacientes.
Christopher R,8 reporta un incremento de los casos en pacientes mayores de 65 años. En un estudio realizado en Francia por Stéphanie André9 que incluyó a 198 pacientes presenta una media de edad de 61±14 años y un predominio del sexo masculino con un 60 %, lo cual difiere del presente estudio donde predominaron los casos en el sexo femenino con un 63,6 %. Los autores consideran que la mayor frecuencia de neutropenia febril en adultos mayores está dado porque estos tienen alteraciones en la absorción, distribución, activación, metabolismo y excreción de las drogas, lo cual modifica la farmacodinamia y la farmacocinética de las diferentes drogas utilizadas, la disminución del filtrado glomerular y reabsorción tubular demora la excreción de las drogas y esto aumenta la toxicidad de las mismas.
En el estudio se encuentra un predominio de los pacientes con diagnóstico de Linfoma no Hodgkin similar a lo reportado por Christopher R8 con un 26 % de los pacientes con este diagnóstico, un 5,5 % de pacientes con cáncer de colon y recto y un 4,4 % de pacientes con cáncer de mama.
Lami Casaus10 en un estudio realizado en INOR en el año 2007 que las localizaciones tumorales más frecuente observadas fueron mama 16 (38,1 %), pulmón 6 pacientes (14,3 %), linfomas (Hodgkin y no Hodgkin) con 5 pacientes de cada uno. (11,9 %)
Stéphanie André9 encuentra un tiempo medio de la aplicación de la quimioterapia y la aparición de la neutropenia fue de 10 días con un rango entre los 4 y 35 días.
Lami Casaus10 encuentra como signos y síntomas más frecuentes a la anemia en un 67 % de los pacientes, síntomas respiratorios en un 38 % y mucositis en un 36 %.
Mical Paul11 describe en su estudio un 61 % de pacientes con neutropenia severa con CAN<100/mm3, similar a lo encontrado en el presente estudio. Por su parte Rabagliati12 encuentra que en el 36 % de los casos el CAN fue menor o igual a 100 cél/mm3.
Stéphanie André9 encuentra 38 pacientes (35 %) con alto riesgo de complicaciones y muerte según los criterios MASCC.
En la muestra estudiada la NF presenta un incremento proporcional con la edad y las enfermedades de origen hematopoyéticos, cuyos esquemas quimioterápicos consisten en altas dosis de agentes citostáticos.
DECLARATORIA
Estimados Colegas de la Revista Cubana de Farmacia.
A través de este documento los autores de este artículo hacemos constar que el mismo no ha sido publicado previamente ni está en consideración para ser publicado en otra revista médica.
Un saludo cordial
Dr. Daniel Ricardo Martínez Avila
REFERENCIAS BIBLIOGRÁFICAS
1. Bodey GP, Buckley M, Sathe YS. Quantitative relationships between circulating leukocytes and infection in patients with acute leukemia. Ann Intern Med. 1966;64:328-40.
2. Rosenberg PS, Alter BP, Bolyard AA. The incidence of leukemia and mortality from sepsis in patients with severe congenital neutropenia receiving long-term G-CSF therapy. Blood. 2006;107:4628-35.
3. Ramphal R. Changes in the etiology of bacteremia in febrile neutropenic patients and the susceptibilities of the currently isolated pathogens. Clin Infect Dis. 2004;39(Suppl 1):S25-31.
4. Klastersky J. Management of fever in neutropenic patients with different risks of complications. Clin Infect Dis. 2004;39(Supl 1):32-7.
5. Vidal L, Paul M, Ben I, Soares-Weiser K, Leibovici L. Oral versus intravenous antibiotic treatment for febrile neutropenia in cancer patients: A systematic review and meta-analysis of randomized trials. J Antimicrob Chemother. 2004;54:29-37.
6. de Naurois J, Novitzky-Basso I, Gill MJ, Marti F, Cullen MH, Roila F. Management of febrile neutropenia: ESMO Clinical Practice Guidelines. Annals of Oncology. 2010;21 (Supplement 5):252-256.
7. Freifeld AG, Bow EJ, Sepkowitz KA, Boeckh MJ, Ito JI, Mullen CA, et al. Clinical Practice Guideline for the Use of Antimicrobial Agents in Neutropenic Patients with Cancer: 2010 Update by the Infectious Diseases Society of America. Clinical Practice Guideline. Clin Infect Dis. 2011 Feb 15;52(4):e56-93.
8. Flowers CR, Seidenfeld J, Bow EJ, Karten C, Gleason C, Hawley DK, et al. Antimicrobial Prophylaxis and Outpatient Management of Fever and Neutropenia in Adults Treated for Malignancy: American Society of Clinical Oncology Clinical Practice Guideline. Journal of Clinical Oncology. 2013; 31(6):794-810.
9. André S, Taboulet P, Elie C, Milpied N, Nahon M, Kierzek G, et al. Febrile neutropenia in French emergency departments: results of a prospective multicentre survey. André et al. Critical Care. 2010;14(2):R68.
10. Lami Casaus L, Arbesú Michelena MA, Alsina Sarmiento S, Brito Iglesia R. Aparición de episodios de neutropenia febril tras la quimioterapia citostática en el paciente oncológico. Rev Cubana Farm. 2009;43(4):68-73.
11. Paul M, Soares-Weiser K, Leibovici L. β lactam monotherapy versus β lactam-aminoglycoside combination therapy for fever with neutropenia: systematic review and meta-analysis. BMJ. 2003;326:1111-20.
12. Rabagliati R, Fuentes G, Orellana E, Oporto J, Domínguez I, Benítez R, et al. Etiología de episodios de neutropenia febril en pacientes adultos con cáncer hematológico y de órganos sólidos en el Hospital Clínico Universidad Católica, Santiago-Chile. Rev Chil Infect. 2009;26(2):106-113.
Recibido: 16 de junio de 2015
Aprobado: 25 de agosto de 2015
Horacio Santos González . Instituto de Oncología y Radiobiología. Calle 29 y E, Vedado, Plaza de la Revolución, La Habana, Cuba. Correo electrónico: horacio@inor.sld.cu