Introducción
La úlcera corneal es un defecto en la superficie del epitelio de la córnea que incluye las capas subyacentes del estroma. Aún, cuando se inicia tratamiento precoz y eficaz, la morbilidad ocular es elevada con secuelas que incluyen el leucoma corneal, perforación corneal, glaucoma secundario, catarata con la consecuente disminución o pérdida de la visión. Una queratitis mal tratada puede evolucionar a endoftalmitis y la subsecuente pérdida del globo ocular como órgano.
A nivel mundial, la incidencia anual de ceguera, definida por la Organización Mundial de la Salud (OMS) como una agudeza visual inferior a 3/60 (20/400), o una pérdida del campo visual a menos de 10° en el mejor ojo1 causada por úlcera debido a queratitis infecciosa o traumática es de 1,5 a 2 millones de casos, siendo motivo de interés y preocupación para los oftalmólogos por sus potenciales consecuencias.
Se estima que ocurren alrededor de 30 000 casos de queratitis infecciosa en los EE. UU. anualmente2) y, aproximadamente 20 individuos por cada 10 000 de ellos, son usuarios de lentes de contacto.3 Mientras que en Gran Bretaña indican 4000 casos anuales de queratitis infecciosa que requieren hospitalización.4) Todo ello se resume a un costo estimado de visitas a los oftalmólogos de $175 millones y 250 000 h oftalmólogo/clínicas anuales.5 Lo que confirma la importante carga económica en el sistema de salud. En América Latina se han reportado pocos estudios, a pesar de constituir una importante causa de ceguera irreversible pero prevenible en los adultos a nivel mundial. Debido a que la mayoría de los casos ocurren en países con medio y bajo ingreso, y que el impacto en salud, economía y social se infraestima.
El éxito en el manejo de la queratitis infecciosa depende del momento del diagnóstico y la indicación de tratamiento apropiado.
En el Instituto Cubano de Oftalmología (ICO) Ramón Pando Ferrer, la mayoría de los pacientes acuden a consulta tardíamente, con tratamiento previo instaurado y frecuentemente inadecuado. Esto provoca cambios en las características de la úlcera, que dificultan definir el verdadero agente causante, por lo que se insiste en la importancia de una detallada anamnesis del paciente, apoyado por el resultado del examen físico y los exámenes de laboratorio.
Cuando se logra el control de la sepsis, el defecto epitelial resultante cura espontáneamente en la gran mayoría de los pacientes, por la capacidad proliferativa del epitelio corneal, sin embargo, en ocasiones la cicatrización epitelial no se produce al ritmo esperado a pesar del tratamiento estándar indicado. Por tanto, la atención al paciente con defecto epitelial refractario es un reto y está sujeto al desarrollo de estudios preclínicos y clínicos en un continuo esfuerzo por obtener tratamientos eficaces, entre los que emerge la insulina tópica.
Se presentan dos pacientes con diagnóstico de defecto epitelial persistente posúlcera corneal tratados con insulina tópica como tratamiento.
Presentación de caso
Paciente 1. Se presenta una paciente de 40 años con antecedentes de buena salud, que fue remitida a consulta de Córnea por necrosis estromal debido a úlcera grave de la córnea por lentes de contacto cosméticos. Se obtuvo cultivo con antibiograma positivo a pseudomona aeruginosa.
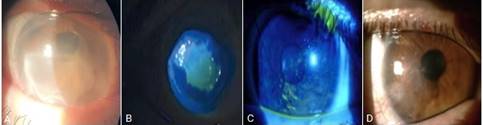
Al examen oftalmológico en el ojo izquierdo se observó moderado edema palpebral, inyección cilioconjuntival marcada, infiltrado corneal de aproximadamente 8 mm, sin signos de actividad, reblandecimiento del estroma corneal, cámara anterior estrecha lo que confirma la existencia de microperforaciones. El resto del segmento anterior no se pudo evaluar. La tensión ocular digital era elevada (fig. 1A).
Debido a que se observó control de la sepsis, se decidió iniciar tratamiento con colirio de insulina 1 gota cada 6 h, asociado a hipotensores oculares (timolol 0,5 % tópico, 1 gota cada 12 h, dorzolamida 1 gota cada 8 h, acetazolamida de 250 mg 1 tableta cada 8 h). A los tres días de tratamiento se observó inicio de la epitelización corneal (fig. 1B) y a los 10 días se observó epitelización corneal total (fig. 1C).
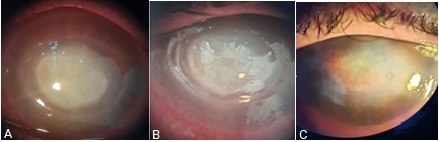
Fig. 1 A) Reblandecimiento corneal; día 0. B) Inicio de epitelización corneal, día 3; C) Epitelización corneal total, día 10.
Paciente 2. Se presenta una paciente de 60 años de edad, con antecedentes de diabetes mellitus tipo II, retinopatía diabética proliferativa y glaucoma neovascular en el ojo izquierdo. Hacía alrededor de cuatro meses se le diagnosticó celulitis preseptal que evolucionó a fascitis necrotizante de párpado superior y úlcera grave de la córnea del ojo derecho. Fue remitida al ICO Ramón Pando Ferrer, para ingreso y tratamiento por lagoftalmo y queratitis neurotrófica.
Se observó defecto epitelial extenso con bordes gruesos y sobreelevados. Durante su estadía hospitalaria se le indicó antibiótico tópico profiláctico (moxifloxacino 1 gota cada 4 h), insulina tópica 1 gota cada 6 h, además de su tratamiento hipotensor previo (timolol + dorzolamida 1 gota cada 12 h). Se observó reducción de alrededor del 50 % del tamaño del defecto epitelial a los 10 días del tratamiento y cicatrización total a los 21 días. Se mantuvo tratamiento hasta completar los 30 días de iniciado el colirio de insulina y posteriormente se indicó lubricantes oculares (figs. 2A, 2B, 2C, 2D).
Discusión
El proceso de renovación del epitelio corneal consiste en la integración de procesos de proliferación celular, migración, diferenciación y apoptosis que mantienen la membrana basal y de 4-5 capas de lás celulas epiteliales escamosas estratificadas no queratinizadas. El limbo corneal juega un papel importante en este proceso debido a la presencia de las células madre que proliferan en células basales, y migran hacia el centro de la superficie corneal, para dar lugar a los tipos celulares antes mencionados y gradualmente pierden su capacidad proliferativa y se descaman en la película lagrimal. El factor de crecimiento epidérmico (EGF) media este proceso de proliferación y migración, promueve la síntesis de ácidos nucléicos en las células eiteliales y fibroblastos del estroma, así como estimula la producción de matix proteica extracelular y fibronectina por las células epiteliales.
En el proceso de cicatrización del epitelio corneal se liberan citoquinas inflamatorias como el factor α de necrosis tumoral (TNF-α) y las interleukinas-1 (IL-1), en repuesta al daño epitelial. Los queratocitos ante la liberación de IL-1, producen diversos factores de crecimiento como el factor de crecimiento de hepatocito (HGF) y el factor de crecimiento de queratocitos (KGF), que influyen en la migración y proliferación de las células epiteliales. El factor de crecimiento similar a la insulina (IGFs) y el factor beta de crecimiento transformador (TGF-b) regulan la diferenciación y crecimiento de los queratocitos estromales y las células epiteliales. El factor de crecimiento derivado de plaquetas (PDFG) regula la migración y proliferación de los queratocitos y la timosina-ß4 promueve la reepitelización y media la migración epitelial durante el proceso de cicatrización de la herida. El factor de crecimiento de nervios (NGF) juega un papel vital en el soporte trófico, la sensación corneal y el mantenimiento de la película lagrimal.6
En condiciones normales, luego de un trauma a la córnea, las capas epiteliales subyacentes inician un proceso de reparación activa con una duración de 7-14 días. Al concluir este proceso, el estroma se adhiere al epitelio regenerado a través de anclajes por hemidesmosas. Cuando este proceso falla, se desarrollan defectos epiteliales.
Cuando existe daño de la membrana basal y el estroma subbasal, la regeneraciòn del epitelio y su unión al estroma puede demorar alrededor de 8 semanas. Comúnmente el defecto epitelial persistente se extiende a las capas estromales y eventualmente se produce reblandecimiento estromal, ulceración, riesgo de perforación o perforación corneal y cicatrización estromal.
El cierre del defecto epitelial puede retrasarse por desórdenes como la deficiencia de células límbicas, infeciones virales, enfermedades sistémicas como la diabetes mellitus, así como procesos locales como inflamaciones, infecciones, traumas, sobreproducción de metaloproteinasas (MMP), distrofia de membrana basal epitelial, queratopatía tóxica, anestesia tópica, degeneración nodular de Salzmann, queratopatía en banda, queratopatía bullosa, deficit de vitamina a entre otras afecciones.6
Existen escasos reportes acerca de la incidencia de los defectos epiteliales persistentes, sin embargo, constituye una causa frecuente de atención en consulta de córnea. En Estados Unidos de América se reporta una incidencia anual menor de 200 000 casos, sin embargo es probable que exista un subregistro al no ser reportado como entidad independiente sino considerarse complicación en la evolución de ciertas afeccione como el herpes simple, la queratopatía diabética, poscirugía (queratoplastia, vitrectomía).7
El manejo del DEP es complejo e incluye varias opciones de tratamiento cuyo objetivo fundamental es proporcionar protección y condiciones favorables que estimulen la diferenciación de células epiteliales, migración, proliferación y regeneración de un epitelio normal. En los casos refractarios al tratamiento convencional se incluye el suero autólogo, lentes de contacto esclerales, reemplazo del ecosistema de la superficie ocular (PROSE), trasplante de membrana amniótica, trasplante de células límbicas, queratectomía fototerapeútica.
Se han descrito novedosas opciones opciones como la fibronectina tópica, timosina beta 4 tópica, factor de crecimimento epidérmico (EGF), factor 1 de crecimiento similar a la insulina tópica (IGF-1), hormona del crecimiento humano (HGH), albúmina topica, insulina tópica, agente de regeneración de la matrix, extracto de membrana amniótica tópica, factor de crecimiento de nervio humano recombinante (rhNGF), oxervate (Cenergermin-bkbj) y la neurotización corneal.8
El empleo de la insulina tópica en el tratamiento de defectos epiteliales de diversa causa se reporta desde 1945. Se sugiere que el mecanismo por el cual la insulina promueve la cicatrización corneal es que restaura los nervios corneales y favorece la migración de células epiteliales. En ratas diabéticas, la insulina tópica ralentiza la pérdida de plexo nervioso subbasal. Además, favorece la migración celular y el cierre de heridas artificiales en cultivos de células epiteliales corneales en un modelo in vitro de cicatrización epitelial de heridas corneales.9
En el 2022, Díaz Valle y otros9 publican los resultados de un estudio retrospectivo de series de caso (insulina)-control (suero autólogo) consecutivos con el objetivo de comparar la eficacia de la insulina y el suero autólogo tópicos en defectos epiteliales persistentes de la córnea. Se consideró eficacia primaria en cuanto al porcentaje de pacientes que alcanzaron la epitelización, así como el promedio y tiempo de epitelización. El segundo punto de eficacia fue la necesidad de tratamiento adyuvante como el trasplante de membrana amniótica y otras cirugías. El tiempo medio entre el inicio del defecto epitelial y el inicio de tratamiento tuvo una media de 22,7 ± 18,5 para el grupo control y de 279 ± 16,8 días para la insulina tópica. El grupo de casos alcanzó la epitelización (84 % vs. 48 %), el tiempo medio de reepitelización fue de 32,6 ± 28,3 días al comparar con los 82,6 ± 82,4 días en el grupo de control. La necesidad de trasplante de membrana amniótica fue significativamente inferior en el grupo de insulina (p = 0005). La recurrencia del defecto epitelial fue mayor en los pacientes tratados con suero autólogo. Estos resultados permiten concluir que la insulina tópica es un tratamiento efectivo y promueve la cicatrización segura el defecto epitelial.
Un estudio retrospectivo llevado a cabo por la Universidad de Wisconsin, evaluó el curso clínico de úlcera corneal neurotrófica refractaria al tratamiento médico y quirúrgico en seis pacientes. Los pacientes fueron tratados con insulina tópica preparada a partir de insulina regular y lágrimas artificiales sin preservo a una concentración de 1 unidad por mL, refrigerado durante un mes, cada 8 a 12 h al día. La adición de insulina tópica permitió una rápida reepitelización en un rango entre 7-25 días. Un paciente desarrolló queratopatía cristalina que se probablemente secundaria al uso de esteroide tópico crónico, no se observó otros efectos colaterales sistémicos o locales. El estudio concluyó que la insulina tópica puede ser un tratamiento simple y efectivo para la úlcera corneal neurotrófica corneal, sin embargo no evalúa la eficacia clínica y los efectos colaterales de la insulina tópica.10)
Al tratarse de una fórmula magistral, surge la necesidad de determinar la estabilidad fisicoquímica y microbiológica de la insulina tópica, por lo que Cuartero y otros11 concluyeron que la insulina tópica, 25 IU/mL, preparada con solución salina normal se mantuvo estable mínimo 90 días, protegida de la luz, independiente de la forma de almacenamiento. Igualmente, Le Nguyen y otros12 reportaron que todas las variables de su estudio mostraron un comportamiento estable lo que le añade seguridad a la formulación oftálmica.
Soares y otros reportaron que el 90 % logró la completa reepitelización corneal, que fue significativamente menor en el estadio 2 (18 ± 9 días) cuando se comparó con el estadio 3 (29 ± 11 días), sin efectos colaterales durante el seguimiento.13) Balal y otros14 y Lorente y otros15) reportaron similares resultados.
El arsenal terapéutico convencional disponible para el abordaje de los defectos epiteliales persistentes resulta insuficiente, por lo que se hace necesario recurrir a opciones terapéuticas que promuevan el crecimiento epitelial como sucede con la insulina, como fórmula magistral, ya que no se cuenta con una presentación comercial. Los resultados en ambas pacientes apoyan el empleo de la insulina tópica como alternativa para el tratamiento del defecto epitelial persistente.