Introducción
La vacunación ante la pandemia por SARS-CoV-2 (del inglés, severe acute respiratory syndrome coronavirus 2), ha marcado un giro en la prevención de formas graves de COVID-19, reduciendo la hospitalización y muerte asociadas a la infección y logrando una disminución de la transmisión, lo que demuestra una elevada efectividad de la vacunación.1 La estrategia global de vacunación anti SARS-CoV-2 comenzó priorizando los grupos más vulnerables y esenciales, entre los que no están los niños sanos.2
Si bien la vacunación en niños con factores o enfermedades de riesgo asociados no ofrece discusión, la decisión de vacunar, universalmente o no, a los niños contra la COVID-19 es compleja.2,3 Según la evidencia científica que respalda la utilidad y seguridad de la vacuna en el paciente pediátrico, influyen factores epidemiológicos como la prevalencia de la enfermedad, el impacto en el sistema sanitario y la cobertura vacunal, factores económicos tales como la accesibilidad a vacunas y los costos asociados, así como factores éticos y políticos.1) En el contexto cubano, los científicos y pediatras consideraron que para lograr altas coberturas de vacunación y tener un impacto significativo en la transmisión del SARS-CoV-2, también era necesario vacunar a los niños.
Cuba cuenta con un Programa de Inmunización creado en 1962, momento en que las enfermedades transmisibles, entre ellas las prevenibles por vacunas, eran la principal causa de morbilidad y mortalidad en la población infantil. En nuestro país se administran anualmente, como promedio, 4. 800 000 dosis de vacunas simples o combinadas que protegen contra 13 enfermedades, incluida una pentavalente cuyos cinco componentes se producen en el país. La vacunación es gratuita, de acceso universal y está integrada en la atención primaria de salud, por lo que Cuba cuenta con gran experiencia de inmunización a la población y en especial a los niños.4
Para evaluar la seguridad y eficacia de la vacunación anti SARS-CoV-2, se realizaron ensayos clínicos con el esquema heterólogo: dos dosis de SOBERANA®02 más una dosis de SOBERANA®PLUS, primero en adultos5,6) y luego en niños.7 A partir de los datos obtenidos en esas investigaciones, se solicitó a la agencia reguladora cubana Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (CECMED), la autorización de uso en emergencia en edades pediátricas, en niños de 2 a 18 años de edad.8,9
De esta manera, Cuba se convirtió en el primer país en realizar una campaña nacional masiva de vacunación anti SARS-CoV-2 en población infantil, lo que ha marcado un hito no solo para la nación del Caribe, sino para el mundo.10
El Centro Nacional de Biopreparados (BioCen), perteneciente a BioCubaFarma es un centro productor de SOBERANA®01, SOBERANA®02 y SOBERANA®PLUS. Existía una experiencia anterior de vacunación a sus trabajadores durante los estudios de intervención en grupos de riesgo, promovidos por el Instituto Finlay de Vacunas, titular del registro de estas vacunas.11 En el presente trabajo se presentan los resultados de la evaluación de la seguridad de la vacunación con SOBERANA®02 y SOBERANA®PLUS realizada a los niños, hijos de los trabajadores del BioCen, cuyo esquema consistió en la aplicación de dos dosis de SOBERANA®02 más una dosis de refuerzo de SOBERANA®PLUS.
Materiales y Métodos
Para el estudio se organizó un vacunatorio, localizado en BioCen, municipio Bejucal, de la provincia Mayabeque. Este sitio de vacunación, certificado por el Programa Nacional de Inmunización (PNI) del Ministerio de Salud Pública (MINSAP), se había utilizado previamente en el estudio de intervención en los trabajadores de BioCen.11 Se conformó un equipo con personal sanitario trabajador de esta institución (que cuenta con la formación especializada necesaria) y una enfermera certificada por el PNI, trabajadora del Área de Salud del municipio.
La vacunación se llevó a cabo del 16 de septiembre al 13 de noviembre de 2021; se incluyeron 200 niños, hijos de los trabajadores de BioCen. Los criterios de inclusión fueron: niños de ambos sexos con edades comprendidas entre 2 y 18 años que sus padres dieron su consentimiento. Se establecieron como criterios de exclusión: individuos previamente vacunados con un candidato vacunal o vacuna anti SARS-CoV-2, o con antecedentes de infección previa por SARS-COV-2, alergia a alguno de los componentes de la vacuna o enfermedad aguda que contraindicara la vacunación.
El esquema de tratamiento consistió en dos dosis de la vacuna de subunidad proteica conjugada SOBERANA®02: 25 µg de proteína recombinante del dominio de unión al receptor (RBD, del inglés receptor binding domain) monomérico, del virus SARS-CoV-2, conjugado con toxoide tetánico y adsorbido en hidróxido de aluminio, más una dosis de SOBERANA®PLUS (50 µg de dímero RBD, adsorbido en hidróxido de aluminio), con 28 días entre dosis. Se administraron 0,5 mL de cada producto en el tercio superior del brazo, a la altura del músculo deltoides, por vía intramuscular siguiendo las especificaciones de la técnica de administración de vacunas establecida por el PNI. Las jeringuillas utilizadas fueron de 1 mL y agujas 23 G x 1". Se realizó el interrogatorio al binomio padre-niño y el examen físico a estos últimos, para precisar si se encontraban aptos para la vacunación.
La seguridad de las vacunas se evaluó a través de la identificación y clasificación de los eventos adversos (EA), incluyendo a todos los sujetos que recibieron, al menos, una dosis. El seguimiento de los EA se realizó por farmacovigilancia activa (FVA) con observación médica directa en la primera hora tras la vacunación y por reporte espontáneo, luego de este tiempo y hasta 28 días después de cada dosis, considerado como farmacovigilancia pasiva (FVP).
Como EA se consideró cualquier acontecimiento médico desfavorable en un sujeto de la investigación al que se le administró un candidato vacunal y que no tenía necesariamente una relación causal con este tratamiento.12 Estos fueron clasificados según intensidad, gravedad y causalidad según se muestra:
Clasificación según intensidad12
- Leve: evento adverso que es fácilmente tolerado por el sujeto, causando el mínimo de molestias y que no interfiere sus actividades cotidianas.
- Moderado: evento adverso que es suficientemente molesto como para interferir las actividades cotidianas normales.
- Severo: evento adverso que impide las actividades cotidianas.
Clasificación según gravedad12
- Grave: 1-requiere hospitalización; 2-prolonga la hospitalización actual; 3-resulta una discapacidad/incapacidad persistente o significativa; 4-amenaza la vida; 5-muerte.
- No grave: no causa nada de lo anterior.
Clasificación según causalidad13)
- A: asociación causal consistente con la vacunación: A1. Evento relacionado con la vacuna (de acuerdo a la literatura publicada); A2. Evento relacionado con un defecto en la calidad de la vacuna; A3. Evento relacionado con un error programático/técnico; A4. Evento relacionado con las condiciones inherentes al vacunado.
- B: indeterminado; B1. La relación de temporalidad es consistente, pero son insuficientes las evidencias para considerar la vacunación causa del evento (puede ser un nuevo evento a la vacuna); B2. Factores de clasificación dan como resultado tendencias contradictorias respecto a consistencias e inconsistencias con la asociación causal con la inmunización.
- C: asociación causal inconsistente con la vacunación.
- D: no clasificable.
Se utilizó el sistema informático creado sobre la plataforma Andariego Vida para la entrada remota de los datos a medida que transcurría la vacunación, el cual constituye el registro oficial de la vacunación en nuestro país que cubre de manera centralizada el proceso de captación de los vacunados. Cumpliendo los principios éticos, en la presentación de los resultados, se omitió toda la información de los niños referente a su identidad, respetando la confidencialidad de sus datos.
Estadística
Los datos fueron recolectados en ficheros Excel y la información fue procesada con el programa SPSS 21.0. Los resultados se expresan en frecuencias absolutas y relativas. Para la variable cuantitativa, edad, se calcularon promedios y desviaciones estándar.
Resultados
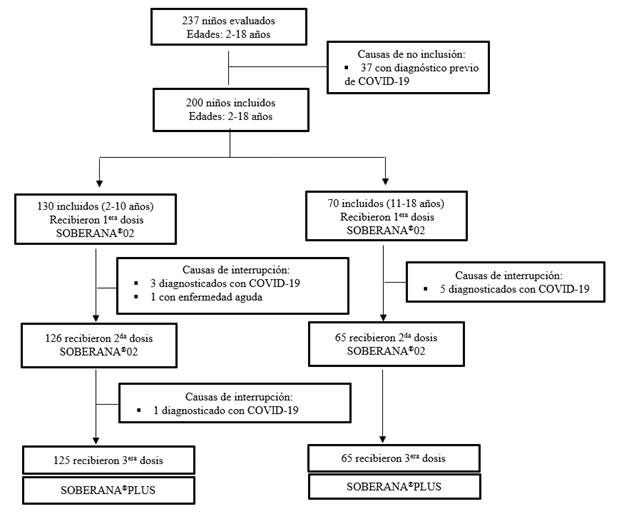
De un universo de 237 niños evaluados, fueron incluidos 200; los 37 restantes no se incluyeron por haber presentado previamente infección por COVID-19 (Fig. 1).
Para el análisis, los incluidos se dividieron en dos grupos según sus edades: de 2 a 10 y de 11 a 18 años, con una edad media de 6,1 ± 2,6 y 13,9 ± 1,9 años, respectivamente. A 191 (95,5% de los incluidos), se les administró la segunda dosis. De estos 191, recibieron la tercera dosis el 99,5% (190 niños). De esta forma el 95,0% de los incluidos recibió el esquema completo de vacunación. La causa principal de interrupción del estudio fue por diagnóstico de COVID-19 como se muestran en la Figura 1.
En la Tabla 1 se muestran los antecedentes patológicos personales (APP), según sexo, de los 200 niños incluidos en los dos grupos de edad. El 45,5% de los individuos (91 niños) no refirieron ningún antecedente y en igual número se recogió el antecedente de alergia. En 21 niños (10,5%), se recogió el antecedente de padecer asma.
Tabla 1 Antecedentes Patológicos Personales (APP) de los incluidos según sexo y grupo de edad.
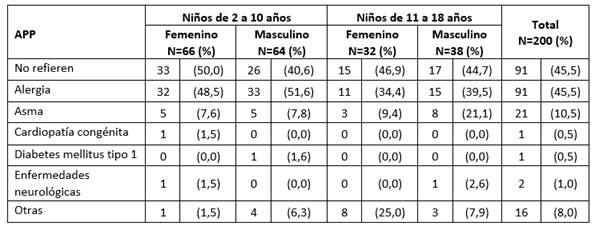
Fuente: Interrogatorio a los padres previo a la vacunación.
La mayoría de los EA comenzaron entre las primeras 24-48 horas tras la vacunación y tuvieron mayormente una duración entre 24-48 horas. Del total de 200 sujetos que recibieron, al menos, una dosis, 77 individuos (que representaron el 38,5 % de los vacunados) reportaron, al menos, un EA; de ellos, 37 fueron niños (28,5%) de 2 a 10 años y 40 (57,1%) adolescentes de 11 a 18 años.
Se registraron 71 EA con la primera dosis, 36 con la segunda y 14 con SOBERANA®PLUS, para un total de 121 EA. De ellos, solo 10 (8,3%) ocurrieron en la primera hora después de la vacunación, siendo considerados como FVA. En los resultados mostrados, no se incluyen los casos diagnosticados como COVID-19 que constituyeron causas de interrupción durante la intervención, los que representaron EA categoría C según la clasificación de causalidad.
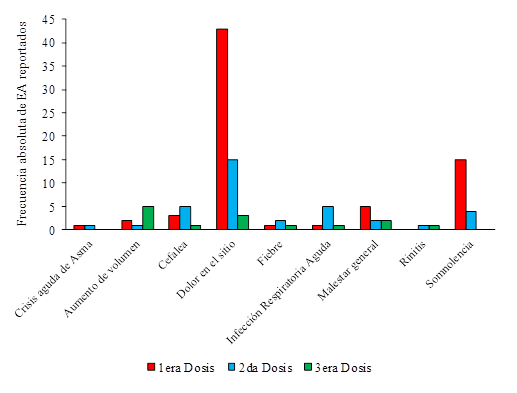
Los EA registrados en cada dosis se muestran en la Figura 2. Los más frecuentes fueron dolor en el sitio de administración, somnolencia, cefalea y malestar general (en dicho orden).
Según la clasificación por intensidad, 115 EA, que representan el 95% de los ocurridos, fueron leves. Solamente seis EA (5%) fueron moderados, todos fueron detectados por FVP, con relación de causalidad con SOBERANA®02 y se trató, en todos los casos, de dolor en el sitio de administración. No se reportaron EA severos.
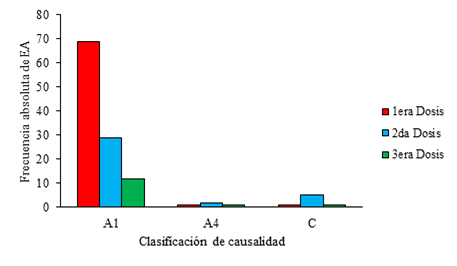
En la Figura 3 se muestra la causalidad de los EA con cada dosis de vacunación. De los 121 EA registrados, 110 (90,9%) fueron relacionados con la vacuna (A1). Siete infecciones respiratorias agudas, que constituyen el 5,8% de los eventos, se clasificaron como categoría C, o sea, con una asociación causal inconsistente con la vacunación. Otros cuatro EA que representan el 3,3% (dos rinitis alérgica y dos crisis agudas de asma) estuvieron relacionados con las condiciones inherentes al vacunado (A4).
No ocurrieron EA graves relacionados con los productos en estudio.
Discusión
El 11 de marzo de 2020 se confirmaron en Cuba los primeros casos importados de adultos con COVID-19, 10 días después, el 21 de marzo, se confirmó el primer caso importado en edad pediátrica procedente de España. Posteriormente se diagnosticaron otros infantes procedentes de Estados Unidos, Guyana y Francia, hasta que se comenzaron a diagnosticar niños cubanos (casos autóctonos). Transcurridos 70 días de evolución de la epidemia en el país, 223 niños y adolescentes habían sido confirmados con COVID-19. De esta manera, los casos confirmados en niños y adolescentes continuaron aumentando en el país según aumentó la trasmisión. A finales de abril de 2021, se apreció un nuevo incremento en la detección con registros de más de 600 y cerca de 800 casos semanales. A partir de ese momento, la detección se elevó a más de 1.000 casos por semana, cifra que alcanzó más de 7.000 casos a mediados del mes de julio de 2021. El total de casos superó los 10.000 entre julio y septiembre de 2021. El día 17 de septiembre (semana 37) se reportaron 2.045 casos pediátricos, el número más elevado de casos diarios de niños y adolescentes desde el inicio de la epidemia en el país, con el consiguiente pico de casos activos.14)
Cuando las hospitalizaciones pediátricas por COVID-19 alcanzaban cifras récord a nivel mundial, la decisión de Cuba de lanzar una campaña de vacunación masiva contra la COVID-19, para niños de hasta dos años, llamó la atención de médicos, inmunólogos, expertos en salud pública, gobiernos y autoridades reguladoras en todo el mundo. Se desplegó en todo el país un cronograma de vacunación comenzando el 5 de septiembre de 2021 con la vacunación a los niños entre 11 y 18 años, y a partir del 17 de septiembre con la población entre los 2 y 10 años de edad. La vacunación de los adolescentes comenzó el 16 de septiembre en el BioCen y el 17 de ese mes se continuó con la vacunación de los niños más pequeños.
Del total de individuos vacunados en esta investigación, el 10,5% eran asmáticos, un porcentaje semejante al reportado para Cuba en población pediátrica mayor de un año (11,8%), según el Anuario Estadístico de Salud de 2020.15) Es de destacar la alta prevalencia de más de un 45% de niños alérgicos, enfermedad considerada un problema de salud pública por su elevada frecuencia, su impacto económico y repercusión en la calidad de vida de los pacientes. La rinitis alérgica y el asma tienen una alta prevalencia en la población pediátrica cubana.16) En el momento de la administración de la vacuna, estos niños se encontraban controlados y sin síntomas agudos de su patología. No obstante, por FVP se registraron cuatro EA de manifestaciones alérgicas. En todos los casos existía el diagnóstico previo de la enfermedad alérgica en los sujetos y habían transcurrido más de 10 días de la vacunación. Todos estos EA fueron clasificados como leves y se presentaron en pacientes diferentes, o sea, ningún niño luego de haber presentado este tipo de EA con una dosis, tuvo otra manifestación similar o más severa en dosis subsiguientes, como hubiera pasado si la reacción alérgica estuviera relacionada con la vacuna. Por otra parte, octubre y noviembre, meses en los que transcurrió la mayor parte del estudio, han evidenciado mayor incidencia de exacerbaciones de asma en niños cubanos pudiendo estar en relación con la época de polinización y otros factores ambientales.17) Todo lo planteado fue tenido en cuenta durante el análisis de causalidad de estos EA, considerándolos no relacionados con las vacunas SOBERANAS®, sino con las características inherentes a los sujetos (A4). La clasificación según la asociación de causalidad se establece a partir de varios elementos, entre los que se incluyen la relación de temporalidad y la información previa disponible sobre el producto.13) En esta investigación se obtuvo un porcentaje de EA relacionados (90,9%), semejante al reportado (88,5%) en el ensayo clínico SOBERANA-PEDIATRÍA7 (estudio fase I-II, secuencial durante la fase I, abierto, adaptativo, y multicéntrico para evaluar la seguridad, la reactogenicidad y la inmunogenicidad, de un esquema heterólogo de dos dosis del candidato vacunal profiláctico anti SARS-CoV-2, FINLAY-FR-2 y una dosis de FINLAY-FR-1A en niños adolescentes cubanos RPCEC 00000374).
A través de los canales de comunicación de BioCen, se informó a los trabajadores la importancia del reporte espontáneo de EA por FVP. De manera semejante a lo reportado en otras investigaciones, los resultados del presente estudio evidencian que a medida que se progresó en el esquema de vacunación, disminuyó el número de sujetos con EA y el número total de EA, sin cambios en su intensidad o gravedad.5,6,7,11 Sin embargo, en estudios con otras vacunas anti COVID-19, la segunda dosis se asocia con mayor incidencia de EA y mayor gravedad de los mismos.18)
En el caso de la tercera dosis con SOBERANA®PLUS, no existió entrevista directa con los padres/hijos como sucedió con las administraciones anteriores de SOBERANA®02. Por tanto, no se puede descartar totalmente la posibilidad de un sub-registro de EA para esta vacuna. No obstante, en otras publicaciones se resaltan los pocos EA para SOBERANA®PLUS, tanto en estudios en adultos,5,6,11) como en el ensayo clínico Fase I/II en niños.7)
Al comparar de manera global los resultados obtenidos en este estudio con los del ensayo clínico SOBERANA-PEDIATRÍA7 se aprecia que del total de niños que recibieron, al menos, una dosis de SOBERANA®, un porciento menor de sujetos (38,5% respecto a lo obtenido en el presente estudio 53,1%) presentaron al menos un EA. En lo anterior pudo influir el seguimiento más estricto que se da a los individuos en el contexto de un ensayo clínico. No obstante, los datos del presente estudio coinciden con los mostrados en el ensayo clínico en relación al mayor reporte de EA en el grupo de 11 a 18 años, en comparación con los niños más pequeños (2 a 10 años). En nuestra investigación fue dos veces mayor el porcentaje de EA en los adolescentes (57,1%) con relación al obtenido en los niños de 2-10 años (28,5%) y en el ensayo clínico esta proporción fue de 1,3 (60% para los adolescentes frente a 46,3% en los niños de 2-10 años).7
El dolor en el sitio de administración constituyó el 50% de los EA reportados en esta investigación. Tanto en los ensayos clínicos realizados en adultos con SOBERANA®02 y SOBERANA®PLUS,5,6) como en el estudio de intervención realizado en los trabajadores de BioCen,11) este EA fue también el más reportado. Igualmente en el ensayo clínico SOBERANA-PEDIATRÍA,7 este evento alcanzó el 47,7% del total de eventos reportados. El dolor local es reportado por la mayoría de las vacunas que utilizan como adyuvante el hidróxido de aluminio. En todos los casos se trató de cifras menores que lo reportado con vacunas contra la COVID-19 basadas en tecnología de ARN. Después de la vacunación con dos dosis de las vacunas BNT162b2 y mRNA-1273, los investigadores informaron un 86% y 94,2%, respectivamente, de adolescentes (edad 12-15 años) con EA locales en el sitio de la inyección.19,20) Mientras que los niños de 5 a 11 años vacunados con BNT162b2 informaron dolor local en el 74% de los casos.21
Resultó muy favorable que cerca del 93% de los EA registrados fueron leves y todos de corta duración, en concordancia con otros reportes para las vacunas anti COVID-19 disponibles en la actualidad. De manera muy satisfactoria, al igual que en los ensayos clínicos publicados con SOBERANA®, tanto en pediatría como en adultos,5,6,7 no ocurrieron en los niños y adolescentes del estudio EA graves relacionados.