Meu SciELO
Serviços Personalizados
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Medicina Tropical
versão On-line ISSN 1561-3054
Rev Cubana Med Trop v.56 n.1 Ciudad de la Habana jan.-abr. 2004
Instituto de Medicina Tropical Pedro Kourí
Estado de la resistencia a insecticidas y mecanismos de resistencia en larvas del municipio Playa, colectadas durante la etapa intensiva contra el Aedes aegypti en Ciudad de La Habana, 2001-2002
Lic. Juan A. Bisset,1 Lic. María Magdalena Rodríguez,2 Téc. Ditter Fernández3 y Dra. Omayda Pérez4
Resumen
Se determinaron los niveles de susceptibilidad y/o resistencia a insecticidas en larvas de Aedes aegypti, colectadas del municipio Playa, durante la etapa intensiva de la campaña contra el mosquito Aedes aegypti en Ciudad de La Habana, en el presente año. En larvas, se encontró alta resistencia a los insecticidas organofosforados fention y temefos y moderada a fenitrotion, también se detectó alta resistencia al carbamato propoxur. Las larvas resultaron susceptibles a clorpirifos, malation y pirimifos metil. Los resultados a través del uso de sinergistas indicaron que las esterasas desempeñan un papel importante en la resistencia detectada a los insecticidas organofosforados, pero no en la resistencia a propoxur, sin embargo, las monoxigenasas intervienen solamente en la resistencia a fenitrotion. Estos mecanismos se encontraron a elevada frecuencia en las larvas de este municipio. Se confirmó el papel de las esterasas en la resistencia a temefos mediante ensayos de inhibición en gel de poliacrilamida.
DeCS: INSECTICIDAS; CONTROL DE MOSQUITOS; RESISTENCIA A INSECTICIDAS; INSECTICIDAS ORGANOFOSFORADOS; SALUD PUBLICA; CUBA.
El municipio Playa es altamente urbanizado, de ahí que las principales actividades de control estén encaminadas hacia la reducción y el tratamiento de los criaderos del vector, basados en esquemas de aplicaciones de temefos (1 ppm). Durante la etapa intensiva contra el Aedes aegypti, que comenzó en la epidemia de 2002, el control del estado adulto se llevó a cabo por el rociado espacial de clorpirifos y se rotó con cipermetrina o lambdacialotrina de acuerdo con la disponibilidad del producto. Desafortunadamente Aedes aegypti ha demostrado la habilidad de desarrollar resistencia a una gran variedad de tóxicos. Los mecanismos responsables de esta resistencia son enzimas que se alteran de forma cuantitativa o cualitativamente y ya existen reportes en Aedes aegypti.1-6
El municipio Playa es uno de los de Ciudad de La Habana donde se ha mantenido alta la infestación residual de Aedes aegypti, de ahí la importancia de evaluar la resistencia de los insecticidas químicos tanto en larvas como en adultos, así como los mecanismos que contribuyen a la resistencia. Con estos resultados se aporta información que puede contribuir al mejor uso de insecticidas para el control del vector en este municipio.
Métodos
Cepas evaluadas
ROCKEFELLER: una cepa de referencia de Aedes aegypti susceptible a insecticidas, suministrada por el CDC de San Juan, Puerto Rico.
Playa: una cepa de Aedes aegypti, colectada del municipio Playa durante la etapa intensiva contra el mosquito Aedes aegypti en el 2002, en una de las áreas de mayor infestación del vector.
Insecticidas evaluados
Organoclorados: DDT.
Organofosforados: malation, fenitrotion, pirimifos metil, temefos, fention y clorpirifos.
Piretroides: deltametrina, lambdacialotrina, ciflutrina y beta cipermetrina.
Bioensayos en larvas
Las larvas de Aedes aegypti en tercer estadio tardío o cuarto estadio temprano, fueron evaluadas a través de los bioensayos de susceptibilidad de la OMS (1981),7 para determinar las concentraciones letales de 50 y 90 % de la población (CL50-CL90) frente a insecticidas. Se aplicaron 5 concentraciones o más de cada insecticida, disueltos en acetona, y 5 réplicas por cada concentración, que causaron mortalidades entre 2 y 98 %. La mortalidad se determinó 24 h después del tratamiento con los insecticidas y los resultados se analizaron mediante el programa probit-logaritmo de Raymond y otros.8 Se calculó el FR50 y 90 (factor de resistencia), comparando los valores de las cepas de campo con la cepa ROCKEFELLER,
Determinación in vivo de los mecanismos de resistencia
Se realizaron bioensayos de susceptibilidad utilizando sinergistas. La acción del S S S tributil fosforotritioato (DEF), inhibidor de esterasas y del piperonil butóxido (PB), inhibidor de las monoxigenasas, se determinó exponiendo las larvas de Aedes aegypti a dosis subletales de estos tóxicos, durante 4 h. Inmediatamente después se le aplicaron las diferentes dosis de insecticidas, y después de 24 h de exposición se determinó la mortalidad, hallándose los valores de concentración letal 50 y 90 (CL50 y CL90) mediante el programa probit-logaritmo. Se calculó el factor de sinergismo (FS).
FS= Cl50 insecticida solo
CL50 insecticida +sinergista
Ensayos bioquímicos: se determinó la actividad de esterasas en larvas de tercer estadio tardío o cuarto temprano, de acuerdo con el método estandarizado para Aedes aegypti.5 Se homogeneizó cada larva en 200 μL de buffer fosfato 0,01 M, pH 7,5. En una placa de microtitulación de ELISA, a 20 μL del homogenato se le añadieron 200 μL del sustrato (0,7-mM de β-naftil acetato). Se dejó transcurrir la reacción por 10 min y se añadieron 40 μL de fast blue. Se leyó la densidad óptica (DO) a 570 nm en lector de placas de ELISA Labsystems iMS, manufacturado en Finlandia.
La actividad de glutatión-S-transferasa (GST) fue determinada de acuerdo con el método de Booth y otros,9 y modificado para Aedes aegypti.5 A 20 μL de cada homogenato de larva se le añadió 250 μL de una mezcla de reacción de 1-cloro-2, 4 dinitrobenzeno 50 mM; y de glutatión reducido 20 mM. Se dejó transcurrir la reacción por 3 min y se leyó la DO a 340 nm. Se calculó la actividad enzimática de la GST y se expresó como μmol/min.
Se determinó la actividad de la acetilcolinesterasa (AchE) normal e inhibida con propoxur según el método de Rodríguez y otros.10 La preparación de las muestras es similar a la descrita anteriormente con la diferencia de que las muestras se homogeneizaron en 50 mL de buffer fosfato, que contenía tritón X-100 1 %. Se utilizaron 2 placas, una para la determinación de la actividad AchE normal y otra para la actividad AchE inhibida con propoxur. En ambas placas se adicionaron 20 mL de DTNB (ácido 5-5 ditiobis 2 nitrobenzoico) 0,07 M, pH 7,5 y 20 mL de acetiltiocolina yodada (Achi) 0,06 M. En la placa donde se midió la actividad AchE inhibida se adicionaron, además, 10 mL de propoxur 0,025 M. Después de preparadas estas 2 placas se adicionó en cada pocillo de ambas, 20 mL del homogeneizado de las larvas. La reacción se dejó transcurrir durante 30 min y se leyó la DO a 405 nm.
Un estimado de la frecuencia de los mecanismos de esterasas, GST y AchE fue calculado a partir del número de individuos susceptibles para cada ensayo, asumiendo que la población se encuentra en equilibrio de Hardy-Weinberg.
Ensayo de inhibición en gel de poliacrilamida
Para el ensayo de inhibición se realizó una electroforesis en gel de poliacrilamida (PAGE) 10 % en buffer Tris-Borato/EDTA, pH 8,6. El gel se corrió a 150 V hasta que el frente de corrida alcanzó las ¾ partes del gel. Se aplicaron muestras individuales de larvas del municipio Playa en cada pocillo. Una vez terminada la corrida, el gel se cortó en tiras y antes del proceso de tinción se incubaron por separado en buffer fosfato 0,01 M, pH 6,5, el cual contenía 10 μL de los inhibidores, temefos, lambdacialotrina y ciflutrina, a una concentración final de 0,1 mM. Para cada ensayo de inhibición se utilizó un control con acetona, donde se incubó la muestra con 10 μL de este solvente y un control sin nada, solo la muestra. Después del período de incubación, las esterasas fueron visualizadas por la adición de 4 mL de los sustratos α-naftil acetato y β-naftil acetato, 10 mL de solución de fast-blue (0,03 g de fast blue + 3 mL de agua + 7 mL de SDS 5 %) en 50 mL de buffer fosfato 0,01 M pH 6,5. Se fijó la tinción de las bandas reemplazando el colorante por ácido acético 7 %.
Resultados
En la tabla 1 se observa que existió alta resistencia (factor de resistencia [FR50] mayor que 10 x), en larvas del municipio Playa, a los insecticidas organofosforados fention y temefos, con valores de, 14,88x y 89,91x, respectivamente y moderada resistencia (FR50 entre 5 y 10) se observó al OP fenitrotion con un FR50 de 5,45x. También se detectó resistencia al carbamato propoxur con un valor de FR50 de 16,41x. Sin embargo, se observó susceptibilidad (FR50< 5x) a los insecticidas organofosforados clorpirifos (3,62x), pirimifos metil (2x) y malation (1,77).
Tabla 1. Nivel de susceptibilidad y/o resistencia a insecticidas organofosforados y a un carbamato (propoxur), en larvas de Aedes aegypti, de la cepa de campo del municipio Playa y de la cepa de referencia susceptible Rockefeller
| | CEPAS | |||||
| Insecticida | Municipio Playa | Rockefeller | ||||
| | CL50 (Límites de confianza) | FR50 | b (±DE) | CL50 (Límites de confianza) | FR50 | b (±DE) |
| Clorpirifos | 0,00417 (0,0038-0,0045) | 3,62 | 4,62 (± 0,46) | 0,00115 (0,0010-0,0013) | - | 4,52 (± 0,50) |
| Piroximetil | 0,371 (0,30-0,45) | 2,00 | 1,56 (± 0,19) | 0,185 (0,13-0,37) | - | 1,71 (± 0,31) |
| Fenitrotion | 0,0922 (0,083-0,11) | 5,45 | 3,88 (± 0,51) | 0,0169 (0,012-0,030) | - | 1,86 (± 0,31) |
| Fention | 0,131 (0,11-0,15) | 14,88 | 4,24 (± 0,41) | 0,00880 (0,0062-0,016) | - | 1,16 (± 0,18) |
| Temefos | 0,107 (0,088-0,12) | 89,91 | 3,24 (± 0,36) | 0,00119 (0,00092-0,0015) | - | 1,27 (± 0,33) |
| Malation | 0,474 (0,43-0,52) | 1,77 | 4,0 (± 0,515) | 0,268 (0,20-0,42) | - | 1,54 (±0,22) |
| Propoxur | 2,00275 (1,57-2,49) | 16,41 | 1,35 (± 0,17) | 0,122 (0,11-0,14) | (0,45) | 3,04 (± 0,31) |
El sinergista DEF se utilizó para determinar in vivo el papel de las enzimas esterasas inespecíficas y el PB para determinar el papel de las enzimas monoxigenasas. Los valores elevados de factor de sinergismo (FS), obtenidos para los 3 organofosforados con el DEF (FS> 5) (tabla 2), indican que las esterasas son un mecanismo importante en la alta resistencia detectada a fention y temefos y, además, a la resistencia moderada detectada a fenitrotion; sin embargo, estas enzimas no desempeñan ningún papel en la resistencia detectada a propoxur, dado por el valor del FS de 3,55.
Tabla 2. Variación de la toxicidad de 3 insecticidas organofosforados y un carbamato (propoxur) al aplicar los sinergistas DEF y PB en la cepa de Aedes aegypti del municipio Playa
| | CL50 (ppm)+ DEF (Límites de confianza) | FS | b (± DE) | CL50 (ppm) + PB (Límites de confianza) | FS | b (± DE) |
| Fenitrotion | 0,00434 (0,0031-0,0054) | 21,24 | 2,18 (± 0,31) | 0,0176 (0,014-0,022) | 5,23 | 1,62 (± 0,18) |
| Fention | 0,00835 (0,00765-0,0092) | 15,68 | 4,16 (± 0,40) | 0,0397 (0,035-0,044) | 3,30 | 4,22 (± 0,45) |
| Temefos | 0,00336 (0,00285-0,0041) | 31,84 | 2,34 (± 0,26) | 0,115 (0,083-0,303) | 0,93 | 1,24 (± 0,37) |
| Propoxur | 0,564 (0,48-0,65) | 3,55 | 2,22 (± 0,25) | 1,667 (1,42-1,91) | 1,20 | 3,28 (± 0,31) |
Los resultados con el sinergista PB indican que las enzimas monoxigenasas no intervienen en la resistencia a temefos, ni fention, pero sí en la resistencia moderada a fenitrotion dado por el valor de FS de 5,23.
A partir de las técnicas bioquímicas en placas de microtitulación, se calculó la frecuencia en que aparecen elevadas las enzimas de acción metabólica (esterasas y monoxigenasas) y, además, determinar con qué frecuencia se detectó el mecanismo de insensibilidad del sitio de acción, acetilcolinesterasa modificada (AchE) en las larvas de Playa. Estos resultados se muestran en la tabla 3, la alta frecuencia en que aparece el mecanismo de esterasa (44 %), y el de la AchE modificada (20,3 %), explica la alta resistencia detectada en las larvas del municipio Playa a los insecticidas organofosforados y al carbamato propoxur.
Tabla 3. Frecuencia en que aparecen los mecanismos de resistencia basados en la elevada actividad de esterasas, glutatión-S-transferasa (GST) y acetilcolinesterasa (Ache) en Aedes aegypti del municipio Playa
| | Municipio Playa | |
| Mecanismo de resistencia | Frecuencia (%) | |
| Esterasas | | 44,0 (176) |
| GST | | 28,62 (176) |
| Ache | | 20,3 (92) |
a: total de larvas evaluadas.
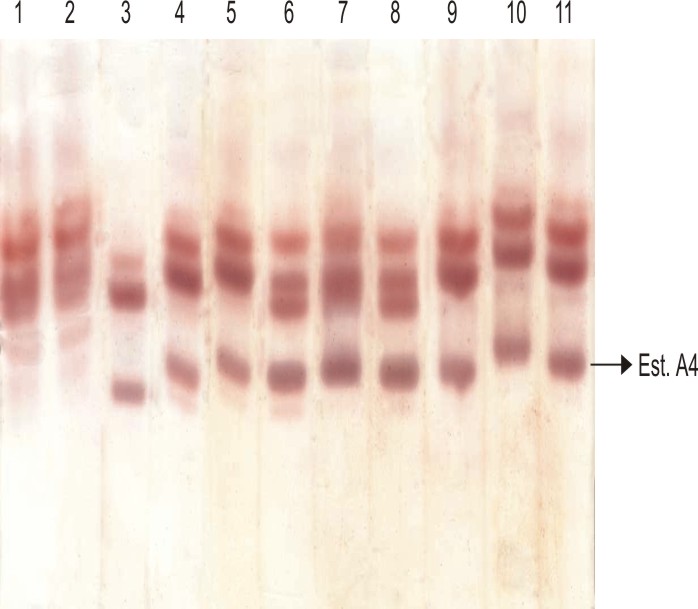
El examen visual de los geles (fig.) reveló la presencia de una elevada actividad de la esterasa A4 en larvas de la cepa Playa. Como se muestra en la figura esta banda no se encuentra incrementada en la cepa susceptible a insecticidas, Rock (pocillo 1). En la misma figura (pocillo 2), se puede observar que la actividad de la esterasa A4 fue inhibida con temefos, si se compara con los pocillos 4 y 5 correspondientes a la actividad de esta enzima, sin el inhibidor; además, como se observa la acetona, solvente del inhibidor, no afectó la actividad de la enzima (pocillo 3). Sin embargo, la actividad de la esterasa A4 no fue inhibida ni por lambdacialotrina (pocillo 6), ni por ciflutrina (pocillo 9), cuando se compara con su control de actividad enzimático normal (pocillo 8 y 11 respectivamente); tampoco la acetona afectó la actividad de esta enzima en estas muestras (pocillo 7 y 10 respectivamente). Esto confirma que es la esterasa A4 la responsable de la resistencia a temefos, detectada en esta cepa.
Fig. Inhibición de la actividad de esterasas con temefos, lambdacialotrina y ciflutrina en larvas individuales de la cepa Playa. Nombrando de izquierda a derecha, pocillo 1: cepa Rock; pocillos 4, 5, 8, 11: actividad de esterasa normal; pocillos 3, 7 y 10: control con acetona; pocillo 2: inhibición con temefos (10–2 M); pocillo 6: inhibición con lambdacialotrina (10–2 M); y pocillo 9: inhibición con ciflutrina (10–2 M).
Discusión
Los insecticidas organofosforados han sido utilizados para el control de Aedes aegypti durante los últimos 15-20 años en las Américas.11 Sin embargo, los piretroides han sido utilizados solamente en caso de emergencia de dengue, y como adulticidas. En Cuba comenzó una campaña activa contra el mosquito Aedes aegypti en el municipio Playa desde el mes de junio del año 2001, debido a que este municipio ha sido el que se ha mantenido con alta infestación residual de este vector. Por la dificultad del control en este municipio, Aedes aegypti se expandió a otros, produciéndose un brote epidémico en el 2002 en Ciudad de La Habana. En estos resultados se detectó que las larvas de Aedes aegypti del municipio Playa fueron más susceptibles a los insecticidas organofosforados que a los piretroides. Similares resultados se obtuvieron en larvas de Aedes aegypti procedentes de Río Piedras, Puerto Rico, las cuales eran resistentes a piretroides, sin embargo no hubo evidencia de resistencia ni a organofosforados ni a carbamatos.12 También Rawlins y Wan13 detectaron muy bajos niveles de resistencia a insecticidas organofosforados tanto en larvas, como en adultos de Aedes aegypti de Trinidad, igual que Sames y otros (Sames WJ4th, Bueno RJr, Hayes J, Olson JK. Insecticide susceptibility of Aedes aegypti and Aedes albopictus in the Lower Río Grande Valley of Texas and Mexico en Texas y México). Similares resultados en una cepa de Santiago de Cuba, colectada durante la epidemia ocurrida en 1997 en este municipio.3 Ping y otros,14 evaluaron la resistencia a pirimifos metil y permetrina en Aedes aegypti y Aedes albopictus y detectaron completa susceptibilidad a piroximetil en ambas especies, pero detectó resistencia a permetrina solo en Ae. aegypti.
Los mecanismos responsables de la resistencia a insecticidas organofosforados están bien documentados en Culex quinquefasciatus de América Latina, como en Cuba, Colombia, Venezuela,15-18, Brasil,19 México,20 y ya han sido caracterizados al nivel molecular, como es el gen de esterasas.21-25 Existen reportes de mecanismos de resistencia en Aedes aegypti.3-5,12,21,26-28
Sobre la base de los resultados obtenidos, se recomienda que a la hora de la toma de decisiones acerca del insecticida a utilizar para el control de Aedes aegypti, se realicen bioensayos con estos productos formulados para verificar su efecto en condiciones de campo, siguiendo pautas sugeridas en la propuesta del programa de monitoreo de la resistencia a insecticidas.
Summary
The levels of susceptibility and/or resistance to inseciticides in Aedes aegypti larvae collected at the municipality of Playa during the intensive campaign against the mosquito Aedes aegypti, in Havana City, in the present year, were determined. In larvae, it was found a high resistance to the organophosphate insecticides phention and temephos and moderate to fenitrothion. A high resistance to propoxur carbamate was also detected. The larvae proved to be susceptible to clorpirifos, malathion and methyl-pyrimifos. The results obtained through the use of sinergists indicated that esterases play an important role in the detected resistance to organophosphate insecticides, but not in the resistance to propoxur. However, the monooxigenases take part only in the resistance to fenitothrion. These mechanisms were found at an alevated frequency in the larvae from this municipality. It was confirmed the role played by esterases in the resistance to temephos by polyacrilamide gel inhibition tests.
Subject headings: INSECTICIDES; MOSQUITO CONTROL; INSECTICIDE RESISTANCE; INSECTICIDES, ORGANOPHOSPHATE; PUBLIC HEALTH; CUBA.
Referencias bibliográficas
- Mazarri MB, Georghiou GP. Characterization of resistance to organophosphate, carbamate, and pyrethroid insecticides in field populations of Aedes aegypti from Venezuela. J Am Mosq. Control Assoc 1995;11:315-22.
- Wirth MC, Georghiou GP. Selection and characterization of temephos resistance in a population of Aedes aegypti from Tortola, British Virgin Islands. J Am Mosq Control Assoc 1999;15:315-20.
- Rodríguez MM, Bisset JA, Mila L, Calvo E, Díaz C, Soca LA. Niveles de resistencia a insecticidas y sus mecanismos en una cepa de Aedes aegypti de Santiago de Cuba. Rev Cubana Med Trop 1999;51:93-8.
- Rodríguez MM, Bisset JA, Milá L, Molina D, Calvo E, Díaz C, Soca LA. Levels of malathion resistance in Aedes aegypti and Culex quinquefasciatus as a result of use in Aedes aegypti control programs. J Am Mosq Control Assoc 2000;15:227.
- Rodríguez MM, Bisset JA, Molina DF, Lauzan L, Soca A. Detection of resistance mechanisms in Aedes aegypti from Cuba and Venezuela. J Med Entomol 2001;38:623-8.
- Bisset JA, Rodríguez MM, Darjaniva MF, Díaz C, Soca A. Esterasas elevadas como mecanismo de resistencia a insecticidas organofosforados en cepas de Aedes aegypti (Diptera: Culicidae). Rev Cubana Med Trop 2001;53:37-43.
- World Health Organization. Instructions for determining the susceptibility or resistance of mosquito larvae to insecticides. 1981. WHO/VBC/81.807.
- Raymond M. Presentation dune programme danalyse log-probit pour microordinateur cahiers Orstrom Sér. Ent Méd Parasitol 1985;23:117-21.
- Booth JE, Boyland E, Sims P. An enzyme from the rat liver catalyzing conjugation with glutathione. Biochem J 1961;79:516-23.
- Rodríguez M, Bisset JA, Díaz C, Ortíz E. Determinación de fenotipos de acetilcolinesterasa modificada en Culex quinquefasciatus por el Sistema Ultramicroanalítico (SUMA). Rev Cubana Med Trop 1993;45(2):122-7.
- Georghiou GP, Wirth M, Tran H,. Saume F, Knudsen AB. Potential for organophosphate resistance in Aedes aegypti in the Caribbean area and neighboring countries. J Med Entomol 1987;24:290-4.
- Hemingway J, Boddington RG, Harris J. Mechanisms of insecticide resistance in Aedes aegypti (L.) (Diptera: Culicidae) from Puerto Rico. Bull Entomol Res 1989;79:123-30.
- Rawlins SC and J Ou Hing Wan.. Resistance in some Caribbean populations of Aedes aegypti to several insecticides. J Am Mosq Control Assoc 1995;11:59-65.
- Ping LT, Yatiman R, Gek LP. Susceptibility of adult field strains of Aedes aegypti and Aedes albopictus in Singapore to pirimiphos-methyl and permethrin. J Am Mosq Control Assoc 2001;17:144-6.
- Bisset JA, Rodríguez MM, Díaz C, Ortíz E, Marquetti MC. The mechanisms of organophosphate and carbamate resistance in Culex quinquefasciatus (Diptera: Culicidae) from Cuba. Bull Entomol Research 1990;80:245-50.
- Bisset JA, Rodríguez MM, Díaz C, Marquetti MC, Navarro A. Patrones de esterasa en Culex quinquefasciatus y su relación con la resistencia al insecticida malation. Rev Cubana Med Trop 1991;43:181-5.
- Bisset JA, Rodríguez MM, Díaz C, González T. Estudio de la resistencia en una cepa de Culex quinquefasciatus procedente de Medellín, Colombia. Rev Cubana Med Trop 1998;50:133-7.
- Bisset JA, Rodríguez MM, Díaz C, Soca LA. Caracterización de la resistencia a insecticidas organofosforados, carbamatos y piretroides en Culex quinquefasciatus del estado de Miranda, Venezuela. Rev Cubana Med Trop 1999;51:117-23.
- Bracco JE, Barata JM, Marinotti O. Evaluation of insecticide resístanse and biochemical mechanisms in a population of Culex quinquefasciatus (Diptera: Culicidae) from Sao Paulo, Brazil. Mem Ins Oswaldo Cruz 1999;94:115-20.
- Pietrantonio PV, Gibson G, Nawrocki S, Carrier F, Knight WPJr. Insecticide resistance status, esterase activity, and electromorphs from mosquito populations of Culex quinquefasciatus Say (Diptera: Culicidae), in Houston (Harris County), Texas. J Vector Ecol 2000;25:74-89.
- Vaughan A, Chadee DD, Ffrench-Constant R. Biochemical monitoring of organophosphurus and carbamate insecticide resistance in Aedes aegypti mosquitoes from Trinidad. Med Vet Entomol 1998;12:318-21.
- Small GJ, Karunaratne SH, Hemingway J. Characterization of amplifued esterase 1 (2) associated with organophosphate resistance in a multi-resistant population of the mosquito Culex quinquefasciatus from Cuba. Med Vet Entomol 1998;12:187-91.
- Small GJ, Karunaratne SH, Shadee DD, Hemingway J. Molecular and kinetic evidence for allelic variants of esterase Estbeta1 in the mosquito Culex quinquefasciatus. Med Vet Entomol 1999;13:274-81.
- Paton MG, Karunaratne SH, Giakoumaki E, Roberts N, Hemingway J. Quantitative analysis of gene amplification in insecticide-resistant Culex mosquitoes. Biochem J 2000;1:17-24.
- Hawkes NJ, Hemingway J. Analysis of the promoters for the beta-esterase genes associated with insecticide resistance in the mosquito Culex quinquefasciatus. Biochim Biophys Acta 2002;4:51-62.
- Field WN, Hitchen JM, Rees AT. Esterases activity in strains of Aedes aegypti (Diptera: Culicidae) tolerant and susceptible to the organophosphate insecticide malathion. J Med Entomol 1984;21:412-8.
- Karunaratne SH, Hemingway J. Malathion resistance and prevalence of the malathion carboxylesterase mechanism in populations of mosquito vectors of desease in Sri lanka. Bull World Health Organ 2001;79:1060-4.
- Rawlins SC. Spatial distribution of insecticide resistance in Caribbean populations of Aedes aegypti and its significance. Pan Am J Public Health 1998;4:243-51.
Recibido: 19 de septiembre de 2002. Aprobado: 28 de noviembre de 2003.
Lic. Juan A. Bisset. Instituto de Medicina Tropical Pedro Kourí. Apartado 601, Marianao 13, Ciudad de La Habana, Cuba. Teléf: 2020426. Correo electrónico: ciipk@ipk.sld.cu
1 Licenciado en Biología. Investigador Auxiliar.
2 Licenciada en Bioquímica. Investigadora Auxiliar.
3 Técnico en Química.
4 Médico Veterinario.
 Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons
Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons