Meu SciELO
Serviços Personalizados
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Hematología, Inmunología y Hemoterapia
versão On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter vol.32 no.2 Ciudad de la Habana abr.-jun. 2016
ARTÍCULO ORIGINAL
Seguridad de la aplicación intravenosa del cigb-300 en pacientes con hemopatías malignas. Estudio EHPMA
Safety of intravenous application of cigb-300 in patients with hematological malignancies. EHPMA study
Julio D. Fernández Águila I, Yanelda García Vega II, Rosa Oliday Ríos JiménezIII, Agnerys López SacerioIII, Carmen R. Rodríguez RodríguezIV, Yusaima Rodríguez FragaIV, Carmen Valenzuela SilvaII, Grupo de trabajo del Estudio EHPMA*
I Hospital Universitario "Dr. Gustavo Aldereguía Lima", Cienfuegos, Cuba.
II Centro de Ingeniería Genética y Biotecnología (CIGB), La Habana, Cuba.
IIIHospital Clinicoquirúrgico "Arnaldo Milián Castro", Villa Clara, Cuba.
IV Hospital Clinicoquirúrgico "Hermanos Ameijeiras", La Habana, Cuba.
RESUMEN
Introducción: el CIGB-300 es un péptido sintético capaz de producir apoptosis en células tumorales.
Objetivos: explorar la seguridad del CIGB-300 administrado por vía intravenosa en pacientes con hemopatías malignas.
Metodología : se realizó un ensayo clínico fase I, multicéntrico, no aleatorizado, adaptativo, con un solo grupo de tratamiento y escalado de dosis en el mismo paciente (Registro No. 05.013.12.B). Los eventos adversos se clasificaron según la versión 4.03 de "Terminología de los Criterios Comunes para Eventos Adversos". Se seleccionaron pacientes con edad igual o mayor a 18 años, no candidatos a trasplante de médula ósea, con leucemias agudas refractarias o en recaída, leucemia aguda mielobástica del anciano y síndromes mielodisplásticos con exceso de blastos, que tuvieron ECOG ≤ 3 y aceptaron participar en la investigación. Se consideraron como criterios de exclusión: la leucemia promielocítica, enfermedades crónicas descompensadas, antecedentes alérgicos graves, embarazo, puerperio y lactancia. Para las variables cuantitativas, se estimaron medidas de tendencia central y para las cualitativas la distribución de frecuencias.
Resultados: de 10 pacientes incluidos, 6 realizaron el tratamiento con los cinco niveles de dosis. Se presentaron 94 tipos de eventos adversos, la mayoría de carácter sistémico, con 619 notificaciones. El prurito y el eritema localizados fueron los eventos más comunes, seguidos de la hipertensión arterial. Los eventos se presentaron con mayor frecuencia el primer día de cada ciclo y no se detectó su aumento al incrementar la dosis del producto. El 87,7 % se consideraron eventos leves y el 61,6 % con causalidad muy probable. Se presentaron 15 eventos adversos graves, pero solo uno fue relacionado con la administración del CIGB 300.
Conclusiones: la administración intravenosa del CIGB-300 fue segura y bien tolerada. El escalado de dosis no aumentó la toxicidad del producto.
Palabras clave : CIGB 300; eventos adversos, seguridad, ensayo clínico.
ABSTRACT
Introduction: CIGB-300 is a synthetic peptide capable of producing apoptosis in tumor cells.
Objectives: To explore the safety of CIGB-300 administered intravenously in patients with hematological malignancies (Registry No. 05.013.12.B).
Methodology : A multicenter, non-randomized, adaptive, with an only treatment group (intravenous administration of the investigational product and dose escalation in the same patient), phase I clinical trial was conducted. Adverse events were classified according to the version 4.03 of "Common Terminology Criteria for Adverse Events". Patients aged 18 years or older were selected, not candidates for bone marrow transplantation, with refractory or relapsed acute leukemias, acute myeloblastic leukemia of elderly, and myelodysplastic syndromes with blast excess, who had ECOG ≤ 3 and agreed to participate in the investigation. We considered as exclusion criteria: acute promyelocytic leukemia, decompensated chronic diseases, severe allergic history, pregnancy, postpartum and breastfeeding. For quantitative variables, measures of central tendency and qualitative distribution of frequencies were estimated.
Results: Of 10 patients included 6 received treatment with five dose levels. Ninety four types of adverse events were present, most systemic, with 619 notifications. Localized itching and rash were the most common events, followed by high blood pressure. The events occurred more frequently on the first day of each cycle and no increase was detected when the dose of the product was rised. Minor events were 87,7% and 61,6% with probable causality . Fifteen serious adverse events occurred, but only one was related to the administration of CIGB 300.
Conclusions : Intravenous administration of CIGB-300 was safe and well tolerated. Dose escalation did not increase the toxicity of the product.
Keywords: CIGB 300 adverse events, safety, clinical trial.
INTRODUCCIÓN
La caseína cinasa 2 (CK2) es una serina-treonina-cinasa que tiene funciones relacionadas con el crecimiento, proliferación, supervivencia y muerte celular 1. La CK2 se ha encontrado desregulada en diversos tumores, con aumento de sus niveles entre tres y siete veces en las células neoplásicas, en comparación con sus contrapartes normales 2,3.
La inhibición de esta enzima con sustancias químicaso con terapia génica antisentido 4-6, conduce a la inducción de apoptosis, por lo que se espera que los fármacos que bloqueen el dominio de fosforilación de CK2, puedan convertirse en poderosas herramientas para la terapéutica del cáncer.
El CIGB-300, desarrollado en el Centro de Ingeniería Genética y Biotecnología (CIGB) de La Habana, es un péptido sintético cuya propiedad biológica fundamental es la capacidad de producir apoptosis en células tumorales, por su efecto inhibidor de la fosforilación por la enzima CK2. Se ha demostrado la eficacia antitumoral del péptido mediante la administración sistémica en animales (ratones) con tumores de pulmón murino y de origen humano. Los resultados de tales modelos experimentales han demostrado su efecto antitumoral con dosis comprendidas en un rango entre 2 y 40 mg/kg del péptido por vía intraperitoneal y hasta 10 - 20 mg/kg por vía intravenosa (IV) 7.
Los datos experimentales en células de líneas de tumores hematológicos indican que células de leucemia mieloide aguda (LMA) y de leucemia linfoide crónica (LLC) son extremadamente sensibles al efecto inhibitorio de la proliferación celular ejercido por el CIGB-300 8,9. Todas las líneas celulares evaluadas mostraron un valor de concentración inhibitoria 50 (CI50) menor de 40 µM, lo cual resulta de gran relevancia si se compara con los valores observados para tumores sólidos (superiores a 50 µM).
Un elevado porcentaje de los enfermos con leucemias agudas en recaídas o refractarias, ancianos con LMA y síndromes mielodisplásticos (SMD), no tienen opciones terapéuticas que garanticen remisiones duraderas y prolonguen la supervivencia significativamente, o no son candidatos a los tratamientos curativos. Por tanto, se hace necesaria la búsqueda de nuevos medicamentos que puedan contribuir a mejorar estos resultados. El CIGB-300 pudiera brindar una opción terapéutica a este grupo de pacientes con una expectativa de vida pobre y que no disponen de tratamiento con eficacia demostrada.
Las dosis de CIGB-300 utilizadas en la administración sistémica en modelos preclínicos no se han usado en seres humanos por vía IV. Con el objetivo de conocer si la administración del CIGB-300 puede ser tolerable y segura, se realizó el estudio EHPMA, según Registro No. 05.013.12.B.
MÉTODOS
Diseño general del estudio
Se realizó un ensayo clínico fase I, multicéntrico, no aleatorizado, adaptativo, con solo un grupo de tratamiento y escalado de dosis en el mismo paciente. El tratamiento consistió en la administración diaria del CIGB-300 por vía IV, durante tres días consecutivos y cuatro días de descanso. Se realizaron cinco ciclos de tratamiento, uno semanal por cinco semanas sucesivas, con diferentes niveles de dosis: 1,6 mg/kg; 3,2 mg/kg; 5,3 mg/kg; 8,0 mg/kg; y 12,8 mg/kg. En función de la toxicidad observada se disminuyó o se escaló a otro nivel de dosis.
Los pacientes se evaluaron antes de cada ciclo de tratamiento y permanecieron hospitalizados durante la aplicación del producto. A los 15, 30 y 60 min posteriores a cada administración del CIGB-300, se realizó examen físico e interrogatorio para identificar los posibles eventos adversos (EA). Después del tratamiento, el paciente se evaluó cada cuatro semanas, hasta la semana 24 o hasta el fallecimiento.
Consideraciones éticas
El estudio se realizó según lo establecido en la Declaración de Helsinki (Principios éticos para las investigaciones médicas en seres humanos, adoptada por la Asamblea Médica Mundial) y sus posteriores clarificaciones10. Se ajusta a las normas y criterios éticos establecidos en los códigos nacionales e internacionales de ética y regulaciones legales vigentes en Cuba11. El protocolo del ensayo clínico fue sometido a la consideración y aprobación del Comité de Ética para las Investigaciones de los sitios clínicos participantes. El inicio de su ejecución fue aprobado por el Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos de Cuba (CECMED).
Selección de los sujetos del estudio
Se reclutaron pacientes en los hospitales CQ "Hermanos Ameijeiras" (La Habana), provincial "Arnaldo Milián Castro" (Villa Clara) y provincial "Dr. Gustavo Aldereguía Lima" (Cienfuegos). El universo quedó constituido por todos los pacientes adultos, residentes en Cuba, con diagnóstico de leucemias agudas refractarias o en recaídas (recaída precoz, segunda recaída o recaída postrasplante), LMA del anciano y SMD con exceso de blastos (AREB-1 y AREB-2), que acudieron a los Servicios de Hematología de los centros asistenciales referidos.
El diagnóstico se estableció por aspiración de la médula ósea (MO) realizada en los 15 días previos a la inclusión. Los pacientes con edad igual o mayor de 18 años y capacidad funcional £ 3 (según grados del Eastern Cooperative Oncology Group), no recibieron tratamiento específico en las dos semanas previas, ni eran candidatos a trasplante de MO. Las mujeres en edad fértil debían usar un método contraceptivo efectivo y todos expresaron su voluntariedad de participación mediante la firma de un consentimiento informado.
Se consideró excluir la LMA variante promielocítica (M3), embarazadas, puérperas y mujeres que lactaran, pacientes con infección activa, enfermedades crónicas descompensadas, antecedentes alérgicos graves, incapacidad mental u otra limitación que impidiera dar su consentimiento o dificultara las evaluaciones del estudio.
Evaluación de variables en estudio
La variable principal fue la seguridad. Se recogieron los EA comunicados por el paciente o el investigador durante el tratamiento, así como los ocurridos en el período posterior a la aplicación. Por experiencia previa, se conocía que la mayoría de los EA se presentan durante la aplicación del producto en investigación (PI) o poco tiempo después de finalizada. El investigador clínico y la enfermera realizaron una observación activa durante la primera hora de la administración del PI.
El tipo de EA y su intensidad se clasificaron según la versión 4.03 de Terminología de los Criterios Comunes para Eventos Adversos (CTCAE v4.03, por sus siglas en inglés)12. La clasificación del sistema corporal se realizó después de recogida la información en la base de datos, por los primeros autores, según los criterios del WHO-ART 13.
Se consideró que el producto fue seguro y bien tolerado en un sujeto, cuando no ocurrieron EA de grado ³3 para no hematológicos, o ³4 para hematológicos con relación de causalidad demostrada (probable o muy probable). Se aceptó toxicidad grave con imputabilidad demostrada como máximo en el 30 % de los pacientes, según algoritmo de Food and Drug Administration (FDA)14.
Técnicas para la recogida y procesamiento de la información
La información durante la etapa de tratamiento y seguimiento fue recogida en el cuaderno de recogida de datos (CRD) que completó el investigador responsable en cada unidad asistencial. Se generó un CRD electrónico (CRDe) con formato similar al impreso, en el sistema de entrada de datos en OpenClinica. La entrada de la información se ejecutó por dos operadores diferentes, incorporando el proceso de comparación automática y corrección de las bases.
Técnicas para el análisis de la información
Para las variables cuantitativas, se estimaron las medidas de tendencia central y dispersión. En el caso de las cualitativas, se estimó la distribución de frecuencias.
Para la especificación del modelo a priori de dosis-toxicidad, se tomaron en cuenta los eventos de toxicidad moderada con relación de causalidad "muy probable". Se partió de un modelo de regresión logística, donde se estimó para cada paciente y después de cada ciclo, la probabilidad de toxicidad en función de la dosis en curso, de la dosis máxima recibida y de la dosis total acumulada, usando el método de Montecarlo vía cadenas de Markov para la estimación de los parámetros del modelo. Cuando la probabilidad de toxicidad estimada excedió en algún punto del análisis, la toxicidad máxima admisible se estimó de manera inversa la dosis a usar en el próximo ciclo.
Se realizó el informe de resultados del estudio analizando las variables mediante los softwares estadísticos: SPSS (versión 15.0 for Windows) y EPIDAT v.3.1.
RESULTADOS
Se evaluaron 12 pacientes y se incluyeron 10, según lo previsto. Las características generales de estos enfermos se detallan en la tabla 1 y la disposición durante las diferentes evaluaciones del estudio en el flujograma de la figura 1.
Seis de los pacientes realizaron el tratamiento completo con los cinco niveles de dosis planificadas. Se presentaron 94 tipos de EA con un total de 619 notificaciones, la mayoría de carácter sistémico, aparecieron durante la administración del PI y fueron de corta duración.
Al agrupar los EA por órganos y sistemas, las localizaciones más frecuentes fueron en piel y apéndices, generales del organismo y cardiovasculares (Tabla 2). En la figura 2 se detallan aquellos EA que se observaron con frecuencia mayor o igual de 1 %. El prurito y eritema localizado fueron los eventos más comunes, seguidos de la hipertensión arterial, que se presentó en el 90 % de los incluidos. Sin embargo, no se demostró una secuencia uniforme con el tiempo de administrado el PI; en algunos pacientes se observaron cifras tensionales elevadas antes de comenzar la infusión, mientras en otros enfermos aparecieron durante o inmediatamente después de la aplicación del CIGB-300. Ninguna de las hipertensiones descritas fue de intensidad grave y exclusivamente el 37 % tuvo una relación de causalidad demostrada con el PI (probable o muy probable). Después de finalizada la aplicación del CIGB-300, las cifras de tensión arterial (TA) retornaron a los rangos normales.
Los EA en otros sistemas de órganos fueron poco frecuentes (< 10 %). Entre estos, es interesante comentar los relacionados con los cambios en las frecuencias respiratorias, así como la sequedad bucal, las náuseas y los vómitos. La mayoría de los eventos se observaron con mayor frecuencia el primer día de cada ciclo y no se detectó aumento de esta al incrementar la dosis del producto (Fig. 2C).
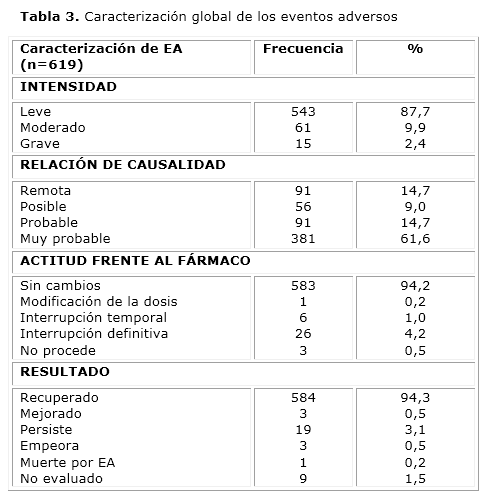
La caracterización global se resume en la tabla 3. El 87,7 % de los eventos fueron de intensidad leve y desaparecieron rápidamente, sin requerir tratamiento. Se informaron 15 EA graves (2,4 %) distribuidos entre 6 de los pacientes incluidos y entre los 5 ciclos de tratamiento. El EA grave reportado con mayor frecuencia fue la trombocitopenia (4 observaciones), que en todos los casos se relacionó con la enfermedad de base y no con el PI. Otros EA graves con similar relación de causalidad fueron: neutropenia febril, hiperuricemia, hiperglicemia, bradicardia, polipnea, hipotensión e infección respiratoria. Sólo apareció un EA grave con relación de causalidad muy probable: reacción vaso-vagal en la primera aplicación del ciclo 5. Se modificó la dosis y se pudo completar el tratamiento. Se actualizaron las probabilidades de toxicidad observadas en cada paciente incluido hasta ese momento. Se obtuvo que en todos, a excepción del paciente con el EA grave, las probabilidades de toxicidad variaban en el rango esperado de 0,1572 a 0,206.
De manera general, más del 75 % de los EA tuvieron causalidad muy probable (61,6 %) o probable (14,7 %), no implicaron cambios en la administración del fármaco (94,2 %) y se recuperaron en su mayoría (94,3 %).
DISCUSIÓN
En el estudio se cumplió con el número de inclusión previsto. Las interrupciones de tratamiento fueron por las causas pronosticadas en el protocolo, relacionadas fundamentalmente con el estado de los pacientes y la evolución propia de las enfermedades en estudio. Solamente un paciente expresó su voluntariedad de no continuar en la investigación, pero fue después de recibir la primera aplicación del último ciclo de tratamiento. No se produjeron interrupciones definitivas del tratamiento de forma temprana, por reacciones adversas graves atribuibles al CIGB-300.
Similar a lo ocurrido con la aplicación IV del CIGB-300 en el estudio TS-FARMEV-30014, los sistemas de órganos más afectados fueron la piel y sus apéndices y los trastornos del organismo en general. Los trastornos cardiovasculares generales fueron el tercer sistema más afectado, a diferencia del estudio TS-FARMEV-300, donde este lugar lo ocupó el sistema de trastornos vasculares (extracardíacos).
Entre los EA informados sobresalen el prurito, el eritema localizado y el rash, relacionados todos con la liberación de histamina. La frecuencia e intensidad de estos eventos son similares a las informadas en los estudios anteriores con CIGB-300 14-16. Respecto a la intensidad de los eventos de tipo histaminérgicos, todos fueron leves y no aumentaron la frecuencia en correspondencia con la magnitud de la dosis. Esta es una diferencia importante con lo observado en el estudio de aplicación IV realizado anteriormente, en el cual se observó un mayor número y aumento de la intensidad de los EA con las dosis mayores del PI 14.
Los trastornos cardiovasculares descritos se circunscribieron, fundamentalmente, a hipertensión arterial o hipotensión. El 30 % de los pacientes incluidos en el estudio eran hipertensos, porcentaje que se corresponde con la prevalencia de la enfermedad en la población geriátrica. La frecuencia de hipertensión demostrada no se observó durante el primer ensayo de aplicación IV (TS-FARMEV-300)14, ni en el CERVISEG-300-II de aplicación intratumoral16. Sin embargo, en los informes de estos estudios se observaron valores fluctuantes de TA. La falta de asociación temporal entre aparición de la hipertensión y administración del PI, puede explicarse por factores no relacionados con el péptido, como los aspectos emocionales del paciente.
De forma general, la hipotensión fue mucho menos frecuente y con intensidad leve o moderada. Un caso fue clasificado con intensidad grave y motivó la interrupción del tratamiento. Este evento (no relacionado con el PI) apareció en el curso de una infección respiratoria en paciente con neutropenia grave.
Se observaron fluctuaciones en la tensión arterial, en la mayoría de los casos con relación de causalidad demostrada, pero sin relevancia clínica. No puede descartarse la posibilidad de que el uso de dosis mayores por ciclos de tratamientos o la dosis acumulativa del CIGB-300, pueda influir en la presentación de estos eventos. Sin embargo, la edad de los pacientes puede ser una explicación alternativa para la aparición de alteraciones de la tensión arterial.
El escalado de dosis estudiado del CIGB-300 no aumentó la toxicidad del producto. La mayoría de los EA graves no se relacionaron el PI ni con la dosis recibida. Se observó un EA grave imputable al CIGB-300 en el quinto ciclo de tratamiento (dosis mayor). En el ensayo de CERVISEG-300-II16 no se encontró correlación entre la intensidad de los eventos histaminérgicos y la magnitud de la dosis, pero se observó mayor número de eventos con la dosis de 70 mg. Sin embargo, en el estudio de aplicación IV (TS-FARMEV-300) 14 se observó mayor número de EA graves en la dosis más alta, que coincide con la menor dosis administrada en el estudio EHPMA.
El mejor perfil de tolerabilidad observado en este ensayo, con el uso de dosis casi 10 veces superiores, pudiera estar relacionado con el tipo de neoplasia en cuestión o con que el escalado de dosis en el mismo paciente, condicione al individuo a una mejor tolerabilidad del medicamento. No se descarta la posibilidad de que un menor tiempo entre los ciclos, también favorezca la tolerancia.
La experiencia con los agentes citotóxicos clásicos admite que la actividad antitumoral se relaciona con la toxicidad y por consiguiente, que los tratamientos deben escalarse hasta las dosis máximas tolerables. Sin embargo, las características únicas de las moléculas pequeñas de blanco específico y los productos biológicos, desafían estos dogmas y demandan nuevas pautas de desarrollo clínico. Para este tipo de drogas, la dosis óptima biológica puede ser muy inferior a la dosis tolerable17.
Probablemente, un estudio con dosis intermedias a las empleadas en el Estudio EHPMA pueda lograr un buen efecto terapéutico con un menor número de EA, o quizás, dosis repetidas con menos intervalo de tiempo de descanso, también pudieran disminuir el número de EA en el tiempo. Esto se sustenta en el hecho de que en las segundas y terceras aplicaciones del PI, la frecuencia de los eventos disminuye con respecto a la primera aplicación de cada ciclo. Este comportamiento también se ha visto en otros ensayos clínicos con el CIGB-300.
En términos de seguridad, la aplicación IV con altas dosis de CIGB-300 y varios ciclos de tratamiento fue segura y tolerable. Los EA más frecuentes fueron los de tipo histaminérgico, en su mayoría leves o moderados. De cualquier forma, los eventos descritos son manejables y en su mayoría de resolución espontánea. Todo esto avala continuar y profundizar en la utilización de dicha vía para la administración del CIGB-300 en estas y otras enfermedades que lo meriten.
REFERENCIAS BIBLIOGRÁFICAS
1. Trembley JH, Chen Z, Unger G, Slaton J, Kren BT, Van Waes C, et al. Emergence of protein kinase CK2 as a key target in cancer therapy. Blood. 2005;105(1):22-30.
2. Guerra Guerra B, Issinger OG. Protein kinase CK2 in human disease. Curr Medicinal Chem. 2008;15:1870-86.
3. Trembley JH, Wang G, Unger G, Slaton J, Ahmed K. CK2: A key player in cancer biology. Cell Mol Life Sci 2009;66:1858-67.
4. Pierre F, Chua PC, O'Brien SE, Siddiqui-Jain A, Bourbon P, Haddach M, et al. Discovery and SAR of 5-(3-chlorophenylamino) benzo [c] [2,6] naphthyridine-8-carboxylic acid (CX-4945), the fi rst clinical stage inhibitor of protein kinase CK2 for the treatment of cancer. J Med Chem. 2011;54:635-54.
5. Pierre F, Chua PC, O'Brien SE, Siddiqui-Jain A, Bourbon P, Haddach M, et al. Pre-clinical characterization of CX-4945, a potent and selective small molecule inhibitor of CK2 for the treatment of cancer. Mol Cell Biochem. 2011;356: 37-43.
6. Slaton JW, Unger GM, Sloper DT, Davis AT, Ahmed K. Induction of apoptosis by antisense CK2 in human prostate cancer xenograft model. Mol Cancer Res. 2004;2:712-2.
7. Perera Y, Farina HG, Hernández I, Mendoza O, Serrano JM, Reyes O, et al. Systemic administration of a peptide that impairs the Protein Kinase (CK2) phosphorylation reduces solid tumor growth in mice. Int J Cancer. 2008;122: 57-62.
8. Perea S, Perera Y, Baladrón I, González L, Benavent F, Fariña H, et al. CIGB-300: A Promising Anti-Casein Kinase 2 (CK2) Peptide for Cancer Targeted Therapy. In: Ahmed K, Issinger OG, Szyszka R (eds). Protein Kinase CK2 Cellular Function in Normal and Disease States. Advances in Biochemistry in Health and Disease 12. Springer International Publishing Switzerland; 2015. p. 281-298. DOI: 10.1007/978-3-319-14544-0_16.
9. Martins LR, Perera Y, Lúcio P, Silva MG, Perea SE, Barata JT. Targeting chronic lymphocytic leukemia using CIGB-300, a clinical-stage CK2-specific cell-permeable peptide inhibitor. Oncotarget. 2013;5(1):258-63.
10. World Medical Association. World Medical Association Declaration of Helsinki Ethical Principles for Medical Research Involving Human Subjects. JAMA. 2013 Nov 27;310(20):2191-4. doi: 10.1001/jama.2013.281053.
11. Grupo de trabajo en Buenas Prácticas Clínicas. Buenas Prácticas Clínicas: Documento de las Américas. Organización Panamericana de la Salud. 2015. (Citado agosto 27, 2015). Disponible en: http://apps.who.int/medicinedocs/documents/s18627es/s18627es.pdf
12. Common Terminology Criteria for Adverse Events (CTCAE), Version 4.03, NIH Publication No. 09-5410 (v4.03: June 14, 2010). Disponible en: http://evs.nci.nih.gov/ftp1/CTCAE/About.html.
13. The WHO Adverse Reaction Terminology - WHO-ART. Terminology for coding clinical information in relation to drug therapy. (June 14, 2010). Disponible en: http://www.umc-products.com
14. Turner WM. The Food and Drug Administration Algorithm. Drug Inf J. 1984;18:259-66.
15. Seguridad y Evaluación Farmacológica de la administración endovenosa del CIGB 300 en pacientes con Tumores Sólidos refractarios al tratamiento oncoespecífico. Estudio TS-FARMEV-300, código IG/CIGB300I/TS/0901. Informe final del Ensayo Clínico, 2014.
16. Solares AM, Santana A, Baladrón I, Valenzuela C, González CA, Díaz A, et al. Safety and preliminary efficacy data of a novel Casein Kinase 2 (CK2) peptide inhibitor administered intralesionally at four dose levels in patients with cervical malignancies. BMC Cancer. 2009;9:146.
17. Seguridad de la Aplicación de CIGB-300 asociado a la pre-medicación con anti-histamínicos, en el Carcinoma Epidermoide del Cuello Uterino Estadio Ib2-II. Estudio fase I. Estudio CERVISEG-300-II, código IG/ IG/CIGB300I/CC/0901. Informe final de Ensayo Clínico, 2011.
18. Lage Dávila A, Crombet Ramos T. Control del Cáncer Avanzado: La ruta hacia la cronicidad. Revista Anales de la Academia de Ciencias de Cuba. 2011;1(1):13-19.
Recibido: agosto 26, 2015.
Aceptado: noviembre 19, 2015.
Dr. Julio D. Fernández Dámaso . Hospital Universitario "Dr. Gustavo Aldereguía Lima". Cienfuegos, Cuba.
E mail: jfernandez@gal.sld.cu
*Grupo de trabajo del Estudio EHPMA CIGB : MSc. Yaleisys Rosales Pantoja, MSc. Angela D. Tuero Iglesias, DrC. Silvio E. Perea Rodríguez, DrC. Yasser Perera Negrin, MSc. DrC. Dania Vásquez Blomquist, Lic. Vilcy Reyes Nicolas, Ing. Reinier Hernández Rodríguez, Ing. Leovaldo Alvarez Falcón, Dr. Amadosoro Bataille García, Dra. Lidia González Méndez, Lic. Lisandra Méndez, MSc. Ivette Raices Cruz, Lic. Clara Yurina Taylor Torres, Ing. Adelaida Villareal Barrios.
HU "Dr. Gustavo Aldereguía Lima " : Lic. Maria del Carmen Mustelier, Lic. Taily Villa Marrero, Dra. Maritza Cabrera Zamora, Lic. Annia García Izquierdo, Lic. Jenia González Martínez, Dr. Ricardo González Puerta, Rodríguez, Téc. Yerendi Reyes Marrero, Lic. Rosario Torres Saroza, Lic. Mayuli Yañez Pérez.
HCQ "Arnaldo Milián Castro": Lic. María Margarita Ríos Cabrera, Lic. Nerelys Díaz Lima, Lic. Yelién Martín Fadragas, Dra. Lugarda Pérez de Alejo Rodríguez, Tec. Ileana Wong Romero Tec. Yamilé Alvarado Pérez, Lic. Yaritsy Abreu Gómez, Dr. Alejandro Agüero.
HCQ "Hermanos Ameijeiras": Dr. Isbel Moya Pérez, Dr. Aramís Nuñez Quintana, Dr. Jorge Muñío Perurena, Dra. Tania Carballo Treto, Dr. José Carnot Uria, Lic. Andria Arias Vázquez, Lic. Ana María Arias, Dr. Jesús Lázaro Diego de la Campa, Lic. Ivelise Nuvia Fleites León, Lic. Felipe Aref Mesa Bacallao, Lic. Liliana Páez Nogueras, Lic. María Elena Suardíaz Espinosa, Dr. Rolando Valle Rodríguez, Dr. Calixto Hernández Cruz, María Regla Vega Ruiz, Orquídea Galindo Almeida.
Instituto de Hematología e Inmunología: DrC. Ana M Amor Vigil, Dra. Kalia Lavaut Sánchez, Dra. Vianed Marsán Suárez, Lic. Lázaro O. del Valle Pérez, DrC. Consuelo Macías Abraham, Dra. Miriam de la C. Sánchez Segura, Dra. Daily Pino Blanco.