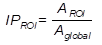Introducción
La evaluación del flujo sanguíneo cerebral regional es importante tanto para uso clínico como científico. En la imagen molecular se utilizan biomarcadores contra dianas biológicas específicas que permiten estudiar procesos celulares y moleculares en vivo o en el medio característico de un proceso patológico. El estudio del flujo sanguíneo cerebral regional se utiliza para evaluar diferentes procesos neurológicos, entre ellos la cirugía de epilepsia, los trastornos neurodegenerativos, las enfermedades cerebrovasculares, las enfermedades psiquiátricas y los trastornos del neurodesarrollo. Las técnicas de imagen molecular más utilizadas son la tomografía por emisión de fotón único (SPECT) y la tomografía por emisión de positrones (PET).
A pesar del avance en las tecnologías de neuroimagen, se requieren métodos superiores al tradicional análisis visual de las imágenes. En los últimos años el enfoque de la teoría de redes y los estudios de conectividad han aportado conocimientos sobre la fisiopatología, evaluación de los tratamientos y progresión de algunas enfermedades neurológicas.1,2,3,4
El objetivo fue proponer una metodología para la descripción de los patrones de conectividad funcional a partir de la perfusión cerebral por SPECT. La metodología se implementó para la epilepsia farmacorresistente y la enfermedad de Parkinson. La bibliografía consultada no tiene estudios sobre la conectividad funcional a partir de la perfusión cerebral por SPECT en ninguna de estas patologías ni tampoco propone una metodología para la cuantificación relativa del flujo sanguíneo cerebral regional a partir del coregistro con imagen estructural de resonancia magnética y el empleo de atlas anatómicos para la definición de las regiones de interés.
Métodos
El estudio se realizó con un equipo de resonancia magnética Magnetom Aera SIEMENS de 1,5 tesla. El protocolo utilizado incluyó imágenes sagitales T1-MPRAGE 3D: tiempo de repetición (TR=2200 ms), tiempo eco (TE=2,67 ms), tiempo de inversión (TI=900 ms) y espesor de corte de 1 ml.
Se inyectó el trazador en el antebrazo, vía endovenosa, dentro de una habitación aislada de estímulos externos. Transcurridos 10 min en condiciones de reposo sensorial y cognitivo, se administraron, igualmente vía endovenosa, [99mTc]Tc-ECD y el paciente continuó inmóvil otros 10 min.
Pasados 40 min de suministrar el radiofármaco, se hicieron las imágenes de SPECT con una cámara gamma de doble cabezal MiE (ECAM, Siemens). Se empleó un colimador de baja energía y alta resolución (LEHR), se hizo en matrices de 128 × 128 píxeles, 128 proyecciones en órbita circular de 360° y con una ventana energética del 20 % centrada en el fotopico del 99mTc. Para la reconstrucción tomográfica se utilizó el método iterativo DROSEM,5 cuyo algoritmo maximiza la verosimilitud, minimiza el error, establece los límites por encima y por debajo del cerebro (incluido el cerebelo) y cuenta con corrección de atenuación.
La metodología incluyó tres pasos principales: pre-procesamiento espacial, corrección del volumen parcial y cálculo de los índices de perfusión. El pre-procesamiento espacial incluye el co-registro de imágenes de resonancia magnética-SPECT y definición de las regiones de interés. La metodología de cuantificación combina información estructural y funcional para localizar más fácilmente las regiones cerebrales que serán analizadas:
Delimitar el encéfalo para eliminar el tejido no cerebral de la imagen con la herramienta BET (Brain Extraction Tool) del programa FSL (FMRIB Software Library v5.0)6 a partir de las imágenes de resonancia magnética anatómica T1.
Segmentación de las imágenes de resonancia magnética en los mapas de sustancia gris, sustancia blanca y líquido cefalorraquídeo a partir de la herramienta FAST (FMRIB's Automated Segmentation Tool) del FSL.
Multiplicación del atlas anatómico co-registrado con la máscara obtenida de las imágenes de resonancia magnética de cada paciente.
Coregistro de las imágenes de resonancia magnética anatómica, las máscaras de sustancia gris y sustancia blanca y el atlas de cada paciente con la SPECT mediante la herramienta FLIRT (Flexible Image Registration Toolbox) del programa FSL.
Para el análisis de pacientes con enfermedad de Parkinson, se construyó un atlas a partir del coregistro del AAL7 (Automated Anatomical Labeling) y un atlas de estructuras subcorticales8 para incluir el núcleo subtalámico y la segregación del pálido (externo e interno). Para el análisis de los pacientes con epilepsia, se utilizó el atlas propuesto por Oishi y colaboradores9 que incluye el tronco encefálico.
La corrección parcial de las imágenes de SPECT se hizo con un algoritmo híbrido que emplea la información de las imágenes de resonancia magnética y calcula la actividad media de las regiones de interés con el método de matriz de transferencia geométrica para luego realizar una corrección voxel a voxel.10
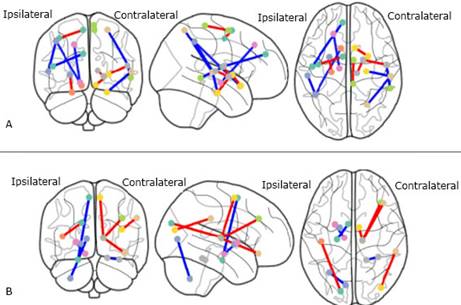
El índice de perfusión (IP) se calculó dividiendo la actividad (cuentas por voxel) media en una región dada por la actividad media del resto de la materia gris (ecuación 1). Indica la perfusión en cada región con respecto al nivel de perfusión global.
Los valores mayores que uno indican hiperperfusión respecto a la perfusión global. En cambio, valores menores indican hipoperfusión. Se aplicó la prueba de Mann Whitney (valor de α ≤ 0,05) para comparar los índices de perfusión entre los pacientes con diferentes tipos de epilepsia y entre los casos en distintos estadios de la enfermedad de Parkinson.
La conectividad funcional son asociaciones estadísticas de determinada métrica entre distintas regiones del cerebro.11 Se midió calculando el coeficiente de correlación de Pearson del flujo sanguíneo cerebral entre sujetos y se obtuvo una matriz de correlación (N × N, N es el número de regiones de interés) donde el elemento cij es el valor de la correlación de Pearson entre las regiones i y j. Solo aquellos coeficientes de correlación estadísticamente significativos (valor de p ≤ 0,05) fueron tomados en cuenta para el estudio de los patrones de conectividad.
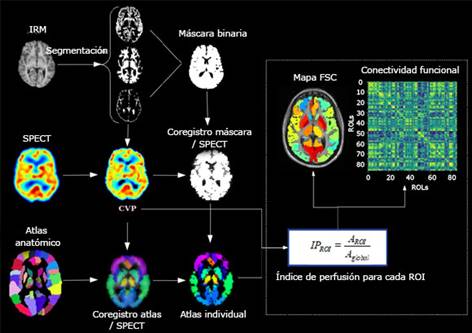
Fig. 1 Esquema de la metodología para la cuantificación del flujo sanguíneo cerebral regional y obtención de la matriz de conectividad funcional.
Todo el procesamiento de las imágenes, cálculo del índice de perfusión, matriz de conectividad y análisis estadístico se realizó a partir de códigos en python. La metodología propuesta se implementó en 25 pacientes: 10 con enfermedad de Parkinson y 15 con epilepsia farmacorresistente. Todos firmaron el consentimiento informado aprobado por el Comité de Ética de la institución.
Los 15 pacientes diagnosticados con epilepsia farmacorresistente pertenecen al Programa de Cirugía en la Epilepsia de Cuba dirigido por el Centro Internacional de Restauración Neurológica (CIREN).12 Como parte de la evaluación prequirúrgica, todos se monitorearon con video-electroencefalograma, imágenes de resonancia magnética y estudios de SPECT ictal e interictal para localizar la zona epileptógena. En esta investigación sólo se tuvieron en cuenta los estudios interictales. En la SPECT interictal, la dosis fue administrada con el paciente en reposo y con un período libre de crisis de al menos 24 horas. En el caso de los pacientes con enfermedad de Parkinson la severidad de los síntomas fue evaluada por la escala de Hoehn-Yahr y la UPDRS III (Unified Parkinson's Disease Rating Scale).
Resultados
Se obtuvieron los índices de perfusión de cada paciente y las matrices de conectividad funcional para cada grupo. De los 15 pacientes epilépticos, 5 padecen de epilepsia del lóbulo temporal y 10 del lóbulo frontal. Se analizó el hemisferio ipsilateral, donde se encuentra la zona epileptógena, y el hemisferio contralateral a esta zona. Dentro del grupo de pacientes con epilepsia frontal hubo diferencias significativas entre ambos hemisferios en el giro fronto-orbital medio y lateral y precúneo. En el grupo de pacientes con epilepsia del lóbulo temporal se encontraron diferencias significativas en giro temporal medio superior, giro lingual y giro angular. En todas estas regiones el índice de perfusión fue mayor en el hemisferio ipsilateral que en el contralateral.
Se identificaron los patrones de conectividad funcional en cada tipo de epilepsia. En la del lóbulo frontal están las regiones giro frontal superior, medial, inferior, fronto-orbital medial, giro temporal inferior, parietal superior, poscentral, núcleos de la base y también mesencéfalo y puente; mientras que en la del lóbulo temporal se encuentran el giro temporal superior, medial e inferior, hipocampo, amígdala, giro fusiforme, parahipocampo, giro frontal superior e inferior, tálamo, giro cingulado, médula y puente (fig. 2).
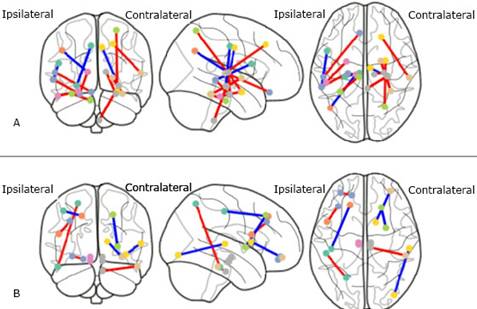
Fig. 2 Patrones de conectividad funcional en pacientes con epilepsia del lóbulo temporal(A) y epilepsia del lóbulo frontal (B).
De los 10 pacientes con enfermedad de Parkinson, 5 se encuentran en los estadios iniciales de la enfermedad con valores de i y ii en la escala de Hoehn-Yahr; el resto tiene un estadio avanzado con un valor de iii en la misma escala, altos valores en la UPDRS iii y evidencia de deterioro cognitivo. El hemisferio cerebral ipsilateral se compromete al inicio de la enfermedad, a él se opone el hemisferio cerebral contralateral. En el hemisferio ipsilateral se encontraron diferencias significativas al comparar los índices de perfusión de ambos grupos en giro frontal inferior, giro cingulado, lingual, fusiforme, lóbulo paracentral y temporal medial. Y en el hemisferio contralateral se encontraron diferencias significativas del índice de perfusión entre ambos grupos en giro frontal inferior, hipocampo, parietal superior, supramarginal y corteza cingulada anterior.
En el patrón de conectividad funcional del inicio de la enfermedad de Parkinson se identificaron las regiones área motora suplementaria, putamen, caudado, sustancia negra, globo pálido, giro de Heschl, corteza calcarina, tálamo, giro frontal medial e inferior y cerebelo. Con la progresión de la enfermedad dicho patrón cambia y abarca las regiones giro parahipocampal, precentral, opérculo rolándico, área motora suplementaria, giro frontal superior, parietal superior e inferior, temporal superior, núcleo subtalámico, giro olfatorio, putamen, globo pálido y tálamo (fig. 3).
Discusión
Esta investigación propone una metodología para estudiar las redes funcionales a partir de la perfusión cerebral por SPECT. La metodología se basa en la cuantificación relativa del flujo sanguíneo cerebral por regiones, integra información estructural y funcional además de utilizar atlas anatómicos. El flujo sanguíneo cerebral local es regionalmente heterogéneo. Su patrón variado no es aleatorio ni está relacionado con la anatomía de la vascularización cerebral o con las diferencias en los modelos de inervación de los vasos cerebrales. Depende del nivel de generación de energía de la actividad neuronal, principal proceso del cerebro; es decir, la actividad en los circuitos neuronales determina las variaciones y patrones regionales del flujo sanguíneo cerebral. Por consiguiente, el estudio de sus fluctuaciones sincronizadas entre regiones anatómicas permite tener una medida de conectividad funcional entre estas áreas del cerebro.
La conectividad funcional se ha estudiado a partir de la señal Blood Oxigenation Level-Dependen (BOLD) en los estudios de resonancia magnética. Sin embargo, dado que el flujo sanguíneo cerebral es un solo parámetro fisiológico, sus datos pueden ser más relevantes que los de la señal BOLD cuyas fluctuaciones representan cambios combinados en la oxigenación de la sangre, el volumen y el flujo sanguíneo cerebral, así como en la tasa metabólica del oxígeno. Además, la magnitud de la fluctuación BOLD depende de especificidades de la resonancia magnética, como la intensidad del campo magnético y el tiempo de eco.
El mapeo de la conectividad funcional basado en el flujo sanguíneo cerebral por SPECT proporciona una estimación cuantitativa de las fluctuaciones en términos de un solo indicador fisiológico. No obstante, el estudio de las redes cerebrales anatómicas y funcionales, mediante la combinación de las distintas técnicas de neuroimagen (resonancia magnética estructural, resonancia magnética funcional y de difusión, SPECT y PET) en un mismo conjunto de sujetos, sería extremadamente útil para encontrar diferencias y propiedades similares de las redes cerebrales a partir de diferentes variables fisiológicas.
La zona epileptógena mostró contrastes en los índices de perfusión. Se obtuvieron patrones de conectividad funcional distintos para cada tipo de epilepsia, que reflejan información funcional de eventos epileptiformes interictales y anomalías distintivas entre epilepsias que no son completamente perceptibles al visualizar las imágenes de los estudios interictales. Esta nueva información sobre el SPECT interictal podría usarse para comprender la epilepsia como un trastorno de la red.13
Los estudios de SPECT ictales no se pueden realizar en todos los contextos clínicos debido a que la fase ictal es extremadamente corta y se dificultad su captura; además al disminuir los fármacos epiltógenos, está en riesgo la seguridad del paciente. Estudios previos han reportado sensibilidades de la SPECT interictal del 44 y 40 % en pacientes con lóbulo temporal y epilepsia extratemporal respectivamente.14 La metodología propuesta atribuye un valor adicional a la SPECT interictal porque caracteriza las redes neurales funcionales de las descargas interictales epileptiformes lo cual contribuye a una mejor identificación de la zona epileptógena.
La SPECT cerebral de perfusión ha sido utilizada para estudiar la enfermedad de Parkinson.15,16 El patrón de perfusión en estos pacientes difiere según los síntomas dominantes y el estadio de la enfermedad.17,18 Se analizó cada hemisferio cerebral teniendo en cuenta la conducta asimétrica de esta patología. Los pacientes en un estadio avanzado presentaban un evidente deterioro cognitivo. En artículos previos esto se relaciona con las diferencias significativas en los índices de perfusión. Para estudios longitudinales del deterioro cognitivo en la enfermedad de Parkison, Pelizzari y colaboradores sugieren como un biomarcador temprano las alteraciones de perfusión en la región parietal.19 Por su parte, Voght refiere que los cambios en la corteza cingulada anterior pueden utilizarse como biomarcadores de déficit cognitivos en este padecimiento.20 También se ha comprobado que el Parkison degenera el sistema olfativo.21,22
Se identificaron dos patrones distintos de conectividad funcional según la progresión de la enfermedad. Asimismo, otros autores proponen que el giro fusiforme, el hipocampo y el lóbulo parietal son regiones críticas en la identificación de las funciones cognitivas y del movimiento en esta patología.23,24 Aunque el número de pacientes analizados fue muy pequeño, la semejanza de los resultados con otras investigaciones refleja la capacidad de la metodología para el estudio de la enfermedad de Parkinson y aporta a la búsqueda de biomarcadores basados en neuroimágenes.
El estudio se encuentra limitado por el reducido tamaño de la muestra y aunque los resultados no permiten realizar una caracterización de los patrones de la conectividad funcional en las patologías estudiadas, son prueba de concepto y constituyen puntos de partida para nuevas indagaciones, por ejemplo, el flujo sanguíneo cerebral podría ser una variable para estudiar la relación funcional entre diferentes regiones anatómicas en patologías cerebrales.
La metodología propuesta para estudiar los patrones de conectividad funcional a partir del flujo sanguíneo cerebral regional por SPECT se considera una novedad y estudios futuros, con mayor número de pacientes, permitirán validar los hallazgos preliminares y profundizar en la caracterización de los patrones de conectividad funcional en ambas patologías. Además pueden contribuir a hacer inferencias sobre los correlatos neurales de los distintos trastornos cerebrales.